ثوريوم
 | |||||||||||||||
| Thorium | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| المظهر | فضي | ||||||||||||||
| الوزن الذري العياري Ar°(Th) | |||||||||||||||
| Thorium في الجدول الدوري | |||||||||||||||
| |||||||||||||||
| الرقم الذري (Z) | 90 | ||||||||||||||
| المجموعة | n/a | ||||||||||||||
| الدورة | period 7 | ||||||||||||||
| المستوى الفرعي | f-block | ||||||||||||||
| التوزيع الإلكتروني | [Rn] 6d2 7s2 | ||||||||||||||
| الإلكترونات بالغلاف | 2, 8, 18, 32, 18, 10, 2 | ||||||||||||||
| الخصائص الطبيعية | |||||||||||||||
| الطور at د.ح.ض.ق | solid | ||||||||||||||
| نقطة الانصهار | 2023 K (1750 °س، 3182 °F) | ||||||||||||||
| نقطة الغليان | 5061 K (4788 °س، 8650 °ف) | ||||||||||||||
| حرارة الانصهار | 13.81 kJ/mol | ||||||||||||||
| حرارة التبخر | 514 kJ/mol | ||||||||||||||
| السعة الحرارية المولية | 26.230 J/(mol·K) | ||||||||||||||
ضغط البخار
| |||||||||||||||
| الخصائص الذرية | |||||||||||||||
| الكهرسلبية | مقياس پاولنگ: 1.3 | ||||||||||||||
| طاقات التأين |
| ||||||||||||||
| نصف القطر الذري | empirical: 179.8 pm | ||||||||||||||
| نصف قطر التكافؤ | 206±6 pm | ||||||||||||||
| خصائص أخرى | |||||||||||||||
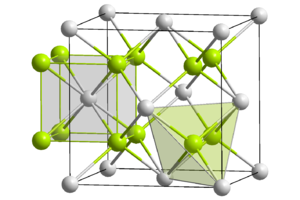
| البنية البلورية | face-centred cubic (fcc) | ||||||||||||||
| سرعة الصوت قضيب رفيع | 2490 م/ث (عند 20 °س) | ||||||||||||||
| قضيب رفيع | 54.0 W/(m·K) | ||||||||||||||
| التمدد الحراري | 11.0 µm/(m⋅K) (عند 25 °س) | ||||||||||||||
| المقاومة الكهربائية | 157 nΩ⋅m (at 0 °C) | ||||||||||||||
| الترتيب المغناطيسي | مغناطيسية مسايرة[1] | ||||||||||||||
| القابلية المغناطيسية | 132.0×10−6 cm3/mol (293 K)[2] | ||||||||||||||
| معامل يونگ | 79 GPa | ||||||||||||||
| معامل القص | 31 GPa | ||||||||||||||
| معاير الحجم | 54 GPa | ||||||||||||||
| نسبة پواسون | 0.27 | ||||||||||||||
| صلادة موز | 3.0 | ||||||||||||||
| صلادة ڤيكرز | 295–685 MPa | ||||||||||||||
| صلادة برينل | 390–1500 MPa | ||||||||||||||
| رقم كاس | 7440-29-1 | ||||||||||||||
| التاريخ | |||||||||||||||
| التسمية | على اسم ثور، الإله النوردي للرعد | ||||||||||||||
| الاكتشاف | يونس ياكوب برزليوس (1829) | ||||||||||||||
| نظائر الThorium | |||||||||||||||
| قالب:جدول نظائر Thorium غير موجود | |||||||||||||||
الثوريوم (thorium)، هو أحد عناصر الجدول الدوري وله الرمز Th، وعدده الذري 90. ونظراً لأنه فلز له نشاط إشعاعي طفيف، ويوجد بصورة طبيعية فإنه يعتبر من أنواع الوقود النووي البديلة لليورانيوم. الثوريوم فضي فاتح، ويتغير لونه إلى الرمادي الزيتوني عند تعرضه للهواء، مكوناً ثاني أكسيد الثوريوم؛ وهو لين نسبياً ومطيلي، ونقطة انصهاره عالية. الثوريوم هو أكتينيد موجب الشحنة، تهيمن على تركيبه الكيميائي حالة الأكسدة +4؛ وهو شديد التفاعل، ويمكن أن يشتعل في الهواء عند انقسامه بدقة.
جميع نظائر الثوريوم المعروفة غير مستقرة. أكثرها استقراراً، وهو الثوريوم-232، يبلغ عمر النصفي 14.05 بليون سنة، أي ما يعادل تقريباً عمر الكون؛ وهو يتحلل ببطء شديد عبر انحلال ألفا، بادئاً سلسلة انحلال تُسمى سلسلة الثوريوم، وتنتهي عند نظير الرصاص المستقر 208. على الأرض، الثوريوم واليورانيوم هما العنصران الوحيدان المشعان بشكل كبير واللذان لا يزالان موجودين بشكل طبيعي بكميات كبيرة العناصر الأزلية. [أ] يُقدر أن الثوريوم أكثر وفرة في الطبيعة بثلاث مرات من اليورانيوم في قشرة الأرض، ويُعدن بشكل أساسي من رمال المونازيت كمنتج ثانوي لاستخراج الفلزات الأرضية النادرة.
اكتُشف الثوريوم عام 1828 على يد عالم المعادن النرويجي الهاوي مورتن ثرين إسمارك، وحدده الكيميائي السويدي يونس ياكوب برزليوس، الذي أطلق عليه اسم ثور، إله الرعد النوردي. طُوّرت تطبيقاته الأولى في أواخر القرن التاسع عشر. حظي النشاط الإشعاعي للثوريوم باعتراف واسع النطاق خلال العقود الأولى من القرن العشرين. في النصف الثاني من القرن، استُبدل الثوريوم في العديد من الاستخدامات بسبب المخاوف المتعلقة بنشاطه الإشعاعي.
لا يزال الثوريوم يُستخدم كعنصر سبائك في أقطاب لحام TIG، لكنه يُستبدل تدريجياً بتركيبات مختلفة. كما استُخدم أيضاً في البصريات المتطورة والأجهزة العلمية، وفي بعض الصمامات المفرغة للبث، وكمصدر للضوء في الوشاح الغازي، إلا أن هذه الاستخدامات أصبحت هامشية. اقتُرح استخدامه كبديل لليورانيوم كوقود نووي في المفاعلات النووية، وقد بُنيت العديد من مفاعلات الثوريوم. كما يُستخدم الثوريوم في تقوية المغنسيوم، وطلاء أسلاك التنگستن في المعدات الكهربائية، والتحكم في حجم حبيبات التنگستن في المصابيح الكهربائية، وفي البوتقات عالية الحرارة، وفي العدسات الزجاجية، بما في ذلك عدسات الكاميرات والأجهزة العلمية. ومن الاستخدامات الأخرى للثوريوم: السيراميك المقاوم للحرارة، ومحركات الطائرات، والمصابيح المتوهجة. وقد استخدم علم المحيطات نسب نظائر الپروتكتينيوم 231/230 لفهم المحيط القديم.[4]
الصفات المميزة
فى حالة نقاءه فإن الثوريوم فلز أبيض فضي يحافظ على لمعانه لشهور عديدة. بينما عند وجود شوائب أكسيدية به فإن لمعانه يخبو في الهواء ويصبح رمادي ثم أخيرا يتحول للأسود. ولأكسيد الثوريم (ThO2) (يسمى أيضا ثوريا) درجة ذوبان عالية جدا مقارنة بباقى الأكاسيد (3300 °C). وعند تسيخنه في الهواء, فإن فلز الثوريوم يشتعل ويحترق بلهب أبيض.
شاهد الأكتينيدات في الطبيعة لتفاصيل أكثر عن السمات المميزة للأكتينيدات في الطبيعة. your a stupid bitch
توافره في الطبيعة
ليس الثوريوم عنصراً نادراً، إذ تُقدَّر نسبته نحو 0.001% (10-3%) وزناً من القشرة الأرضية. وهو يوجد في فلزات كثيرة، مرافقاً لعناصر الأتربة النادرة ويكون في الغالب مع التيتانيوم والنيوبيوم والتنتاليوم واليورانيوم. إن أغنى المعادن بالثوريوم هما الثوريت Thorite على شكل سيليكات الثوريوم (ThSiO4) الذي تبلغ نسبة الثوريوم فيه نحو 60%، والثوريانيت Thorianite وهو مزيج من ثنائي أكسيد الثوريوم ThO2 وأكسيد اليورانيوم U3O8. وتبلغ نسبة ما فيه من الثوريوم نحو 90%. ولكن أهم مصدر تجاري للثوريوم هو المونازيت Monazite، ويتواجد هذا المعدن في شواطىء الهند والبرازيل وسيلان ومدغشقر، كما يوجد في مناطق أخرى من العالم كجنوب أفريقيا وروسيا واسكندنافية وأستراليا والولايات المتحدة.
خواصه
تتلخص خواصه الفيزيائية فيما يلي:
إلكترونات المدارات التكافؤية (صيغة) k5f 0 6d2 7S؛ نصف القطر الذري 1.8أنغستروم، نصف القطر الشاردي Th4+ ن0.1 أنغستروم، الكتلة الحجمية: 11.7غ/سم3، درجة الانصهار: 1750 ْس، متوسط درجة الغليان: 3850 ْس (3500 ْس ـ4200 ْس)، كمون التشرّد (التأيُّن) الأول: 6.95 ev الرابع 29.38 ev (إلكترون ـ فولط).
ويتكون الثوريوم الطبيعي من نظيرين Isotopes هما: 232Th وما ينشأ عنه 228Th، ونصف حياة الأول 1.4 ×1010 سنة بينما نصف حياة الثاني 1.9سنة. أمَّا نظائر الثوريوم الأخرى فهي:
234Th وهو يُصدر جُسيمات ونصف حياته 24.1يوم.
230Th وهو يُصدر جُسيمات، ونصف حياته 80ألف سنة.
231Th وهو يُصدر جُسيمات، ونصف حياته 25.6ساعة.
227Th وهو يُصدر جُسيمات، ونصف حياته 18.6يوم.
وللثوريوم نظير اصطناعي هو 233Th وهو يصدر -β ونصف حياته 23.5 دقيقة، وهو يتحول إلى بروتِكْنتيوم 233 الذي يتحوَّل بدوره إلى (233U) اليورانيوم القابل للانشطار.
أمَّا خواصه الكيمياوية فتتلخص فيما يلي: لا يتأثر بالأحماض الممددة كثيراً، غير أنه ينحل في حمض كلور الماء المركز، وهو يتفاعل مع حمض الآزوت المركز بسرعة في بداية التفاعل لكنه سرعان ما يتوقف بسبب السلبية المتولدة عن تشكل طبقة ثنائي أكسيد الثوريوم. ولا ينحل الثوريوم في المحاليل المائية لهيدروكسيدات المعادن القلوية، كما لا يتأثر بالهواء في درجة الحرارة العادية، لكنه يحترق فيه إذا كان مسحوقاً ويكوّن حينئذٍ أكسيد الثوريوم. وهو يتفاعل مع الماء في الدرجة 100 ْس، ببطء وتزداد شدة تفاعله بارتفاع درجة الحرارة، كما يتفاعل مع الهالوجينات في الدرجة 450 ْس، ومع الآزوت بالدرجة 650 ْس مكوناً الهاليد والنيتريد الموافقين، ويتفاعل مع الهدروجين بالدرجة 300 ـ400 ْس مكوّناً هيدريد الثوريوم.
النظائر
جميع العناصر باستثناء عنصرين حتى البيزموث (العنصر 83) لها نظير مستقر عملياً لجميع الأغراض ("مستقر كلاسيكياً")، باستثناء التكنيشيوم والپروميثيوم (العنصرين 43 و61). جميع العناصر من الپولونيوم (العنصر 84) فصاعداً قابلة للقياس من حيث النشاط الإشعاعي. 232Th is one of the two nuclides beyond bismuth (the other being 238U) that have half-lives measured in billions of years; its half-life is 14.05 billion years, about three times the age of the earth, and slightly longer than the age of the universe. Four-fifths of the thorium present at Earth's formation has survived to the present.[5][6][7] 232Th is the only isotope of thorium occurring in quantity in nature.[5] Its stability is attributed to its closed nuclear subshell with 142 neutrons.[8][9] Thorium has a characteristic terrestrial isotopic composition, with atomic weight 232.0377±0.0004.[10] It is one of only four radioactive elements (along with bismuth, protactinium and uranium) that occur in large enough quantities on Earth for a standard atomic weight to be determined.[citation needed]
Thorium nuclei are susceptible to alpha decay because the strong nuclear force cannot overcome the electromagnetic repulsion between their protons.[11] The alpha decay of 232Th initiates the 4n decay chain which includes isotopes with a mass number divisible by 4 (hence the name; it is also called the thorium series after its progenitor). This chain of consecutive alpha and beta decays begins with the decay of 232Th to 228Ra and terminates at 208Pb.[5] Any sample of thorium or its compounds contains traces of these daughters, which are isotopes of thallium, lead, bismuth, polonium, radon, radium, and actinium.[5] Natural thorium samples can be chemically purified to extract useful daughter nuclides, such as 212Pb, which is used in nuclear medicine for cancer therapy.[12][13] 227Th (alpha emitter with an 18.68 days half-life) can also be used in cancer treatments such as targeted alpha therapies.[14][15][16] 232Th also very occasionally undergoes spontaneous fission rather than alpha decay, and has left evidence of doing so in its minerals (as trapped xenon gas formed as a fission product), but the partial half-life of this process is very large at over 1021 years and alpha decay predominates.[17][18]
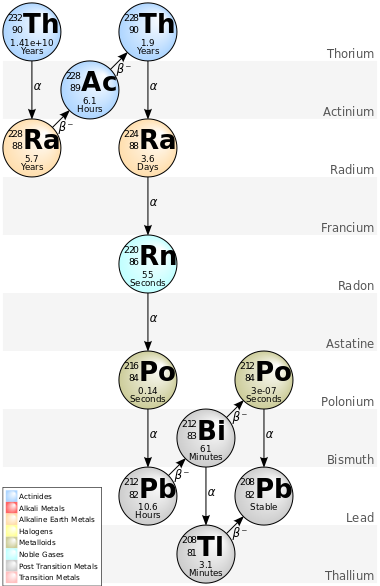
In total, 32 radioisotopes have been characterised, which range in mass number from 207[19] to 238.[17] After 232Th, the most stable of them (with respective half-lives) are 230Th (75,380 years), 229Th (7,917 years), 228Th (1.92 years), 234Th (24.10 days), and 227Th (18.68 days). All of these isotopes occur in nature as trace radioisotopes due to their presence in the decay chains of 232Th, 235U, 238U, and 237Np: the last of these is long extinct in nature due to its short half-life (2.14 million years), but is continually produced in minute traces from neutron capture in uranium ores. All of the remaining thorium isotopes have half-lives that are less than thirty days and the majority of these have half-lives that are less than ten minutes.[5]
In deep seawaters the isotope 230Th makes up to 0.02% of natural thorium.[20] This is because its parent 238U is soluble in water, but 230Th is insoluble and precipitates into the sediment. Uranium ores with low thorium concentrations can be purified to produce gram-sized thorium samples of which over a quarter is the 230Th isotope, since 230Th is one of the daughters of 238U.[17] The International Union of Pure and Applied Chemistry (IUPAC) reclassified thorium as a binuclidic element in 2013; it had formerly been considered a mononuclidic element.[21]
Thorium has three known nuclear isomers (or metastable states), 216m1Th, 216m2Th, and 229mTh. 229mTh has the lowest known excitation energy of any isomer,[22] measured to be 7.6±0.5 eV. This is so low that when it undergoes isomeric transition, the emitted gamma radiation is in the ultraviolet range.[23][24][ب] The nuclear transition from 229Th to 229mTh is being investigated for a nuclear clock.[24]
Different isotopes of thorium are chemically identical, but have slightly differing physical properties: for example, the densities of pure 228Th, 229Th, 230Th, and 232Th are respectively expected to be 11.5, 11.6, 11.6, and 11.7 g/cm3.[26] The isotope 229Th is expected to be fissionable with a bare critical mass of 2839 kg, although with steel reflectors this value could drop to 994 kg.[26][ت] 232Th is not fissionable, but it is fertile as it can be converted to fissile 233U by neutron capture and subsequent beta decay.[26][27]
Radiometric dating
Two radiometric dating methods involve thorium isotopes: uranium–thorium dating, based on the decay of 234U to 230Th, and ionium–thorium dating, which measures the ratio of 232Th to 230Th.[ث] These rely on the fact that 232Th is a primordial radioisotope, but 230Th only occurs as an intermediate decay product in the decay chain of 238U.[28] Uranium–thorium dating is a relatively short-range process because of the short half-lives of 234U and 230Th relative to the age of the Earth: it is also accompanied by a sister process involving the alpha decay of 235U into 231Th, which very quickly becomes the longer-lived 231Pa, and this process is often used to check the results of uranium–thorium dating. Uranium–thorium dating is commonly used to determine the age of calcium carbonate materials such as speleothem or coral, because uranium is more soluble in water than thorium and protactinium, which are selectively precipitated into ocean-floor sediments, where their ratios are measured. The scheme has a range of several hundred thousand years.[28][29] Ionium–thorium dating is a related process, which exploits the insolubility of thorium (both 232Th and 230Th) and thus its presence in ocean sediments to date these sediments by measuring the ratio of 232Th to 230Th.[30][31] Both of these dating methods assume that the proportion of 230Th to 232Th is a constant during the period when the sediment layer was formed, that the sediment did not already contain thorium before contributions from the decay of uranium, and that the thorium cannot migrate within the sediment layer.[30][31]
الكيمياء
A thorium atom has 90 electrons, of which four are valence electrons. Four atomic orbitals are theoretically available for the valence electrons to occupy: 5f, 6d, 7s, and 7p.[32] Despite thorium's position in the f-block of the periodic table, it has an anomalous [Rn]6d27s2 electron configuration in the ground state, as the 5f and 6d subshells in the early actinides are very close in energy, even more so than the 4f and 5d subshells of the lanthanides: thorium's 6d subshells are lower in energy than its 5f subshells, because its 5f subshells are not well-shielded by the filled 6s and 6p subshells and are destabilized. This is due to relativistic effects, which become stronger near the bottom of the periodic table, specifically the relativistic spin–orbit interaction. The closeness in energy levels of the 5f, 6d, and 7s energy levels of thorium results in thorium almost always losing all four valence electrons and occurring in its highest possible oxidation state of +4. This is different from its lanthanide congener cerium, in which +4 is also the highest possible state, but +3 plays an important role and is more stable. Thorium is much more similar to the transition metals zirconium and hafnium than to cerium in its ionization energies and redox potentials, and hence also in its chemistry: this transition-metal-like behaviour is the norm in the first half of the actinide series.[33][34]
Despite the anomalous electron configuration for gaseous thorium atoms, metallic thorium shows significant 5f involvement. A hypothetical metallic state of thorium that had the [Rn]6d27s2 configuration with the 5f orbitals above the Fermi level should be hexagonal close packed like the group 4 elements titanium, zirconium, and hafnium, and not face-centred cubic as it actually is. The actual crystal structure can only be explained when the 5f states are invoked, proving that thorium is metallurgically a true actinide.[35]
Tetravalent thorium compounds are usually colourless or yellow, like those of silver or lead, as the Th4+ ion has no 5f or 6d electrons.[36] Thorium chemistry is therefore largely that of an electropositive metal forming a single diamagnetic ion with a stable noble-gas configuration, indicating a similarity between thorium and the main group elements of the s-block.[37][ج] Thorium and uranium are the most investigated of the radioactive elements because their radioactivity is low enough not to require special handling in the laboratory.[38]
التفاعلات الكيميائية
Thorium is a highly reactive and electropositive metal. With a standard reduction potential of −1.90 V for the Th4+/Th couple, it is somewhat more electropositive than zirconium or aluminium.[39] Finely divided thorium metal can exhibit pyrophoricity, spontaneously igniting in air.[40] When heated in air, thorium turnings ignite and burn with a brilliant white light to produce the dioxide. In bulk, the reaction of pure thorium with air is slow, although corrosion may occur after several months; most thorium samples are contaminated with varying degrees of the dioxide, which greatly accelerates corrosion.[40] Such samples slowly tarnish, becoming grey and finally black at the surface.[40]
At standard temperature and pressure, thorium is slowly attacked by water, but does not readily dissolve in most common acids, with the exception of hydrochloric acid, where it dissolves leaving a black insoluble residue of ThO(OH,Cl)H.[40][41] It dissolves in concentrated nitric acid containing a small quantity of catalytic fluoride or fluorosilicate ions;[40][42] if these are not present, passivation by the nitrate can occur, as with uranium and plutonium.[40][43][44]
المركبات غير العضوية
Most binary compounds of thorium with nonmetals may be prepared by heating the elements together.[45] In air, thorium burns to form ThO
2, which has the fluorite structure.[46] Thorium dioxide is a refractory material, with the highest melting point (3390 °C) of any known oxide.[47] It is somewhat hygroscopic and reacts readily with water and many gases;[48] it dissolves easily in concentrated nitric acid in the presence of fluoride.[49]
When heated in air, thorium dioxide emits intense blue light; the light becomes white when ThO
2 is mixed with its lighter homologue cerium dioxide (CeO
2, ceria): this is the basis for its previously common application in gas mantles.[48] A flame is not necessary for this effect: in 1901, it was discovered that a hot Welsbach gas mantle (using ThO
2 with 1% CeO
2) remained at "full glow" when exposed to a cold unignited mixture of flammable gas[which?] and air.[50] The light emitted by thorium dioxide is higher in wavelength than the blackbody emission expected from incandescence at the same temperature, an effect called candoluminescence. It occurs because ThO
2 : Ce acts as a catalyst for the recombination of free radicals that appear in high concentration in a flame, whose deexcitation releases large amounts of energy. The addition of 1% cerium dioxide, as in gas mantles, heightens the effect by increasing emissivity in the visible region of the spectrum; but because cerium, unlike thorium, can occur in multiple oxidation states, its charge and hence visible emissivity will depend on the region on the flame it is found in (as such regions vary in their chemical composition and hence how oxidising or reducing they are).[50]
Several binary thorium chalcogenides and oxychalcogenides are also known with sulfur, selenium, and tellurium.[51]
All four thorium tetrahalides are known, as are some low-valent bromides and iodides:[52] the tetrahalides are all 8-coordinated hygroscopic compounds that dissolve easily in polar solvents such as water.[53] Many related polyhalide ions are also known.[52] Thorium tetrafluoride has a monoclinic crystal structure like those of zirconium tetrafluoride and hafnium tetrafluoride, where the Th4+ ions are coordinated with F−
ions in somewhat distorted square antiprisms.[52] The other tetrahalides instead have dodecahedral geometry.[53] Lower iodides ThI
3 (black) and ThI
2 (gold-coloured) can also be prepared by reducing the tetraiodide with thorium metal: they do not contain Th(III) and Th(II), but instead contain Th4+ and could be more clearly formulated as electride compounds.[52] Many polynary halides with the alkali metals, barium, thallium, and ammonium are known for thorium fluorides, chlorides, and bromides.[52] For example, when treated with potassium fluoride and hydrofluoric acid, Th4+ forms the complex anion [ThF
6]2− (hexafluorothorate(IV)), which precipitates as an insoluble salt, K
2[ThF
6] (potassium hexafluorothorate(IV)).[42]
Thorium borides, carbides, silicides, and nitrides are refractory materials, like those of uranium and plutonium, and have thus received attention as possible nuclear fuels.[45] All four heavier pnictogens (phosphorus, arsenic, antimony, and bismuth) also form binary thorium compounds. Thorium germanides are also known.[54] Thorium reacts with hydrogen to form the thorium hydrides ThH
2 and Th
4H
15, the latter of which is superconducting below 7.5–8 K; at standard temperature and pressure, it conducts electricity like a metal.[55] The hydrides are thermally unstable and readily decompose upon exposure to air or moisture.[56]
Coordination compounds
In an acidic aqueous solution, thorium occurs as the tetrapositive aqua ion [Th(H
2O)
9]4+, which has tricapped trigonal prismatic molecular geometry:[57][58] at pH < 3, the solutions of thorium salts are dominated by this cation.[57] The Th4+ ion is the largest of the tetrapositive actinide ions, and depending on the coordination number can have a radius between 0.95 and 1.14 Å.[57] It is quite acidic due to its high charge, slightly stronger than sulfurous acid: thus it tends to undergo hydrolysis and polymerisation (though to a lesser extent than Fe3+), predominantly to [Th
2(OH)
2]6+ in solutions with pH 3 or below, but in more alkaline solution polymerisation continues until the gelatinous hydroxide Th(OH)
4 forms and precipitates out (though equilibrium may take weeks to be reached, because the polymerisation usually slows down before the precipitation).[59] As a hard Lewis acid, Th4+ favours hard ligands with oxygen atoms as donors: complexes with sulfur atoms as donors are less stable and are more prone to hydrolysis.[33]
High coordination numbers are the rule for thorium due to its large size. Thorium nitrate pentahydrate was the first known example of coordination number 11, the oxalate tetrahydrate has coordination number 10, and the borohydride (first prepared in the Manhattan Project) has coordination number 14.[59] These thorium salts are known for their high solubility in water and polar organic solvents.[36]
Many other inorganic thorium compounds with polyatomic anions are known, such as the perchlorates, sulfates, sulfites, nitrates, carbonates, phosphates, vanadates, molybdates, and chromates, and their hydrated forms.[60] They are important in thorium purification and the disposal of nuclear waste, but most of them have not yet been fully characterized, especially regarding their structural properties.[60] For example, thorium nitrate is produced by reacting thorium hydroxide with nitric acid: it is soluble in water and alcohols and is an important intermediate in the purification of thorium and its compounds.[60] Thorium complexes with organic ligands, such as oxalate, citrate, and EDTA, are much more stable. In natural thorium-containing waters, organic thorium complexes usually occur in concentrations orders of magnitude higher than the inorganic complexes, even when the concentrations of inorganic ligands are much greater than those of organic ligands.[57]
In January 2021, the aromaticity has been observed in a large metal cluster anion consisting of 12 bismuth atoms stabilised by a center thorium cation.[61] This compound was shown to be surprisingly stable, unlike many previous known aromatic metal clusters.
Organothorium compounds
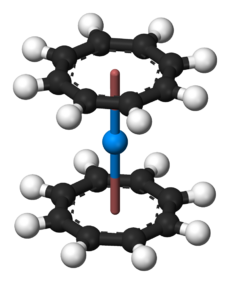
Most of the work on organothorium compounds has focused on the cyclopentadienyl complexes and cyclooctatetraenyls. Like many of the early and middle actinides (up to americium, and also expected for curium), thorium forms a cyclooctatetraenide complex: the yellow Th(C
8H
8)
2, thorocene. It is isotypic with the better-known analogous uranium compound uranocene.[62] It can be prepared by reacting K
2C
8H
8 with thorium tetrachloride in tetrahydrofuran (THF) at the temperature of dry ice, or by reacting thorium tetrafluoride with MgC
8H
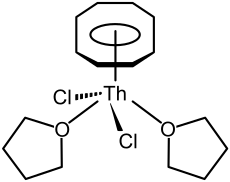
8.[62] It is unstable in air and decomposes in water or at 190 °C.[62] Half sandwich compounds are also known, such as (η8
-C
8H
8)ThCl
2(THF)
2, which has a piano-stool structure and is made by reacting thorocene with thorium tetrachloride in tetrahydrofuran.[33]
The simplest of the cyclopentadienyls are Th(C
5H
5)
3 and Th(C
5H
5)
4: many derivatives are known. The former (which has two forms, one purple and one green) is a rare example of thorium in the formal +3 oxidation state;[62][63] a formal +2 oxidation state occurs in a derivative.[64] The chloride derivative [Th(C
5H
5)
3Cl] is prepared by heating thorium tetrachloride with limiting KC
5H
5 used (other univalent metal cyclopentadienyls can also be used). The alkyl and aryl derivatives are prepared from the chloride derivative and have been used to study the nature of the Th–C sigma bond.[63]
Other organothorium compounds are not well-studied. Tetrabenzylthorium, Th(CH
2C
6H
5)
4, and tetraallylthorium, Th(CH
2CH=CH
2)
4, are known, but their structures have not been determined. They decompose slowly at room temperature. Thorium forms the monocapped trigonal prismatic anion [Th(CH
3)
7]3−, heptamethylthorate(IV), which forms the salt [Li(tmeda)]
3[Th(CH
3)
7] (tmeda = (CH
3)
2NCH
2CH
2N(CH
3)
2). Although one methyl group is only attached to the thorium atom (Th–C distance 257.1 pm) and the other six connect the lithium and thorium atoms (Th–C distances 265.5–276.5 pm), they behave equivalently in solution. Tetramethylthorium, Th(CH
3)
4, is not known, but its adducts are stabilised by phosphine ligands.[33]
تحضيره
يحضر معدن الثوريوم بإرجاع رباعي فلوريد الثوريوم Th F4 أو ثنائي أكسيد الثوريوم بوساطة معدن الكالسيوم، ويجري التفاعل بتسخين مزيج من Th F4 وCa بوجود ثنائي كلوريد الزنك ZnCl2 اللامائي عند الدرجة 600 ْس تقريباً. ويمكن الحصول عليه بالتحليل الكهربائي لمركب سداسي فلورو ثورات (IV) البوتاسيوم K2Th F6 أو خماسي فلورو ثورات (IV) البوتاسيوم KTh F5 المنحل في صهارة ملح كلوريد الصوديوم والبوتاسيوم KCl-NaCl.
الإستخدامات
إستخدامات الثوريوم:
- يستخدم لعمل سبيكة مع الماغنسيوم يكون لها مقاومة عالية لقوة الشد والزحف في درجات الحرارة العالية.
- يستخدم الثوريوم لتغطية أسلاك التنجستين المستخدمة في المعدات الإلكترونية, مما يحسن الإنبعاث الإلكتروني للكاثود عند تسخينه.
- يستخدم الثوريوم في إلكترودات لحام القوس التنجستين الغازي والخزفيات المقاومة للحرارة.
- تستخدم تقنية تحديد العمر بواسطة يورانيوم-ثوريوم لتحديد عمر الحفريات الأدمية.
- كمادة خصبة لإنتاج الوقود النووي. وبالتحديد, في مفاعل مضخم الطاقة يجب الأخذ في الإعتبار إستخدام الثوريوم حيث انه متوافر عن اليورانيوم, كما أن بعض تصميمات المفاعلات النووية تأخذ في الإعتبار مساهمة الثوريوم في دورة وقودها النووي.
- الثوريوم يعتبر واقي أشعة قوي, بالرغم من أنه لم يستخدم كواقي أعة بطريقة فعلية مثل الرصاص أو اليورانيوم المستنزف.
- يمكن إستخدام الثوريوم في المفاعلات تحت الحرجة بدلا من اليورانيوم كوقود. وهذا يبنتج عنه نفايات أقل ولا يمكن أن يذوب.
إستخدامات ثانى أكسيد الثوريوم (ThO2):
- كمصدر إنارة في المصابيح الغازية المتنقلة. وهذه المصادر لها بريق ضوئي (لا يعتمد على النشاط الإشعاعي) عندما يتم تسخينها في لهب غازي.
- يستخدم للتحكم في حجم حبيبات التنجستين المستخدم في المصابيح الكهربية.
- يستخدم في البوتقات المعملية التى تتحمل درجات حرارة عالية.
- بإضافته إلى الزجاج, ينتج زجاج له معامل إنكسار عالي, وتشتت منخفض. وبالتالى تم إستخدام الزجاج الناتج في عدسات الكاميرات والتطبيقات العلمية.
- يستخدم كحفاز:
- فى تحويل الأمونيا إلى حمض نيتريك.
- فى عمليات تكسير البترول.
- فى إنتاج حمض الكبريتيك.
- يعتبر المكون النشيط في الثوروستات, الذى يستخدم في التشخيصات التى تتم بواسطة الأشعة السينية. وقد تم البدء في التوقف عن إستخدام الثوروستات لوجود خطر الإصابة بالسرطان بسببه.
الثوريوم تاريخيا
تم إكتشاف الثوريوم عام 1828 بواسطة الكيميائي السويدي جونز جاكوب بيرزيليوس, والذى قام بتسميته على إسم ثور إله الرعد الإسكندنافي. ولم يكن للثوريوم أى إستخدامات حتى عام 1885 حيث تم إكتشاف المصباح المغطى.
طريقة القضيب البللوري (أو طريقة التأيد) تم إكتشافها بواسطة أنطون إدوارد فان أركيل وجان هنريك دي بوير في عام 1925. وكانت هذه هى أول طريقة صناعية للإنتاج التجارى للثوريوم الطيع الفلزي.
وكان الإسم أيونيوم تم إقتراحه عند دراسة العناصر المشعة لنظير 230Th الناتج من سلسلة الإضمحلال لل238U قبل أن يعرف أن الأيونيوم والثوريوم متطابقان كيميائيا. وتم إقتراح Io للعنصر المتوقع.
استخراج الثوريوم
التواجد
ويوجد الثوريوم بكميات ضئيلة في معظم الصخور وأنواع التربة, ولكنه يتواجد ثلاث مرات أكثر من اليورانيوم, ويوجد بكمية تماثل الرصاص. وتحتوى التربة بصفة عامة على 6 أجزاء في المليون من الثوريوم في المتوسط. ويتواجد الثوريوم في عدة معادن, وأكثرها شهرة المونازايت والذى يحتوى على 12% تقريبا من أكسيد الثوريوم. ويوجد من هذا المعدن مخزون طبيعى في عديد من البلدان. ويضمحل 232Th ببطيء شديد (يصل عمر النصف له ثلاث مرات مثل عمر الأرض تقريبا) ولكن توجد نظائر أخى للثوريوم تنتج من الإضمحلال التسلسلي لليورانيوم. ومعظمها له فترة عمر نصف قليلة وتكون مشعة، ولكنها ضيئلة عند مقارنتها مع 232Th.
| البلد | احتياطيات الثوريوم (طن) | الاحتياطيات القاعدية للثوريوم (طن) | ||
|---|---|---|---|---|
| أستراليا | 300,000 | 340,000 | ||
| الهند | 290,000 | 300,000 | ||
| النرويج | 170,000 | 180,000 | ||
| الولايات المتحدة | 160,000 | 300,000 | ||
| كندا | 100,000 | 100,000 | ||
| جنوب أفريقيا | 35,000 | 39,000 | ||
| البرازيل | 16,000 | 18,000 | ||
| ماليزيا | 4,500 | 4,500 | ||
| بلدان أخرى | 95,000 | 100,000 | ||
| إجمالي العالم | 1,200,000 | 1,400,000 | ||
Note: The Australian figures are based on assumptions and not on actual geological surveys, therefore the figures cited for Australia may be misleading, should be treated with caution and could possibly indicate inflated values for Australia's actual reserves of thorium; note the OECD estimates of Australian's Reasonably Assured Reserves (RAR) of Thorium (listed below) indicate only 19,000 metric tonnes and not 300,000 tonnes as listed above.
- Another estimate of Reasonably Assured Reserves (RAR) and Estimated Additional Reserves (EAR) of thorium comes from OECD/NEA, Nuclear Energy, "Trends in Nuclear Fuel Cycle", Paris, France (2001):[65]
| البلد | RAR Th (طن) | EAR Th (طن) | ||
|---|---|---|---|---|
| البرازيل | 606,000 | 700,000 | ||
| تركيا | 380,000 | 500,000 | ||
| الهند | 319,000 | — | ||
| الولايات المتحدة | 137,000 | 295,000 | ||
| النرويج | 132,000 | 132,000 | ||
| گرينلاند | 54,000 | 32,000 | ||
| كندا | 45,000 | 128,000 | ||
| أستراليا | 19,000 | — | ||
| جنوب أفريقيا | 18,000 | — | ||
| مصر | 15,000 | 309,000 | ||
| بلدان أخرى | 505,000 | — | ||
| الإجمالي العالمي | 2,230,000 | 2,130,000 | ||
شاهد أيضا: تصنيف:معادن ثوريوم
الثوريوم كوقود نووي
الثوريوم مثل اليورانيوم والبلوتونيوم, يمكن أن يستخدم كوقود في المفاعلات النووية. برغم أنه لا ينشطر بمفرده, 232Th يقوم بإمتصاص النيترونات البطيئة لإنتاج اليورانيوم-233 (233U), والذى يحدث له إنشطار. ومثله مثل 238U فإنه يوانيوم خصب. وبالترتيب طبق للأهمية فإن 233 أفضل من النظيرين الأخرين المستخدمان كوقود, 235U والبلوتينيوم-239 (239Pu), نظرا لإنتاجه العالي من النيترونات لكل نيترون ممتص. ويعطى بداية ببعض المواد المنشطرة (235U أو 239Pu) تنتج دورة مستمرة مشابهة, ولكن بكفاءة أعلى من الممكنة بواسطة 238U إلى 239Pu (فى مفاعلات النيترون البطيء). يقوم 232Th بإمتصاص النيترون ليصبح 233Th الذى ينحل تلقائيا إلى بروأكتينيوم-233 (233Pa) ثم 233U, ويمكن عندها الحصول على الوقود المشع من المفاعل, ويفصل 233U من الثوريوم (عملية مشابهة حيث انها تتضمن فصل كيميائي بدلا من الفصل بواسطة النظائر), ويتم تغذيته لمفاعل أخر كنوع من أنواع الدورة المغلقة في دورات الوقود النووي.
وتتضمن مشاكل تصنيع الوقود التكلفة العالية الناتجة من الإشعاع العالي لليورانيوم 233U والذى نظرا لتلوثه ببعض أجزاء من 232U القصير العمر, تحدث نفس المشكلة في إعادة تشكيل الثوريوم نظرا للإشعاع العالي للثوريوم 228Th, ويأتى خطر بعض الأسلحة من تكاثر 233U, ولم تحل المشاكل التقنية المتعلقة بهذا الموضوع للآن. ولازال هناك عمل كثير لتطوير طريقة إستخدام الثوريوم كوقود, بحيث يمكن إستخدامه بطريقة تجارية. وبالرغم من ندرة وجود اليورانيوم, فلا زالت هذه الجهود غير كافية للإتجاه للثوريوم.
ومع ذلك, فإن دورة وقود الثوريوم, بقدرتها على توليد وقود متوالد بدون الحاجة لمفاعل نيترون سريع, ترجح بإستخدامه على المدى البعيد. وبتوافر الثوريوم عن اليورانيوم, فإنه من أهم الركائز التى سيستند عليها الوقود النووي.
الهند لديها مخزون كبير من الثوريوم, ولذا فإنها تخطط لإستخدامه في برنامجها النووي, مستخدمة اليورانيوم كمادة مساعدة فقط. وهذه الخطة الطموحة تستخدم كل من المفاعل المولد السريع والحراري. ويعتبر كل من مفاعل المياه الثقيلة المتقدم ، مفاعل KAMINI جهود مبذولة في هذا الإتجاه.
والكميات الآتية تمثل المخزون الطبيعي للثوريوم مقدر بالطن[1]:
- 360000 الهند[2]
- 300000 أستراليا
- 170000 النرويج
- 160000 الولايات المتحدة
- 100000 كندا
- 35000 جنوب أفريقيا
- 16000 الرازيل
- 95000 الدول الأخرى
النظائر
يتكون الثوريوم الموجود طبيعيا من نظير واحد 232Th. ويوجد للثوريوم 25 نظير مشع وأكثرهم ثباتا 232Th وله عمر نصف مقداره 14.05 مليار سنة, 230Th وله عمر نصف مقداره 75380 سنة, 229Th وله عمر نصف مقداره 7340 سنة, 228Th وله عمر نصف مقداره 1.92 سنة. أما بقية النظائر فلها عمر نصف أقل من 30 يوم ومعظم هذه النظائر أقل من 10 دقائق. وللعنصر أيزومر نووي واحد.
ويتراوح الوزن الذري لنظائر الثوريوم من 212 وحدة كتل ذرية (212Th) إلى 236 (236Th)
الإحتياطات
يشتعل مسحوق فلز الثوريوم تلقائيا في الهواء, ولذا يجب التعامل معه بحرص شديد.
كما يزيد معدل إحتمال الإصابة بسرطان الرئة, والبنكرياس, والدم عند التعرض لدخان الثوريوم. كما أن تعرض الجسم من الداخل للثوريوم يؤدى لزيادة معدل الإصابة بأمراض الكبد. ولا يوجد للعنصر أى دور حيوي أخر معروف. شاهد أيضا ثوروتراست.
الثوريوم في الثقافة العامة
شاهد أيضا إستخدامات الثوريوم الخيالية. دافيد هان, والذى يطلق عليه "الفتى سكوت المشع", يقوم بإطلاق الثوريوم من خلال مصباح مع النيترونات لإنتاج كميات صغيرة من المواد الإنشطارية في ساحة بيته الخلفية. وكان عليه أن لا يقوم بتطوير عمله نظرا لإرتفاع مشتوى الإشعاع في البيوت المحيطة به.
وفى عام 1999, قامت مجموعة طلبة من جامعة شيكاغو بإنشاء مفاعل نووي صغير يعمل.
المراجع
- معمل لوس الاموس القومي- الثوريوم
- المجمع النووي الأوربي- سلاسل الإضمحلال الطبيعي
- تحضير التيتانيوم, والزركونيوم, والهافيوم, والثوريم van Arkel, A.E., and de Boer, J.H., 1925 : Zeitschrift für Anorganische und Allgemeine Chemie, v. 148, p. 345–350
وصلات خارجية
- الطاقة من الثوريوم
- صفحة المعلومات حول الثوريوم
- شركة طاقة الثوريوم- تطوير وقود الثوريوم
- العناصر على الشبكة- الثوريوم
- أسئلة متكررة- الثوريوم
- الفحص الجيولوجي الأمريكي- الثوريوم
- مركز معلومات اليورانيوم يقدم بعض المواد الأصلية في تركيبه.
- المبرد اللانهائي - مزيل رائحة المجمد, منتج تجاري يفترض أنه يزيل الروائح للأبد مصنوع من Th-232.
- الطاقة من الثوريوم
شاهد أيضا
ملاحظات شارحة
- ^ Bismuth is very slightly radioactive, but its half-life (1.9×1019 years) is so long that its decay is negligible even over geological timespans.
- ^ Gamma rays are distinguished by their origin in the nucleus, not their wavelength; hence there is no lower limit to gamma energy derived from radioactive decay.[25]
- ^ A fissionable nuclide is capable of undergoing fission (even with a low probability) after capturing a high-energy neutron. Some of these nuclides can be induced to fission with low-energy thermal neutrons with a high probability; they are referred to as fissile. A fertile nuclide is one that could be bombarded with neutrons to produce a fissile nuclide. Critical mass is the mass of a ball of a material which could undergo a sustained nuclear chain reaction.
- ^ The name ionium for 230Th is a remnant from a period when different isotopes were not recognised to be the same element and were given different names.
- ^ Unlike the previous similarity between the actinides and the transition metals, the main-group similarity largely ends at thorium before being resumed in the second half of the actinide series, because of the growing contribution of the 5f orbitals to covalent bonding. The only other commonly-encountered actinide, uranium, retains some echoes of main-group behaviour. The chemistry of uranium is more complicated than that of thorium, but the two most common oxidation states of uranium are uranium(VI) and uranium(IV); these are two oxidation units apart, with the higher oxidation state corresponding to formal loss of all valence electrons, which is similar to the behaviour of the heavy main-group elements in the p-block.[37]
المصادر
- ^ Lide, D. R., ed. (2005). "Magnetic susceptibility of the elements and inorganic compounds". CRC Handbook of Chemistry and Physics (PDF) (86th ed.). CRC Press. pp. 4–135. ISBN 978-0-8493-0486-6.
- ^ Weast, R. (1984). CRC, Handbook of Chemistry and Physics. Chemical Rubber Company Publishing. p. E110. ISBN 978-0-8493-0464-4.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةArblaster 2018 - ^ Negre, César et al. “Reversed flow of Atlantic deep water during the Last Glacial Maximum.” Nature, vol. 468,7320 (2010): 84-8. doi:10.1038/nature09508
- ^ أ ب ت ث ج Audi, G.; Bersillon, O.; Blachot, J.; Wapstra, A.H. (December 2003). "The Nubase evaluation of nuclear and decay properties" (PDF). Nuclear Physics A. 729 (1): 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ قالب:CIAAW2003
- ^ Wieser, M. E. (1 January 2006). "Atomic weights of the elements 2005 (IUPAC Technical Report)". Pure and Applied Chemistry. 78 (11): 2051–2066. doi:10.1351/pac200678112051. S2CID 94552853.
- ^ Nagy, S. (2009). Radiochemistry and Nuclear Chemistry. Vol. 2. EOLSS Publications. p. 374. ISBN 978-1-84826-127-3.
- ^ Griffin, H. C. (2010). "Natural Radioactive Decay Chains". In Vértes, A.; Nagy, S.; Klencsár, Z.; et al. (eds.). Handbook of Nuclear Chemistry. Springer Science+Business Media. p. 668. ISBN 978-1-4419-0719-6.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. (2022-05-04). "Standard atomic weights of the elements 2021 (IUPAC Technical Report)". Pure and Applied Chemistry (in الإنجليزية). doi:10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ Beiser, A. (2003). "Nuclear Transformations" (PDF). Concepts of Modern Physics (6 ed.). McGraw-Hill Education. pp. 432–434. ISBN 978-0-07-244848-1. Archived from the original (PDF) on 4 October 2016. Retrieved 4 July 2016.
- ^ "AREVA Med launches production of lead-212 at new facility" (Press release). Areva. 2013. Retrieved 1 January 2017.
- ^ "Mineral Yearbook 2012" (PDF). United States Geological Survey. Retrieved 30 September 2017.
- ^ Ramdahl, Thomas; Bonge-Hansen, Hanne T.; Ryan, Olav B.; Larsen, Åsmund; Herstad, Gunnar; Sandberg, Marcel; Bjerke, Roger M.; Grant, Derek; Brevik, Ellen M.; Cuthbertson, Alan S. (September 2016). "An efficient chelator for complexation of thorium-227". Bioorganic & Medicinal Chemistry Letters. 26 (17): 4318–4321. doi:10.1016/j.bmcl.2016.07.034. PMID 27476138.
- ^ Deblonde, Gauthier J.-P.; Lohrey, Trevor D.; Booth, Corwin H.; Carter, Korey P.; Parker, Bernard F.; Larsen, Åsmund; Smeets, Roger; Ryan, Olav B.; Cuthbertson, Alan S.; Abergel, Rebecca J. (19 November 2018). "Solution Thermodynamics and Kinetics of Metal Complexation with a Hydroxypyridinone Chelator Designed for Thorium-227 Targeted Alpha Therapy". Inorganic Chemistry. 57 (22): 14337–14346. doi:10.1021/acs.inorgchem.8b02430. OSTI 1510758. PMID 30372069. S2CID 53115264.
- ^ Captain, Ilya; Deblonde, Gauthier J.-P.; Rupert, Peter B.; An, Dahlia D.; Illy, Marie-Claire; Rostan, Emeline; Ralston, Corie Y.; Strong, Roland K.; Abergel, Rebecca J. (21 November 2016). "Engineered Recognition of Tetravalent Zirconium and Thorium by Chelator–Protein Systems: Toward Flexible Radiotherapy and Imaging Platforms". Inorganic Chemistry. 55 (22): 11930–11936. doi:10.1021/acs.inorgchem.6b02041. OSTI 1458481. PMID 27802058.
- ^ أ ب ت Wickleder, Fourest & Dorhout 2006, pp. 53–55.
- ^ Bonetti, R.; Chiesa, C.; Guglielmetti, A.; et al. (1995). "First observation of spontaneous fission and search for cluster decay of 232Th". Physical Review C. 51 (5): 2530–2533. Bibcode:1995PhRvC..51.2530B. doi:10.1103/PhysRevC.51.2530. PMID 9970335.
- ^ Yang, H. B.; et al. (2022). "New isotope 207Th and odd-even staggering in α-decay energies for nuclei with Z > 82 and N < 126". Physical Review C. 105 (L051302). Bibcode:2022PhRvC.105e1302Y. doi:10.1103/PhysRevC.105.L051302. S2CID 248935764.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). "The NUBASE2020 evaluation of nuclear properties" (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ "Standard Atomic Weights: Thorium". CIAAW. 2013.
- ^ Ruchowska, E.; Płóciennik, W. A.; Żylicz, J.; et al. (2006). "Nuclear structure of 229Th". Physical Review C. 73 (4): 044326. Bibcode:2006PhRvC..73d4326R. doi:10.1103/PhysRevC.73.044326. hdl:10261/12130.
- ^ Beck, B. R.; Becker, J. A.; Beiersdorfer, P.; et al. (2007). "Energy splitting in the ground state doublet in the nucleus 229Th". Physical Review Letters. 98 (14): 142501. Bibcode:2007PhRvL..98n2501B. doi:10.1103/PhysRevLett.98.142501. PMID 17501268.
- ^ أ ب von der Wense, L.; Seiferle, B.; Laatiaoui, M.; et al. (2016). "Direct detection of the 229Th nuclear clock transition". Nature. 533 (7601): 47–51. arXiv:1710.11398. Bibcode:2016Natur.533...47V. doi:10.1038/nature17669. PMID 27147026. S2CID 205248786.
- ^ Feynman, R.; Leighton, R.; Sands, M. (1963). The Feynman Lectures on Physics. Vol. 1. Addison-Wesley. pp. 2–5. ISBN 978-0-201-02116-5. Retrieved 13 January 2018.
- ^ أ ب ت "Evaluation of nuclear criticality safety data and limits for actinides in transport" (PDF). Institut de radioprotection et de sûreté nucléaire. p. 15. Archived from the original (PDF) on 10 July 2007. Retrieved 20 December 2010.
- ^ Wickleder, Fourest & Dorhout 2006, pp. 52–53.
- ^ أ ب "3–6: Uranium Thorium Dating" (PDF). Institute for Structure and Nuclear Astrophysics, University of Notre Dame. Archived from the original (PDF) on 21 April 2021. Retrieved 7 October 2017.
- ^ Davis, O. "Uranium-Thorium Dating". Department of Geosciences, University of Arizona. Archived from the original on 28 March 2017. Retrieved 7 October 2017.
- ^ أ ب Rafferty, J. P. (2010), Geochronology, Dating, and Precambrian Time: The Beginning of the World As We Know It, The Geologic History of Earth, Rosen Publishing, p. 150, ISBN 978-1-61530-125-6
- ^ أ ب Vértes, A. (2010), Nagy, S.; Klencsár, Z.; Lovas, R. G. et al., eds., Handbook of Nuclear Chemistry, 5 (2nd ed.), Springer Science+Business Media, p. 800, ISBN 978-1-4419-0719-6
- ^ Wickleder, Fourest & Dorhout 2006, pp. 59–60.
- ^ أ ب ت ث Cotton, S. (2006). Lanthanide and Actinide Chemistry. John Wiley & Sons.
- ^ Martin, W. C.; Hagan, Lucy; Reader, Joseph; Sugar, Jack (July 1974). "Ground Levels and Ionization Potentials for Lanthanide and Actinide Atoms and Ions". Journal of Physical and Chemical Reference Data. 3 (3): 771–780. Bibcode:1974JPCRD...3..771M. doi:10.1063/1.3253147.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةJohansson - ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةYu. D. Tretyakov - ^ أ ب King, R. Bruce (1995). Inorganic Chemistry of Main Group Elements. Wiley-VCH. ISBN 978-0-471-18602-1.
- ^ Greenwood & Earnshaw 1997, p. 1262.
- ^ Stoll 2005, p. 6.
- ^ أ ب ت ث ج ح Wickleder, Fourest & Dorhout 2006, pp. 61–63.
- ^ Hammond, C. R. (2004). The Elements, in Handbook of Chemistry and Physics (81st ed.). CRC Press. ISBN 978-0-8493-0485-9.
- ^ أ ب Hyde, E. K. (1960). The radiochemistry of thorium (PDF). National Academy of Sciences. Retrieved 29 September 2017.
- ^ Greenwood & Earnshaw 1997, p. 1264.
- ^ Moore, Robert Lee; Goodall, C. A.; Hepworth, J. L.; Watts, R. A. (May 1957). "Nitric Acid Dissolution of Thorium. Kinetics of Fluoride-Catalyzed Reaction". Industrial & Engineering Chemistry. 49 (5): 885–887. doi:10.1021/ie50569a035.
- ^ أ ب Greenwood & Earnshaw 1997, p. 1267.
- ^ Yamashita, Toshiyuki; Nitani, Noriko; Tsuji, Toshihide; Inagaki, Hironitsu (1997). "Thermal expansions of NpO2 and some other actinide dioxides". J. Nucl. Mater. 245 (1): 72–78. Bibcode:1997JNuM..245...72Y. doi:10.1016/S0022-3115(96)00750-7.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةEmsley2011 - ^ أ ب Wickleder, Fourest & Dorhout 2006, pp. 70–77.
- ^ Greenwood & Earnshaw 1997, p. 1269.
- ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةIvey - ^ Wickleder, Fourest & Dorhout 2006, pp. 95–97.
- ^ أ ب ت ث ج Wickleder, Fourest & Dorhout 2006, pp. 78–94.
- ^ أ ب Greenwood & Earnshaw 1997, p. 1271.
- ^ Wickleder, Fourest & Dorhout 2006, pp. 97–101.
- ^ Wickleder, Fourest & Dorhout 2006, pp. 64–66.
- ^ Greenwood & Earnshaw 1997, p. 127.
- ^ أ ب ت ث Wickleder, Fourest & Dorhout 2006, pp. 117–134.
- ^ Persson, I. (2010). "Hydrated metal ions in aqueous solution: How regular are their structures?". Pure and Applied Chemistry. 82 (10): 1901–1917. doi:10.1351/PAC-CON-09-10-22.
- ^ أ ب Greenwood & Earnshaw 1997, pp. 1275–1277.
- ^ أ ب ت Wickleder, Fourest & Dorhout 2006, pp. 101–115.
- ^ Krämer2021-01-04T14:40:00+00:00, Katrina. "Heavy-metal cluster sets size record for metal aromaticity". Chemistry World (in الإنجليزية). Retrieved 2022-07-02.
{{cite web}}: CS1 maint: numeric names: authors list (link) - ^ أ ب ت ث Wickleder, Fourest & Dorhout 2006, pp. 116–117.
- ^ أ ب Greenwood & Earnshaw 1997, pp. 1278–1280.
- ^ Langeslay, Ryan R.; Fieser, Megan E.; Ziller, Joseph W.; Furche, Philip; Evans, William J. (2015). "Synthesis, structure, and reactivity of crystalline molecular complexes of the {[C5H3(SiMe3)2]3Th}1− anion containing thorium in the formal +2 oxidation state". Chemical Science. 6 (6): 517–521. doi:10.1039/C4SC03033H. PMC 5811171. PMID 29560172.
- ^ IAEA: Thorium fuel cycle — Potential benefits and challenges (PDF). pp. 45(table 8), 97(ref 78).
- ويكيبيديا الإنجليزية.
- CS1 maint: numeric names: authors list
- Short description is different from Wikidata
- WikiProject Elements pages using ENGVAR
- Pages using infobox element with unknown parameters
- Articles with hatnote templates targeting a nonexistent page
- Articles with unsourced statements from March 2023
- All articles with specifically marked weasel-worded phrases
- Articles with specifically marked weasel-worded phrases from November 2022
- Carcinogens
- Chemical elements with face-centered cubic structure
- Nuclear fuels
- أكتينيدات
- عناصر كيميائية
- مواد نووية