فلور
| ||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| غاز: أصفر شاحب جداً سائل: أصفر زاهي صلب: شفاف (بيتا)، معتم (ألفا)  فلور سائل في درجات حرارة تبريدية | ||||||||||||||||||||||||||||
| الخصائص العامة | ||||||||||||||||||||||||||||
| الاسم، الرمز، الرقم | فلور, F, 9 | |||||||||||||||||||||||||||
| النطق | /ˈflʊəriːn/ FLUU-reen, /ˈflʊərɪn/, /ˈflɔːriːn/ | |||||||||||||||||||||||||||
| تصنيف العنصر | هالوجين | |||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 17, 2, p | |||||||||||||||||||||||||||
| الوزن الذري القياسي | 18.9984032(5)[1] | |||||||||||||||||||||||||||
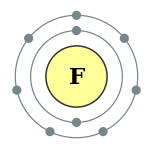
| التوزيع الإلكتروني | [He] 2s2 2p5[2] | |||||||||||||||||||||||||||
| التاريخ | ||||||||||||||||||||||||||||
| التسمية | على اسم المعدن فلوريت، والذي سُمِّي بدَوره من الكلمة اللاتينية fluo (ينساب، في انصهار) | |||||||||||||||||||||||||||
| الاكتشاف | أندريه-ماري أمپير (1810) | |||||||||||||||||||||||||||
| أول عزل | هنري مواسان[2] (26 يونيو 1886) | |||||||||||||||||||||||||||
| سُمّي من قِبل | همفري ديڤي | |||||||||||||||||||||||||||
| الخصائص الطبيعية | ||||||||||||||||||||||||||||
| الطور | غاز | |||||||||||||||||||||||||||
| الكثافة | (0 °س، 101.325 كپا) 1.696[3] g/L | |||||||||||||||||||||||||||
| الكثافة السائلة عند ن.غ. | 1.505[4] گ·سم−3 | |||||||||||||||||||||||||||
| نقطة الانصهار | 53.53 ك, −219.62 °C, −363.32[5] °F | |||||||||||||||||||||||||||
| نقطة الغليان | 85.03 ك, −188.12 °س, −306.62[5] °ف | |||||||||||||||||||||||||||
| النقطة الحرجة | 144.4 ك، 5.215[4] مپا | |||||||||||||||||||||||||||
| حرارة التبخر | 6.51[3] كج·مول−1 | |||||||||||||||||||||||||||
| السعة الحرارية المولية | (Cp) (21.1 °C) 825[4] J·mol−1·K−1 (Cv) (21.1 °C) 610[4] ج·مول−1·ك−1 | |||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| الخصائص الذرية | ||||||||||||||||||||||||||||
| حالات الأكسدة | −1 (يؤكسد الأكسجين) | |||||||||||||||||||||||||||
| سالبية كهربية | 3.98[2] (مقياس پولنگ) | |||||||||||||||||||||||||||
| طاقات التأين (المزيد) |
الأولى: 1,681[6] كج·مول−1 | |||||||||||||||||||||||||||
| الثانية: 3,374[6] كج·مول−1 | ||||||||||||||||||||||||||||
| الثالثة: 6,147[6] كج·مول−1 | ||||||||||||||||||||||||||||
| نصف قطر تساهمي | 64[7] pm | |||||||||||||||||||||||||||
| نصف قطر ڤان در ڤالز | 135[8] pm | |||||||||||||||||||||||||||
| متفرقات | ||||||||||||||||||||||||||||
| البنية البلورية | monoclinic
الحالة ألفا (درجة حرارة منخفضة)[9] الحالة بيتا (درجة حرارة مرتفعة) | |||||||||||||||||||||||||||
| الترتيب المغناطيسي | مغناطيسية معاكسة، −1.2×10−4 (SI)[10][11] | |||||||||||||||||||||||||||
| ناقلية حرارية | 0.02591[12] W·m−1·K−1 | |||||||||||||||||||||||||||
| رقم تسجيل كاس | 7782-41-4[2] | |||||||||||||||||||||||||||
| أكثر النظائر استقراراً | ||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر فلور | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
الفلور إنگليزية: Fluorine (الاسم مشتق من اللاتينية "fluere" والتي تعني السريان) هو عنصر كيميائي ذو خواص لا معدنية، وهو أحـد عناصر الفصيلة VIIA أو (17) في الدور الثاني في الجدول الدوري وهي تشمل إضافة إلى الفلور كلاً من الكلور والبروم واليود والأستاتين. يرمز له بالرمز F وعدده الذري 9، ويكون في الحالة الغازية في درجة حرارة الغرفة. له تأثير سام على الكائنات الحية. لونه أصفر مخضر شاحب، غاز أحادي التكافؤ وهو أكثر الهالوجينات الغازية نشاطا. والفلور النقي خطرا جدا ويسبب حروقا كيميائية شديدة عند ملامسته للجلد.
عدده الذري 9، بنيته الإلكترونية: n9F:1s2 2s2 2p5 أي ينقصه إلكترون واحد حتى تصبح بنيته مثل بنية الغاز الخامل النيون، لذلك يشكل الأيون F- بإضافة إلكترون، أو يشكل رابطة مشتركة وحيدة.
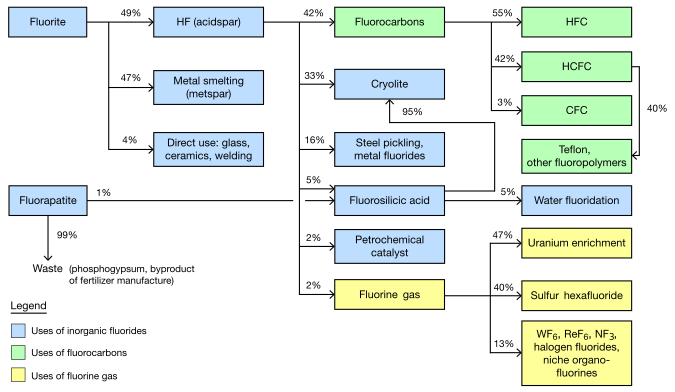
Among the elements, fluorine ranks 24th in universal abundance and 13th in terrestrial abundance. Fluorite, the primary mineral source of fluorine which gave the element its name, was first described in 1529; as it was added to metal ores to lower their melting points for smelting, the Latin verb fluo meaning 'flow' gave the mineral its name. Proposed as an element in 1810, fluorine proved difficult and dangerous to separate from its compounds, and several early experimenters died or sustained injuries from their attempts. Only in 1886 did French chemist Henri Moissan isolate elemental fluorine using low-temperature electrolysis, a process still employed for modern production. Industrial production of fluorine gas for uranium enrichment, its largest application, began during the Manhattan Project in World War II.
Owing to the expense of refining pure fluorine, most commercial applications use fluorine compounds, with about half of mined fluorite used in steelmaking. The rest of the fluorite is converted into corrosive hydrogen fluoride en route to various organic fluorides, or into cryolite, which plays a key role in aluminium refining. Molecules containing a carbon–fluorine bond often have very high chemical and thermal stability; their major uses are as refrigerants, electrical insulation and cookware, and PTFE (Teflon). Pharmaceuticals such as atorvastatin and fluoxetine contain C−F bonds. The fluoride ion from dissolved fluoride salts inhibits dental cavities, and so finds use in toothpaste and water fluoridation. Global fluorochemical sales amount to more than US$69 billion a year.
Fluorocarbon gases are generally greenhouse gases with global-warming potentials 100 to 23,500 times that of carbon dioxide, and SF6 has the highest global warming potential of any known substance. Organofluorine compounds often persist in the environment due to the strength of the carbon–fluorine bond. Fluorine has no known metabolic role in mammals; a few plants and sea sponges synthesize organofluorine poisons (most often monofluoroacetates) that help deter predation.[14]
السمات
النسق الإلكتروني
Fluorine atoms have nine electrons, one fewer than neon, and electron configuration 1s22s22p5: two electrons in a filled inner shell and seven in an outer shell requiring one more to be filled. The outer electrons are ineffective at nuclear shielding, and experience a high effective nuclear charge of 9 − 2 = 7; this affects the atom's physical properties.[15]
Fluorine's first ionization energy is third-highest among all elements, behind helium and neon,[16] which complicates the removal of electrons from neutral fluorine atoms. It also has a high electron affinity, second only to chlorine,[17] and tends to capture an electron to become isoelectronic with the noble gas neon;[15] it has the highest electronegativity of any reactive element.[18] Fluorine atoms have a small covalent radius of around 60 picometers, similar to those of its period neighbors oxygen and neon.[19][20][note 1]
التفاعلية
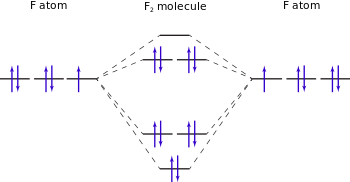
The bond energy of difluorine is much lower than that of either Cl 2 or Br 2 and similar to the easily cleaved peroxide bond; this, along with high electronegativity, accounts for fluorine's easy dissociation, high reactivity, and strong bonds to non-fluorine atoms.[21][22] Conversely, bonds to other atoms are very strong because of fluorine's high electronegativity. Unreactive substances like powdered steel, glass fragments, and asbestos fibers react quickly with cold fluorine gas; wood and water spontaneously combust under a fluorine jet.[23][24]
Reactions of elemental fluorine with metals require varying conditions. Alkali metals cause explosions and alkaline earth metals display vigorous activity in bulk; to prevent passivation from the formation of metal fluoride layers, most other metals such as aluminium and iron must be powdered,[21] and noble metals require pure fluorine gas at 300–450 °C (575–850 °F).[25] Some solid nonmetals (sulfur, phosphorus) react vigorously in liquid fluorine.[26] Hydrogen sulfide[26] and sulfur dioxide[27] combine readily with fluorine, the latter sometimes explosively; sulfuric acid exhibits much less activity, requiring elevated temperatures.[28]
Hydrogen, like some of the alkali metals, reacts explosively with fluorine.[29] Carbon, as lamp black, reacts at room temperature to yield tetrafluoromethane. Graphite combines with fluorine above 400 °C (750 °F) to produce non-stoichiometric carbon monofluoride; higher temperatures generate gaseous fluorocarbons, sometimes with explosions.[30] Carbon dioxide and carbon monoxide react at or just above room temperature,[31] whereas paraffins and other organic chemicals generate strong reactions:[32] even completely substituted haloalkanes such as carbon tetrachloride, normally incombustible, may explode.[33] Although nitrogen trifluoride is stable, nitrogen requires an electric discharge at elevated temperatures for reaction with fluorine to occur, due to the very strong triple bond in elemental nitrogen;[34] ammonia may react explosively.[35][36] Oxygen does not combine with fluorine under ambient conditions, but can be made to react using electric discharge at low temperatures and pressures; the products tend to disintegrate into their constituent elements when heated.[37][38][39] Heavier halogens[40] react readily with fluorine as does the noble gas radon;[41] of the other noble gases, only xenon and krypton react, and only under special conditions.[42] Argon does not react with fluorine gas; however, it does form a compound with fluorine, argon fluorohydride.
الأطوار
At room temperature, fluorine is a gas of diatomic molecules,[23] pale yellow when pure (sometimes described as yellow-green).[43] It has a characteristic halogen-like pungent and biting odor detectable at 20 ppb.[44] Fluorine condenses into a bright yellow liquid at −188 °C (−306 °F), a transition temperature similar to those of oxygen and nitrogen.[45]
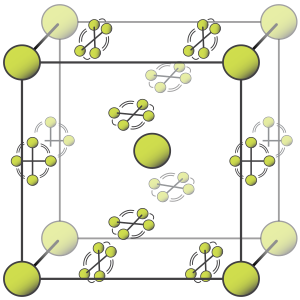
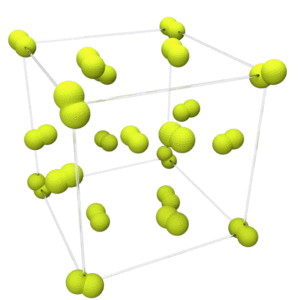
Fluorine has two solid forms, α- and β-fluorine. The latter crystallizes at −220 °C (−364 °F) and is transparent and soft, with the same disordered cubic structure of freshly crystallized solid oxygen,[45][note 2] unlike the orthorhombic systems of other solid halogens.[49][50] Further cooling to −228 °C (−378 °F) induces a phase transition into opaque and hard α-fluorine, which has a monoclinic structure with dense, angled layers of molecules. The transition from β- to α-fluorine is more exothermic than the condensation of fluorine, and can be violent.[49][50][note 3]
النظائر
Only one isotope of fluorine occurs naturally in abundance, the stable isotope 19 F.[51] It has a high magnetogyric ratio[note 4] and exceptional sensitivity to magnetic fields; because it is also the only stable isotope, it is used in magnetic resonance imaging.[53] Eighteen radioisotopes with mass numbers from 13 to 31 have been synthesized, of which 18 F is the most stable with a half-life of 109.77 minutes. 18 F is a natural trace radioisotope produced by cosmic ray spallation of atmospheric argon as well as by reaction of protons with natural oxygen: 18O + p → 18F + n.[54] Other radioisotopes have half-lives less than 70 seconds; most decay in less than half a second.[55] The isotopes 17 F and 18 F undergo β+ decay and electron capture, lighter isotopes decay by proton emission, and those heavier than 19 F undergo β− decay (the heaviest ones with delayed neutron emission).[55][56] Two metastable isomers of fluorine are known, 18m F, with a half-life of 162(7) nanoseconds, and 26m F, with a half-life of 2.2(1) milliseconds.[57]
التواجد
في الكون
| Atomic number |
Element | Relative amount |
|---|---|---|
| 6 | Carbon | 4,800 |
| 7 | Nitrogen | 1,500 |
| 8 | Oxygen | 8,800 |
| 9 | Fluorine | 1 |
| 10 | Neon | 1,400 |
| 11 | Sodium | 24 |
| 12 | Magnesium | 430 |
Among the lighter elements, fluorine's abundance value of 400 ppb (parts per billion) – 24th among elements in the universe – is exceptionally low: other elements from carbon to magnesium are twenty or more times as common.[59] This is because stellar nucleosynthesis processes bypass fluorine, and any fluorine atoms otherwise created have high nuclear cross sections, allowing collisions with hydrogen or helium to generate oxygen or neon respectively.[59][60]
Beyond this transient existence, three explanations have been proposed for the presence of fluorine:[59][61]
- during type II supernovae, bombardment of neon atoms by neutrinos could transmute them to fluorine;
- the solar wind of Wolf–Rayet stars could blow fluorine away from any hydrogen or helium atoms; or
- fluorine is borne out on convection currents arising from fusion in asymptotic giant branch stars.
على الأرض
لا يصادف الفلور حراً في القشرة الأرضية لأنه شديد النشاط الكيمياوي، وتبلغ نسبته في القشرة الأرضية (0.056%)، وتوضعاته مركـزة أهمها الفلوريت CaF2، والكريوليت Na3AlF6 والفلور أباتيت s3Ca(PO4)2.Ca(F,Cl)2. أما محتوى مياه البحر من أيون الفلور F- فمحدود لوجود أيونات الكلسيوم بتراكيز كبيرة، ولعدم انحلال فلوريد الكلسيوم]] في الماء.
النظير s19F هو النظير المستقر وهو الموجود في الطبيعة. أما النظير s18F فهو مشع وعمر نصفه 109.7 دقيقة وهو يستعمل للتقفي.
Fluorine is the thirteenth most common element in Earth's crust at 600–700 ppm (parts per million) by mass.[62] Though believed not to occur naturally, elemental fluorine has been shown to be present as an occlusion in antozonite, a variant of fluorite.[63] Most fluorine exists as fluoride-containing minerals. Fluorite, fluorapatite and cryolite are the most industrially significant.[62][64] Fluorite (CaF 2), also known as fluorspar, abundant worldwide, is the main source of fluoride, and hence fluorine. China and Mexico are the major suppliers.[64][65][66][67][68] Fluorapatite (Ca5(PO4)3F), which contains most of the world's fluoride, is an inadvertent source of fluoride as a byproduct of fertilizer production.[64] Cryolite (Na 3AlF 6), used in the production of aluminium, is the most fluorine-rich mineral. Economically viable natural sources of cryolite have been exhausted, and most is now synthesised commercially.[64]
Other minerals such as topaz contain fluorine. Fluorides, unlike other halides, are insoluble and do not occur in commercially favorable concentrations in saline waters.[64] Trace quantities of organofluorines of uncertain origin have been detected in volcanic eruptions and geothermal springs.[69] The existence of gaseous fluorine in crystals, suggested by the smell of crushed antozonite, is contentious;[70][63] a 2012 study reported the presence of 0.04% F 2 by weight in antozonite, attributing these inclusions to radiation from the presence of tiny amounts of uranium.[63]
تاريخ الفلور
 مقالة مفصلة: تاريخ الفلور
مقالة مفصلة: تاريخ الفلور
الاكتشافات المبكرة


إن الفلورسبار CaF2 هو الفلز الرئيسي الذي يُستحصل منه الفلور. يستعمل هذا الفلز في الصناعات التعدينية. وقد لُوحظ، في القرن السابع عشر، أن الفلورسبار الصلب يصدر ضوءاً عندما يُسخَّن، ودعيت هذه الظاهرة الفلورة fluorescence. وعندما تبيَّن في بداية القرن التاسع عشر أن الفلورسبار يحوي عنصراً جديداً F، اقترح أمبير A.Ampere أن يسميه الفلور.
الفلور في شكل الفلورسبار فلوريد الكالسيوم تم وصفه عام 1529 بواسطة جورج أجريكولا لإستخدامه كصهور، وهى المادة التي تستخدم لدفع عملية إنصهار المعادن والأملاح. وفي عام 1670 وجد شواندهارد أن الزجاج يحدث به حفر عند تعرضه للفلورسبار الذي تم معالجته بحمض. وقد قام كثيرون بتجارب على حمض الهيدروفلوريك، الذي يتم الحصول عليه بسهولة بمعاملة فلوريد الكالسيوم (فلورسبار) بحمض كبرتيك مركز، ومنهم كارل شيلي، همفرى دافي، جوزيف لويس جاى-لوساك، أنتونى لافوازير، لويس ثينارد.
وتم أخيرا إكتشاف أن حمض الهيدروفلوريك به عنصر لم يكتشف بعد. وهذا العنصر لم يتم عزله لعدة سنين بعد ذلك نظرا لنشاطه الفائق- وعند فصله من مركباته بصعوبة بالغه فإنه يهاجم المادة الباقية من المركب في الحال. وأخيرا في عام 1886 تم عزل الفلور عن طريق هنرى مويسان بعد 74 عام تقريبا من المحاولات. وقد كلفت هذه المحاولات عديد من الباحثين صحتهم، أو حتى حياتهم، وقد حصل مويسان على جائزة نوبل في الكيمياء عام 1916.
وأول إنتاج كبير للفلور كان عند إنتاج القنبلة الذرية مشروع مانهاتن في الحرب العالمية الثانية حيث تم إستخدام المركب هيكسا فلوريد اليورانيوم (UF6) لعزل U-235، و U-238نظائر اليورانيوم. وفي هذه الأيام يتم إستخدام (UF6) الغازي في عمليتي الإنتشار الغازي، وطرد الغاز مركزيا لإنتاج اليورانيوم الغني للتطبيقات التي تستخدم القوة النووية
Isolation
Initial studies on fluorine were so dangerous that several 19th-century experimenters were deemed "fluorine martyrs" after misfortunes with hydrofluoric acid.[note 5] Isolation of elemental fluorine was hindered by the extreme corrosiveness of both elemental fluorine itself and hydrogen fluoride, as well as the lack of a simple and suitable electrolyte.[71][72] Edmond Frémy postulated that electrolysis of pure hydrogen fluoride to generate fluorine was feasible and devised a method to produce anhydrous samples from acidified potassium bifluoride; instead, he discovered that the resulting (dry) hydrogen fluoride did not conduct electricity.[71][72][73] Frémy's former student Henri Moissan persevered, and after much trial and error found that a mixture of potassium bifluoride and dry hydrogen fluoride was a conductor, enabling electrolysis. To prevent rapid corrosion of the platinum in his electrochemical cells, he cooled the reaction to extremely low temperatures in a special bath and forged cells from a more resistant mixture of platinum and iridium, and used fluorite stoppers.[72][74] In 1886, after 74 years of effort by many chemists, Moissan isolated elemental fluorine.[73][75]
In 1906, two months before his death, Moissan received the Nobel Prize in Chemistry,[76] with the following citation:[72]
[I]n recognition of the great services rendered by him in his investigation and isolation of the element fluorine ... The whole world has admired the great experimental skill with which you have studied that savage beast among the elements.[note 6]
Later uses

The Frigidaire division of General Motors (GM) experimented with chlorofluorocarbon refrigerants in the late 1920s, and Kinetic Chemicals was formed as a joint venture between GM and DuPont in 1930 hoping to market Freon-12 (CCl 2F 2) as one such refrigerant. It replaced earlier and more toxic compounds, increased demand for kitchen refrigerators, and became profitable; by 1949 DuPont had bought out Kinetic and marketed several other Freon compounds.[77][78][79][80] Polytetrafluoroethylene (Teflon) was serendipitously discovered in 1938 by Roy J. Plunkett while working on refrigerants at Kinetic, and its superlative chemical and thermal resistance lent it to accelerated commercialization and mass production by 1941.[77][78][79]
Large-scale production of elemental fluorine began during World War II. Germany used high-temperature electrolysis to make tons of the planned incendiary chlorine trifluoride[81] and the Manhattan Project used huge quantities to produce uranium hexafluoride for uranium enrichment. Since UF 6 is as corrosive as fluorine, gaseous diffusion plants required special materials: nickel for membranes, fluoropolymers for seals, and liquid fluorocarbons as coolants and lubricants. This burgeoning nuclear industry later drove post-war fluorochemical development.[82]
Compounds
Fluorine has a rich chemistry, encompassing organic and inorganic domains. It combines with metals, nonmetals, metalloids, and most noble gases,[83] and almost exclusively assumes an oxidation state of −1.[note 7] Fluorine's high electron affinity results in a preference for ionic bonding; when it forms covalent bonds, these are polar, and almost always single.[86][87][note 8]
Metals
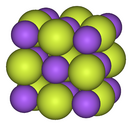
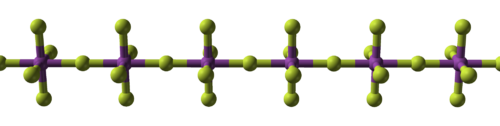
Alkali metals form ionic and highly soluble monofluorides; these have the cubic arrangement of sodium chloride and analogous chlorides.[88][89] Alkaline earth difluorides possess strong ionic bonds but are insoluble in water,[90] with the exception of beryllium difluoride, which also exhibits some covalent character and has a quartz-like structure.[91] Rare earth elements and many other metals form mostly ionic trifluorides.[92][93][94]
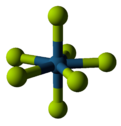
Covalent bonding first comes to prominence in the tetrafluorides: those of zirconium, hafnium[95][96] and several actinides[97] are ionic with high melting points,[98][note 9] while those of titanium,[101] vanadium,[102] and niobium are polymeric,[103] melting or decomposing at no more than 350 °C (660 °F).[104] Pentafluorides continue this trend with their linear polymers and oligomeric complexes.[105][106][107] Thirteen metal hexafluorides are known,[note 10] all octahedral, and are mostly volatile solids but for liquid MoF 6 and ReF 6, and gaseous WF 6.[108][109][110] Rhenium heptafluoride, the only characterized metal heptafluoride, is a low-melting molecular solid with pentagonal bipyramidal molecular geometry.[111] Metal fluorides with more fluorine atoms are particularly reactive.[112]
| Structural progression of metal fluorides | ||
|
|
|
| Sodium fluoride, ionic | Bismuth pentafluoride, polymeric | Rhenium heptafluoride, molecular |
Hydrogen
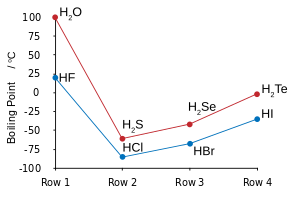
Hydrogen and fluorine combine to yield hydrogen fluoride, in which discrete molecules form clusters by hydrogen bonding, resembling water more than hydrogen chloride.[113][114][115] It boils at a much higher temperature than heavier hydrogen halides and unlike them is miscible with water.[116] Hydrogen fluoride readily hydrates on contact with water to form aqueous hydrogen fluoride, also known as hydrofluoric acid. Unlike the other hydrohalic acids, which are strong, hydrofluoric acid is a weak acid at low concentrations.[117][note 11] However, it can attack glass, something the other acids cannot do.[119]
Other reactive nonmetals

Binary fluorides of metalloids and p-block nonmetals are generally covalent and volatile, with varying reactivities. Period 3 and heavier nonmetals can form hypervalent fluorides.[121]
Boron trifluoride is planar and possesses an incomplete octet. It functions as a Lewis acid and combines with Lewis bases like ammonia to form adducts.[122] Carbon tetrafluoride is tetrahedral and inert;[note 12] its group analogues, silicon and germanium tetrafluoride, are also tetrahedral[123] but behave as Lewis acids.[124][125] The pnictogens form trifluorides that increase in reactivity and basicity with higher molecular weight, although nitrogen trifluoride resists hydrolysis and is not basic.[126] The pentafluorides of phosphorus, arsenic, and antimony are more reactive than their respective trifluorides, with antimony pentafluoride the strongest neutral Lewis acid known, only behind gold pentafluoride.[105][127][128]
Chalcogens have diverse fluorides: unstable difluorides have been reported for oxygen (the only known compound with oxygen in an oxidation state of +2), sulfur, and selenium; tetrafluorides and hexafluorides exist for sulfur, selenium, and tellurium. The latter are stabilized by more fluorine atoms and lighter central atoms, so sulfur hexafluoride is especially inert.[129][130] Chlorine, bromine, and iodine can each form mono-, tri-, and pentafluorides, but only iodine heptafluoride has been characterized among possible interhalogen heptafluorides.[131] Many of them are powerful sources of fluorine atoms, and industrial applications using chlorine trifluoride require precautions similar to those using fluorine.[132][133]
Noble gases
Noble gases, having complete electron shells, defied reaction with other elements until 1962 when Neil Bartlett reported synthesis of xenon hexafluoroplatinate;[135] xenon difluoride, tetrafluoride, hexafluoride, and multiple oxyfluorides have been isolated since then.[136] Among other noble gases, krypton forms a difluoride,[137] and radon and fluorine generate a solid suspected to be radon difluoride.[138][139] Binary fluorides of lighter noble gases are exceptionally unstable: argon and hydrogen fluoride combine under extreme conditions to give argon fluorohydride.[42] Helium has no long-lived fluorides,[140] and no neon fluoride has ever been observed;[141] helium fluorohydride has been detected for milliseconds at high pressures and low temperatures.[140]
Organic compounds

The carbon–fluorine bond is organic chemistry's strongest,[143] and gives stability to organofluorines.[144] It is almost non-existent in nature, but is used in artificial compounds. Research in this area is usually driven by commercial applications;[145] the compounds involved are diverse and reflect the complexity inherent in organic chemistry.[78]
Discrete molecules
The substitution of hydrogen atoms in an alkane by progressively more fluorine atoms gradually alters several properties: melting and boiling points are lowered, density increases, solubility in hydrocarbons decreases and overall stability increases. Perfluorocarbons,[note 13] in which all hydrogen atoms are substituted, are insoluble in most organic solvents, reacting at ambient conditions only with sodium in liquid ammonia.[146]
The term perfluorinated compound is used for what would otherwise be a perfluorocarbon if not for the presence of a functional group,[147][note 14] often a carboxylic acid. These compounds share many properties with perfluorocarbons such as stability and hydrophobicity,[149] while the functional group augments their reactivity, enabling them to adhere to surfaces or act as surfactants;[150] Fluorosurfactants, in particular, can lower the surface tension of water more than their hydrocarbon-based analogues. Fluorotelomers, which have some unfluorinated carbon atoms near the functional group, are also regarded as perfluorinated.[149]
Polymers
Polymers exhibit the same stability increases afforded by fluorine substitution (for hydrogen) in discrete molecules; their melting points generally increase too.[151] Polytetrafluoroethylene (PTFE), the simplest fluoropolymer and perfluoro analogue of polyethylene with structural unit –CF 2–, demonstrates this change as expected, but its very high melting point makes it difficult to mold.[152] Various PTFE derivatives are less temperature-tolerant but easier to mold: fluorinated ethylene propylene replaces some fluorine atoms with trifluoromethyl groups, perfluoroalkoxy alkanes do the same with trifluoromethoxy groups,[152] and Nafion contains perfluoroether side chains capped with sulfonic acid groups.[153][154] Other fluoropolymers retain some hydrogen atoms; polyvinylidene fluoride has half the fluorine atoms of PTFE and polyvinyl fluoride has a quarter, but both behave much like perfluorinated polymers.[155]
الخواص الفيزيائية والكيمائية
الفلـور غـاز أصفر شـاحـب أكال وعامل مؤكسد قوي. وزنـه الذري 18.998، درجـة حرارة انصهاره -220 ْس، درجة حرارة غليانه -188 ْس، كتلته الحجمية 1.7غ/ل، نصف القطـر الـذري 72 بيكومتر، نصف قطـر الأيـون 119:F - بيكومتر، الكهرسلبية (السالبية الكهربائية): 4 وفـق مقياس بولنغ، كمـون الإرجـاع القياسي X2 + 2e- ® 2X- يساوي 2.87، عدد الأكسدة -1، طاقة التأين 1681 كيلو جول/مول.
وهو أكثر العناصر نشاطية وسالبية كهربية على الإطلاق، ويكون مركبات بسرعة مع العناصر الأخرى. يتحد الفلور مع الغازات النبيلة مثل الكربتون، والزينون، وال[برادون]]. حتى في الظلام، والبرودة، يتفاعل الفلور بشدة مع الهيدروجين. وهو نشط لدرجة أنه لا يوجد في حالته العنصرية وله انجذاب لمعظم الفلزات، بما فيها السيليكون، ولذلك لا يمكن تحضيره أو تخزينه في آنية زجاجية. في الهواء الذي يحتوى على بخار الماء يتفاعل بسرعة مع الماء لينتج حمض هيدروفلوريك شديد الخطورة.
وفي المحاليل المائية، يتواجد الفلور عامة كأيون الفلوريد ion F-</sup والأشكال الأخرى معقدات الفلور (مثل [FeF4]- أو H2F+</sup)

|

|
| Phase diagram of fluorine | Alpha-fluorine crystal structure |
الفلور أنشط عناصر الجدول الدوري جميعاً، يعود هذا النشاط إلى ضعف الرابطة بين ذرتي الفلور في جزيئه F2، فالفلور يؤكسد المعادن جميعها ويكوِّن معها مركبات تدعى الفلوريدات. مثال ذلك فلوريد الصوديوم NaF و[[فلوريد الحديد FeF3 ([[III) ، كما يتفاعل مع باقي العناصر جميعاً باستثناء الأكسجين والآزوت والكلور والغازات الخاملة الخفيفة.
للفلور أكسيدان O2F2 وOF2.
الأكسيد OF2 غاز لا لون له ويُحصل عليه بفعل F2 على محلول NaOH:
2F2 + 2NaOH ® 2NaF + OF2 + H2O
والأكسيد OF2 نشيط كيمياوياً يتفاعل مع المعادن والكبريت والفسفور والهالوجينات مكوّناً فلوريدات وأكاسيد، ومع الماء مكوناً محلولاً معتدلاً، فهو ليس بلا ماء حمضياً.
والأكسيد O2F2 وهو جسم صلب نارنجي محمر، يستحضر بإمرار شرارة كهربائية في مزيج من الأكسجين والكلور تحت ضغط مخفَّف عند درجـة الحـرارة -165 ْس. وهو غير ثابت يتفكك إلى عناصره التي يتألف منها عند درجة الحرارة -95 ْس، وهي درجة حرارة غليانه.
الهيكل الالكتروني
|
التفاعلات الكيميائية
| X | XX | HX | BX3 | AlX3 | CX4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| I | 151 | 294 | 272 | 285 | 239 |
مركبات الفلور
يحل الفلور في كثير من الأحيان محل الهيدرجين في المركبات العضوية، ولذلك فإن الفلور يتمكن من الدخول في عدد هائل من المركبات. مركبات الفلور وبينها لاغازات النبيلة تم تصنيعها لأول مرة عن طريق نيل بارتليت في عام 1962 – زينون هيكسا فلورو بلانتينات XePtF6 كان اولها. ثم تم تصنيع فلوريدات الكرتون والرادون بعد ذلك.
هذا العنصر تم الحصول عليه من فلوريت، كريوليت، فلوروأباتيت

غير العضوية
فلوريد الهيدروجين
وهو غاز سام جداً لا لون له ينصهر عند الدرجة -83 ْس، ويغلي عند الدرجة 20 ْس، له رائحة واخزة ويدخِّن بشدة في الهواء الرطب، وهو شديد الانحلال في الماء وهو حمض ضعيف، ويحفظ في أوعية من النحاس لأنه يتفاعل بشدة مع الزجاج.
 مقالات مفصلة: حامض الهيدروفلوريك
مقالات مفصلة: حامض الهيدروفلوريك - فلوريد الهيدروجين
فلوريدات المعادن
فلوريد الليثيوم LiF وفلوريدات المعادن القلوية الترابية، وفلوريدات معادن الأتربة النادرة (زمرة اللنتانيوم) وهي ضعيفة الانحلال في الماء. ويدخل أيون الفلور في تشكيل معقدات كثيرة بعضها صيغته MXm- مثال ذلك SiF 62- وبعضها الآخـر يكون فيها مرتبط ligand آخـر إضافة إلى الفلوريد مثال ذلك +[Co(NH3)4F2].
وتشكل فلوريدات المعادن أملاحاً حمضية مثال ذلك KHF2 وKH3F4.
حالات الأكسدة المنخفضة

Alkaline earth metals fluorides solubility-related constants[note 15] Metal
M2+
HE
[157]F-
HE
[158]"MF2"
unit
HEMF2
lattice
energies
[159]Solubility
[160]Be 2,455 458 3,371 3,526 soluble Mg 1,922 458 2,838 2,978 0.0012 Ca 1,577 458 2,493 2,651 0.0002 Sr 1,415 458 2,331 2,513 0.0008 Ba 1,361 458 2,277 2,373 0.006
حالات الأكسدة العالية
فلوريدات غير المعادن
مفرط الحموضة
 مقالة مفصلة: مفرط الحموضة
مقالة مفصلة: مفرط الحموضة
مركبات الغازات النبيلة
 مقالة مفصلة: مركبات الغازات النبيلة
مقالة مفصلة: مركبات الغازات النبيلة
التأكسد الأعلى: الفلور مقابل الأكسجين
| Ruthenium's highest fluoride and oxide | |
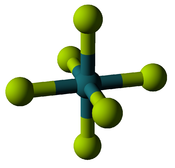
|

|
| Ruthenium hexafluoride: Six fluorines fit around the ruthenium but only make a +6 oxidation state. | Ruthenium tetroxide: Four oxygens fit around the ruthenium, making a +8 oxidation state. |
العضوية
 مقالة مفصلة: كيمياء الفلور العضوي
مقالة مفصلة: كيمياء الفلور العضوي

|

|

|
|
|

|
|---|---|---|---|---|---|
| Fluoromethane (methyl fluoride), used in semiconductor processing |
Tetrafluoroethane (R-134a), a HFC |
Dichlorodifluoromethane (R-12 refrigerant), a CFC |
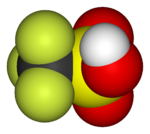
Trifluoromethanesulfonic acid (triflic acid), a superacid |
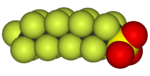
Perfluorooctanesulfonic acid, a fluorosurfactant (the anion is depicted) |
A section of polytetrafluoroethylene (Teflon) polymer |
الجزيئات الصغيرة

تكون هذه المركبات عادة، طيارة باستثناء البوليمرات polymers مثال ذلك التفلون (-CF2-)m. ومعظم العناصر الكهرسلبية، والمعادن بدرجات الأكسدة العالية (5 أو6) تكوِّن فلوريدات جزيئية. وتختلف الفلوريدات الجزيئية بخواصها بعضها عن بعض حسب العنصر الآخر المتحد مع الفلور فيها.
البوليمرات
مركبات ما بين الهالوجينات
يكوّن الفلور العديد من المركبات مع باقي عناصر فصيلته. مثال ذلك BrF, ClF وهما جزيئان قطبيان مكوّنان من ذرتين، أما F2 فهو غير قطبي. وهذه المركبات تتحلل بالماء بسرعة مقارنة مع سرعات تحلل الهالوجينات نفسها. ويكوّن الفلور أيضاً مركبات صيغها XFn. مثال ذلك BrF3 وIFn ويكون n عدداً فردياً وهي مواد ذات مغنطيسية عكسية.[161]
علاقته بالإنسان
يدخل الفلور في تركيب مينا الأسنان والبناء العظمي كما يسهل عملية امتصاص الجسم للعناصر الأخرى مثل الكالسيوم والماغنسيوم وأيضاً يساعد على إبطاء هشاشة العظام.
والنقص في عنصر الفلور يؤدي إلى حالات التواء العمود الفقري وتأخر التئام العظام المكسورة بالإضافة إلى تسوس الأسنان، ونذكر أن الزيادة في نسبة الفلور تؤدي إلى إصابة الأسنان ببقع غامقة اللون.
ومصادر الفلور في غذاء الإنسان تشمل مشروب الشاي وبعض أصناف المياه المعدنية والأسماك البحرية.
الانتاج
Elemental fluorine and virtually all fluorine compounds are produced from hydrogen fluoride or its aqueous solutions, hydrofluoric acid. Hydrogen fluoride is produced in kilns by the endothermic reaction of fluorite (CaF2) with sulfuric acid:[162]
- CaF2 + H2SO4 → 2 HF(g) + CaSO4
The gaseous HF can then be absorbed in water or liquefied.[163]
About 20% of manufactured HF is a byproduct of fertilizer production, which produces hexafluorosilicic acid (H2SiF6), which can be degraded to release HF thermally and by hydrolysis:
- H2SiF6 → 2 HF + SiF4
- SiF4 + 2 H2O → 4 HF + SiO2
Industrial routes to F2

Moissan's method is used to produce industrial quantities of fluorine, via the electrolysis of a potassium bifluoride/hydrogen fluoride mixture: hydrogen and fluoride ions are reduced and oxidized at a steel container cathode and a carbon block anode, under 8–12 volts, to generate hydrogen and fluorine gas respectively.[66][164] Temperatures are elevated, KF•2HF melting at 70 °C (158 °F) and being electrolyzed at 70–130 °C (158–266 °F). KF, which acts to provide electrical conductivity, is essential since pure HF cannot be electrolyzed because it is virtually non-conductive.[77][165][166] Fluorine can be stored in steel cylinders that have passivated interiors, at temperatures below 200 °C (392 °F); otherwise nickel can be used.[77][167] Regulator valves and pipework are made of nickel, the latter possibly using Monel instead.[168] Frequent passivation, along with the strict exclusion of water and greases, must be undertaken. In the laboratory, glassware may carry fluorine gas under low pressure and anhydrous conditions;[168] some sources instead recommend nickel-Monel-PTFE systems.[169]
Laboratory routes
While preparing for a 1986 conference to celebrate the centennial of Moissan's achievement, Karl O. Christe reasoned that chemical fluorine generation should be feasible since some metal fluoride anions have no stable neutral counterparts; their acidification potentially triggers oxidation instead. He devised a method which evolves fluorine at high yield and atmospheric pressure:[170]
- 2 KMnO4 + 2 KF + 10 HF + 3 H2O2 → 2 K2MnF6 + 8 H2O + 3 O2↑
- 2 K2MnF6 + 4 SbF5 → 4 KSbF6 + 2 MnF3 + F2↑
Christe later commented that the reactants "had been known for more than 100 years and even Moissan could have come up with this scheme."[171] As late as 2008, some references still asserted that fluorine was too reactive for any chemical isolation.[172]
الإستخدامات
الصناعة
يستخدم الفلور في إنتاج اللدائن ذات الأحتكاك القليل مثل التيفلون، وفي الهالون ألكانات مثل الفريون. ومن إستخداماته الأخرى:
- حمض الهيدروفلوريك (HF) يستخدم للحفر على الزجاج في المصابيح والمنتجات الأخرى.
- الفلور أحادي الذرة يستخدم في رماد البلازما في تصنيع أشباه الموصلات.
- ومع مركباته يستخدم الفلور في إنتاج اليورانيوم (من الهيكسافلورايد)، وفي أكثر من الكيمويات الفلورية، منها اللدائن التي تتحمل درجة الحرارة العالية.
- يستخدم هيدرو كلورو فلورو كربون بكثرة في مكيفات الهواء وفي التبريد. وقد تم حظر إستخدام كلورو فلورو كربون نظرا لوجود شك في أنه سبب في ثقب الأوزون.
- سادس فلوريد الكبريت خامل للغاية (وعلى غير عادة مركبات الفلور) غير سام. وهذه المجموعة من المركبات فعالة ومهمة في الصوب الزجاجية.
- بوتاسيوم هيكسا فلورو ألومينات، والذي يسمى أيضا كريوليت يستخدم التحليل الكهربي للألومنيوم.
- فلوريد الصوديوم يستخدم كمبيد للحشرات، وخاصة الصراصير.
- بعض أوان الفلوريدات تضاف لمعجون الأسنان، كما أنها تضاف للمياه العمومية لمنع تسوس الأسنان.
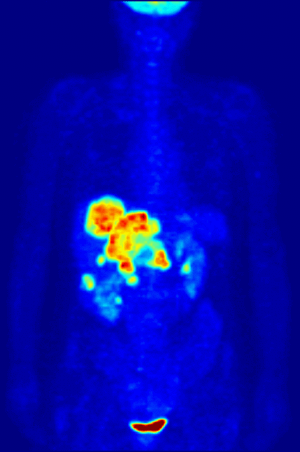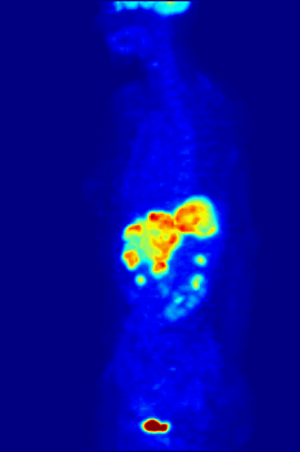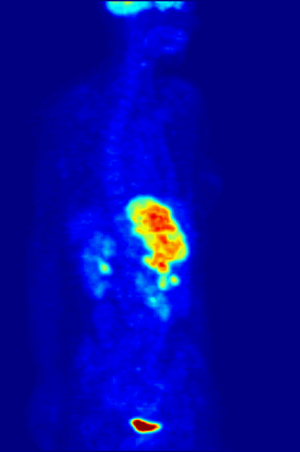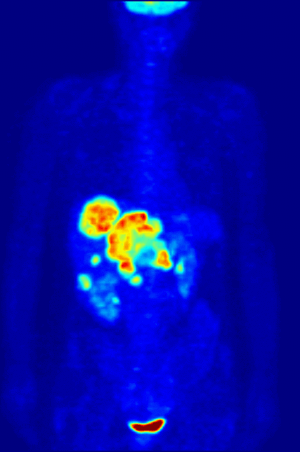
- كما أن الفلور كان يستخدم قديما للمساعدة في إذابة مصهور المعادن، ومن ثم فلور-18 النظير النشيط إشعاعيا الذي ينبعث منه البوزيترونات، غالبا ما يستخدم في التصوير بإنبعاث البوزيترون نظرا لأن له فترة عمر نصف تبلغ 110 دقيقة.
دارت بعض الأبحاث – متضمنة علمء الفضاء الأمريكان في أوائل الستينات من القرن العشرين- بدراشة الفلور في حالته العنصرية ليكون وقود للصواريخ نظرا لقوة دفعه الفائقة. وقد فشلت هذه التجارب نظرا لصعوبة التعامل مع الفلور.
التطبيقات الصناعية
Fluorite mining, which supplies most global fluorine, peaked in 1989 when 5.6 million metric tons of ore were extracted. Chlorofluorocarbon restrictions lowered this to 3.6 million tons in 1994; production has since been increasing. Around 4.5 million tons of ore and revenue of US$550 million were generated in 2003; later reports estimated 2011 global fluorochemical sales at $15 billion and predicted 2016–18 production figures of 3.5 to 5.9 million tons, and revenue of at least $20 billion.[77][173][174][175][176] Froth flotation separates mined fluorite into two main metallurgical grades of equal proportion: 60–85% pure metspar is almost all used in iron smelting whereas 97%+ pure acidspar is mainly converted to the key industrial intermediate hydrogen fluoride.[66][77][177]
At least 17,000 metric tons of fluorine are produced each year. It costs only $5–8 per kilogram as uranium or sulfur hexafluoride, but many times more as an element because of handling challenges. Most processes using free fluorine in large amounts employ in situ generation under vertical integration.[178]
The largest application of fluorine gas, consuming up to 7,000 metric tons annually, is in the preparation of UF 6 for the nuclear fuel cycle. Fluorine is used to fluorinate uranium tetrafluoride, itself formed from uranium dioxide and hydrofluoric acid.[178] Fluorine is monoisotopic, so any mass differences between UF 6 molecules are due to the presence of 235 U or 238 U, enabling uranium enrichment via gaseous diffusion or gas centrifuge.[23][66] About 6,000 metric tons per year go into producing the inert dielectric SF 6 for high-voltage transformers and circuit breakers, eliminating the need for hazardous polychlorinated biphenyls associated with oil-filled devices.[179] Several fluorine compounds are used in electronics: rhenium and tungsten hexafluoride in chemical vapor deposition, tetrafluoromethane in plasma etching[180][181][182] and nitrogen trifluoride in cleaning equipment.[66] Fluorine is also used in the synthesis of organic fluorides, but its reactivity often necessitates conversion first to the gentler ClF 3, BrF 3, or IF 5, which together allow calibrated fluorination. Fluorinated pharmaceuticals use sulfur tetrafluoride instead.[66]
Inorganic fluorides
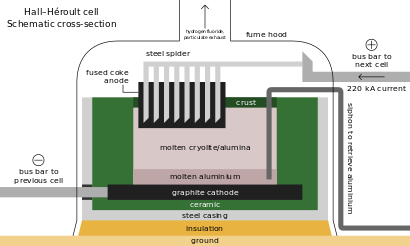
As with other iron alloys, around 3 kg (6.5 lb) metspar is added to each metric ton of steel; the fluoride ions lower its melting point and viscosity.[66][183] Alongside its role as an additive in materials like enamels and welding rod coats, most acidspar is reacted with sulfuric acid to form hydrofluoric acid, which is used in steel pickling, glass etching and alkane cracking.[66] One-third of HF goes into synthesizing cryolite and aluminium trifluoride, both fluxes in the Hall–Héroult process for aluminium extraction; replenishment is necessitated by their occasional reactions with the smelting apparatus. Each metric ton of aluminium requires about 23 kg (51 lb) of flux.[66][184] Fluorosilicates consume the second largest portion, with sodium fluorosilicate used in water fluoridation and laundry effluent treatment, and as an intermediate en route to cryolite and silicon tetrafluoride.[185] Other important inorganic fluorides include those of cobalt, nickel, and ammonium.[66][89][186]
Organic fluorides
Organofluorides consume over 20% of mined fluorite and over 40% of hydrofluoric acid, with refrigerant gases dominating and fluoropolymers increasing their market share.[66][187] Surfactants are a minor application but generate over $1 billion in annual revenue.[188] Due to the danger from direct hydrocarbon–fluorine reactions above −150 °C (−240 °F), industrial fluorocarbon production is indirect, mostly through halogen exchange reactions such as Swarts fluorination, in which chlorocarbon chlorines are substituted for fluorines by hydrogen fluoride under catalysts. Electrochemical fluorination subjects hydrocarbons to electrolysis in hydrogen fluoride, and the Fowler process treats them with solid fluorine carriers like cobalt trifluoride.[78][189]
Refrigerant gases
Halogenated refrigerants, termed Freons in informal contexts,[note 16] are identified by R-numbers that denote the amount of fluorine, chlorine, carbon, and hydrogen present.[66][190] Chlorofluorocarbons (CFCs) like R-11, R-12, and R-114 once dominated organofluorines, peaking in production in the 1980s. Used for air conditioning systems, propellants and solvents, their production was below one-tenth of this peak by the early 2000s, after widespread international prohibition.[66] Hydrochlorofluorocarbons (HCFCs) and hydrofluorocarbons (HFCs) were designed as replacements; their synthesis consumes more than 90% of the fluorine in the organic industry. Important HCFCs include R-22, chlorodifluoromethane, and R-141b. The main HFC is R-134a[66] with a new type of molecule HFO-1234yf, a Hydrofluoroolefin (HFO) coming to prominence owing to its global warming potential of less than 1% that of HFC-134a.[191]
Polymers

About 180,000 metric tons of fluoropolymers were produced in 2006 and 2007, generating over $3.5 billion revenue per year.[192] The global market was estimated at just under $6 billion in 2011 and was predicted to grow by 6.5% per year up to 2016.[193] Fluoropolymers can only be formed by polymerizing free radicals.[151]
Polytetrafluoroethylene (PTFE), sometimes called by its DuPont name Teflon,[194] represents 60–80% by mass of the world's fluoropolymer production.[192] The largest application is in electrical insulation since PTFE is an excellent dielectric. It is also used in the chemical industry where corrosion resistance is needed, in coating pipes, tubing, and gaskets. Another major use is in PFTE-coated fiberglass cloth for stadium roofs. The major consumer application is for non-stick cookware.[194] Jerked PTFE film becomes expanded PTFE (ePTFE), a fine-pored membrane sometimes referred to by the brand name Gore-Tex and used for rainwear, protective apparel, and filters; ePTFE fibers may be made into seals and dust filters.[194] Other fluoropolymers, including fluorinated ethylene propylene, mimic PTFE's properties and can substitute for it; they are more moldable, but also more costly and have lower thermal stability. Films from two different fluoropolymers replace glass in solar cells.[194][195]
The chemically resistant (but expensive) fluorinated ionomers are used as electrochemical cell membranes, of which the first and most prominent example is Nafion. Developed in the 1960s, it was initially deployed as fuel cell material in spacecraft and then replaced mercury-based chloralkali process cells. Recently, the fuel cell application has reemerged with efforts to install proton exchange membrane fuel cells into automobiles.[196][197][198] Fluoroelastomers such as Viton are crosslinked fluoropolymer mixtures mainly used in O-rings;[194] perfluorobutane (C4F10) is used as a fire-extinguishing agent.[199]
Surfactants
Fluorosurfactants are small organofluorine molecules used for repelling water and stains. Although expensive (comparable to pharmaceuticals at $200–2000 per kilogram), they yielded over $1 billion in annual revenues by 2006; Scotchgard alone generated over $300 million in 2000.[188][200][201] Fluorosurfactants are a minority in the overall surfactant market, most of which is taken up by much cheaper hydrocarbon-based products. Applications in paints are burdened by compounding costs; this use was valued at only $100 million in 2006.[188]
الكيماويات الزراعية
About 30% of agrichemicals contain fluorine,[202] most of them herbicides and fungicides with a few crop regulators. Fluorine substitution, usually of a single atom or at most a trifluoromethyl group, is a robust modification with effects analogous to fluorinated pharmaceuticals: increased biological stay time, membrane crossing, and altering of molecular recognition.[203] Trifluralin is a prominent example, with large-scale use in the U.S. as a weedkiller,[203][204] but it is a suspected carcinogen and has been banned in many European countries.[205] Sodium monofluoroacetate (1080) is a mammalian poison in which two acetic acid hydrogens are replaced with fluorine and sodium; it disrupts cell metabolism by replacing acetate in the citric acid cycle. First synthesized in the late 19th century, it was recognized as an insecticide in the early 20th, and was later deployed in its current use. New Zealand, the largest consumer of 1080, uses it to protect kiwis from the invasive Australian common brushtail possum.[206] Europe and the U.S. have banned 1080.[207][208][note 17]
التطبيقات الدوائية
العناية بالأسنان
 مقالات مفصلة: العلاج الفلوريد
مقالات مفصلة: العلاج الفلوريد - فلورة المياه
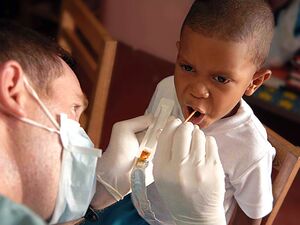
Population studies from the mid-20th century onwards show topical fluoride reduces dental caries. This was first attributed to the conversion of tooth enamel hydroxyapatite into the more durable fluorapatite, but studies on pre-fluoridated teeth refuted this hypothesis, and current theories involve fluoride aiding enamel growth in small caries.[209] After studies of children in areas where fluoride was naturally present in drinking water, controlled public water supply fluoridation to fight tooth decay[210] began in the 1940s and is now applied to water supplying 6 percent of the global population, including two-thirds of Americans.[211][212] Reviews of the scholarly literature in 2000 and 2007 associated water fluoridation with a significant reduction of tooth decay in children.[213] Despite such endorsements and evidence of no adverse effects other than mostly benign dental fluorosis,[214] opposition still exists on ethical and safety grounds.[212][215] The benefits of fluoridation have lessened, possibly due to other fluoride sources, but are still measurable in low-income groups.[216] Sodium monofluorophosphate and sometimes sodium or tin(II) fluoride are often found in fluoride toothpastes, first introduced in the U.S. in 1955 and now ubiquitous in developed countries, alongside fluoridated mouthwashes, gels, foams, and varnishes.[216][217]
الصيدلة
Twenty percent of modern pharmaceuticals contain fluorine.[218] One of these, the cholesterol-reducer atorvastatin (Lipitor), made more revenue than any other drug until it became generic in 2011.[219] The combination asthma prescription Seretide, a top-ten revenue drug in the mid-2000s, contains two active ingredients, one of which – fluticasone – is fluorinated.[220] Many drugs are fluorinated to delay inactivation and lengthen dosage periods because the carbon–fluorine bond is very stable.[221] Fluorination also increases lipophilicity because the bond is more hydrophobic than the carbon–hydrogen bond, and this often helps in cell membrane penetration and hence bioavailability.[220]
Tricyclics and other pre-1980s antidepressants had several side effects due to their non-selective interference with neurotransmitters other than the serotonin target; the fluorinated fluoxetine was selective and one of the first to avoid this problem. Many current antidepressants receive this same treatment, including the selective serotonin reuptake inhibitors: citalopram, its isomer escitalopram, and fluvoxamine and paroxetine.[222][223] Quinolones are artificial broad-spectrum antibiotics that are often fluorinated to enhance their effects. These include ciprofloxacin and levofloxacin.[224][225][226][227] Fluorine also finds use in steroids:[228] fludrocortisone is a blood pressure-raising mineralocorticoid, and triamcinolone and dexamethasone are strong glucocorticoids.[229] The majority of inhaled anesthetics are heavily fluorinated; the prototype halothane is much more inert and potent than its contemporaries. Later compounds such as the fluorinated ethers sevoflurane and desflurane are better than halothane and are almost insoluble in blood, allowing faster waking times.[230][231]
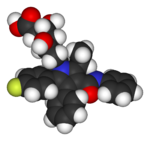
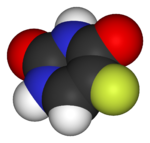
|
|

|
|

|
|---|---|---|---|---|
| Lipitor (atorvastatin) | 5-FU (fluorouracil) | Florinef (fludrocortisone) | Isoflurane | Trifluralin |
الكيمياويات الزراعية والسموم الطبيعية
المسح الضوئي
 مقالات مفصلة: التصوير المقطعي بالإصدار البوزيتروني
مقالات مفصلة: التصوير المقطعي بالإصدار البوزيتروني - Fludeoxyglucose (18F)
Fluorine-18 is often found in radioactive tracers for positron emission tomography, as its half-life of almost two hours is long enough to allow for its transport from production facilities to imaging centers.[232] The most common tracer is fluorodeoxyglucose[232] which, after intravenous injection, is taken up by glucose-requiring tissues such as the brain and most malignant tumors;[233] computer-assisted tomography can then be used for detailed imaging.[234]
Oxygen carriers
Liquid fluorocarbons can hold large volumes of oxygen or carbon dioxide, more so than blood, and have attracted attention for their possible uses in artificial blood and in liquid breathing.[235] Because fluorocarbons do not normally mix with water, they must be mixed into emulsions (small droplets of perfluorocarbon suspended in water) to be used as blood.[236][237] One such product, Oxycyte, has been through initial clinical trials.[238] These substances can aid endurance athletes and are banned from sports; one cyclist's near death in 1998 prompted an investigation into their abuse.[239][240] Applications of pure perfluorocarbon liquid breathing (which uses pure perfluorocarbon liquid, not a water emulsion) include assisting burn victims and premature babies with deficient lungs. Partial and complete lung filling have been considered, though only the former has had any significant tests in humans.[241] An Alliance Pharmaceuticals effort reached clinical trials but was abandoned because the results were not better than normal therapies.[242]
الدور الحيوي

Fluorine is not essential for humans and other mammals, but small amounts are known to be beneficial for the strengthening of dental enamel (where the formation of fluorapatite makes the enamel more resistant to attack, from acids produced by bacterial fermentation of sugars). Small amounts of fluorine may be beneficial for bone strength, but the latter has not been definitively established.[243] Both the WHO and the Institute of Medicine of the US National Academies publish recommended daily allowance (RDA) and upper tolerated intake of fluorine, which varies with age and gender.[244][245]
Natural organofluorines have been found in microorganisms and plants[69] but not animals.[246] The most common is fluoroacetate, which is used as a defense against herbivores by at least 40 plants in Africa, Australia and Brazil.[207] Other examples include terminally fluorinated fatty acids, fluoroacetone, and 2-fluorocitrate.[246] An enzyme that binds fluorine to carbon – adenosyl-fluoride synthase – was discovered in bacteria in 2002.[247]
السمية
Elemental fluorine is highly toxic to living organisms. Its effects in humans start at concentrations lower than hydrogen cyanide's 50 ppm[248] and are similar to those of chlorine:[249] significant irritation of the eyes and respiratory system as well as liver and kidney damage occur above 25 ppm, which is the immediately dangerous to life and health value for fluorine.[250] The eyes and nose are seriously damaged at 100 ppm,[250] and inhalation of 1,000 ppm fluorine will cause death in minutes,[251] compared to 270 ppm for hydrogen cyanide.[252]
حمض الهيدروفلوريك
| المخاطر | |
|---|---|
| ن.م.ع. مخطط تصويري |      
|
| ن.م.ع. كلمة الاشارة | Danger |
| H270, H314, H330[253] | |
| NFPA 704 (معيـَّن النار) | |
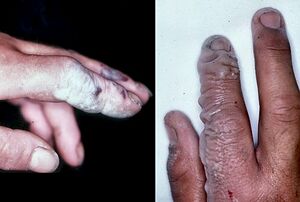
Hydrofluoric acid is the weakest of the hydrohalic acids, having a pKa of 3.2 at 25 °C.[255] It is a volatile liquid due to the presence of hydrogen bonding (while the other hydrohalic acids are gases). It is able to attack glass, concrete, metals, and organic matter.[256]
Hydrofluoric acid is a contact poison with greater hazards than many strong acids like sulfuric acid even though it is weak: it remains neutral in aqueous solution and thus penetrates tissue faster, whether through inhalation, ingestion or the skin, and at least nine U.S. workers died in such accidents from 1984 to 1994. It reacts with calcium and magnesium in the blood leading to hypocalcemia and possible death through cardiac arrhythmia.[257] Insoluble calcium fluoride formation triggers strong pain[258] and burns larger than 160 cm2 (25 in2) can cause serious systemic toxicity.[259]
Exposure may not be evident for eight hours for 50% HF, rising to 24 hours for lower concentrations, and a burn may initially be painless as hydrogen fluoride affects nerve function. If skin has been exposed to HF, damage can be reduced by rinsing it under a jet of water for 10–15 minutes and removing contaminated clothing.[260] Calcium gluconate is often applied next, providing calcium ions to bind with fluoride; skin burns can be treated with 2.5% calcium gluconate gel or special rinsing solutions.[261][262][263] Hydrofluoric acid absorption requires further medical treatment; calcium gluconate may be injected or administered intravenously. Using calcium chloride – a common laboratory reagent – in lieu of calcium gluconate is contraindicated, and may lead to severe complications. Excision or amputation of affected parts may be required.[259][264]
أيون الفلوريد
Soluble fluorides are moderately toxic: 5–10 g sodium fluoride, or 32–64 mg fluoride ions per kilogram of body mass, represents a lethal dose for adults.[265] One-fifth of the lethal dose can cause adverse health effects,[266] and chronic excess consumption may lead to skeletal fluorosis, which affects millions in Asia and Africa.[266][267] Ingested fluoride forms hydrofluoric acid in the stomach which is easily absorbed by the intestines, where it crosses cell membranes, binds with calcium and interferes with various enzymes, before urinary excretion. Exposure limits are determined by urine testing of the body's ability to clear fluoride ions.[266][268]
Historically, most cases of fluoride poisoning have been caused by accidental ingestion of insecticides containing inorganic fluorides.[269] Most current calls to poison control centers for possible fluoride poisoning come from the ingestion of fluoride-containing toothpaste.[266] Malfunctioning water fluoridation equipment is another cause: one incident in Alaska affected almost 300 people and killed one person.[270] Dangers from toothpaste are aggravated for small children, and the Centers for Disease Control and Prevention recommends supervising children below six brushing their teeth so that they do not swallow toothpaste.[271] One regional study examined a year of pre-teen fluoride poisoning reports totaling 87 cases, including one death from ingesting insecticide. Most had no symptoms, but about 30% had stomach pains.[269] A larger study across the U.S. had similar findings: 80% of cases involved children under six, and there were few serious cases.[272]
المخاوف البيئية
يجب التعامل مع الفلور وHF بحرص شديد ولا يجب أن يكون لهما أى تلامس مع الجلد والعين. ويجب تخميد كل المعدات قبل إستخدمها معهم.
كل من الفلور في حالته العنصرية، وأيون الفلوريد في غاية السمية. والفلور له رائحة لاذعة مميزة ويمكن تمييزها في التركيزات القليلة حتى 20 nL/L. وينصح بان يكون أقصى تركيز لتعرض الشخص البالغ له لفترة عمل تبلغ 8 ساعات 1 µL/L(جزء في المليون بالحجم)، أى أقل من سيانيد الهيدروجين.
وعموما، فإن التعامل آمن مع الفلور يمكن من نقله بكميات كبيرة.
الغلاف الجوي
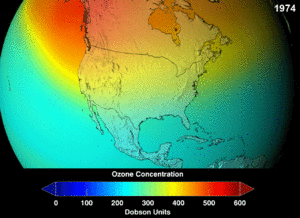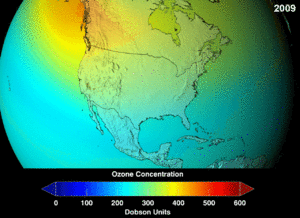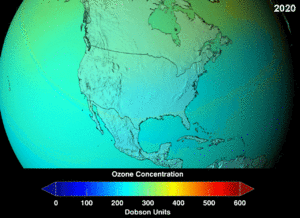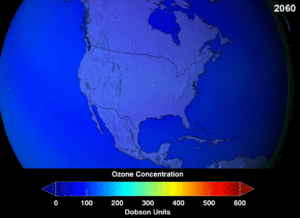
The Montreal Protocol, signed in 1987, set strict regulations on chlorofluorocarbons (CFCs) and bromofluorocarbons due to their ozone damaging potential (ODP). The high stability which suited them to their original applications also meant that they were not decomposing until they reached higher altitudes, where liberated chlorine and bromine atoms attacked ozone molecules.[274] Even with the ban, and early indications of its efficacy, predictions warned that several generations would pass before full recovery.[275][276] With one-tenth the ODP of CFCs, hydrochlorofluorocarbons (HCFCs) are the current replacements,[277] and are themselves scheduled for substitution by 2030–2040 by hydrofluorocarbons (HFCs) with no chlorine and zero ODP.[278] In 2007 this date was brought forward to 2020 for developed countries;[279] the Environmental Protection Agency had already prohibited one HCFC's production and capped those of two others in 2003.[278] Fluorocarbon gases are generally greenhouse gases with global-warming potentials (GWPs) of about 100 to 10,000; sulfur hexafluoride has a value of around 20,000.[280] An outlier is HFO-1234yf which is a new type of refrigerant called a Hydrofluoroolefin (HFO) and has attracted global demand due to its GWP of less than 1 compared to 1,430 for the current refrigerant standard HFC-134a.[191]
Biopersistance
Organofluorines exhibit biopersistence due to the strength of the carbon–fluorine bond. Perfluoroalkyl acids (PFAAs), which are sparingly water-soluble owing to their acidic functional groups, are noted persistent organic pollutants;[282] perfluorooctanesulfonic acid (PFOS) and perfluorooctanoic acid (PFOA) are most often researched.[283][284][285] PFAAs have been found in trace quantities worldwide from polar bears to humans, with PFOS and PFOA known to reside in breast milk and the blood of newborn babies. A 2013 review showed a slight correlation between groundwater and soil PFAA levels and human activity; there was no clear pattern of one chemical dominating, and higher amounts of PFOS were correlated to higher amounts of PFOA.[283][284][286] In the body, PFAAs bind to proteins such as serum albumin; they tend to concentrate within humans in the liver and blood before excretion through the kidneys. Dwell time in the body varies greatly by species, with half-lives of days in rodents, and years in humans.[283][284][287] High doses of PFOS and PFOA cause cancer and death in newborn rodents but human studies have not established an effect at current exposure levels.[283][284][287]
انظر أيضاً
- Halogens—the periodic group to which fluorine belongs
- Caesium—the least electronegative element, fluorine's "opposite"
الهوامش
- ^ Sources disagree on the radii of oxygen, fluorine, and neon atoms. Precise comparison is thus impossible.
- ^ α-Fluorine has a regular pattern of molecules and is a crystalline solid, but its molecules do not have a specific orientation. β-Fluorine's molecules have fixed locations and minimal rotational uncertainty. For further detail on α-fluorine, see the 1970 structure by Pauling.[46] For further detail on the concept of disorder in crystals, see the referenced general reviews.[47][48]
- ^ A loud click is heard. Samples may shatter and sample windows blow out.
- ^ The ratio of the angular momentum to magnetic moment is called the gyromagnetic ratio. "Certain nuclei can for many purposes be thought of as spinning round an axis like the Earth or like a top. In general the spin endows them with angular momentum and with a magnetic moment; the first because of their mass, the second because all or part of their electric charge may be rotating with the mass."[52]
- ^ Davy, Gay-Lussac, Thénard, and the Irish chemists Thomas and George Knox were injured. Belgian chemist Paulin Louyet and French chemist Jérôme Nicklès died. Moissan also experienced serious hydrogen fluoride poisoning.[71][72]
- ^ Also honored was his invention of the electric arc furnace.
- ^ Fluorine in F 2 is defined to have oxidation state 0. The unstable species F−2 and F−3, which decompose at around 40 K, have intermediate oxidation states;[84] F+4 and a few related species are predicted to be stable.[85]
- ^ The metastable boron and nitrogen monofluoride have higher-order fluorine bonds, and some metal complexes use it as a bridging ligand. Hydrogen bonding is another possibility.
- ^ ZrF 4 melts at 932 °C (1710 °F),[99] HfF 4 sublimes at 968 °C (1774 °F),[96] and UF 4 melts at 1036 °C (1897 °F).[100]
- ^ These thirteen are those of molybdenum, technetium, ruthenium, rhodium, tungsten, rhenium, osmium, iridium, platinum, polonium, uranium, neptunium, and plutonium.
- ^ See also the explanation by Clark.[118]
- ^ Carbon tetrafluoride is formally organic, but is included here rather than in the organofluorine chemistry section – where more complex carbon-fluorine compounds are discussed – for comparison with SiF 4 and GeF 4.
- ^ Perfluorocarbon and fluorocarbon are IUPAC synonyms for molecules containing carbon and fluorine only, but in colloquial and commercial contexts the latter term may refer to any carbon- and fluorine-containing molecule, possibly with other elements.
- ^ This terminology is imprecise, and perfluorinated substance is also used.[148]
- ^ Energies are given in −kJ/mol, solubilities in mol/L; HE means "hydration energy"
- ^ This DuPont trademark is sometimes further misused for CFCs, HFCs, or HCFCs.
- ^ American sheep and cattle collars may use 1080 against predators like coyotes.
المصادر
- ^ Wieser, Michael E.; Coplen, Tyler B. (2010). "Atomic weights of the elements 2009 (IUPAC Technical Report)". Pure and Applied Chemistry. 83: 359–396. doi:10.1351/PAC-REP-10-09-14.
- ^ أ ب ت ث Aigueperse et al. 2005, "Fluorine", p. 1.
- ^ أ ب Aigueperse et al. 2005, "Fluorine", p. 2.
- ^ أ ب ت ث Compressed Gas Association (1999). Handbook of compressed gases. Springer. p. 365. ISBN 9780412782305.
- ^ أ ب Dean 1999, p. 3.29.
- ^ أ ب ت Dean 1999, p. 4.6.
- ^ Dean 1999, p. 4.35.
- ^ Kim, Sung-Hoon (2006). Functional dyes. Elsevier. p. 257. ISBN 9780444521767.
- ^ Young, David A. (2011-06-10). Phase Diagrams of the Elements. Springer. p. 10. Archived from the original. You must specify the date the archive was made using the
|archivedate=parameter. http://www.osti.gov/bridge/servlets/purl/4010212-0BbwUC/4010212.pdfaccess. - ^ Mackay, Mackay & Henderson 2002, p. 72.
- ^ Cheng, H.; Fowler, D. E.; Henderson, P. B.; Hobbs, J. P.; Pascaloni, M. R. (1999). "On the magnetic susceptibility of fluorine". Journal of Physical Chemistry A. 103 (15): 2861–2866. doi:10.1021/jp9844720.
- ^ Yaws & Braker 2001, p. 385.
- ^ Chiste, V. (2006). "F-18" (PDF). Table de radionucleides. Laboratoire National Henri Becquerel. Retrieved 15 June 2011.
{{cite web}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ^ Lee et al. 2014.
- ^ أ ب Jaccaud et al. 2000, p. 381.
- ^ Dean 1999, p. 564.
- ^ Lide 2004, pp. 10.137–10.138.
- ^ Moore, Stanitski & Jurs 2010, p. 156.
- ^ Cordero et al. 2008.
- ^ Pyykkö & Atsumi 2009.
- ^ أ ب ت Greenwood & Earnshaw 1998, p. 804.
- ^ Macomber 1996, p. 230
- ^ أ ب ت Jaccaud et al. 2000, p. 382.
- ^ Nelson 1947.
- ^ Lidin, Molochko & Andreeva 2000, pp. 442–455.
- ^ أ ب Wiberg, Wiberg & Holleman 2001, p. 404.
- ^ Patnaik 2007, p. 472.
- ^ Aigueperse et al. 2000, p. 400.
- ^ Greenwood & Earnshaw 1998, pp. 76, 804.
- ^ Kuriakose & Margrave 1965.
- ^ Hasegawa et al. 2007.
- ^ Lagow 1970, pp. 64–78.
- ^ Lidin, Molochko & Andreeva 2000, p. 252.
- ^ Tanner Industries 2011.
- ^ Morrow, Perry & Cohen 1959.
- ^ Emeléus & Sharpe 1974, p. 111.
- ^ Wiberg, Wiberg & Holleman 2001, p. 457.
- ^ Brantley 1949, p. 26.
- ^ Jaccaud et al. 2000, p. 383.
- ^ Pitzer 1975.
- ^ أ ب Khriachtchev et al. 2000.
- ^ Burdon, Emson & Edwards 1987.
- ^ Lide 2004, p. 4.12.
- ^ أ ب Dean 1999, p. 523.
- ^ Pauling, Keaveny & Robinson 1970.
- ^ Bürgi 2000.
- ^ Müller 2009.
- ^ أ ب Young 1975, p. 10.
- ^ أ ب Barrett, Meyer & Wasserman 1967.
- ^ National Nuclear Data Center NuDat 2.1, Fluorine-19.
- ^ Vigoureux 1961.
- ^ Meusinger, Chippendale & Fairhurst 2012, pp. 752, 754.
- ^ SCOPE 50 - Radioecology after Chernobyl Archived 2014-05-13 at the Wayback Machine, the Scientific Committee on Problems of the Environment (SCOPE), 1993. See table 1.9 in Section 1.4.5.2.
- ^ أ ب National Nuclear Data Center NuDat 2.1.
- ^ NUBASE 2016, pp. 030001-23–030001-27.
- ^ NUBASE 2016, pp. 030001–24.
- ^ Cameron 1973.
- ^ أ ب ت Croswell 2003.
- ^ Clayton 2003, pp. 101–104.
- ^ Renda et al. 2004.
- ^ أ ب Jaccaud et al. 2000, p. 384.
- ^ أ ب ت Schmedt, Mangstl & Kraus 2012.
- ^ أ ب ت ث ج Greenwood & Earnshaw 1998, p. 795.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةKGS fluorite terminology - ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص Villalba, Ayres & Schroder 2008.
- ^ Kelly & Miller 2005.
- ^ Lusty et al. 2008.
- ^ أ ب Gribble 2002.
- ^ Richter, Hahn & Fuchs 2001, p. 3.
- ^ أ ب ت خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةWeeks - ^ أ ب ت ث ج Toon 2011.
- ^ أ ب Asimov 1966, p. 162.
- ^ Greenwood & Earnshaw 1998, pp. 789–791.
- ^ Moissan 1886.
- ^ Viel & Goldwhite 1993, p. 35.
- ^ أ ب ت ث ج ح Kirsch 2004, pp. 3–10.
- ^ أ ب ت ث Okazoe 2009.
- ^ أ ب Hounshell & Smith 1988, pp. 156–157.
- ^ DuPont 2013a.
- ^ Meyer 1977, p. 111.
- ^ Kirsch 2004, pp. 60–66.
- ^ Riedel & Kaupp 2009.
- ^ Wiberg, Wiberg & Holleman 2001, p. 422.
- ^ Schlöder & Riedel 2012.
- ^ Harbison 2002.
- ^ Edwards 1994, p. 515.
- ^ Katakuse et al. 1999, p. 267.
- ^ أ ب Aigueperse et al. 2000, pp. 420–422.
- ^ Storer 1864, pp. 278–280.
- ^ Walsh 2009, pp. 99–102, 118–119.
- ^ Emeléus & Sharpe 1983, pp. 89–97.
- ^ Babel & Tressaud 1985, pp. 91–96.
- ^ Einstein et al. 1967.
- ^ Brown et al. 2005, p. 144.
- ^ أ ب Perry 2011, p. 193.
- ^ Kern et al. 1994.
- ^ Lide 2004, pp. 4.60, 4.76, 4.92, 4.96.
- ^ Lide 2004, p. 4.96.
- ^ Lide 2004, p. 4.92.
- ^ Greenwood & Earnshaw 1998, p. 964.
- ^ Becker & Müller 1990.
- ^ Greenwood & Earnshaw 1998, p. 990.
- ^ Lide 2004, pp. 4.72, 4.91, 4.93.
- ^ أ ب Greenwood & Earnshaw 1998, pp. 561–563.
- ^ Emeléus & Sharpe 1983, pp. 256–277.
- ^ Mackay, Mackay & Henderson 2002, pp. 355–356.
- ^ Greenwood & Earnshaw 1998, (various pages, by metal in respective chapters).
- ^ Lide 2004, pp. 4.71, 4.78, 4.92.
- ^ Drews et al. 2006.
- ^ Greenwood & Earnshaw 1998, p. 819.
- ^ Bartlett 1962.
- ^ Pauling 1960, pp. 454–464.
- ^ Atkins & Jones 2007, pp. 184–185.
- ^ Emsley 1981.
- ^ Greenwood & Earnshaw 1998, pp. 812–816.
- ^ Wiberg, Wiberg & Holleman 2001, p. 425.
- ^ Clark 2002.
- ^ Chambers & Holliday 1975, pp. 328–329.
- ^ Air Products and Chemicals 2004, p. 1.
- ^ Noury, Silvi & Gillespie 2002.
- ^ Chang & Goldsby 2013, p. 706.
- ^ Ellis 2001, p. 69.
- ^ Aigueperse et al. 2000, p. 423.
- ^ Wiberg, Wiberg & Holleman 2001, p. 897.
- ^ Raghavan 1998, pp. 164–165.
- ^ Godfrey et al. 1998, p. 98.
- ^ Aigueperse et al. 2000, p. 432.
- ^ Murthy, Mehdi Ali & Ashok 1995, pp. 180–182, 206–208.
- ^ Greenwood & Earnshaw 1998, pp. 638–640, 683–689, 767–778.
- ^ Wiberg, Wiberg & Holleman 2001, pp. 435–436.
- ^ Greenwood & Earnshaw 1998, pp. 828–830.
- ^ Patnaik 2007, pp. 478–479.
- ^ Moeller, Bailar & Kleinberg 1980, p. 236.
- ^ Wiberg, Wiberg & Holleman 2001, pp. 392–393.
- ^ Wiberg, Wiberg & Holleman 2001, p. 395–397, 400.
- ^ Lewars 2008, p. 68.
- ^ Pitzer 1993, p. 111.
- ^ Lewars 2008, p. 67.
- ^ أ ب Bihary, Chaban & Gerber 2002.
- ^ Lewars 2008, p. 71.
- ^ Hoogers 2002, pp. 4–12.
- ^ O'Hagan 2008.
- ^ Siegemund et al. 2005, p. 444.
- ^ Sandford 2000, p. 455.
- ^ Siegemund et al. 2005, pp. 451–452.
- ^ Barbee, McCormack & Vartanian 2000, p. 116.
- ^ Posner et al. 2013, pp. 187–190.
- ^ أ ب Posner 2011, p. 27.
- ^ Salager 2002, p. 45.
- ^ أ ب Carlson & Schmiegel 2000, p. 3.
- ^ أ ب Carlson & Schmiegel 2000, pp. 3–4.
- ^ Rhoades 2008, p. 2.
- ^ Okada et al. 1998.
- ^ Carlson & Schmiegel 2000, p. 4.
- ^ Calderazzo, Fausto (2010). "Halide-bridged polymers of divalent metals with donor ligands – structures and properties". Coordination Chemistry Reviews. 254 (5–6): 537–554. doi:10.1016/j.ccr.2009.08.007.
{{cite journal}}: Unknown parameter|month=ignored (help) - ^ Wiberg, Wiberg & Holleman 2001, p. XXXVI–XXXVII.
- ^ Wiberg, Wiberg & Holleman 2001, p. XXXVI.
- ^ Lide 2004, p. 12-23.
- ^ Wiberg, Wiberg & Holleman 2001, p. 1073.
- ^ هيام بيرقدار. "الفلور". الموسوعة العربية.
- ^ Aigueperse et al. 2000.
- ^ Norris Shreve; Joseph Brink, Jr. (1977). Chemical Process Industries (4 ed.). McGraw-Hill. p. 321. ISBN 0070571457.
- ^ Jaccaud et al. 2000, p. 386.
- ^ Jaccaud et al. 2000, pp. 384–285.
- ^ Greenwood & Earnshaw 1998, pp. 796–797.
- ^ Jaccaud et al. 2000, pp. 384–385.
- ^ أ ب Jaccaud et al. 2000, pp. 390–391.
- ^ Shriver & Atkins 2010, p. 427.
- ^ Christe 1986.
- ^ Christe Research Group n.d.
- ^ Carey 2008.
- ^ Miller 2003b.
- ^ PRWeb 2012.
- ^ Bombourg 2012.
- ^ TMR 2013.
- ^ Fulton & Miller 2006, p. 471.
- ^ أ ب Jaccaud et al. 2000, p. 392.
- ^ Aigueperse et al. 2000, p. 430.
- ^ Jaccaud et al. 2000, pp. 391–392.
- ^ El-Kareh 1994, p. 317.
- ^ Arana et al. 2007.
- ^ Miller 2003a.
- ^ Energetics, Inc. 1997, pp. 41, 50.
- ^ Aigueperse et al. 2000, p. 428.
- ^ Willey 2007, p. 113.
- ^ PRWeb 2010.
- ^ أ ب ت Renner 2006.
- ^ Green et al. 1994, pp. 91–93.
- ^ DuPont 2013b.
- ^ أ ب Walter 2013.
- ^ أ ب Buznik 2009.
- ^ PRWeb 2013.
- ^ أ ب ت ث ج Martin 2007, pp. 187–194.
- ^ DeBergalis 2004.
- ^ Grot 2011, pp. 1–10.
- ^ Ramkumar 2012, p. 567.
- ^ Burney 1999, p. 111.
- ^ Slye 2012, p. 10.
- ^ Kissa 2001, pp. 516–551.
- ^ Ullmann 2008, pp. 538, 543–547.
- ^ ICIS 2006.
- ^ أ ب Theodoridis 2006.
- ^ EPA 1996.
- ^ DG Environment 2007.
- ^ Beasley 2002.
- ^ أ ب Proudfoot, Bradberry & Vale 2006.
- ^ Eisler 1995.
- ^ Pizzo et al. 2007.
- ^ CDC 2001.
- ^ Ripa 1993.
- ^ أ ب Cheng, Chalmers & Sheldon 2007.
- ^ NHMRC 2007; see Yeung 2008 for a summary.
- ^ Marya 2011, p. 343.
- ^ Armfield 2007.
- ^ أ ب Baelum, Sheiham & Burt 2008, p. 518.
- ^ Cracher 2012, p. 12.
- ^ Emsley 2011, p. 178.
- ^ Johnson 2011.
- ^ أ ب Swinson 2005.
- ^ Hagmann 2008.
- ^ Mitchell 2004, pp. 37–39.
- ^ Preskorn 1996, chap. 2.
- ^ Werner et al. 2011.
- ^ Brody 2012.
- ^ Nelson et al. 2007.
- ^ King, Malone & Lilley 2000.
- ^ Parente 2001, p. 40.
- ^ Raj & Erdine 2012, p. 58.
- ^ Filler & Saha 2009.
- ^ Bégué & Bonnet-Delpon 2008, pp. 335–336.
- ^ أ ب Schmitz et al. 2000.
- ^ Bustamante & Pedersen 1977.
- ^ Alavi & Huang 2007, p. 41.
- ^ Gabriel et al. 1996.
- ^ Sarkar 2008.
- ^ Schimmeyer 2002.
- ^ Davis 2006.
- ^ Gains 1998.
- ^ Taber 1999.
- ^ Shaffer, Wolfson & Clark 1992, p. 102.
- ^ Kacmarek et al. 2006.
- ^ Nielsen 2009.
- ^ Olivares & Uauy 2004.
- ^ Food and Nutrition Board.
- ^ أ ب Murphy, Schaffrath & O'Hagan 2003
- ^ O'Hagan et al. 2002.
- ^ The National Institute for Occupational Safety and Health 1994a.
- ^ The National Institute for Occupational Safety and Health 1994b.
- ^ أ ب Keplinger & Suissa 1968.
- ^ Emsley 2011, p. 179.
- ^ Biller 2007, p. 939.
- ^ "Fluorine. Safety data sheet" (PDF). Airgas. Archived from the original (PDF) on 19 April 2015.
- ^ Eaton 1997.
- ^ "Inorganic Chemistry" by Gary L. Miessler and Donald A. Tarr, 4th edition, Pearson
- ^ "Inorganic Chemistry" by Shriver, Weller, Overton, Rourke and Armstrong, 6th edition, Freeman
- ^ Blodgett, Suruda & Crouch 2001.
- ^ Hoffman et al. 2007, p. 1333.
- ^ أ ب HSM 2006.
- ^ Fischman 2001, pp. 458–459.
- ^ El Saadi et al. 1989.
- ^ Roblin et al. 2006.
- ^ Hultén et al. 2004.
- ^ Zorich 1991, pp. 182–183.
- ^ Liteplo et al. 2002, p. 100.
- ^ أ ب ت ث Shin & Silverberg 2013.
- ^ Reddy 2009.
- ^ Baez, Baez & Marthaler 2000.
- ^ أ ب Augenstein et al. 1991.
- ^ Gessner et al. 1994.
- ^ CDC 2013.
- ^ Shulman & Wells 1997.
- ^ Beck et al. 2011.
- ^ Aucamp & Björn 2010, pp. 4–6, 41, 46–47.
- ^ Mitchell Crow 2011.
- ^ Barry & Phillips 2006.
- ^ EPA 2013a.
- ^ أ ب EPA 2013b.
- ^ McCoy 2007.
- ^ Forster et al. 2007, pp. 212–213.
- ^ Schwarcz 2004, p. 37.
- ^ Giesy & Kannan 2002.
- ^ أ ب ت ث Steenland, Fletcher & Savitz 2010.
- ^ أ ب ت ث Betts 2007.
- ^ EPA 2012.
- ^ Zareitalabad et al. 2013.
- ^ أ ب Lau et al. 2007.
المراجع
- Dean, John A. (1999). Lange's handbook of chemistry (15th ed.). McGraw-Hill, Inc. ISBN 0-07-016190-9.
{{cite book}}: Invalid|ref=harv(help) - Emeléus, H. J.; Sharpe, A. G. (1983). Advances in Inorganic Chemistry and Radiochemistry (27th ed.). Academic Press. ISBN 0-12-023627-3.
{{cite book}}: Invalid|ref=harv(help) - Greenwood, N. N.; Earnshaw, A. (1998). Chemistry of the Elements (2nd ed.). Butterworth Heinemann. ISBN 0-7506-3365-4.
{{cite book}}: Invalid|ref=harv(help) - Hounshell, David A.; Smith, John Kelly (1988). Science and Corporate Strategy: DuPont R&D, 1902–1980. Cambridge University Press. ISBN 0-521-32767-9.
{{cite book}}: Invalid|ref=harv(help) - Lewars, Errol G. (2008). Modeling Marvels: Computational Anticipation of Novel Molecules. Springer. ISBN 1-4020-6972-3.
{{cite book}}: Invalid|ref=harv(help) - Lide, David R. (2004). Handbook of Chemistry and Physics (84th ed.). CRC Press. ISBN 0-8493-0566-7.
{{cite book}}: Invalid|ref=harv(help) - (بالروسية) Lidin, P. A.; Molochko, V. A.; Andreeva, L. L. (2000). Химические свойства неорганических веществ. Khimiya. ISBN 5-7245-1163-0.
{{cite book}}: Invalid|ref=harv(help); Unknown parameter|trans_title=ignored (|trans-title=suggested) (help) - Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. (2002). Introduction to modern inorganic chemistry (6th ed.). CRC Press. ISBN 0-7487-6420-8.
{{cite book}}: Invalid|ref=harv(help) - Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic chemistry. Academic Press. ISBN 978-0-12-352651-9. Retrieved 3 March 2011.
{{cite book}}: Invalid|ref=harv(help) - Yaws, Carl L.; Braker, William (2001). "Fluorine". Matheson Gas Data Book, Book 2001. McGraw-Hill Professional. ISBN 978-0-07-135854-5.
{{cite book}}: Invalid|ref=harv(help)
- Ullmann, Franz, ed. (2005). Encyclopedia of Industrial Chemistry. Wiley-VCH. ISBN 978-3-527-30673-2.
- Aigueperse, Jean; Mollard, Paul; Devilliers, Didier; Chemla, Marius; Faron, Robert; Romano, Renée; Cuer, Jean Pierre. "Fluorine Compounds, Inorganic". doi:10.1002/14356007. ISBN 978-3-527-30673-2.
{{cite book}}: Missing or empty|title=(help) - Siegemund, Günter; Schwertweger, Werner; Feiring, Andrew; Smart, Bruce; Behr, Fred; Vogel, Herward; McKusick, Blain. "Fluorine Compounds, Organic". doi:10.1002/14356007.a11_349.
{{cite book}}: Missing or empty|title=(help) - Jassaud, Michael; Faron, Robert; Devilliers, Didier; Romano, René. "Fluorine". doi:10.1002/14356007.a11_293.
{{cite book}}: Missing or empty|title=(help) - Carlson, D. Peter; Scmiegel, Walter. "Fluoropolymers, Organic". doi:10.1002/14356007.a11_393.
{{cite book}}: Missing or empty|title=(help)
- Aigueperse, Jean; Mollard, Paul; Devilliers, Didier; Chemla, Marius; Faron, Robert; Romano, Renée; Cuer, Jean Pierre. "Fluorine Compounds, Inorganic". doi:10.1002/14356007. ISBN 978-3-527-30673-2.
- Bayerische Julius-Maximilians-Universität Würzburg (2006). The Highest Oxidation States of the 5d Transition Metals: a Quantum-Chemical Study. Chemical Society. Archived from the original. You must specify the date the archive was made using the
|archivedate=parameter. http://opus.bibliothek.uni-wuerzburg.de/volltexte/2006/1940/pdf/The_Highest_Oxidation_States_of_the_5d_Transition_Metals.pdf. Retrieved on 2011-06-20.
- معهد لوس ألاموس القومي – فلور
- أحاديث في العلم - دكتور توفيق محمد قاسم - الهيئة المصرية العامة للكتاب.
وصلات خارجية
- CS1 errors: unsupported parameter
- Articles containing لاتينية-language text
- Articles containing إنگليزية-language text
- Pages using Lang-xx templates
- Articles with hatnote templates targeting a nonexistent page
- Chembox container only
- Short description is different from Wikidata
- CS1 errors: missing title
- فلور
- علم الأحياء وعلم صيدلة العناصر الكيميائية
- عوامل فلورة
- عوامل مؤكسدة
- عناصر كيميائية
- هالوجينات
- Reactive nonmetals
- Diatomic nonmetals
- غازات صناعية
- Gases with color