نيتروجين
| |||||||||||||||||||||||||
| صفات عامة | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| الإسم, الرقم, الرمز | نيتروجين, N, 7 | ||||||||||||||||||||||||
| سلاسل كيميائية | لا فلز | ||||||||||||||||||||||||
| المجموعة, الدورة, المستوى الفرعي | p , 2 , 15 | ||||||||||||||||||||||||
| المظهر | عديم اللون 
| ||||||||||||||||||||||||
| كتلة ذرية | 14.0067(2) g/mol | ||||||||||||||||||||||||
| شكل إلكتروني | 1s2 2s2 2p3 | ||||||||||||||||||||||||
| عدد الإلكترونات لكل مستوى | 2, 5 | ||||||||||||||||||||||||
| خواص فيزيائية | |||||||||||||||||||||||||
| الحالة | غاز | ||||||||||||||||||||||||
| كثافة | 0 °C, 101.325 kPa 1.251 g/L | ||||||||||||||||||||||||
| نقطة الإنصهار | 63.15 ك -210.00 م ° -346.00 ف ° | ||||||||||||||||||||||||
| نقطة الغليان | 77.36 ك -195.79 م ° -320.42 ف ° | ||||||||||||||||||||||||
| النقطة حرجة | 126.21 K, 3.39 MPa | ||||||||||||||||||||||||
| حرارة الإنصهار | kJ/mol (N2) 0.720 | ||||||||||||||||||||||||
| حرارة التبخر | kJ/mol (N2) 5.57 | ||||||||||||||||||||||||
| السعة الحرارية | (25 (N2) 29.124 C (م) ° ( J/(mol·K | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| الخواص الذرية | |||||||||||||||||||||||||
| البنية البللورية | سداسية | ||||||||||||||||||||||||
| حالة التأكسد | ±3, 5, 4, 2 (أكسيد شديد الحامضية) | ||||||||||||||||||||||||
| سالبية كهربية | 3.04 (مقياس باولنج) | ||||||||||||||||||||||||
| طاقة التأين (المزيد) |
1st: 1402.3 kJ/mol | ||||||||||||||||||||||||
| 2nd: 2856 kJ/mol | |||||||||||||||||||||||||
| 3rd: 4578.1 kJ/mol | |||||||||||||||||||||||||
| نصف قطر ذري | 65 pm | ||||||||||||||||||||||||
| نصف قطر ذري (حسابيا) | 56 pm | ||||||||||||||||||||||||
| نصف القطر التساهمي | 75 pm | ||||||||||||||||||||||||
| نصف قطر فان دير فال | 155 pm | ||||||||||||||||||||||||
| متفرقة | |||||||||||||||||||||||||
| الترتيب المغناطيسي | no data | ||||||||||||||||||||||||
| توصيل حراري | (300 K ك ) 25.83 m (W/(m·K) | ||||||||||||||||||||||||
| سرعة الصوت | (gas, 27 °C) 353 m/s | ||||||||||||||||||||||||
| رقم التسجيل | 7727-37-9 | ||||||||||||||||||||||||
| النظائر المهمة | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| المراجع | |||||||||||||||||||||||||
النيتروجين هو عنصر كيميائي في الجدول الدوري له الرمز N والعدد الذري 7 . وهو عديم اللون والطعم والرائحة ، وهو عادة غير نشط وعلى شكل غاز في درجة الحرارة وقياس الضغط القياسيين ، كما أنه لا فلز ويكون على شكل جزيء من ذرتين. يشكل النيتروجين 78 بالمائة من الغلاف الجوي للأرض كما أنه يدخل في تركيب جميع الأنسجة الحية. كما يشكل العديد من المركبات المهمة كالأمونيا (النشادر) وحمض النيتريك والسيانيد.ويستعمل ايضا في صناعة الاسمده.
وجوده في الطبيعة ووظائفه وخواصه
يوجد القسم الأعظم من النيتروجين حراً في الطبيعة، وهو من أجلّ عناصر الهواء إذ يؤلف أربعة أخماسه تقريباً أو 78.8% منه حجماً أي مايعادل أربعة أمثال الأكسجين الهوائي. ولا يعادل القسم الموجود منه متحداً في الطبيعة بغيره أكثر من واحد بالمليون من النيتروجين الحر. ويوجد متحداً بالأكسجين والهدروجين والكربون والكبريت في المواد الهيولية ويؤلف 16% منها. وهو أحد العناصر الجوهرية في الخلايا الحية ويدخل في تركيب الأمينات والأميدات وأشباه القلويات و[[النتريلات وغيرها، ومن مركباته غير العضوية [[النشادر ونترات البوتاسيوم والصوديوم والكالسيوم والمغنزيوم، وأهمها نترات الصوديوم الموجودة في تشيلي في أمريكا. وما تزال عبارة ملح البارود تستعمل للدلالة على [[نترات البوتاسيوم منذ القرن الثالث عشر والتي تسمى اليوم «ملح الصخر»، وهو الملح الذي يُرى على الجدران القديمة والصخور الرطبة ويحتوي في المقام الأول على النترات.
إن العدد الذري للنيتروجين 7 وبنيته الإلكترونية الأساسية هي 1S2, 2S2 2P3 وتساوي الطاقة الضرورية لنزع الإلكترون أي طاقة التأين أو التشرد 14.1 إ- ف (إلكترون - فلط) للإلكترون الأول وهي طاقة مرتفعة، و29.7 إ-ف للثاني و47.7 إ-ف للثالث و77.5 إ-ف للرابع و100 إ-ف للخامس و507 إ-ف للسادس و665 إ-ف للأخير. وتزداد قيمة هذه الطاقة عند الانتقال من إلكترونات الطبقة الخارجية إلى إلكترونات الطبقة الداخلية ازدياداً كبيراً جداً. ينتج من هذه القيم أن لروابط الآزوت مع الذرات الأخرى صفة تكافئية خاصة. ويساوي نصف قطر ذرة النيتروجين 0.74 Aْ أنغستروم (Aْ=10-10م)
النيتروجين غاز عديم اللون في الشروط النظامية، يغلي بدرجة -196ْ س (سلزيوس) ويتجمد في الدرجة -210ْس. جزيئاته ثنائية الذرة وحرارة تفككها إلى ذراتٍ مرتفعةٌ إذ تساوي (225) حرة في المول وترتبط ذرتا الجزيء برابطة ثلاثية N ≡ N.
النيتروجين عنصر خامل إلا أنه يعطي بعض تفاعلات مهمة بالحرارة ولاسيما مع الهدروجين والأكسجين والسيليسيوم ومعادن شتى. ويُراوح رقم أكسدته بين (-3) و(+5) فهو يتحول مع الأكسجين في القوس الكهربائية تحولاً ضئيلاً إلى ثاني أكسيد النيتروجين N2+O2"2NO ويعد تفاعله مع الهدروجين N2+3H2"2NH3 أساس اصطناع النشادر. وينفرد الليثيوم من بين المعادن باتحاده بالآزوت في درجة حرارة معتدلة معطياً نتريد nitride الليتيوم Li3N، ويتحد بالمغنزيوم والمعادن القلوية الترابية والبور والسيليسيوم والألمنيوم في درجة الحرارة الحمراء. وما إن يجتاز النيتروجين القوس الكهربائية حتى يغدو فعالاً نتيجة لتكون نسبة مئوية مهمة من الذرات الحرة، ففي هذه الشروط يتفاعل في درجة الحرارة العادية مع الزئبق كما يتحد بالكبريت والفسفور مباشرة.
النيتروجين والحياة
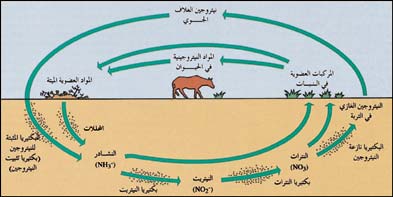
كل الكائنات الحية تحتاج إلى النيتروجين لكي تعيش، إذ يكوِّن النيتروجين أهم جزء من جزيء البروتين، الذي يوجد في البروتوبلازم، وهي مادّة حيّة موجودة في كلّ من خلايا النّباتات والحيوانات. يحصل الإنسان والحيوان على البروتين من الطعام من النباتات والحيوانات الأخرى.
تنتج النباتات من البروتينات المركبات النيتروجينية اليسيرة المذابة في التربة. بعض النيتروجين المذاب في التربة يأتي من الغلاف الجوي على شكل حمض النتريك، إذْ يتفاعل النيتروجين مع الأكسجين عند وقوع الصواعق مكوّنا مركّبات عديدة تعرف بأكاسيد النيتروجين، والتي بدورها تتفاعل مع الماء مكوِّنة حمض النيتريك الذي تحمله الأمطار إلى التربة.
تنتج النباتات من عائلة البقول البروتين من نيتروجين الهواء بمساعدة نوع معين من البكتيريا. وتشمل البقول نباتات عديدة مثل: البرسيم والبازلاء، وفول الصويا. تحتوي جذور البقول على انتفاخات صغيرة تسمى العقيدات. وتحتوي هذه العقيدات على نوع من البكتيريا المثبتة للنيتروجين، إذ لها القدرة على أخذ النيتروجين من الهواء وتحويله إلى مركبات النيتروجين.
ويستخدم النبات المركبات النيتروجينية المتكونة ويحولها إلى بروتين، وبعد موت النبات تتحلل المركبات النيتروجينية وتصبح جزءا من التربة. ولأن النيتروجين يُستخدم ويُعاد استخدامه بوساطة الكائنات الحية، فإنه يمر خلال دورة مستمرة من التغيير الكيميائي. وتسمى هذه الدورة بدورة النيتروجين.
خصائصة
النيتروجين من اللا فلزات ، وبسالبية كهربائية مقدارها 3.0 ، لديه خمسة إلكترونات في الغلاف الإلكتروني الخارجي ، وهو ثلاثي التكافؤ في معظم مركباته. النيتروجين النقي غير نشط كيميائيا ، عديم اللون ، جزيئه ثنائي الذرات في درجة حرارة الغرفة ، يتكثف بدرجة حرارة 77 كالفن ويتجمد بدجة 63 كالفن. والنيتروجين السائل شائع لدراسة تأثير درجات الحرارة المنخفضة على الكائنات الحية.
استخداماته
يُسْتَخْرج النيتروجين النَّقي في الصِّناعة بوساطة تقطير الهواء السائل ويتكون الهواء من النيتروجين والأكسجين تقريبا. ولأن درجة غليان النيتروجين أقل من درجة غليان الأكسجين، فإنه يغلي أولا في عملية التقطير، وعندما يتبخر يجمع ويحفظ تحت ضغط معين في أسطوانات من الفولاذ.
المركبات الهدروجينية: النشادر، وهو أكثرها أهمية، والهدْرازين H2N-NH2 وحمض آزوت الماء NH3، وتصنف معها منتجات تفاعل حمض آزوت الماء مع النشادر (أزيد الأمونيوم NH4N3) ومع الهدْرازين (أزيد الهدْرازين N2H5N3).
إن الهدْرازين مركب ذو تكون ماص للحرارة وهو يتفكك بنسبة لا يستهان بها بدءاً من الدرجة 50 ْس، وجذره NH2 ذو خواص أساسية وأملاحه (أملاح الهدْرازينيوم) أكثر ثباتاً منه. وهناك هدْرازينات متبادلة كثاني ميتيل الهدْرازين (CH3)2N-NH2 المستعمل وقوداً دافعاً في الصواريخ نظراً لسهولة أكسدته وشدة هذه الأكسدة.
ويحضر الهدرازين بفعل تحت كلوريت الصوديوم بالنشادر ويحفظ على شكل كبريتات، أما الهدروكسيلامين (NH2.OH) فهو مركب قليل الثبات ينصهر في درجة 38ْس وهو جسم مُرجع ويعطي أملاح هدروكسيل الأمونيوم (NH3OHCl). وحمض آزوت الماء (HN3) hydrazoic acid مركب مرجع وهو قليل الثبات وكذلك أملاحه.
إنتاج النَّشَادر
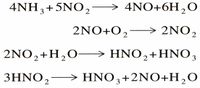
يعتبر إنتاج النشادر NH3 من غاز النيتروجين الاستخدام الأساسي المهم له. ويتكون غاز النشادر من النيتروجين والهيدروجين. وينتج غاز النشادر في الصناعة بوساطة عملية هابر. وفي هذه العملية يتفاعل النيتروجين والهيدروجين عند درجة حرارة 550°م، وضغط يعادل حوالي 200 إلى 250 مرة ضغط جوي. ويتم التفاعل أيضا في وجود عامل حفاز، والعامل الحفاز هو مادة تساعد على زيادة سرعة التفاعل الكيميائي.
وهو سهل التمييع وينقل مائعه بسهولة في خزانات من الفولاذ، ذلك أن توتر سائله يساوي (8) ضغط جوي في الدرجة (20)ْ س. يتفكك النشادر بالحرارة إلى آزوت وهدروجين، وهو ذو خواص مرجعة، ويحترق في الأكسجين ويتأكسد بوجود البلاتين في الدرجة (850)ْ س مكوِّناً ثنائي أكسيد الآزوت الذي يعطي حمض الآزوت الصناعي وذلك وفق التفاعلات الآتية:
ويتحد النشادر مع المعادن ليكوّن النتريدات:
إن هدروجين النشادر قابل للتبادل، إذ يتفاعل النشادر مع بعض المعادن كالمعادن القلوية كالصوديوم أو الكالسيوم معطياً تفاعلَ تبادلٍ جزئياً مؤدياً إلى أميد معدني كأميد الصوديوم أو أميد الكالسيوم:
ويمكن أن يحل الهالوجين محل الهدروجين تدريجياً معطياً مركبات مثل NH2X.
يستخدم النشادر سمادًا مخصبًا، وفي إنتاج المتفجرات، وحمض النيتريك، ومواد كيميائية أخرى. ومن المنظفات المنزلية المعروفة ذلك المحلول المخفف المكون من النشادر المذاب في الماء.
النيتروجين في الزراعة
مُعْظمُ السِّماد المُخَصِّب للأرض المستخدم بوساطة المزارعين والمشرفين على الحدائق يحتوي على النيتروجين الذي يساعد على ازدياد النّمو الصّحي للنبات. والنشادر أكثر المخصبات النيتروجينية شيوعا. يحقن المزارعون غاز النشادر في التربة مباشرة حيث يذوب ويساعد النباتات على النمو. كما يستخدم النشادر السائل، وكبريتات الأمونيوم، ونترات الأمونيوم، سمادًا نيتروجينيًا، ومن المصادر الأخرى للنيتروجين السماد الطبيعي، والجوانو، وهو من مخلفات الطيور البحرية.
ويمكن للمزارعين إمداد حقولهم بالنيتروجين عن طريق زراعة محاصيل مختلفة في دورة زراعية؛ أي تدويرها. ففي الدورة الزراعية يمكن للمزارع زراعةُ الحقل بالذرة الشامية، أو القمح تارة، أو أي نبات آخر آخذ للنيتروجين من التربة ؛ يعقبها زراعة الحقل نفسه بنباتات قرنية كالبرسيم، أو فول الصويا، مما يؤدي إلى تغذية التربة بالنيتروجين.
أوسع استخدام تجاري للنيتروجين هو كجزء في عملية تصنيع النشادر (الأمونيا) باستخدام طريقة هابر. وتستخدم الأمونيا بعدها لإنتاج الأسمدة وحمض النيتريك. ويستخدم النيتروجين كمادة غير نشطة في أجواء خزانات السوائل القابلة للانفجار، وأثناء تصنيع الأجزاء الإلكترونية كالصمامات الإلكترونية (ترانزيستورات) والدايود والدوائر المتكاملة، كما يستخدم في صناعة الفولاذ الذي لا يصدأ (Stainless Steel).
ويستخدم النيتروجين السائل كمبرد للمنتوجات الغذائية، إما بالغمر أو لأغراض النقل لحفظ الأجسام والخلايا التكاثرية كالحيوانات المنوية والبويضات الإنثوية، وللتخزين الآمن للعينات الحيوية. كما أنه يستخدم في دراسات حفظ الأجسام الحية. ويتم الحصول على النيتروجين السائل بعملية التقطير للهواء السائل.
أملاح حمض النيتريك تشمل بعض المركبات المهمة، على سبيل المثال نترات البوتاسيوم الذي يدخل في تركيب البارود و نترات الأمونيوم الذي يدخل في تركيب الأسمدة ومخصبات التربة. المركبات العضوية التي يدخل فيها النيتروجين ، كالنيتروجليسرين والترينيترولولين تكون قابلة للانفجار عادة.
يستخدم حمض النيتريك كعامل أكسدة في الصورايخ التي تعمل بالوقود السائل، فالهايدرازين ومشتقاته تستخدم في وقود الصواريخ. كما يستخدم النيتروجين السائل لعلاج لعلاج الأورام الجلدية خاصة الحميدة منها (الثآليل).
استخدام النيتروجين السائل
يستخدم النيتروجين السائل في صناعة الأغذية لتجميد الأطعمة بسرعة كبيرة. ويستخدم النيتروجين السائل مبردًا لحفظ الأغذية أثناء نقلها. كما يستخدم النيتروجين السائل بوساطة العلماء في إنتاج درجات حرارة منخفضة ضرورية لاستخدامها في تجارب معينة.
المركبات الأكسجينية
يكوِّن الآزوت مع الأكسجين خمسة أكاسيد مختلفة هي: أكسيد الآزوتي N2O وأكسيد الآزوت NO وثنائي أكسيد الآزوت NO2 وثلاثي أكسيد الآزوت N2O3 وخماسي أكسيد الآزوت N2O5 وفيما يلي خواص أهمها:
أكسيد الآزوت NO
هو أكثر أكاسيد الآزوت فائدة في الصناعة مع أنه لا يعزل أبداً بالحالة الصرفة بسبب تأكسده. ويحصل عليه بأكسدة النشادر بالهواء:
ويتحد تلقائياً مع الأكسجين بالدرجة العادية من الحرارة فيعطي ثنائي أكسيد الآزوت:
يحوي الجزيء NO عدداً فردياً من الإلكترونات Ń=Ö: فهو جذر حقيقي مثل جذر النتروزيل، وهو يحقِّق تفاعلات ضم عدة، ويعطي مع الهالوجينات [[هالوجين النتروزيل مثل كلور النتروزيل NOCl وهناك معادن نتروزيلية مثل Fe(NO)4 وهناك مركبات مزيج نتروزيلية ـ كربونيلية أو مركبات هالوجين المعادن النتروزيلية Fe(NO)2X حيث X هالوجين I-Br-Cl.
ثنائي أكسيد الآزوت NO2
سائل في الدرجة (صفر) س، وهو مكوَّن من الجزيئات N2O4 ويثار تفكك جزيئاته هذه في درجة غليانه النظامية (21.1)س ويصبح التفكك كلياً في الدرجة (150) س وفق التفاعل:
ثلاثي أكسيد الآزوت N2O3
ويسمى أيضاً بلا ماء الآزوتي، سائل يغلي في الدرجة 3ْس، وهو قليل الثبات، ويعطي مع الماء محلولاً حمضياً هو حمض الآزوتي HNO2 ، وتدعى أملاحه النتريتات nitrites ويُرجع حمض الآزوتي فوق منغنات البوتاسيوم KMnO4 ويؤكسد أملاح الحديدي وأملاح القصديري، ويتكاثف مع كلوريدرات الأمين C6H5NH2.HCl معطياً مركب ديأزو C6H5.N=N.Cl.
تنحل النتريتات القلوية في الماء وهي أكثر ثباتاً من النترات الموافقة ويمكن أن تُشتق منها بالتفكك الحراري.
تتحلل بالماء نتريدات المعادن الشديدة الكهربائية الموجبة كالمعادن القلوية مطلقة النشادر أو NHX2 أو NX3؛ فالمركب NH2Cl هو كلور الأمين، والمركب NHCl2 هو ثنائي كلور الأمين، أما NCl3 فهو كلور الآزوت.
ويحصل على الأمينات
باستبدال ذرات هدروجين النشادر بجذور فحمية هدروجينية R. كما يمكن أيضاً أن يستبدل الهدروجين بجذور شتى كما في الأسِت أميد CH3CONH2 والسُّلفاميد O2S(NH2)2 والسُّلفيميد O2S=NH.
وهناك زمرة أخرى من الخاصيات توافق تفاعلات ضم، وخاصة ضم الشاردة H+ حيث تحصل شاردة الأمونيوم NH+ 4 وأملاح الأمونيوم التي لبعضها أهمية كبيرة لاستعمالها سماداً. كما تحصل تفاعلات ضم مع كثير من أملاح المعادن الانتقالية مثل CO(NH3)6Cl2 أو Cu(NH3)4Cl2، والتي تدعى أملاح المعادن النشادرية، وهناك أيضاً تفاعلات ضم للنشادر مع أملاح أخرى مثل LiCl,nNH3 حيث n =1 أو 2 أو 3.
حمض الآزوت HNO3
هو من أكثر المركبات الآزوتية الأكسجينية أهمية، عُرِفَ قديماً واستعمل باسم «الماء القوي» كما اشتهر بـ «ماء الفضة» لأنه كان يستعمل لفصل الفضة عن الذهب.
اكتشفه أول مرة العالم العربي جابر بن حيان الكوفي في القرن الثامن للميلاد. كان يستحصله بتقطير ملح البارود بعد مزجه بالشب والزنجار (كربونات النحاس الأساسية) تقطيراً جافاً. وفي عام 1784 أبان العالم الانكليزي كافندش Cavendish تركيبه ونوع العناصر التي يتألف منها، ثم جاء العالم الفرنسي غاي لوساك Gay- Lussac وحدد نسبة ذلك التركيب.
يحصل على حمض الآزوت اليوم صناعياً بأكسدة النشادر؛ وتسوَّق محاليله المائية بتراكيز مختلفة. يتفكك حمض الآزوت عند درجة حرارة غليانه في الضغط الجوي 84ْس، وبما أن حمض الآزوت المركّز الساخن مركب غير ثابت فهو يسلك سلوك مؤكسد عنيف فهو مثلاً يؤكسد الكبريت والفسفور وشوارد الحديدي ++Fe. ويعطي مع الأسس أملاحاً تدعى «النترات» أو «الآزوتات». ويتفاعل مع المعادن باستثناء الذهب والبلاتين معطياً أملاح النترات الموافقة إضافةً إلى منتجات إرجاعه NO مع النحاس والزئبق، وملح الأمونيوم مع التوتياء والحديد. وبإمكان حمض الآزوت الشديد التركيز تمنيع passivation بعض المعادن؛ فالحديد المعالج بحمض الآزوت الوسطي التمديد لا يتأثر عملياً بحمض الآزوت الشديد التركيز بل يغدو مُمَنَّعاً passive، أي أن قطعة الحديد التي غدت ممنعة لم تعد تتأثر حتى بحمض الآزوت الممدد.
ويعطي حمض الآزوت إيتيرات ملحية مع الأغوال، ويعطي منتجات تبادل مع المواد العطرية العضوية، كالحصول على النتروبنزن بتأثير حمض الآزوت في البنزن:
يفيد حمض الآزوت في تحضير الأسمدة الآزوتية، كما تستعمل المشتقات العطرية المنترجة بحمض الآزوت ([[مركبات النترو) وإيتيراته الملحية مع متعددات أغوال شتى كالنتروغليسرين والنتروسلولوز.[1]
التاريخ
النيتروجين من اللاتينية nitrumواليوناينة Nitron لفظة تعني الصودا الأصيلة، أصل أو يشكل ،ويعتبر وعلى نطاق واسع ان مكتشفها هو إرنست رذرفورد عام 1772، الذي أسماها الهواء الضار (؟) noxious air، أو الهواء المحروق (؟)'phlogisticated air .وكان من المعروف لدى الكيميائيين وجود جزء من الهواء لا يحترق منذ نهايات القرن الثامن عشر. وكان العالم كارل ويلهلم شيل والعالم هنري كاڤنديش وجوزيف بريستلي الذي أسماه بالهواء المحروق ، يدرسون غاز النيتروجين في ذات الفترة تقريبا ، وكان يعتبر غير نشط لدرجة أن أنطون لافوزييه أطلق عليه تسمية الآزوت والتي تعني "بلا حياة".
كانت مركبات النيتروجين معروفة في العصور الوسطى ، وعرف الخيميائيون حمض النيتريك بإسم الماء الشديد aqua fortis، وخليط حمض النيتريك وحمض الهيدروكلوريك عرف بإسم "الماء الملكي"، المعروف بقدرته على إذابة الذهب.
كما يستخدم النيتروجين في ملء الإطارات ، وذلك يعود إلى الثبات النسبي لحجمه لدى تغير درجات الحرارة.
النيتروجين والتلوث
يؤثرّ الإنسان في دورة النيتروجين؛ وذلك لأن استخدام الأسمدة النيتروجينية يزيد من نيتروجين التربة. ثم تحمل مياه الأمطار الأسمدة غير المستخدمة ومركبات النيتروجين الأخرى إلى الأنهار والبحيرات مما يؤدي إلى تكاثر النباتات المائية والطحالب. وعندما تموت تلك النباتات والطحالب وتتحلل، فإنها تستخدم الأكسجين المذاب في الماء مما يهدد حياة الحيوانات الموجودة داخل المياه. تُعْتَبر أكاسيدُ النيتروجين من ملوثات الهواء الجوي، وتُطْلَقُ هذه المُلوِّثات في الجو عن طريق حرق الوقود المتحجّر كالفحم الحجري والنفط. كما أن ضوء الشمس يساعد على تفاعل أكاسيد النيتروجين في الغلاف الجوي مع الأكسجين مكونة الأوزون. وهو مادة مهيجة في الضباب الدخاني. كما أن أكاسيد النيتروجين تعود للأرض في شكل حمض النيتريك أحيانا، وهو من المكونات الأساسية للأمطار الحمضية. وتنتج المحركات النفاثة أكاسيد النيتروجين في الطبقات العليا من الغلاف الجوي، مما يؤدي إلى إتلاف البيئة بطرق مختلفة. ومن أمثلة ذلك أن أكاسيد النيتروجين تزيد من تفكك الأوزون في الطبقات العليا،حيث يعمل الأوزون على حماية الإنسان والنبات وذلك بمنعه وصول الأشعة فوق البنفسجية الضارّة.
أنظر أيضاً
- Industrial gas
- Liquid nitrogen
- Nitrogen asphyxiation
- Nitrogenomics
- Nutrient
- Reactive nitrogen species
- Tetranitrogen
- TKN
المصادر
قراءات أخرى
- Garrett, Reginald H. (1999). Biochemistry (2nd ed.). Fort Worth: Saunders College Publ. ISBN 0030223180.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help)
- Greenwood, Norman N. (1984). Chemistry of the Elements. Oxford: Pergamon Press. ISBN 0080220576.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help)
- "Nitrogen". Los Alamos National Laboratory. 2003-10-20.
وصلات خارجية
- Etymology of Nitrogen
- Why high nitrogen density in explosives?
- WebElements.com - Nitrogen
- It's Elemental - Nitrogen
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry: Nitrogen
- Schenectady County Community College - Nitrogen
- Nitrogen N2 Properties, Uses, Applications
- Handling procedures for liquid nitrogen
- Material Safety Data Sheet
| Diatomic Elements | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
هيدروجين |
| |
نيتروجين |
| |
أكسجين |
| |
فلور |
|||||||||||||||||||||||||
|
كلور |
| |
بروم |
| |
يود |
| |
أستاتين |
|||||||||||||||||||||||||
| الجدول الدوري | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||