زركونيوم
ساهم بشكل رئيسي في تحرير هذا المقال
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
أبيض فضي
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخصائص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، الرمز، الرقم | زركونيوم, Zr, 40 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النطق | /zərˈkoʊniəm/ zər-KOH-ni-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | فلز انتقالي | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 4, 5, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الوزن الذري القياسي | 91.224 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التوزيع الإلكتروني | [Kr] 5s2 4d2 2, 8, 18, 10, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخصائص الطبيعية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | 6.52 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة السائلة عند ن.إ. | 5.8 گ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 2128 ك, 1855 °C, 3371 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 4682 ك, 4409 °س, 7968 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 14 كج·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 573 كج·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية المولية | 25.36 ج·مول−1·ك−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخصائص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حالات الأكسدة | 4, 3, 2, 1[1] (amphoteric oxide) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سالبية كهربية | 1.33 (مقياس پولنگ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأولى: 640.1 كج·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثانية: 1270 كج·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالثة: 2218 كج·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف القطر الذري | 160 پم | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 175±7 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| متفرقات | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | hexagonal close-packed | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الترتيب المغناطيسي | مسايرة[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقاومية الكهربائية | (20 °C) 421 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ناقلية حرارية | 22.6 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | (25 °س) 5.7 µm·م−1·ك−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت (قضيب رفيع) | (20 °س) 3800 م·ث−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل ينگ | 88 گپا | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 33 گپا | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 91.1 گپا | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة پواسون | 0.34 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 5.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة ڤيكرز | 903 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة برينل | 650 مپا | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم تسجيل كاس | 7440-67-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| أكثر النظائر استقراراً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر زركونيوم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
الزركونيوم Zirconium (الذي ينطق حسب IPA: /zəˈkəʊniəm, ˌzɛːˈkəʊniəm, zɜːɹ'kəʊniəm) هو عنصر كيميائي في الجدول الدوري المعاصر ورمزه Zr وله رقم ذري 40. لونه رمادي-أبيض براق، فلز انتقالي قوي يشابه التيتانيوم, معظم الزركونيوم يستخرج من الزركون وهو مقاوم قوي للتآكل. ويستخدم الزركونيوم أساساً في المفاعلات النووية بسبب مقاومته للتآكل ومقطعه النيوتروني المنخفض.
يوجد عنصر الزركونيوم بشكل واسع في الطبيعة بنسبة توافر تبلغ 28 من الألف في المائة ويحتل المرتبة ال11 في التواجد في الطبيعة قبل عناصر أخرى كثيرة مشهورة.
ويتواجد في الطبيعة في شكل معدنين رئيسين وهما الزركون (Zr,Hf) SiO4 وأكسيد الزركونيوم (Zr,Hf)O2 . يوجد في الطبيعة في المعدن السليكاتي المعروف باسم الزركون وفي المعدن الأكسيدي المسمى باديليت.
والزركونيوم معدن انتقالي، يقع في فصيلة التيتانيوم (الفصيلة الثانوية الرابعة) بنيته الإلكترونية [Kr]5S24d2. تدل [Kr] على البنية الإلكترونية للغاز الخامل كريبتون (عدده الذري36). حصل الألماني كلابروث M.H.Klaproth على ثنائي أكسيد الزركونيوم ZrO2 من فلز الزركون (سيليكات الزركونيوم) عام 1789. وقد تمكّن برزليوس عام 1824 من فصل الزركونيوم الحر.
التاريخ
كلمة زركونيوم اشتقت من الكلمة العربية "زركون" والتي كانت تعريباُ للكلمة الفارسية "زرگون" وتعني "ذهبي" وكان العرب والفرس يطلقونها على معدن. (Arabic zarkûn from Persian zargûn زرگون meaning "gold like") was discovered in 1789 by Martin Heinrich Klaproth and isolated in 1824 by Jöns Jakob Berzelius.
وقد فصل الكيميائي الألماني مارتن هينريش كلابروث أكسيد الزركونيوم عن معدن الزركون في عام 1789م. وقام الكيميائي السويدي جونز برزيليوس بتحضير عنصر الزركونيوم لأول مرة في عام 1824م.
النظائر
 مقالة مفصلة: نظائر الزركونيوم
مقالة مفصلة: نظائر الزركونيوم
يوجد للمعدن عدة نظائر مهمة، أهمها 91Zr و 92Zr و 93Zr و 94Zr و90Zr
التواجد
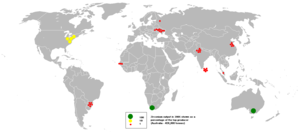
الزركون أو سليكات الزركونيوم (ZrO2.SiO2)، هو مادة خام موجودة بشكل طبيعى لها مقاومة ممتازة للحرارة، ثقلها النوعى (4,5 - 4,6 جم/سم3) عالى بصورة غير عادية بالمقارنة مع معظم المواد الحرارية. وتشمل مصادر الزركون الرئيسية رمال غرب أستراليا الطبيعية، وشرق ولاية فلوريدا، وساحل ناتال الشرقى في شمال جنوب أفريقيا، وبلدان المجموعة الاقتصادية الأوروبية وجمهورية الصين الشعبية. عادة ما يتم العثور على الزركون مع رمال معادن ثقيلة أخرى، وعلى الأخص معادن التيتانيا. ويبين جدول 15 خصائص الزركون.[4]
ويشكل الزركونيوم 0.025% وزناً من القشرة الأرضية. وهذه نسبة مرتفعة نسبياً إلا أنه شديد التبعثر وتندر مراقده الهامة، وأهم فلزاته الزركون ZrSiO4 والبادليت ZrO2 وهو أكثر انتشاراً في الطبيعة من النحاس والزنك والرصاص مجتمعة. ويصادف في الطبيعة مصحوباً دوماً بالهافنيوم بكميات صغيرة لاتتجاوز أجزاء من 1%، يعود السبب في ذلك للشبه الكيميائي الكبير بين هذين المعدنين، وهما يستحصلان مختلطين معاً ومن ثم يفصلان عن بعضهما بطرائق كيميائية تعتمد على التبادل الشاردي ion exchange أو التجزئة باستخلاص المذيب solvent extraction fractionation، إذ إن هذين العنصرين يتشابهان أكثر من أي عنصرين آخرين في الجدول الدوري.
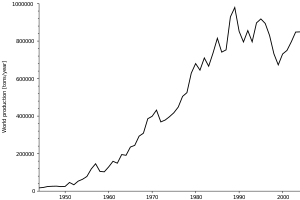
الإنتاج
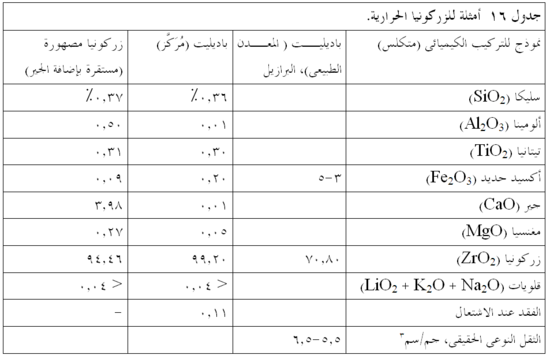
يُنتج أكسيد الزركونيوم (ZrO2) تجاريا مثل معدن الباديليت الموجود بشكل طبيعي. وقد مثلت صناعة الحراريات أحد مجالات النمو الرئيسية للزركونيوم. الارتفاع النسبى في درجة إنصهار باديليت، جنبا إلى جنب مع المقاومة الفائقة للتآكل والتحات، تجعل الزركونيا مكوناً مثالياً للعديد من نظم الحراريات. الزركونيا في الحالة طبيعية توجد في طور ذو بلورة أحادية الميل. وعند تسخينها، تخضع الزركونيا لتحول طورى (للنظام الرباعي) وانكماش للحجم يبلغ نحو 5 ٪، ومع زيادات إضافية في درجة الحرارة يستقر الشكل (البلورى) المكعبى عند 2350 ْم. ولمواجهة هذه التحولات الطورية الضارة، يمكن استقرار الزركونيا على الطور المكعبى بإضافة كميات صغيرة من الكالسيا والمغنسيا، أو الإيتريا، ونتيجة لذلك الاستقرار تتحسن مقاومة الصدمات الحرارية وخصائص التحميل الساخن في المنتج النهائي. الزركونيا متوفرة في الصورة الطبيعية أو المستقرة أو المصهورة، وهذه الأخيرة غالبا ما تكون خليطاً مع الألومينا والسليكا أو غيرها من الأكاسيد المتوافقة. ويبين جدول 16 الخصائص النموذجية للزركونيا.
الفصل بين الزركونيوم والهافنيوم
أكاسيد، نيتريدات وكربيدات
مشتقات عضوية

سبائك الزركونيوم
يمكن إضافة معادن اخرى إلى الزركونيوم مثل Snو Crو Fe و Niو Nb و ذلك لتحسين خواصة الميكانيكية و مقاومته للتاكل الصدأ
اشهر هذه السبائك
زركالوي 2 Zircaloy 2 وتتكون من النيكل والكروم والحديد والقصدير وزالكوري 4.
أهم مركباته
الأكسيد MO2 مادة بيضاء صعبة الانصهار والانحلال في الماء أو في الحموض والأسس الممددة. وهو ينحل في حمض الكبريتيك المركّز ببطء إلا أن هذا الأكسيد ينحل بسهولة في HF أو القلويات المصهورة. وهو أكسيد مذبذب amphoteric مع تغلب الخواص القلوية نسبياً إذ ينحل هدروكسيد الزركونيوم Zr(OH)4 في الحموض القوية.
أملاح الشاردة Zr4+ لا لون لها وهي في المحاليل أكثر ثباتاً من الزركونات ِA4ZrO4 و A2ZrO3، ويتكّون من حلمهتها أملاح الزكونيل بحسب التفاعل:
ومن أملاح الزركونيل التي فصلت ZrOCl2.8H2O
ولهاليدات الزركونيوم أهمية خاصة من بين مركباته جميعها، وصيغتها العامة ZrX4، ويحصل عليها بحرق مزيج من الأكسيد الموافق للمعدن مع الكربون في جو من الهالوجين ويتم التفاعل وفق المعادلة:
ويتشكل كربيد الزركونيوم ZrC بتسخين المعدن أو أكسيده بدرجة عالية من الحرارة مع الكربون، وهو جسم قاس يمكنه خدش الكوارتز، وناقل للكهرباء وينحل في القلويات المصهورة.
نتريد الزركونيوم ZrN (درجة انصهاره 3200 ْس) يستحصل بتسخين ثنائي الأكسيد مع الكربون في جو من الآزوت، له البنية البلورية لكلوريد الصوديوم وهو مركب ثابت جداً وذو ناقلية جيدة للكهرباء.
يميل الزركونيوم لتشكيل مركبات بيروكسيدية (− O − O -) مع الماء الأكسجيني H2O2 أو هبوكلوريت الصوديوم NaOCl. ويمكن استحضار سلسلة من ضروب بيروكسي الزوكونات وذلك حسب شدة تركيز الماء الأكسجيني المستعمل مثل K4ZrO8.6H2O، ومركبات أكثر تعقيداً مثل Na4Zr2O11.9H2O.
قلما يشكل الزركونيوم أملاحاً معتدلة مع الحموض الأكسجينية (القوية منها والضعيفة)، نظراً لضعف الخواص الأساسية للهيدروكسيد Zr(OH)4.
فالزركونيوم يشكل كبريتات الزركونيوم Zr(SO4)2 إلا أنه لايمكن الحصول على بلوراته من الماء لأنها تتحول في أثناء البلورة إلى أملاح أساسية؛ ولا يمكن الحصول على أملاح النترات المعتدلة بسهولة وتتحول مباشرة إلى نترات أساسية.
الزركونيوم معدن انتقالي نموذجي، فهو يشكل معقدات مع الهاليدات مثل A2[ZrX6] حيث A معدن أحادي التكافؤ A3[ZrF7]، و A4[ZrF8]، و A5[ZrF9]، حيث يكون العدد التساندي فيها 7 و8 و9 على التوالي، كما يشكل معقدات مع مرتبطات أخرى.
يشكل الزركونيوم رباعي نترات Zr(NO3)4 غير مميهة طيارة وهي مركبات تساندية معقدة وليست أملاحاً.
يتحد الزركونيوم مع السيليكون بطريقة مشابهة لاتحاده مع الكربون مكوناً المركب ZrSi2 ويتم هذا التفاعل بانتشار كمية كبيرة من الحرارة. وهو مركب مقاوم للحرارة وقاس، ويستعمل بدلاً من الألماس لصقل الأحجار الكريمة وغيرها.
يمتص الزركونيوم، وهو بشكل مسحوق الهدروجين. وتتوقف كمية الهيدروجين الممتصة على الضغط ودرجة الحرارة وتتشكل هدريدات ذات تركيب غير معين صيغتها الحدية MH2، وهي هدريدات ثابتة في الهواء ولاتتأثر بالماء.
إن سيليكات الزركونيوم، الموجودة في الطبيعة، المعروفة باسم زركون Zircon تعدّ حجراً كريماً. ويستعمل الزركون، نظراً لقساوته (7.5) ولمعانه بديلاً عن الألماس أو الأحجار الكريمة الأخرى. وهو يصادف بألوان عديدة مثل الأحمر، والأخضر، والأزرق، والأبيض.
إن مركبات الزركونيوم الموافقة للتكافؤين (2) و(3) قليلة الثبات يعرف منها الهاليدات: ZrX3، ZrX2. يحصل على ZrX3 بتسخين ZrX4 مع الألمنيوم في أنبوب مغلق، ويحصل على ZrX2 بتفكك MX3 بالحرارة بمعزل عن الهواء.
وهذه المركبات جميعها مرجعة قوية. ويكون ZrCl3 على شكل بلورات بنية اللون تتحول في الهواء إلى أوكسي كلوريد ZrOCl. ويحضر ZrCl2 بصورة غير نقية بإرجاع ZrCl3 بالصوديوم وهو أسود اللون
خواصه الفيزيائية والكيمياوية
الزركونيوم معدن صعب الانصهار، درجة انصهاره 1857 ْس ونظراً لميله الشديد للاتحاد مع الكربون، والأكسجين، والنتروجين (الآزوت) بخاصة يصعب الحصول عليه نقياً. يحصل عليه في الحالة المعدنية الحرة بإرجاعه من كلوريده بالمگنزيوم أو الصوديوم في جو من الأرگون، ويحصل عليه بدرجة عالية من النقاوة بتفكيك يوديده في درجة عالية من الحرارة (1800 ْس) على سلك من التنگستين.
له مظهر الفولاذ، يقبل الطرق والسحب جيداً، كثافته 6.53غ/سم3، يغلي عند الدرجة 3600 ْس تقريباً.
يدخل الزركونيوم في تركيب عدد من الخلائط alloys فيزيد من متانتها (مع النحاس والمغنزيوم والزنك)، كما أن ارتفاع درجة انصهاره ومتانته ومقاومته للتآكل وضآلة تفاعله مع النترونات تجعله مادة جيدة لبناء المفاعلات النووية.
الزركونيوم خامل كيميائياً إلا أنه يتفاعل عند الحرارة المرتفعة مع حمض فلور الماء، والماء الملكي، وإذا سُخِّن بشدة يتحد مع الكربون والآزوت والأكسجين والهالوجينات.
للزركونيوم عدة درجات أكسدة: +4، +3، +2، وأثبتها +4 إذ تتأكسد مركباته بدرجات الأكسدة الأخرى بسرعة متحولة إلى +Zr4 بفعل الهواء أو الماء أو مواد أخرى. للزركونيوم والهافنيوم نصفا قطر ذري متماثلان كما أن نصفي قطري +Zr4 وHf4+ متماثلان أيضاً للانكماش في نصف القطر الذري الحاصل في زمرة اللانثانوم. لذا كان السلوك الكيميائي لهما متشابهاً بدرجة كبيرة جداً.[5]
استخداماته
نظراً لأنه يقاوم التآكل ولا يمتص النيوترونات بسهولة، فإنه يستخدم في صناعة قلوب المفاعلات النووية. وتعد سبيكة الزركونيوم (زركالوي) مهمة، وقد صُنِّعت لأغراض الاستخدامات النووية مثل طلاء الأجزاء التي تحتوي على الوقود. يتحمل الباديليت درجات الحرارة الشديدة للغاية ويستخدم في صناعة بواتق المعامل (أواني صهر الفلزات) وبطانات الأفران.
الأمان
معدن الزركونيوم وأملاحه به نسبة سُمية ضئيلة، لا توجد هناك أية نتائج تشير إلى حدوث حالات تسمم الزركونيوم من الأطعمة لوجوده بتركيزات ضئيلة في المواد الغذائية.[6]
انظر أيضاً
المراجع
- ^ "Zirconium: zirconium(I) fluoride compound data". OpenMOPAC.net. Retrieved 2007-12-10.
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ Pritychenko, Boris. "Adopted Double Beta Decay Data". National Nuclear Data Center. Retrieved 2008-02-11.
{{cite web}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ^ وليد خليفة. "الحراريات المتالورجية: الأنواع والتركيبات الكيميائية (4) - حراريات الزركون / الزركونيا". نول. Retrieved 2012-03-27.
- ^ هيام بيرقدار. "الزركونيوم". الموسوعة العربية.
- ^ المعادن الثقيلة.. سموم بيئية، فيدو
وصلات خارجية
- WebElements.com - Zirconium
- روابط إلى مصادر كيميائية خارجية
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry's Chemistry World: Zirconium
| الجدول الدوري | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||