فسفور
| |||||||||||||||||||||||||
| المظهر | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
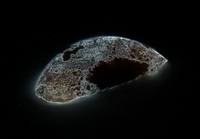
colourless, waxy white, yellow, scarlet, red, violet, black waxy white (yellow cut), red (granules centre left, chunk centre right), and violet phosphorus | |||||||||||||||||||||||||
| الخصائص العامة | |||||||||||||||||||||||||
| الاسم، الرمز، الرقم | الفسفور phosphorus, P, 15 | ||||||||||||||||||||||||
| النطق | /ˈfɒsfərəs/ FOS-fər-əs | ||||||||||||||||||||||||
| تصنيف العنصر | nonmetal | ||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 15, 3, p | ||||||||||||||||||||||||
| الوزن الذري القياسي | 30.973762(2) | ||||||||||||||||||||||||
| التوزيع الإلكتروني | [Ne] 3s2 3p3 2, 8, 5 | ||||||||||||||||||||||||
| التاريخ | |||||||||||||||||||||||||
| الاكتشاف | هـ. براند (1669) | ||||||||||||||||||||||||
| Recognized as an element by | A. Lavoisier[1] (1777) | ||||||||||||||||||||||||
| الخصائص الطبيعية | |||||||||||||||||||||||||
| الطور | solid | ||||||||||||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | (white) 1.823, (red) ≈ 2.2 – 2.34, (violet) 2.36, (black) 2.69 g·cm−3 | ||||||||||||||||||||||||
| نقطة الانصهار | (white) 44.2 °C, (black) 610 °C | ||||||||||||||||||||||||
| نقطة التسامي | (red) ≈ 416 – 590 °C, (violet) 620 °س | ||||||||||||||||||||||||
| نقطة الغليان | (white) 280.5 °س | ||||||||||||||||||||||||
| حرارة الانصهار | (white) 0.66 كج·مول−1 | ||||||||||||||||||||||||
| حرارة التبخر | (white) 12.4 كج·مول−1 | ||||||||||||||||||||||||
| السعة الحرارية المولية | (white) 23.824 ج·مول−1·ك−1 | ||||||||||||||||||||||||
| ضغط البخار (white) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Vapor pressure (red, bp. 431 °C) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| الخصائص الذرية | |||||||||||||||||||||||||
| حالات الأكسدة | 5, 4, 3, 2[2], 1[3], −1, −2, −3 (mildly acidic oxide) | ||||||||||||||||||||||||
| سالبية كهربية | 2.19 (مقياس پولنگ) | ||||||||||||||||||||||||
| طاقات التأين (المزيد) |
الأولى: 1011.8 كج·مول−1 | ||||||||||||||||||||||||
| الثانية: 1907 كج·مول−1 | |||||||||||||||||||||||||
| الثالثة: 2914.1 كج·مول−1 | |||||||||||||||||||||||||
| نصف قطر تساهمي | 107±3 pm | ||||||||||||||||||||||||
| نصف قطر ڤان در ڤالز | 180 pm | ||||||||||||||||||||||||
| متفرقات | |||||||||||||||||||||||||
| البنية البلورية | triclinic | ||||||||||||||||||||||||
| الترتيب المغناطيسي | (white, red, violet, black) diamagnetic[4] | ||||||||||||||||||||||||
| ناقلية حرارية | (أبيض) 0.236، (أسود) 12.1 W·m−1·K−1 | ||||||||||||||||||||||||
| معامل الحجم | (أبيض) 5، (أحمر) 11 گپا | ||||||||||||||||||||||||
| رقم تسجيل كاس | 7723-14-0 | ||||||||||||||||||||||||
| أكثر النظائر استقراراً | |||||||||||||||||||||||||
| المقالة الرئيسية: [[نظائر الفسفور phosphorus]] | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| خطأ لوا في وحدة:Navbar على السطر 58: Invalid title Infobox الفسفور<br>phosphorus. | |||||||||||||||||||||||||
الفسفور، (IPA: /ˈfɒsfərəs/, phôs تعني "ضوء"، وphoros تعني "حامل"), هو عنصر كيميائي ورمزه P ورقمه الذري 15. A multivalent لا فلز من مجموعة النيتروجين، الفسفور يكثر تواجده في صخور الفوسفات غير الحيوي. وهو عنصر ذو خواص لا معدنية نموذجية، أي إنه ناقل سيئ للحرارة والكهرباء ويكوِّن أكاسيد حمضية، ومركباته تغلب عليها الخواص المشتركة (التكافؤية). وهو معروف منذ القدم، عزله براندت Brandt عام 1669، يقع في الفصيلة VA (أو 15) بالدور الثالث، عدده الذري 15.
الخصائص الفيزيائية
 مقالة مفصلة: Allotropes of phosphorus
مقالة مفصلة: Allotropes of phosphorus
جزيء الفسفور P4 في الحالة الغازية ذو شكل رباعي الوجوه منتظم، وطاقة تفكّكه أصغر من طاقة تفكك جزيء الآزوت. لذا كان الفسفور أكثر نشاطاً (فعالية) من الآزوت.
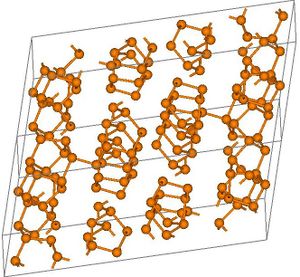
له متآصلات (متغايرات) allotropes بلورية:
الفسفور الأبيض والأشكال الجزيئية ذات الصلة
الفسفور الأبيض P4، يشبه الشمع، سام جداً لا يجوز لمسه. يحترق بسرعة عندما يتعرض للهواء مكوناً P4O10، ولذلك يحفظ الفسفور الأبيض تحت الماء عادة لحمايته من الهواء. وينحل في المحلات العضوية مثل CS2. يلمع الفسفور الأبيض في الظلام ويعود السبب في ذلك إلى فعل الفَسْفَرة phosphorescence الذي يفسّر بالاستناد إلى البنية الإلكترونية وخواص الأمواج الكهرطيسية (الكهرمغنطيسية). وهو يختلف عن الفَلْوَرَة.
الفوسفور الأحمر
الفسفور الأحمر وهو متماثر لـ P4 أي (P4)n، مسحوق أحمر داكن، غير سام، يحصل عليه بتسخين الفسفور الأبيض بمعزل عن الهواء وهو أقل فعالية من الفسفور الأبيض.
الفوسفور البنفسج
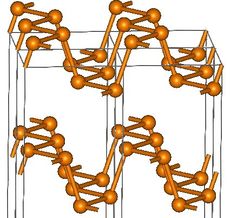
الفسفور الأسود
الفسفور الأسود، يحصل عليه بتسخين الفسفور الأبيض تحت ضغط عال وبوجود الزئبق الذي يعمل حفّازاً (وسيطاً) catalyst. لونه أسود مثل فحم الجرافيت. وهو أقل الأشكال الثلاثة فعالية.
| الشكل | أبيض (α) | أبيض (β) | بنفسجي | أسود |
|---|---|---|---|---|
| Symmetry | Body-centred cubic | Triclinic | Monoclinic | Orthorhombic |
| Pearson symbol | aP24 | mP84 | oS8 | |
| Space group | I43m | P1 No.2 | P2/c No.13 | Cmca No.64 |
| Density (g/cm3) | 1.828 | 1.88 | 2.36 | 2.69 |
| Bandgap (eV) | 2.1 | 1.5 | 0.34 | |
| Refractive index | 1.8244 | 2.6 | 2.4 |
الخواص الكيمائية
للفسفور عدة درجات أكسدة تراوح بين (-3) و(+5). درجتا الأكسدة الرئيسيتان له (+3) و(+5)، ويلخص المخطط الآتي أهم خواصه الكيمياوية:
بعض التفاعلات النموذجية للفسفور الأبيض والأحمر
من مركبات الفسفور الفُسفين PH3 وهو غاز (درجة حرارة غليانه - 87.5 ْس ودرجة حرارة انصهاره - 132.5 ْس) لا يمكن تحضيره بالاتحاد المباشر بين الهدروجين والعنصر لعدم ثباته. فالفسفين يتفكك فور تسخينه. وتعتمد الطريقة العامة في استحصاله على حلمهة (التحلل بالماء) لمركباته الثنائية مثال ذلك فسفيد الكالسيوم :Ca3P2
Ca3P2 + 6H2O ® 3Ca(OH)2 + 2PH3
كما يمكن استحصاله بتفاعل الفسفور الأبيض مع محلول قلوي بدرجة الغليان :
4P + 3OH- + 3H2O ® 3H2PO2 + PH3
وهو مركب سام واستنشاقه خطر ولو بكميات صغيرة. يشتعل في الهواء متحولاً إلى حمض الفسفور. قليل الانحلال في الماء ومحلوله غير قلوي، ويشكل مثل النشادر NH3 أملاحاً تدعى مركبات الفسفونيوم وهي أقل ثباتاً من أملاح الأمونيوم بكثير.
النظائر
 مقالة مفصلة: نظائر الفوسفور
مقالة مفصلة: نظائر الفوسفور
التواجد
الفسفور قليل الانتشار في الطبيعة فهو يؤلف 0.118% أي نحو 1120 جزء بالمليون من القشرة الأرضية، ويأتي في الدرجة العاشرة بين العناصر بسعة انتشاره. ولا يُصادف حراً في الطبيعة وإنما على شكل فوسفات الكالسيوم Ca3(PO4)2 أو على شكل ضروب الأباتيت التي صيغتها 3Ca3(PO4)2. CaX2 حيث X هي Cl أو F أو OH.
الإنتاج
 مقالة مفصلة: حمض الفوسفوريك
مقالة مفصلة: حمض الفوسفوريك
يختلف الفسفور عن باقي العناصر جميعاً أنه استحصل أول مرة من أصل حيواني بدلاً من أن يستحصل من فلز، ففي عام 1669 قام كيميائي بتعفين البول ثم قطّره فحصل على الفسفور P4. ويوجد في العظام والأسنان، وفي مواد كيمياوية في جسم الإنسان وظيفتها تخزين الطاقة.
ويستحصل الفسفور من الفلز بتسخينه مع الرمل (SiO2) وفحم الكوك بطريقة كهربائية في أغلب الأحيان. وبتكثيف البخار الناتج يتشكل الفسفور الأبيض.
المركبات
أكاسيد الفسفور
| حالة الأكسدة | المعادلة | الاسم | الپروتون المكسد | المركبات |
|---|---|---|---|---|
| +1 | HH2PO2 | Hypophosphorous acid | 1 | acid, salts |
| +3 | H2HPO3 | Phosphorous acid | 2 | acid, salts |
| +3 | HPO2 | metaphosphorous acid | 1 | salts |
| +3 | H3PO3 | (ortho)phosphorous acid | 3 | acid, salts |
| +5 | (HPO3)n | metaphosphoric acids | n | salts (n=3,4,6) |
| +5 | H(HPO3)nOH | polyphosphoric acids | n+2 | acids, salts (n=1-6) |
| +5 | H5P3O10 | tripolyphosphoric acid | 3 | salts |
| +5 | H4P2O7 | pyrophosphoric acid | 4 | acid, salts |
| +5 | H3PO4 | (ortho)phosphoric acid | 3 | acid, salts |
مركبات الفوسفور
الأكاسيد
ليس للفسفور بدرجة الأكسدة +1 أي أكسيد ولكن الحمض H3PO2 حمض تحت الفسفوري معروف، وليس له أكسيد بدرجة الأكسدة +2 ولكن الحمض HPO2 ميتا حمض الفسفوري معروف، ويكوِّن الأكسيد P4O6 بدرجة الأكسدة +3 وهو بلا ماء أورتو حمض الفسفوري H3PO3، وهو يكوِّن الأكسيد P4O8 بدرجة الأكسدة +4 وهو بلا ماء حمض تحت الفسفور H4P2O6 كما يكوِّن الأكسيد P4O9، وأهم أكاسيده P4O10 بدرجة الأكسدة +5 وهو بلا ماء ميتا حمض الفسفور HPO3 وأورتو حمض الفسفور H3PO4 وهو أهم حموض الفسفور صناعياً، وناري حمض الفسفور H4P2O7، وثلاثي حمض الفسفور H5P3O10. أما ثلاثي الأكسيد P4O6 فقد سمي بهذا الاسم لأسباب تاريخية (واسمه الكيمياوي سداسي أكسيد رباعي الفسفور) وهو مركب صلب لا لون له قابل للتبخر (درجة حرارة انصهاره 23.8 ْس ودرجة حرارة غليانه175 ْس). وإذا حُرِّك (خضّ) بشدة في الماء يتحول كله إلى حمض الفسفوري H3PO3، إلا أنه لا يمكن الحصول عليه بتجفاف حمض الفسفوري. تفاعلاته الكيمياوية معقدة وليست مفهومة تماماً. وخماسي أكسيد الفسفور P4O10 سمي بهذا الاسم لأسباب تاريخية أيضاً، ويسمى كيمياوياً عشاري أكسيد رباعي الفسفور، وهو الناتج الرئيسي من احتراق الفسفور: وبالتحكم بشروط التفاعل يكون هو الناتج الوحيد. وهو جسم صلب أبيض بلوري يتصعَّد (أي يتحول من صلب إلى غاز مباشرة) عند درجة الحرارة 360 ْس تحت الضغط الجوي. وأهم خواصّه شرهه الشديد للماء، لذا يعدُّ أفضل مادة مجفِّفة عند درجات الحرارة الأخفض من 100 ٍْ. وعندما يتفاعل مع الماء يتكون مزيج من حموض الفسفور التي يتوقف تركيبها على شروط التفاعل وكمية الماء، ويستعمل P2O5 مجفّفاً حتى لمواد هي نفسها مجفِّفة، ومثال ذلك تحويل HNO3 حمض الآزوت إلى N2O5 وH2SO4 إلى SO3. وهو يسحب الماء من المواد العضوية (مثال ذلك تحويل ضروب الأميد إلى ضروب نتريل).
الحموض
أهم الحموض التي يشكلها الفسفور هو أورتو حمض الفسفور H3PO4 أو PO(OH)3 واسمه الشائع حمض الفسفور. ويصطنَع على شكل حمض لزج تركيزه 85% بتفاعل الصخر الفسفاتي المطحون مع حمض الكبريت، كما يستحصل بحرق الفسفور مباشرة ثم إضافة ماء إلى الأكسيد الناتج P4O10. والحمض النقي مادة بلورية لا لون لها (درجة حرارة انصهاره 42.35 ْس). وبرفع درجة الحرارة يصبح نشيطاً كيمياوياً ويتفاعل مع المعادن، كما يتفاعل مع الكوارتز. والحمض ذو وظيفة حمضية ثلاثية. يبلغ ثابت التأين الأول للحمض 0.717×10-2 وثابت التأين الثاني 7.99×10-8، وثابت التأين الثالث 4 × 10-13.
تعرف أملاح الفسفات لمعظم الأيونات (الشوارد) المعدنية وفلزات الفسفات في الطبيعة، وتصادف بشكل أورتو فسفات. ولبعض هذه الأملاح أهمية تجارية وعملية كبيرة، ومثال ذلك فسفات الكلسيوم، وخاصة الأباتيت وهو المكوِّن الرئيسي في الصخر الفسفاتي الذي توجد توضّعاته في أنحاء مختلفة من العالم وهو الخام الرئيسي لاستحصال الفسفور، وفسفات الأمونيوم الذي يستعمل سماداً والمحاليل الموقية buffer solutions التي يدخل في تركيبها فسفات المعادن القلوية.
يكوّن حمض الفسفور وضروب الفسفات معقدات مع كثير من المعادن الانتقالي. تترسـب أملاح فسـفات بعض المعادن بدرجة الأكسـدة (+4) مثل Pu, U, Zr, Th, Ce. وتُستعمل فسفات البور، والألمنيوم، والزركونيوم حفّازات في الصناعة بتفاعلات عدة.
هاليدات الفسفور
يبيِّن الجدول (1) أهم هاليدات الفسفور، أي المركبات التي يكوِّنها الفسفور مع الهالوجينات، وهي مركبات لا لون لها باستثناء الهاليدات التي ذكر لونها إلى جانبها في الجدول.
تستحضر الهاليدات PX3 عادة بالاتحاد المباشر بين الفسفور والهالوجينات المختلفة. وفلوريد الفسفور PF3، مثله CO، شديد السميّة لأنه يشكل معقداً مع الهيموجلوبين.
وكلوريد الفسفور PCl3 يجري تفاعلات مع مواد كثيرة، ويوديد الفسفور PI3 شره للأكسجين فهو على سبيل المثال يحوّل R2SO إلى R2S ويحوّل RCH2NO2 إلى RCN.
ثلاثي الهاليدات
خماسي الهاليدات
هاليدات أخرى
فلوريد PF3 (درجة حرارة غليانه -101.8 ْس)
PF5 (درجة غليانه -85 ْس)
P2Cl4 (درجة غليانه 180 ْس)
كلوريد PCl3 (درجة حرارة غليانه 76.2 ْس)
PCl5 (يتصعد بالدرجة 163 ْس)
بروميد PBr3 (درجة حرارة غليانه 173.22 ْس)
PBr5 (درجة حرارة انصهاره 100 ْس) (أصفر)
يوديد PI3 (درجة حرارة غليانه 61.2 ْس) (أحمر غامق)
P2I4 (درجة حرارة انصهاره 124 ْس) (نارنجي)
الجدول (1) هاليدات الفسفور
الفوسفيدات
يشكل الفسفور، في الواقع، مركباً ثنائياً مع كل عنصر معدني في الجدول الدوري. وتراوح الخواص الفيزيائية والكيمياوية والبنى لهذه المركبات بين المركبات ذات البنية البسيطة وتلك المعقدة التي تحوي سلاسل، أو صفائح أو بنى هيكلية يكوِّنها الفسفور. كما أن الفسفور يشكل مركبات توافق درجة الأكسدة -3، مثال ذلك فسفيد السترونسيوم Sr3P2، ولكن لهذه المركبات خواص المعادن وليس خواص المركبات الأيونية (الشاردية) ويحضَّر معظمها بتفاعل الكميات المناسبة من الفسفور والعنصر الثاني.
تتحد المعادن الانتقالية(وهي الموجودة في الفصائل 3-12 أو من III B إلى II B في الجدول الدوري) مع الفسفور وتتكوّن مركبات صيغتها MPn (n= 3،2،1)، ومعظم هذه المركبات لا تنحل بالماء وضعيفة النشاط الكيمياوي وهي نصف ناقلة، مثال ذلك CdP وInP.
النيتريدات
الكبريتيدات
 مقالة مفصلة: كبريتيد الفسفور
مقالة مفصلة: كبريتيد الفسفور
مركبات الفوسفور (III)
مركبات الفوسفور العضوي
 مقالة مفصلة: مركبات الفوسفور العضوي
مقالة مفصلة: مركبات الفوسفور العضوي
مركبات الفوسفور (I) والفوسفور (II)

Spelling and etymology
التاريخ والاكتشاف
The glow, the explanation, and the term derived from it
الدور الحيوي للإسترات الفسفاتية
تقوم الإسترات الفسفاتية بدور كيمياويات رئيسية في العمليات الحيوية. وتشمل هذه الكيمياويات المواد الوراثية، الدنا DNA والرنا RNA وكذلك المركب الحلقي أدينوسين أحادي الفسفات adenosine monophosphate AMP. إضافة إلى ذلك فإن انتقال زمر الفوسفات بين ADP وATP يُعد ذا أهمية رئيسية، طاقياً، في الأنظمة البيولوجية. والتفاعلات البيولوجية جميعها التي يتم فيها تشكل هذه الإسترات الفسفاتية وغيرها وضروب عديدات الفوسفات، يتأثر تشكُّلها أو حلمهتها (تحللها بالماء) بالحفّازات الأنزيمية التي يحوي كثيرٌ منها أيوناتٍ معدنيةً أجزاءً من بناها، أو تتطلب هذه الأيونات حتى تقوم بعمل كوإنزيمات coenzymes.
التطبيقات
الأسمدة
| المركبات الأكثر استخداماً | الاستخدام |
|---|---|
| Ca(H2PO4)2·H2O | Baking powder and fertilizers |
| CaHPO4·2H2O | Animal food additive, toothpowder |
| H3PO4 | Manufacture of phosphate fertilizers |
| PCl3 | Manufacture of POCl3 and pesticides |
| POCl3 | Manufacturing plasticizer |
| P4S10 | Manufacturing of additives and pesticides |
| Na5P3O10 | Detergents |
مركبات الفوسفور العضوي
الجوانب المعدنية
Matches
 مقالة مفصلة: Match
مقالة مفصلة: Match
تليين المياه
التطبيقات المتخصصة
الدور البيولوجي
العظام ومينا الأسنان
نقص الفوسفور
مصادر الغذاء
استعمالات الفسفور
من أهم استعمالاته الحصول على حمض الفسفور H3PO4 (أورتو حمض الفسفور)، ويستعمل الحمض لاستحصال أملاح الفسفات المختلفة ولاستحصال الحموض الهالوجينية مثل HBr. ويستعمل الحمض في صناعة الحديد وفي صناعة الفولاذ الذي لا يصدأ. ويستعمل أيضاً في صناعة المشروبات الغازية (مثال ذلك مشروبات الكولا).
يستعمل الفسفور في صنع الإشارات والأصبغة المتوهجة المستخدمة في الطرقات وفي الألعاب النارية.
ويستعمل الفسفور الأحمر في صناعة أعواد الثقاب؛ فعندما تحك أعواد الثقاب ينقلب الفسفور الأحمر إلى فسفور أبيض فيشتعل بشدة في الهواء. كما يستعمل في صنع مبيدات الحشرات pesticides، ويستعمل الفسفور الأبيض في صنع سم الفأر.
تستعمل ضروب كبريتيد الفسفور P4S3 خاصة في صناعة أعواد الثقاب؛ ولصنع رأس عود الثقاب يخلط الكبريتيد مع عامل مؤكسِد مثل كلورات (V) البوتاسيوم KClO3 وقليل من الزجاج المسحوق ويضاف إليه صمغ حتى يتماسك المزيج. وهذه الخلطة تفيد في صنع أعواد الثقاب التي تشتعل أينما حكت. أما علب الكبريت فيوضع على طرفيها لصاقة من الورق الرملي، والاحتكاك الناتـج من حـك رأس عـود الثقاب على طول اللصاقة كاف لكي يتفاعل الكبريتيد مع الكلورات (V).
يطلق على أملاح الفسفور مع الأكسجين اسم الفسفات. ولها أهمية كبيرة في نمو الحيوان لذلك تضاف إلى غذاء الحيوان. كما أن لبعض هذه الأملاح أهمية كبيرة في الزراعة فهي مصدر لنمو النبات. مثال ذلك يستعمل الفسفور في بناء الزمـر الفسفاتية للدنا DNA وللمادة الكيمياوية الحيوية ثلاثي فوسفات الأدينوسين ATP. وسماد السوبر فسفات هو مزيج Ca(H2PO4)2 مع كبريتات الكلسيوم اللامائية CaSO4 ويستحصل بفعل حمض الكبريت على الصخر الفسفاتي. فسفات الكلسيوم ثنائية الهدروجين Ca(H2 PO4)2.H2O الممزوجة مع كربونات الصوديوم الحمضية Na HCO3 والنشاء]] تكوِّن مسحوقاً جيداً للخَبْز. فعندما ترتفع درجة الحرارة ارتفاعاً كافياً يحرِّر الملح وكربونات الصوديوم الحمضية غاز ثاني أكسيد الكربون CO2 الذي يتغلغل في العجين ويسبب انتفاخه. ومن الأملاح الفسفاتية الحمضية الأخرى التي تستعمل مسحوق خبْز NaH2PO4 وKH2PO4 وNa2H2P2O7.
تحوي معاجين تنظيف الأسنان بعض أنواع الفسفات، ومثال ذلك فسفات الصوديوم وفسفات ثلاثية الصوديوم، وهي تعمل على حل الكيمياويات المكوّنة للبقع التي تتجمع على الأسنان فتبقى الأسنان بيضاء اللون. ويستعمل ملح ثلاثي فسفات الصوديوم Na5P3O10 مادةً منظفة.[7]
الاحتياطات
US DEA List I status
انظر أيضاً
مركبات
- فوسفات الأمونيوم ((NH4)3PO4)
- Calcium phosphate (Ca3(PO4)2)
- Calcium dihydrogen phosphate (Ca(H2PO4)2)
- فوسفيد الكالسيوم (Ca3P2)
- Iron(III) phosphate (FePO4)
- Iron(II) phosphate (Fe3(PO4)2)
- Gallium(III) phosphide (GaP)
- Hypophosphorous acid (H3PO2)
- Lawesson's reagent
- Parathion
- Phosphine (Phosphorus Trihydride PH3)
- Phosphoric acid (H3PO4)
- Phosphorus pentabromide (PBr5)
- Phosphorus pentasulfide (P2S5)
- Phosphorus pentoxide (P2O5)
- Phosphorus sesquisulfide (P4S3)
- Phosphorus tribromide (PBr3)
- ثالث كلوريد الفسفور (PCl3)
- Phosphorus triiodide (PI3)
- سارين
- Soman
- Tabun
- Triphenyl phosphine
- Monopotassium phosphate (KH2PO4)
- Trisodium phosphate (Na3PO4)
- VX غاز أعصاب
الهوامش
المصادر
- ^ cf. "Memoir on Combustion in General" Mémoires de l'Académie Royale des Sciences 1777, 592–600. from Henry Marshall Leicester and Herbert S. Klickstein, A Source Book in Chemistry 1400–1900 (New York: McGraw Hill, 1952)
- ^ webelements
- ^ Ellis, Bobby D.; MacDonald, Charles L. B. (2006). "Phosphorus(I) Iodide: A Versatile Metathesis Reagent for the Synthesis of Low Oxidation State Phosphorus Compounds". Inorganic Chemistry. 45 (17): 6864–74. doi:10.1021/ic060186o. PMID 16903744.
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةHW85 - ^ Berger, L. I. (1996). Semiconductor materials. CRC Press. p. 84. ISBN 0-8493-8912-7.
- ^ هيام بيرقدار. "الفسفور". الموسوعة العربية.
المراجع
- Emsley, John (2000). The Shocking history of Phosphorus. A biography of the Devil's Element. London: MacMillan. ISBN 0-333-76638-5.
{{cite book}}: Invalid|ref=harv(help) - Parkes, G.D.; Mellor, J.W. (1939). Mellor's Modern Inorganic Chemistry. Longman's Green and Co.
{{cite book}}: Invalid|ref=harv(help) - Podger, Hugh (2002). Albright & Wilson. The Last 50 years. Studley: Brewin Books. ISBN 1-85858-223-7.
{{cite book}}: Invalid|ref=harv(help) - Threlfall, Richard E. (1951). The Story of 100 years of Phosphorus Making: 1851–1951. Oldbury: Albright & Wilson Ltd.
{{cite book}}: Invalid|ref=harv(help)
وصلات خارجية
- WebElements.com - Phosphorus
- Entrez PubMed - Acute Yellow Phosphorus Poisoning
- قالب:PeriodicVideo
- Further warnings of toxic effects and recommendations for treatment can be found in "Emergency War Surgery NATO Handbook: Part I: Types of Wounds and Injuries: Chapter III: Burn Injury: Chemical Burns And White Phosphorus injury". Retrieved 2009-05-05.
- Simon, Fa; Pickering, Lk (1976). "Acute yellow phosphorus poisoning. "Smoking stool syndrome"". JAMA: the Journal of the American Medical Association. 235 (13): 1343–4. doi:10.1001/jama.235.13.1343. ISSN 0098-7484. PMID 946251.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - eMedicine.com: Article on White Phophorus as used as weapon
- Website of the Technische Universität Darmstadt and the CEEP about Phosphorus Recovery
| الجدول الدوري | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||