أكسيد الألومنيوم
ساهم بشكل رئيسي في تحرير هذا المقال
|
| |

| |
| المُعرِّفات | |
|---|---|
| رقم CAS | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.014.265 |
PubChem CID
|
|
| رقم RTECS |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | Al2O3 |
| كتلة مولية | 101.95 g mol-1 |
| المظهر | white solid |
| الرائحة | odorless |
| الكثافة | 3.95–4.1 g/cm3 |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | insoluble |
| قابلية الذوبان | insoluble in diethyl ether practically insoluble in ethanol |
| التوصيل الحراري | 30 W·m−1·K−1[1] |
| معامل الانكسار (nD) | nω=1.768–1.772 nε=1.760–1.763 Birefringence 0.008 |
| البنية | |
| البنية البلورية | Trigonal, hR30, space group = R3c, No. 167 |
| هندسة إحداثية |
octahedral |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
−1675.7 kJ·mol−1[4] |
| Standard molar entropy S |
50.92 J·mol−1·K−1[4] |
| المخاطر | |
تبويب الاتحاد الاوروپي (DSD)
|
Not listed. |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | non-flammable |
| مركبات ذا علاقة | |
أنيونات أخرى
|
aluminium hydroxide |
كاتيونات أخرى
|
boron trioxide gallium oxide indium oxide thallium oxide |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
أكسيد الألومنيوم هو أكسيد أمفوتيري للألومنيوم، صيغته الكيميائية Al2O3. ويشيع الإشارة إليه بأسماء الألومينا أو الزفير أو ألوكسيت aloxite[5] في أوساط التعدين والسيراميك و علم المواد. ويتم انتاجها عبر عملية باير من البوكسيت. أهم استخداماتها هو انتاج فلز الألومنيوم، إلا أنها تستخدم أيضاً ككاشط لصلادتها وكمادة حرارية لارتفاع نقطة انصهارها.
التواجد الطبيعي
الكورندم هو أكثر الصيغ البلورية شيوعاً لأكسيد الألومنيوم، الياقوت والزفير هما صيغ أقل شيوعاً بكثير للكورندم ويأخذوا ألوانهم المميزة من الشوائب. وتوجد أيضًا مع مواد أخرى، في خام البوكسيت الذي يعد مصدرًا رئيسيًا للألومينا التي يصنع منها المنتجون الألومنيوم.
الخصائص
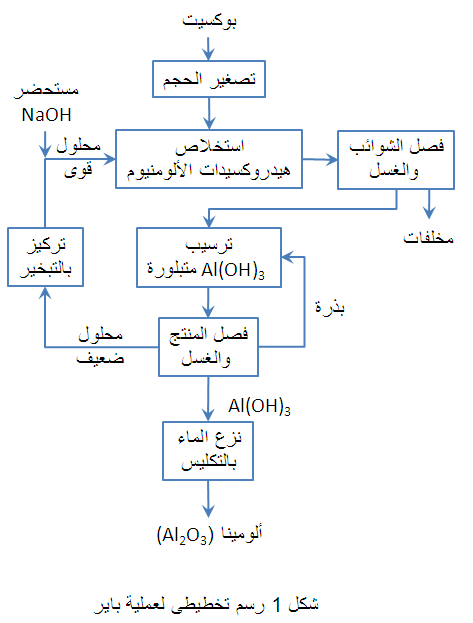
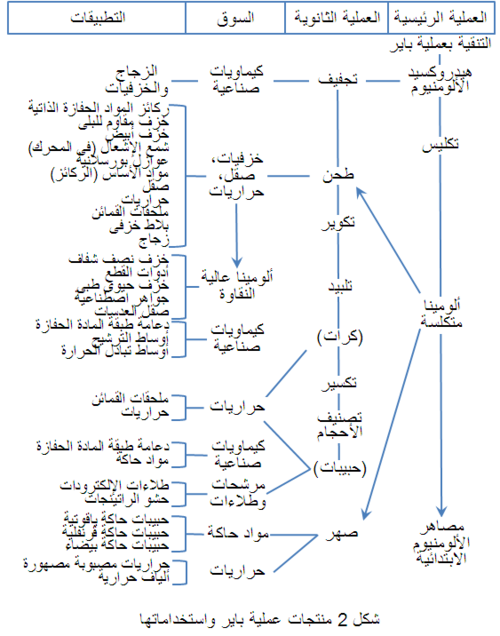
الألومينا عالية النقاوة المنتجة بعملية "باير" متاحة في صورة متفاعلة أو متكلسة، وتباع الأخيرة تحت الاسم التجارى "ألومينا صفيحية". والألومينا المصهورة متاحة أيضاً كمنتج مصنوع من البوكسيت، الذى رُكِّز أثناء الصهر بإزالة الحديد والسليكا في صورة حديد سليكونى (فروسليكون). وقد تصنع رُتَب خاصة من الألومينا من منتجات عملية باير. يوضح شكل 1 رسم تخطيطى لعملية "باير"، ويوضح شكل 2 منتجاتها واستخداماتها المختلفة. وفى العموم تستخدم الألومينات المتكلسة لتعزيز ترابط الحراريات أثناء التصنيع أو الاستخدام، بينما تشكل المنتجات الصفيحية والمصهورة ركامات شديدة الاستقرار. وتتكون الألومينا الصفيحية بالتكليس في 1925 ْم، بينما تتكون الألومينا المصهورة الأكثر كثافة بالصهر الكلى ثم التجميد السريع. وبالإضافة إلى ذلك فحبيبات الموليت المصهورة عالية النقاوة المصنوعة من خلائط الألومينا عالية الجودة والسليكا متاحة أيضاً. يوضح جدول 8 خصائص الألومينات المختلفة.[6]
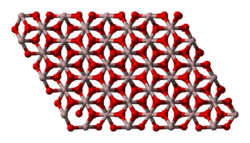
البنية البلورية

توجد الألومينا في أشكال بلورية متعددة. ولهذه الأشكال الصيغة الكيميائية نفسها، ولكنها تختلف في انتظام ذرات الألومنيوم والأكسجين. ويمكن تغيير هذه الأشكال المتنوعة من شكل إلى آخر عن طريق تسخينها لدرجة حرارة معينة. يوجد على شكل نمطين يختلفان عن بعضهما في البنية البلورية ، وبالتالي يختلفان أيضاً في الخصائص الفيزيائية والكيميائية بالإضافة إلى التطبيقات، وهما النمط ألفا α والنمط گاما γ .
α-أكسيد الألمنيوم
الخواص
يكون α-أكسيد الألمنيوم على شكل بلورات بيضاء قاسية، لا تنحل لا في الأحماض ولا الأسس، ولا تظهر أي شغف للرطوبة (استرطاب).
التحضير
يتم الحصول على α-أكسيد الألمنيوم من تسخين هيدروكسيد الألمنيوم فوق 1100°س
- 2Al(OH)3 → Al2O3 + 3H2O
الاستخدامات
تستخدم الألومينا المنقاة استخدامًا واسعًـا كمادة كاشطـة، تستخـدم للطــحن أو التلمـيع. وتقاوم الألومـينا درجـات الحرارة العالية. وهي موصِّل رديء للكهـرباء، ولهذا فهي تستخدم في تبطين الأفران وفي العوازل الكهربائية. يستخدم المنتجون صلصالاً أبيض يسمى الكاولين، وهو يتركب من الألومينا والسليكا والماء، في صنـاعة أواني الخـزف الصـيني. ويستـخدم الكاولــين أيضًا في إنتاج الدهان والورق ومنتجات أخرى.
نظراً لصلابة مركب α-أكسيد الألمنيوم (قساوة 9 على مقياس موس) فإنه يستخدم في معدات صقل وتلميع المعادن. كما يستخدم المركب في صنع الأجهزة المخبرية المعدة لتحمل درجات حرارة عالية مثل البواتق.
γ-أكسيد الألمنيوم
يتشكل γ-أكسيد الألمنيوم من تسخين هيدروكسيد الألمنيوم إلى حوالي 400°س، فنحصل على مسحوق أبيض ناعم شغوف للرطوبة، ينحل في كل من الحموض والأسس. بالتسخين فوق 950°س يتحول γ-أكسيد الألمنيوم إلى النمط ألفا. يتميز γ-أكسيد الألمنيوم بأن لديه قابلية كبيرة للامتصاص، لذلك يستخدم في الكروماتوگرافيا، في عمليات التجفيف، وفي إزالة ألوان المحاليل.
الإنتاج
انظر أيضاً
المصادر
Taschenbuch chemische Substanzen, Willmes, Verlag Harri Deutsch, ISBN 3-8171-1662-4
- ^ Material Properties Data: Alumina (Aluminum Oxide)
- ^ P. Patnaik (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 0-07-049439-8.
- ^ Roew, Raymond (2009). "Handbook of Pharmaceutical Excipients": 11–12.
{{cite journal}}:|contribution=ignored (help); Cite journal requires|journal=(help) - ^ أ ب Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. ISBN 0-618-94690-X.
- ^ "Aloxite", ChemIndustry.com database, retrieved 24 February 2007
- ^ وليد خليفة. "الحراريات المتالورجية: الأنواع والتركيبات الكيميائية (2) - طوب الألومينا". نول. Retrieved 2012-03-27.
وصلات خارجية
- CS1 errors: chapter ignored
- Pages using Chembox with unknown parameters
- ECHA InfoCard ID from Wikidata
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Short description is different from Wikidata
- Pages using div col with unknown parameters
- كواشط
- Sesquioxides
- مواد حرارية
- مركبات غير عضوية
- مكونات الزجاج من الأكاسيد الشائعة
- أكاسيد
- مركبات الألومنيوم