الإدمان
| الإدمان | |
|---|---|
| الأسماء الأخرى | اضطراب استعمال المواد الشديد[1][2] |
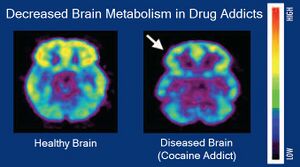 | |
| صور التصوير المقطعي بالإصدار البوزيتروني للدماغ التي تقارن التمثيل الغذائي للدماغ في فرد سليم وفرد مصاب بإدمان الكوكايين | |
| التخصص | الطب النفسي ، علم النفس السريري ، علم السموم ، طب الإدمان |
| مسرد الإدمان والإعتياد [3][4][5][2] | |
|---|---|
| |
الإدمان (إنگليزية: Addiction)، بالاتينية (PROCLIVITAS) هو اضطراب نفسي اجتماعي يتميز بالاشتراك القهري في مكافأة المنبهات على الرغم من العواقب السلبية.[3][5][2][6][7][8]مجموعة متنوعة من العوامل العصبية الحيوية المعقدة[3]والنفسية الاجتماعية[9] مشتركة في تطور الإدمان، مع النموذج السائد بين الباحثين في الولايات المتحدة هو نموذج أمراض الدماغ، على الرغم من وجود جدل داخل المجال حول المساهمة النسبية لأي عامل معين.[10][11][12][13][14][15] تشمل السمات المميزة للإدمان ضعف التحكم في المواد (المخدرات) أو السلوك، والانشغال بالمواد أو السلوك، والاستمرار في الاستخدام على الرغم من العواقب.[9][16] عادة ما تتميز العادات والأنماط المرتبطة بالإدمان بالإشباع الفوري (مكافأة قصيرة الأجل)، إلى جانب الآثار الضارة المتأخرة (التكاليف طويلة الأجل)).[9][17]
تشمل الأمثلة على المخدرات والإدمان السلوكي إدمان الكحول وإدمان الماريجوانا وإدمان الأمفيتامين وإدمان الكوكايين وإدمان النيكوتين وإدمان المواد الأفيونية وإدمان الطعام وإدمان الشوكولاتة وإدمان ألعاب الڤيديو وإدمان القمار والإدمان الجنسي. الإدمان السلوكي الوحيد المعترف به بواسطة DSM-5 (الدليل التشخيصي والإحصائي للاضطرابات النفسية (الطبعة الخامسة)و ICD-10 (المراجعة العاشرة للتصنيف الدولي للأمراض)هو إدمان القمار. مع إدخال ICD-11، تم إلحاق إدمان الألعاب.[18] كثيرًا ما يُساء استخدام مصطلح "الإدمان" عند الإشارة إلى سلوكيات أو اضطرابات قهرية أخرى، لا سيما الاعتماد، في وسائل الإعلام.[19] من الاختلافات المهمة بين إدمان المخدرات والاعتماد عليها أن الاعتماد عليها هو اضطراب يؤدي فيه التوقف عن تعاطي المخدرات إلى حالة غير محببة من الانسحاب، مما قد يؤدي إلى مزيد من تعاطي المخدرات.[20]الإدمان هو الاستخدام القهري لمادة أو أداء سلوك مستقل عن الانسحاب. يمكن أن يحدث الإدمان في غياب الاعتماد، ويمكن أن يحدث الاعتماد في حالة عدم وجود إدمان، على الرغم من أن الاثنين يحدثان معًا في كثير من الأحيان.
التاريخ والتسمية
غالبًا ما يُساء فهم أصل كلمة مصطلح الإدمان عبر التاريخ واتخذ معاني مختلفة مرتبطة بالكلمة. مثال على ذلك هو استخدام الكلمة خلال الفترة الحديثة المبكرة. "الإدمان" في ذلك الوقت كان يعني "الارتباط" بشيء ما، مما يمنحه دلالات إيجابية وسلبية. يمكن وصف موضوع هذا المرفق بأنه "جيد أو سيئ".[21] ومع ذلك، ارتبط معنى الإدمان خلال هذه الفترة بالإيجابية والخير. خلال العصر الديني للغاية، كان يُنظر إليه على أنه طريقة "لتكريس الذات للآخر".[21]
أدت الأبحاث الحديثة حول الإدمان إلى فهم أفضل للمرض من خلال الدراسات البحثية حول هذا الموضوع التي يعود تاريخها إلى عام 1875، وتحديداً حول إدمان المورفين.[22] عزز هذا من فهم الإدمان كونه حالة طبية. لم يُنظر إلى الإدمان حتى القرن التاسع عشر ويُعترف به في العالم الغربي على أنه مرض، كونه حالة جسدية ومرض عقلي.[23]يُفهم الإدمان اليوم على أنه اضطراب بيولوجي نفسي اجتماعي يؤثر سلبًا على من يتأثرون به، ويرتبط في الغالب بتعاطي المخدرات والكحول.[9] لقد تغير فهم الإدمان عبر التاريخ، مما أثر ولا يزال يؤثر على طرق علاجه وتشخيصه طبيًا.
الآثار
يتسبب الإدمان في "خسائر مالية وبشرية باهظة بشكل مذهل" على الأفراد والمجتمع ككل.[24][25][26] في الولايات المتحدة، التكلفة الاقتصادية الإجمالية التي يتحملها المجتمع أكبر من جميع أنواع مرض السكري وجميع أنواع السرطان مجتمعة.[26] تنشأ هذه التكاليف من الآثار السلبية المباشرة للأدوية وتكاليف الرعاية الصحية المرتبطة بها (على سبيل المثال، الخدمات الطبية الطارئة ورعاية المرضى الخارجيين والداخليين)، والمضاعفات طويلة الأجل (على سبيل المثال، سرطان الرئة الناتج عن تدخين منتجات التبغ وتليف الكبد والخرف من استهلاك الكحول المزمن، وفم الميث الناتج عن استخدام الميثامفيتامين)، وفقدان الإنتاجية وتكاليف الرعاية المرتبطة بها، والحوادث المميتة وغير المميتة (على سبيل المثال، الاصطدامات المرورية)، والانتحار، والقتل، والحبس، من بين أمور أخرى.[24][25][26][27] في الولايات المتحدة، وجدت دراسة أجراها المعهد الوطني لتعاطي المخدرات أن الوفيات الناجمة عن الجرعات الزائدة في الولايات المتحدة قد تضاعفت ثلاث مرات تقريبًا بين الذكور والإناث من عام 2002 إلى عام 2017، حيث تم الإبلاغ عن 72306 حالة وفاة بسبب الجرعة الزائدة في عام 2017 في الولايات المتحدة.[28]تميز العام 2020 بأكبر عدد من الوفيات بسبب الجرعات الزائدة على مدى 12 شهرًا، مع 81000 حالة وفاة بسبب الجرعة الزائدة، متجاوزة الأرقام القياسية المسجلة في عام 2017.[29]
علم النفس العصبي
يمثل التحكم المعرفي والتضبيط بالمحفز، المرتبط بالإشراط الاستثابي والكلاسيكي، عمليات معاكسة (على سبيل المثال، داخلية مقابل خارجية أو بيئية، على التوالي) تتنافس على التحكم في سلوكيات الفرد المستنبطة.[30] التحكم المعرفي، وخاصة السيطرة المثبطة على السلوك، ضعيفة في كل من الإدمان وقصور الإنتباه وفرط الحركة.[31][32] تميل الاستجابات السلوكية التي يحركها الحافز (أي التحكم في المنبهات) المرتبطة بمحفز مكافاءة معين إلى السيطرة على سلوك الفرد في حالة الإدمان.[32]
التحكم التحفيزي في السلوك
التحكم المعرفي في السلوك
الإدمان السلوكي
يشير مصطلح "الإدمان السلوكي" إلى القهر على الانخراط في مكافأة طبيعية - وهو سلوك يعود بطبيعته إلى المكافأة (على سبيل المثال، مرغوب فيها أو جذابة) - على الرغم من العواقب السلبية.[7][33][34] أثبتت الأدلة قبل السريرية أن الزيادات الملحوظة في التعبير عن ΔFosB من خلال التعرض المتكرر والمفرط لمكافأة طبيعية تؤدي إلى نفس التأثيرات السلوكية واللدونة العصبية كما يحدث في إدمان المخدرات.[33][35][36][37]
حددت مراجعات كل من الأبحاث السريرية في البشر والدراسات قبل السريرية التي تتضمن ΔFosB النشاط الجنسي القهري - على وجه التحديد، أي شكل من أشكال الجماع الجنسي - كإدمان (أي الإدمان الجنسي ).[33][35] علاوة على ذلك، فقد ثبت أن المكافئة التحسسية المتبادلة بين الأمفيتامين والنشاط الجنسي، مما يعني أن التعرض لأحدهما يزيد من الرغبة في كليهما، يحدث قبل الإكلينيكي والسريري كمتلازمة خلل تنظيم الدوبامين;[33][35][36][37] تعبير ΔFosB مطلوب لتأثير التحسس المتبادل هذا، والذي يتكثف مع مستوى التعبير FosB.[33][36][37]
تشير مراجعات الدراسات قبل السريرية إلى أن الاستهلاك المتكرر والمفرط على المدى الطويل للأطعمة التي تحتوي على نسبة عالية من الدهون أو السكر يمكن أن يؤدي إلى الإدمان ( إدمان الطعام ).[33][34] يمكن أن يشمل ذلك الشيوكلاتة. من المعروف أن النكهة الحلوة للشوكولاتة والمكونات الدوائية تخلق رغبة قوية أو تشعر "بالإدمان" من قبل المستهلك.[38] قد يشير الشخص الذي يحب الشيوكلاتة إلى نفسه على أنه مدمن للشيوكلاتة. لم يتم التعرف على الشوكولاتة رسميًا من قبل DSM-5 كإدمان قابل للتشخيص.[39]
تقدم المقامرة مكافأة طبيعية مرتبطة بالسلوك القهري والتي حددت لها أدلة التشخيص السريري، أي DSM-5، معايير تشخيص "الإدمان".[33] من أجل أن يلبي سلوك المقامرة لدى الشخص معايير الإدمان، فإنه يظهر خصائص معينة، مثل تعديل الحالة المزاجية والقسر والانسحاب. هناك دليل من التصوير العصبي الوظيفي على أن المقامرة تنشط نظام المكافأة والمسار الوسطي الطرفي على وجه الخصوص.[33][40] وبالمثل، يرتبط التسوق ولعب ألعاب الفيديو بالسلوكيات القهرية لدى البشر، وقد ثبت أيضًا أنهما ينشطان المسار الوسطي الطرفي وأجزاء أخرى من نظام المكافآت.[33] بناءً على هذا الدليل، يتم تصنيف إدمان القمار وإدمان ألعاب الڤيديو وإدمان التسوق وفقًا لذلك.[33][40]
عوامل الخطر
هناك عدد من عوامل الخطر الجينية والبيئية لتطوير الإدمان، والتي تختلف باختلاف السكان.[3][41] عوامل الخطر الجينية والبيئية تمثل كل منها ما يقرب من نصف خطر إصابة الفرد بالإدمان;[3][41] مساهمة عوامل الخطر اللاجينية في إجمالي المخاطر غير معروفة، حتى في الأفراد الذين لديهم مخاطر وراثية منخفضة نسبيًا، فإن التعرض لجرعات عالية بما فيه الكفاية من عقار مسبب للإدمان لفترة طويلة من الزمن (على سبيل المثال، أسابيع - أشهر) يمكن أن يؤدي إلى الإدمان.[3]
العوامل الوراثية
تم تحديد العوامل الوراثية، إلى جانب العوامل البيئية (مثل العوامل النفسية والاجتماعية)، كمساهمين مهمين في قابلية الإدمان.[3][41] تقدر الدراسات الوبائية أن العوامل الوراثية مسؤولة عن 40-60٪ من عوامل الخطر للإدمان على الكحول.[42] أشارت دراسات أخرى إلى معدلات وراثية مماثلة لأنواع أخرى من إدمان المخدرات، وتحديداً في الجينات التي تشفر مستقبلات ألفا 5 نيكوتينيك أسيتيل كولين.[43] افترض Knestler في عام 1964 أن الجين أو مجموعة الجينات قد تساهم في التأهب للإدمان بعدة طرق. على سبيل المثال، قد تغير المستويات المتغيرة من البروتين الطبيعي بسبب العوامل البيئية بنية أو عمل الخلايا العصبية في الدماغ أثناء التطور. يمكن أن تؤثر هذه الخلايا العصبية المتغيرة في الدماغ على قابلية الفرد لتجربة تعاطي المخدرات الأولية. لدعم هذه الفرضية، أظهرت الدراسات على الحيوانات أن العوامل البيئية مثل الإجهاد يمكن أن تؤثر على التعبير الجيني للحيوان.[43]
في البشر، قدمت دراسات التوائم حول الإدمان بعضًا من أعلى الأدلة جودة على هذا الارتباط، ووجدت النتائج أنه إذا تأثر أحد التوأمين بالإدمان، من المحتمل أن يكون التوأم الآخر كذلك، وغالبًا ما يكون لنفس المادة.[44] دليل آخر على المكون الجيني هو نتائج البحث من دراسات الأسرة التي تشير إلى أنه إذا كان أحد أفراد الأسرة لديه تاريخ من الإدمان، فإن فرص أحد الأقارب أو الأسرة المقربة في تطوير نفس العادات تكون أعلى بكثير من الشخص الذي لم يتم تعرضه للإدمان في في سن مبكر.[45]
ومع ذلك، فإن البيانات التي تضمن جينات معينة في تطوير إدمان المخدرات مختلطة بالنسبة لمعظم الجينات. تركز العديد من دراسات الإدمان التي تهدف إلى تحديد جينات معينة على المتغيرات الشائعة التي يزيد تكرار الأليل فيها عن 5٪ في عموم السكان ؛ ومع ذلك، عند ارتباطها بالمرض، فإنها تمنح فقط قدرًا صغيرًا من المخاطر الإضافية مع نسبة أرجحية تبلغ 1.1 - 1.3٪ ؛ وقد أدى ذلك إلى تطوير فرضية المتغير النادر، والتي تنص على أن الجينات ذات الترددات المنخفضة في السكان (أقل من 1٪) تمنح مخاطر إضافية أكبر بكثير في تطور المرض.[46]
تُستخدم دراسات الارتباط الجينومي الكامل (GWAS) لفحص الارتباطات الجينية مع الاعتماد والإدمان وتعاطي المخدرات ؛ ومع ذلك، نادرًا ما تحدد هذه الدراسات الجينات من البروتينات الموصوفة سابقًا عبر نماذج الضربة القاضية الحيوانية وتحليل الجينات المرشحة. بدلاً من ذلك، يتم تحديد نسب كبيرة من الجينات المشاركة في عمليات مثل التصاق الخلية بشكل شائع. لا يمكن عادةً التقاط التأثيرات المهمة للأنماط الداخلية للظهور بهذه الطرق. قد تشارك الجينات التي تم تحديدها في GWAS لإدمان المخدرات إما في تعديل سلوك الدماغ قبل تجارب المخدرات، أو بعد ذلك، أو كليهما.[47]
العوامل البيئية
عوامل الخطر البيئية للإدمان هي تجارب الفرد خلال حياته التي تتفاعل مع التركيب الجيني للفرد لزيادة أو تقليل تعرضه للإدمان.[3] على سبيل المثال، بعد اندلاع COVID-19 على الصعيد الوطني، أقلع المزيد من الناس عن التدخين (مقابل بدأوا) ؛ كما أن المدخنين، في المتوسط، قللوا من كمية السجائر التي يستهلكونها.[48] بشكل عام، تضمنت عدد من العوامل البيئية المختلفة كعوامل خطر للإدمان، بما في ذلك الضغوطات النفسية والاجتماعية المختلفة. يشير المعهد الوطني لتعاطي المخدرات (NIDA) إلى الافتقار إلى الإشراف الأبوي، وانتشار تعاطي المخدرات من قبل الأقران، وتوافر المخدرات، والفقر كعوامل خطر لتعاطي المخدرات بين الأطفال والمراهقين.[49] يفترض نموذج أمراض الدماغ المتعلقة بالإدمان أن تعرض الفرد لعقار يسبب الإدمان هو أهم عامل خطر بيئي للإدمان.[50] ومع ذلك، يشير العديد من الباحثين، بما في ذلك علماء الأعصاب، إلى أن نموذج أمراض الدماغ يقدم تفسيرًا مضللًا وغير مكتمل وربما يكون ضارًا للإدمان.[51]
تجارب الطفولة الضارة (ACEs) هي أشكال مختلفة من سوء المعاملة والخلل الوظيفي المنزلي الذي يعاني منه الطفولة. أظهرت دراسة تجارب الطفولة الضارة التي أجرتها مراكز السيطرة على الأمراض والوقاية منها وجود علاقة قوية بين الجرعات والاستجابة بين تجارب الطفولة الضارة والعديد من المشكلات الصحية والاجتماعية والسلوكية طوال عمر الشخص، بما في ذلك تعاطي المخدرات.[52] يمكن أن يتعطل النمو العصبي للأطفال بشكل دائم عندما يتعرضون بشكل مزمن لأحداث مرهقة مثل الاعتداء الجسدي أو العاطفي أو الجنسي، أو الإهمال الجسدي أو العاطفي، أو مشاهدة العنف في المنزل، أو سجن أحد الوالدين أو معاناته من مرض عقلي. نتيجة لذلك، قد تتأثر الوظائف المعرفية للطفل أو قدرته على التعامل مع المشاعر السلبية أو المضطربة. بمرور الوقت، قد يتبنى الطفل تعاطي المخدرات كآلية للتكيف، خاصة خلال فترة المراهقة.[52]وجدت دراسة أجريت على 900 قضية قضائية تتعلق بأطفال تعرضوا للإيذاء أن عددًا كبيرًا منهم يعانون من شكل من أشكال الإدمان في فترة المراهقة أو البالغين.[53] يمكن تجنب هذا المسار نحو الإدمان الذي يتم فتحه من خلال التجارب المجهدة أثناء الطفولة من خلال تغيير العوامل البيئية طوال حياة الفرد وفرص المساعدة المهنية.[53] إذا كان لدى المرء أصدقاء أو أقران يتعاطون المخدرات بشكل إيجابي، تزداد فرص إدمانهم. الصراع الأسري وإدارة المنزل هو أيضًا سبب للانخراط في تعاطي الكحول أو تعاطي المخدرات الأخرى.[54]
العمر
تمثل المراهقة فترة قابلية فريدة لتطوير الإدمان.[55] في مرحلة المراهقة، تنضج أنظمة المكافآت التحفيزية في الدماغ جيدًا قبل مركز التحكم المعرفي. وهذا بالتالي يمنح أنظمة المكافآت التحفيزية قدرًا غير متناسب من القوة في عملية صنع القرار السلوكي. لذلك، من المرجح بشكل متزايد أن يتصرف المراهقون بناءً على دوافعهم والانخراط في سلوك محفوف بالمخاطر، يحتمل أن يؤدي إلى الإدمان قبل التفكير في العواقب.[56] ليس المراهقون فقط أكثر عرضة لبدء استخدام المخدرات والحفاظ عليه، ولكن بمجرد إدمانهم يصبحون أكثر مقاومة للعلاج وأكثر عرضة للانتكاس.[57][58]
أظهرت الإحصاءات أن أولئك الذين بدأوا في شرب الكحول في سن أصغر هم أكثر عرضة للاعتماد عليه فيما بعد. حوالي 33٪ من السكان[أين؟] أظهرت الإحصاءات أن أولئك الذين بدأوا في شرب الكحول في سن أصغر هم أكثر عرضة للاعتماد عليه فيما بعد. حوالي 33٪ من السكان تذوقوا أول مشروب كحولي لهم بين سن 15 و 17 سنة، بينما 18٪ جربوه قبل ذلك. أما بالنسبة لتعاطي الكحوليات أو الاعتماد عليها، فإن الأعداد تبدأ مرتفعة مع من شربوا قبل بلوغهم سن الثانية عشرة ثم ينخفضون بعد ذلك. على سبيل المثال، بدأ 16٪ من مدمني الكحول الشرب قبل بلوغ سن 12 عامًا، بينما 9٪ فقط شربوا الكحول لأول مرة بين 15 و 17 عامًا. هذه النسبة أقل من ذلك، حيث تصل إلى 2.6٪، لأولئك الذين بدأوا هذه العادة لأول مرة بعد سن 21 عامًا[59]
يتعرض معظم الأفراد للعقاقير المسببة للإدمان ويستخدمونها لأول مرة خلال سنوات المراهقة.[60] في الولايات المتحدة، كان هناك ما يزيد قليلاً عن 2.8 مليون متعاط جديد للعقاقير الغير مشروعة في عام 2013 (حوالي 7800 مستخدم جديد يوميًا) [60]من بينهم 54.1٪ كانوا تحت سن 18 سنة.[60] في عام 2011، كان هناك ما يقرب من 20.6 مليون شخص في الولايات المتحدة فوق سن 12 يعانون من الإدمان.[61] أكثر من 90٪ من المدمنين بدأوا في الشرب أو التدخين أو تعاطي العقاقير الغير مشروعة قبل سن 18 عامًا.[61]
الاضطرابات المرضية
الأفراد الذين يعانون من اضطرابات الصحة العقلية المرضية (أي التي تحدث بشكل متزامن) مثل الاكتئاب والقلق واضطراب قصور الانتباه مع فرط الحركة (ADHD) أو اضطراب ما بعد الصدمة هم أكثر عرضة للإصابة باضطرابات تعاطي المخدرات.[62][63][64] تستشهد NIDA بالسلوك العدواني المبكر كعامل خطر لتعاطي المخدرات.[49] وجدت دراسة أجراها المكتب الوطني للبحوث الاقتصادية أن هناك "علاقة مؤكدة بين المرض العقلي واستخدام المواد المسببة للإدمان" وأن غالبية مرضى الصحة العقلية يشاركون في استخدام هذه المواد: 38٪ كحول، 44٪ كوكايين، و 40٪ سجائر.[65]
علم التخلق
الوراثة التخلقية الجينية عبر الأجيال
تعد الجينات التخلقية ومنتجاتها (مثل البروتينات) هي المكونات الرئيسية التي يمكن للتأثيرات البيئية من خلالها أن تؤثر على جينات الفرد;[41] كما أنها تعمل كآلية مسؤولة عن الوراثة المتعلقة بالتخلق عبر الأجيال، وهي ظاهرة يمكن أن تؤثر فيها التأثيرات البيئية على جينات أحد الوالدين على السمات المرتبطة والأنماط الظاهرية السلوكية لنسلهم (على سبيل المثال، الاستجابات السلوكية للمنبهات البيئية).[41] في الإدمان، تلعب الآليات التخلقية دورًا مركزيًا في الفيزيولوجيا المرضية للمرض;[3] في الإدمان، تلعب الآليات التخلقية دورًا مركزيًا في الفيزيولوجيا المرضية للمرض ؛ لقد لوحظ أن بعض التغييرات التي تطرأ على مافوق الجينوم والتي تنشأ من خلال التعرض المزمن لمحفزات إدمانية أثناء الإدمان يمكن أن تنتقل عبر الأجيال، مما يؤثر بدوره على سلوك الأطفال (على سبيل المثال، استجابات الطفل السلوكية للعقاقير المسببة للإدمان والمكافآت الطبيعية )).[41][66]
تشمل الفئات العامة للتغييرات التخلقية التي تورطت في الوراثة المتعلقة بالتخلقية عبر الأجيال مثيلة الحمض النووي، وتعديلات هيستون، والتنظيم بالنقصان أو بالزيادة لرنا الميكروي.[41]فيما يتعلق بالإدمان، هناك حاجة إلى مزيد من البحث لتحديد التغييرات الوراثية المتعلقة بالتخلقية المحددة التي تنشأ من أشكال مختلفة من الإدمان لدى البشر والأنماط الظاهرية السلوكية المقابلة من هذه التعديلات التخلقية التي تحدث في سلالة الإنسان.[41][66] استنادًا إلى الأدلة قبل السريرية من الأبحاث على الحيوانات، يمكن أن تنتقل بعض التغيرات التخلقية التي يسببها الإدمان في الفئران من الوالدين إلى النسل وتنتج أنماطًا سلوكية تقلل من مخاطر النسل في تطوير الإدمان.[note 1][41] بشكل عام، قد تعمل الأنماط الظاهرية السلوكية الموروثة المشتقة من التغيرات التخلقية التي يسببها الإدمان والتي تنتقل من الأب إلى الأبناء إما على زيادة أو تقليل مخاطر إصابة النسل بالإدمان.[41][66]
الميول لسوء الاستخدام
الميول لإساءة الاستخدام، والتي تُعرف أيضًا باسم قابلية الإدمان، هي الميل إلى تعاطي المخدرات في حالة غير طبية. هذا عادة بسبب النشوة أو تغير المزاج أو التخدير.[67] يتم استخدام الميول لإساءة الاستخدام عندما يريد الشخص الذي يستخدم المخدرات شيئًا لا يمكنه الحصول عليه بخلاف ذلك. الطريقة الوحيدة للحصول على ذلك هي من خلال استخدام العقاقير. عند النظر في الميول لإساءة الاستخدام، هناك عدد من العوامل المحددة فيما إذا كان قد تم إساءة استخدام الدواء. هذه العوامل هي: التركيب الكيميائي للدواء، وتأثيراته على الدماغ، والعمر، وسرعة التأثر، والصحة (العقلية والبدنية) للسكان محل الدراسة.[67] هناك عدد قليل من الأدوية ذات التركيبة الكيميائية المحددة التي تؤدي إلى ميول كبير لإساءة الاستخدام. هذه هي: الكوكايين، الهيروين، المستنشقات، الماريجوانا، MDMA (الإكستاسي)، الميثامفيتامين، الفينول الخماسي الكلور، القنب الصناعي، الكاثينونات الاصطناعية (أملاح الاستحمام)، التبغ، والكحول.[68]
الآليات
نموذج مرض الدماغ
يصور نموذج مرض الدماغ الإدمان على أنه اضطراب في نظام المكافأة في الدماغ يتطور من خلال آليات النسخ و التخلق كنتيجة لمستويات عالية بشكل مزمن من التعرض لمحفز الإدمان (على سبيل المثال، تناول الطعام، واستخدام الكوكايين، والمشاركة في النشاط الجنسي، والمشاركة في الأنشطة الثقافية عالية التشويق مثل المقامرة وما إلى ذلك) على مدى فترة زمنية طويلة.[3][69][33] دلتاΔFosB) FosB،) عامل نسخ الجينات، هو عنصر حاسم وعامل مشترك في تطوير جميع أشكال الإدمان السلوكي والمخدرات.[69][33][70][34] أظهر عقدين من البحث في دور ΔFosB في الإدمان أن الإدمان ينشأ، ويكثف السلوك القهري المرتبط به أو يخفف، جنبًا إلى جنب مع الإفراط في التعبير عن ΔFosB في الخلايا العصبية الشوكية المتوسطة من النوع D1 للنواة المتكئة.[3][69][33][70] نظرًا للعلاقة السببية بين تعبير ΔFosB والإدمان، يتم استخدامه قبل السريري كعلامة حيوية للإدمان.[3][69][70] ينظم تعبير ΔFosB في هذه الخلايا العصبية بشكل مباشر وإيجابي الإعطاء الذاتي للعقار وتحسس المكافاْة من خلال التعزيز الإيجابي، مع تقليل الحساسية للنفور.[note 2][3][69]
| معجم عوامل النسخ |
|---|
| • النسخ – نسخ الدنا الذي يقوم به پوليمريز الرنا إلى مرسال الرنا |
| • عامل – مادة، مثل الپروتين، تساهم في سبب تفاعل كيميائي حيوي معين أو عملية جسدية |
| • تنظيم النسخ – التحكمفي معدل نسخ الجينات على سبيل المثال من خلال مساعدة أو إعاقة ربط پوليمريز الرنا بالدنا |
| • تحسين التنظيم، التنشيط، أو التعزيز – يزيد معدل نسخ الجين |
| • تقليل التنظيم، القمع، أو التثبيط – يقلل معدل نسخ الجين |
| • المنشط المرافق – بروتين يعمل مع عوامل النسخ لزيادة معدل نسخ الجين |
| • تميم الكاظمة – بروتين يعمل مع عوامل النسخ لتخفيض معدل نسخ الجينات |
| عدِّل |
يتسبب تعاطي المخدرات المسببة للإدمان المزمن في حدوث تغييرات في التعبير الجيني في إسقاط القشرة الحوفية المتوسطة.[34][78][79] أهم عوامل النسخ التي تنتج هذه التعديلات هي ΔFosB، وبروتين ربط عنصر استجابة أحادي فوسفات الأدينوسين الحلقي (CREB )،والعامل النووي كابا ب(NF-κB).[34]تعتبر ΔFosB هي الآلية الجزيئية الحيوية الأكثر أهمية في الإدمان لأن الإفراط في التعبير عن ΔFosB في الخلايا العصبية الشوكية المتوسطة من النوع D1 في النواة المتكئة ضروري وكافي للعديد من التكيفات العصبية والتأثيرات السلوكية (على سبيل المثال، تزداد التعبيرات المعتمدة في الاعطاء الذاتي للعقار و تحسس المكافأة) يُلاحظ في إدمان المخدرات.[34] تعبير ΔFosB في النواة المتكئة للخلايا العصبية المتوسطة من النوع D1 ينظم بشكل مباشر وإيجابي الإعطاء الذاتي للعقار وتحسس المكافأة من خلال التعزيز الإيجابي مع تقليل الحساسية للنفور.[note 2][3][69] ΔFosB مشترك في التوسط في الإدمان للعديد من العقاقير وأصناف العقاقير المختلفة، بما في ذلك الكحول والأمفيتامين والأمفيتامينات البديلة الأخرى، القنب، الكوكايين، الميثيل فينيدات، النيكوتين، المواد الأفيونية، فينيلسيكلدين، والبروبوفول، من بين أمور أخرى.[69][34][78][80][81] ΔJunD، عامل النسخ، و G9a، هيستون ميثيل ترانسفيراز، كلاهما يعارضان وظيفة ΔFosB ويمنعان الزيادات في تعبيره.[3][34][82] الزيادات في تعبير Δ JunD في النواة المتكئة (عن طريق نقل الجينات بوساطة ناقلات فيروسية ) أو تعبير G9a (عبر الوسائل الدوائية) يقلل، أو مع زيادة كبيرة يمكن حتى أن يمنع، العديد من التغيرات العصبية والسلوكية التي تنتج عن الاستخدام المزمن للجرعات العالية العقاقير المسببة للإدمان (أي التغييرات بوساطة ΔFosB).[70][34]
يلعب ΔFosB أيضًا دورًا مهمًا في تنظيم الاستجابات السلوكية للمكافآت الطبيعية، مثل الطعام اللذيذ والجنس والتمارين الرياضية.[34][83] تحفز المكافآت الطبيعية، مثل تعاطي المخدرات، التعبير الجيني عن ΔFosB في النواة المتكئة، ويمكن أن يؤدي الاستحواذ المزمن لهذه المكافآت إلى حالة إدمان مرضية مماثلة من خلال التعبير المفرط عن ΔFosB.[33][34][83] وبالتالي، فإن ΔFosB هو عامل النسخ الرئيسي المتضمن في الإدمان على المكافآت الطبيعية (أي الإدمان السلوكي) أيضًا;[34][33][83] علي وجه الخصوص، ΔFosB في النواة المتكئة أمر بالغ الأهمية لتعزيز تأثيرات المكافأة الجنسية.[83] تشير الأبحاث حول التفاعل بين المكافآت الطبيعية والمكافآت الدوائية إلى أن المنشطات النفسية الدوبامينية (مثل الأمفيتامين ) والسلوك الجنسي تعمل على آليات جزيئية حيوية مماثلة لتحفيز ΔFosB في النواة المتكئة وتمتلك تأثيرات تحسس ثنائية الاتجاه يتم التوسط فيها من خلال ΔFosB.[33][36][37] هذه الظاهرة جديرة بالملاحظة، حيث لوحظ في البشر متلازمة خلل تنظيم الدوبامين، والتي تتميز بالمشاركة القهرية التي يسببها الدواء في المكافآت الطبيعية (على وجه التحديد، النشاط الجنسي والتسوق والقمار)، وقد لوحظ أيضًا في بعض الأفراد الذين يتناولون أدوية الدوبامين.[33]
قد تكون مثبطاتΔFOSB (الأدوية أو العلاجات التي تعارض عملها) علاجًا فعالًا للإدمان واضطرابات الإدمان.[84]
يلعب إطلاق الدوپامين في النواة المتكئة دورًا في تعزيز الصفات للعديد من أشكال المنبهات، بما في ذلك المنبهات المعززة بشكل طبيعي مثل الطعام اللذيذ والجنس.[85][86] كثيرا ما لوحظ تغير انتقال الدوبامين العصبي بعد تطور حالة إدمان.[33] في البشر وحيوانات المختبر التي أظهرت إدمانًا، تظهر التغيرات في الدوبامين أو النقل العصبي الأفيوني في النواة المتكئة وأجزاء أخرى من الجسم المخطط.[33] لقد وجدت الدراسات أن استخدام بعض الأدوية (مثل الكوكايين ) يؤثر على الخلايا العصبية الكولينية التي تعصب نظام المكافأة، مما يؤثر بدوره على إشارات الدوبامين في هذه المنطقة.[87]
نظام المكافأة
This section requires expansion. (August 2015) |
المسار الوسطي الطرفي
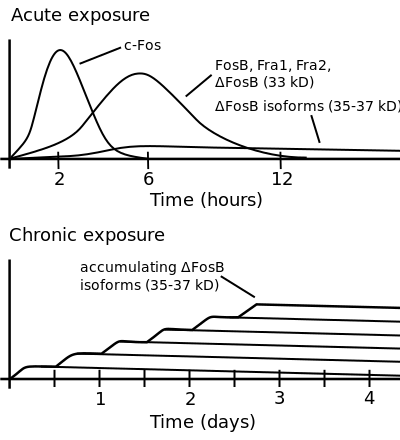
تراكم ΔFosB من سوء استخدام العقاقير المفرط
أعلى: يوضح هذا التأثيرات الأولية للتعرض بجرعات عالية من عقار مسبب للإدمان على التعبير الجيني في النواة المتكئة لعائلة بروتينات Fos المختلفة (i.e., c-Fos, FosB, ΔFosB, Fra1, و Fra2).
أسفل: يوضح هذا الزيادة التدريجية في تعبير FosB في النواة المتكئة بعد نوبات تعاطي المخدرات المتكررة مرتين يوميًا , حيث تستمر هذة الفسفرة (35–37 كيلو دالتون) ΔFosB اشكال أيسوية في نوع D1-type الخلايا العصبية الشوكية المتوسطة للنواة المتكئة لمدة تصل إلى شهرين.[76][88] |
يعد فهم المسارات التي تعمل بها المخدرات وكيف يمكن للعقاقير أن تغير هذه المسارات أمرًا أساسيًا عند فحص الأساس البيولوجي لإدمان المخدرات. يتميز مسار المكافأة، المعروف باسم المسار الوسطي الطرفي، أو امتداده، مسار القشرة الوسطية الطرفية، بالتفاعل بين عدة مناطق من الدماغ.
- الإسقاطات من المنطقة السقيفية البطنية (VTA) هي شبكة من الخلايا العصبية الدوپامينية مع مستقبلات الگلوتامات بعد المشبكي المشتركة (AMPAR و NMDAR). تستجيب هذه الخلايا عند وجود محفزات من المكافأة موجودة. المنطقة السقيفية البطنية تدعم تطوير التعلم والتحسيس وتطلق الدوپامين في الدماغ الأمامي.[89] تقوم هذه الخلايا العصبية أيضًا بإسقاط وإطلاق الدوپامين في النواة المتكئة،[90] من خلال المسار الوسطي الطرفي. تعمل جميع الأدوية التي تسبب إدمان المخدرات تقريبًا على زيادة إفراز الدوپامين في المسار الوسطي الطرفي،[91]بالإضافة إلى تأثيراتها المحددة.
- النواة المتكئة (NAcc) هي أحد مخرجات اسقاطات المنطقة السقيفية البطنية. تتكون النواة المتكئة نفسها بشكل أساسي من الخلايا العصبية الشوكية المتوسطة الگابايرجيك (MSNs).[92] ترتبط النواة المتكئة باكتساب واستنباط السلوكيات المشروطة، وتشارك في زيادة الحساسية للمخدرات مع تقدم الإدمان.[89] يعتبر الإفراط في التعبير عن ΔFosB في النواة المتكئة عاملاً مشتركًا ضروريًا في جميع أشكال الإدمان المعروفة;[3] ΔFosB هو معدل إيجابي قوي للسلوكيات المعززة بشكل إيجابي.[3]
- قشرة الفص الجبهي، بما في ذلك القشرة الحزامية الأمامية والقشرة الحجاجية الجبهية،[93] هما ناتج المنطقة السقيفية البطنية آخر في مسار القشرة الوسطية الطرفية. هو مهم لتكامل المعلومات التي تساعد على تحديد ما إذا كان سيتم استنباط السلوك.[94] كما أنه ضروري لتكوين روابط بين تجربة المكافأة لتعاطي المخدرات والإلماعات في البيئة. الأهم من ذلك، أن هذه الإلماعات هي وسطاء أقوياء لسلوك البحث عن المخدرات ويمكن أن تؤدي إلى الانتكاس حتى بعد شهور أو سنوات من التوقف.[95]
تشمل هياكل الدماغ الأخرى التي تشارك في الإدمان ما يلي:
- اللوزة الجانبية القاعدية تسقط في النواة المتكئة ويعتقد أنها مهمة أيضًا للتحفيز.[94]
- يتدخل الحصين في إدمان المخدرات، لما له من دور في التعلم والذاكرة. تنبع الكثير من هذه الأدلة من التقصي التي أظهرت أن التلاعب بالخلايا في الحُصين يغير مستويات الدوپامين في النواة المتكئة ومعدلات إطلاق خلايا الدوبامين القشرة الوسطية الطرفية.[90]
دور الدوپامين والگلوتامات
الدوپامين هو الناقل العصبي الأساسي لنظام المكافأة في الدماغ. يلعب دورًا في تنظيم الحركة والعاطفة والإدراك والتحفيز ومشاعر المتعة.[96] تتسبب المكافآت الطبيعية، مثل الأكل، وكذلك تعاطي العقاقير الترويحي في إفراز الدوپامين، وترتبط بالطبيعة المعززة لهذه المنبهات.[96][97] تعمل جميع العقاقير المسببة للإدمان تقريبًا، بشكل مباشر أو غير مباشر، على نظام المكافأة في الدماغ عن طريق زيادة نشاط الدوپامين.[98]
يؤدي الإفراط في تناول العديد من أنواع العقاقير المسببة للإدمان إلى إطلاق متكرر لكميات كبيرة من الدوپامين، والذي بدوره يؤثر على مسار المكافأة مباشرة من خلال تنشيط مستقبلات الدوپامين. يمكن أن تؤدي المستويات الطويلة والمرتفعة بشكل غير طبيعي من الدوپامين في الشق المشبكي إلى تقليل تنظيم المستقبلات في المسار العصبي. يمكن أن يؤدي تقليل تنظيم مستقبلات الدوپامين الوسطية الطرفية إلى انخفاض في الحساسية تجاه المعززات الطبيعية.[96]
سلوك البحث عن العقاقير ناتج عن الإسقاطات الگلوتاماتية من قشرة الفص قبل الجبهي إلى النواة المتكئة. يتم دعم هذه الفكرة ببيانات من التجارب التي تُظهر أنه يمكن منع سلوك البحث عن العقاقير بعد تثبيط مستقبلات الگلوتامات AMPA وإطلاق الگلوتامات في النواة المتكئة.[93]
تحسس المكافأة
| الجين المستهدف | التعبير الجيني المستهدف | التأثير العصبي | التأثير السلوكي |
|---|---|---|---|
| c-Fos | ↓ | التبديل الجزيئي يمكن حث ΔFosB المزمن[note 3] | – |
| دينورفين | ↓ [note 4] |
• تقليل تنظيم حلقة التغذية الراجعة لمستقبلات لمواد الأفيونية | • زيادة مكافأة الدواء |
| NF-κB | ↑ | • التسوع في الزوائد التغصنية للنواة المتكئة • NF-κB الاستجابة الالتهابية في النواة المتكئة • NF-κB الاستجابة الالتهابية في البطامة المذنبة |
• زيادة مكافأة الدواء • زيادة مكافأة الدواء • التحسس الحركي |
| GluR2 | ↑ | • انخفاض تحسس للگلوتامات | • زيادة مكافأة الدواء |
| Cdk5 | ↑ | • فسفرة البروتين التشابك GluR1 • التسوع في الزوائد التغصنية للنواة المتكئة |
انخفاض مكافأة الدواء (التأثير الكلي) |
تحسس المكافأة هي عملية تؤدي إلى زيادة مقدار المكافأة (على وجه التحديد، بروز الحافز[note 5]) التي يخصصها الدماغ لمنبه تكافئي (على سبيل المثال، دواء). بعبارات بسيطة، عندما يحدث تحسس المكافأة لمنبه معين (على سبيل المثال، دواء)، تزداد "رغبة" الفرد أو رغبته في التحفيز نفسه والإلماعات المرتبطة به.[101][100][102] عادةً ما يحدث التحسس بشأن المكافأة بعد مستويات عالية مزمنة من التعرض للمنبهات. لقد ثبت أن تعبير ΔFosB (دلتاFosB) في الخلايا العصبية الشوكية المتوسطة من النوع D1 في النواة المتكئة ينظم بشكل مباشر وإيجابي تحسس المكافأة الذي يشمل الأدوية والمكافآت الطبيعية.[3][69][70]
"الإلماع الناتج عن الانتظار" أو "الإلماع المستحثة بالإشارة"، وهي شكل من أشكال الرغبة التي تحدث في الإدمان، هي المسؤولة عن معظم السلوك القهري الذي يظهره الأشخاص المصابون بالإدمان.[100][102] أثناء تطور الإدمان، يؤدي الارتباط المتكرر للمنبهات المحايدة وغير المكافأة مع استهلاك المخدرات إلى عملية تعلم ترابطية تجعل هذه المحفزات المحايدة سابقًا تعمل كمعززات إيجابية مشروطة لتعاطي المخدرات (أي، تبدأ هذه المحفزات في تعمل كإلمعات للمخدرات).[100][103][102] بصفتها معززات إيجابية مشروطة لتعاطي المخدرات، يتم تعيين هذه المحفزات المحايدة سابقًا كدافع مهم (والذي يتجلى في الرغبة الشديدة) - في بعض الأحيان عند مستويات عالية مرضيًا بسبب حساسية المكافأة - التي يمكن أن تنتقل إلى المعزز الأساسي (على سبيل المثال، استخدام عقار مسبب للإدمان) الذي تم إقرانه به في الأصل.[100][103][102]
تشير الأبحاث حول التفاعل بين المكافآت الطبيعية والمكافآت الدوائية إلى أن المنشطات النفسية للدوپامين (مثل الأمفيتامين ) والسلوك الجنسي يعملوا على آليات جزيئية حيوية مماثلة لتحفيز ΔFosB في النواة المتكئة وتمتلك تأثير تحسس متبادل للمكافأة[note 6] يتم التوسط من خلاله ΔFosB.[33][36][37] على النقيض من تأثير تحسس المكافأة الخاص بـ ΔFosB، فإن نشاط النسخ CREB (بروتين رابط عنصر الاستجابة أدينوزين احادي الفوسفات الحلقي) يقلل من حساسية المستخدم لتأثيرات المكافأة للمادة. يتورط نسخ الروتين CREB في النواة المتكئة في الاعتماد النفسي والأعراض التي تنطوي على قلة المتعة أو الدافع أثناء التوقف عن تعاطي المخدرات.[3][88][99]
إن مجموعة البروتينات المعروفة باسم " منظمات إطلاق اشارات البروتين G " (RGS)، وخاصة RGS4 و RGS9-2، قد شاركت في تعديل بعض أشكال التحسس الأفيوني، بما في ذلك تحسس المكافأة.[104]
| شكل اللدونة العصبية أو اللدونة السلوكية |
نوع المُعزز | المصادر | |||||
|---|---|---|---|---|---|---|---|
| الأفيونيات | المنبهات النفسية | الأغذية الغنية بالدهون أو السكريات | الجماع الجنسي | التمرينات الرياضية (الهوائية) |
التعزيز البيئي | ||
| تعبير ΔFosB في النويات المكتئة D1-type MSNs |
↑ | ↑ | ↑ | ↑ | ↑ | ↑ | [33] |
| اللدونة السلوكية | |||||||
| زيادة الجرعة | نعم | نعم | نعم | [33] | |||
| الوعي-المتبادل للمنبه النفسي |
نعم | غير قابل للتطبيق | نعم | نعم | ضعيفة | ضعيفة | [33] |
| المنبه النفسي الإدارة الذاتية |
↑ | ↑ | ↓ | ↓ | ↓ | [33] | |
| المنبه النفسي التفضيل المكاني المشروط |
↑ | ↑ | ↓ | ↑ | ↓ | ↑ | [33] |
| إعادة سلوك البحث عن المخدرات | ↑ | ↑ | ↓ | ↓ | [33] | ||
| اللدونة الكيميائية-العصبية | |||||||
| فسفرة CREB في النوية المتكئة |
↓ | ↓ | ↓ | ↓ | ↓ | [33] | |
| استجابة الدوپامين في النوية المتكئة |
لا | نعم | لا | نعم | [33] | ||
| تاشير الدوپامين في الجسم المخطط | ↓DRD2, ↑DRD3 | ↑DRD1, ↓DRD2, ↑DRD3 | ↑DRD1, ↓DRD2, ↑DRD3 | ↑DRD2 | ↑DRD2 | [33] | |
| التأشير الشبه أفيوني الداخلي المتغير | لا يوجد تغير أو ↑μ-مستقبلات أفيونية |
↑μ ↑κ-مستقبلات أفيونية |
↑μ-مستقبلات أفيونية | ↑μ-مستقبلات أفيونية | لا يوجد تغير | لا يوجد تغير | [33] |
| تغيرات في الپپتيدات الشبه أفيونية في الجسم المخطط | ↑دينورفين لا يوجد تغير: إنكفالين |
↑دينورفين | ↓إنكفالين | ↑دينورفين | ↑دينورفين | [33] | |
| اللدونة التشابكية للمسار الوسطي الطرفي | |||||||
| عددالزوائد الشجرية في النوية المتكئة | ↓ | ↑ | ↑ | [33] | |||
| كثافة الشوكة التغصنية في النوية المتكئة |
↓ | ↑ | ↑ | [33] | |||
آليات التخلق العصبي
يلعب التنظيم التخلقي المتغير للتعبير الجيني داخل نظام المكافأة في الدماغ دورًا مهمًا ومعقدًا في تطوير إدمان المخدرات.[82][105] ترتبط العقاقير المسببة للإدمان بثلاثة أنواع من التعديلات التخلقية داخل الخلايا العصبية.[82] هما (1) تعديلات الهيستون، (2) المثيلة التخلقية للحمض النووي في مواقع ثنائي النوكليوتيد CpG عند (أو مجاورة) لجينات معينة، و (3) نقص التنظيم أو زيادة التنظيم التخلقي للـحمض نووي ريبوزي ميكروي الذي له جينات مستهدفة معينة.[82][34][105] على سبيل المثال، في حين أن مئات الجينات في خلايا النواة المتكئة (NAc) تظهر تعديلات على الهيستون بعد التعرض للعقار - لا سيما حالات الأستلة المتغيرة وحالات المثيلة لبقايا الهيستون[105] – فإن معظم الجينات الأخرى في الخلايا المتكئة لا تظهر مثل هذا التغييرات.[82]
التشخيص
يستخدم الإصدار الخامس من الدليل التشخيصي والإحصائي للاضطرابات النفسية (DSM-5) مصطلح " اضطراب تعاطي المخدرات (العقاقير)" للإشارة إلى مجموعة من الاضطرابات المرتبطة بتعاطي المخدرات. يزيل الدليل التشخيصي والإحصائي للاضطرابات النفسية (DSM-5) مصطلحات " سوء الاستخدام " و "الاعتماد" من فئات التشخيص، بدلاً من استخدام محددات معتدلة ومتوسطة وشديدة للإشارة إلى مدى الاستخدام المضطرب. يتم تحديد هذه المحددات من خلال عدد معايير التشخيص الموجودة في حالة معينة. في الدليل التشخيصي والإحصائي للاضطرابات النفسية DSM-5، يعتبر مصطلح إدمان المخدرات مرادفًا لاضطراب تعاطي المخدرات الشديد.[1][2]
قدمت DSM-5 فئة تشخيصية جديدة للإدمان السلوكي ؛ ومع ذلك، فإن إدمان القمار هي الحالة الوحيدة المتضمنة في هذه الفئة في الإصدار الخامس.[19] تم إدراج اضطراب الألعاب عبر الإنترنت على أنه "حالة تتطلب مزيدًا من الدراسة" في الدليل التشخيصي والإحصائي للاضطرابات النفسية (DSM-5).[106]
استخدمت الإصدارات السابقة الاعتماد الجسدي ومتلازمة الانسحاب المصاحبة لتحديد حالة الإدمان. يحدث الاعتماد الجسدي عندما يتكيف الجسم عن طريق دمج المادة في وظيفتها "الطبيعية" - أي تصل إلى الاستتباب - وبالتالي تحدث أعراض الانسحاب الجسدي عند التوقف عن الاستخدام.[107] التحمل هو العملية التي من خلالها يتكيف الجسم باستمرار مع المادة ويتطلب كميات أكبر بشكل متزايد لتحقيق التأثيرات الأصلية. يشير الانسحاب إلى الأعراض الجسدية والنفسية التي تحدث عند تقليل أو التوقف عن مادة أصبح الجسم يعتمد عليها. تشمل أعراض الانسحاب عمومًا على سبيل المثال لا الحصر آلام الجسم والقلق والتهيجية والرغبة الشديدة في تناول المادة والغثيان والهلوسة والصداع والتعرق البارد والرعشة والاختلاج
انتقد الباحثون الطبيون الذين يدرسون الإدمان بنشاط تصنيف DSM للإدمان لكونه معيبًا ويتضمن معايير تشخيصية تعسفية.[20] في عام 2013، ناقش مدير المعهد الوطني الأمريكي للصحة العقلية والنفسية عدم صلاحية تصنيف DSM-5 للاضطرابات النفسية:[108]
بينما تم وصف الدليل التشخيصي والإحصائي DSM بأنه "كتاب مقدس" للمجال، فإنه في أفضل الأحوال قاموس، يقوم بإنشاء مجموعة من الملصقات وتحديد كل منها. كانت قوة كل إصدار من إصدارات DSM هي "الموثوقية" - فقد ضمنت كل نسخة أن الأطباء يستخدمون المصطلحات نفسها بنفس الطرق. الضعف هو نقص صلاحيتها على عكس تعريفاتنا لأمراض القلب الإقفارية، أو سرطان الغدد الليمفاوية، أو الإيدز، فإن تشخيصات الدليل التشخيصي والإحصائي للاضطرابات النفسية (DSM) تستند إلى إجماع حول مجموعات من الأعراض السريرية، وليس أي إجراء معملي موضوعي. في بقية الطب، سيكون هذا معادلاً لإنشاء أنظمة تشخيص بناءً على طبيعة ألم الصدر أو نوع الحمى.
بالنظر إلى أن الإدمان يتجلى في التغييرات الهيكلية للدماغ، فمن الممكن استخدام فحوصات التصوير العصبي غير الغازية التي تم الحصول عليها عن طريق التصوير بالرنين المغناطيسي للمساعدة في تشخيص الإدمان في المستقبل.[109] كمؤشر بيولوجي تشخيصي، يمكن استخدام تعبير ΔFosB لتشخيص الإدمان لدى البشر، لكن هذا يتطلب خزعة من المخ، وبالتالي لا يتم استخدامه في الممارسة السريرية
العلاج
وفقًا لمراجعة، "من أجل أن تكون فعالة، يجب دمج جميع العلاجات الدوائية أو البيولوجية للإدمان في أشكال أخرى من إعادة التأهيل من الإدمان، مثل العلاج السلوكي المعرفي، والعلاج النفسي الفردي والجماعي، واستراتيجيات تعديل السلوك و برنامج الاثنتي عشرة خطوة والمرافق العلاجية السكنية".[8]
يبرز النهج الاجتماعي الحيوي لعلاج الإدمان المحددات الاجتماعية للمرض والرفاهية ويأخذ في الاعتبار العلاقات الديناميكية والمتبادلة الموجودة لتجربة الفرد والتأثير عليها.[110]
يهدف عمل (AV Schlosser (2018 إلى اعلان التجارب الفردية التي تعيشها النساء اللائي يتلقين العلاج بمساعدة الأدوية (على سبيل المثال، الميثادون، النالتريكسون، البوربرينورفين) في بيئة إعادة التأهيل طويلة الأجل، من خلال تحقيق إثنوغرافي ميداني لمدة عشرين شهرًا. يُظهر هذا البحث الذي يركز على الفرد كيف أن تجارب هؤلاء النساء "تنبثق من أنظمة عدم المساواة المستقرة القائمة على التهميش الجنسي والعرقي والطبقي المتداخل مع عمليات العمل الداخلي".[111]
إن مشاهدة علاج الإدمان من خلال هذه العدسة يسلط الضوء أيضًا على أهمية تأطير المشتركين أجسادهم على أنها "جسد اجتماعي". كما يشير شلوسر (2018)، فإن "اجساد المشتركين" وكذلك "الخبرات المتجسدة للانتماء الذاتي والاجتماعي تظهر في ومن خلال الهياكل والزمان والتوقعات الخاصة بمركز العلاج."[111]
المزيد من التحديات والتوترات المتجسدة لديها القدرة على الظهور كنتيجة للديناميكيات المتأصلة في العلاقة بين المريض ومقدم الخدمة، بالإضافة إلى تجربة "العزلة عن أجسادهم ونفسهم وحياتهم الاجتماعية عند تخديرهم بالأدوية أثناء العلاج"."[111]
تشكل التقنيات الحيوية حاليًا جزءًا كبيرًا من العلاجات المستقبلية للإدمان. على سبيل المثال لا الحصر، تحفيز الدماغ العميق والغرسات الناهضة / المناهضة واللقاحات المقترنة. تتداخل التطعيمات ضد الإدمان على وجه التحديد مع الاعتقاد بأن الذاكرة تلعب دورًا كبيرًا في الآثار الضارة للإدمان والانتكاسات. تم تصميم لقاحات الناشبة المقترنة لمنع المستقبلات الأفيونية في منطقة واحدة، مع السماح للمستقبلات الأخرى بالتصرف بشكل طبيعي. بشكل أساسي، بمجرد عدم إمكانية تحقيق النشوة فيما يتعلق بحدث صادم، يمكن فصل العلاقة بين الأدوية والذاكرة المؤلمة ويمكن أن يلعب العلاج دورًا في العلاج.[112]
العلاج السلوكي
وجدت مراجعة تحليلية تلوية حول فعالية العلاجات السلوكية المختلفة لعلاج الإدمان على المخدرات والسلوك أن العلاج السلوكي المعرفي (على سبيل المثال، منع الانتكاس ومعالجة الطوارئ )، والمقابلات التحفيزية، ونهج التعزيز المجتمعي كانت تدخلات فعالة بأحجام تأثير معتدلة.[113]
تشير الأدلة السريرية وما قبل السريرية إلى أن التمارين الهوائية المتسقة، وخاصة تمارين التحمل (على سبيل المثال، الجري الماراثون )، تمنع بالفعل تطور بعض إدمان المخدرات وهي علاج مساعد فعال لإدمان المخدرات، ولإدمان المنبهات النفسية على وجه الخصوص.[33][114][115][116][117] تمرينات الأيروبيك المتناغمة التي تعتمد على الحجم (أي حسب المدة والشدة) تقلل من خطر إدمان المخدرات، والذي يبدو أنه يحدث من خلال عكس اللدونة العصبية المرتبطة بالإدمان الناجم عن المخدرات.[33][115] وأشارت أحد المراجعات أن التمرينات الرياضية قد تمنع تطور إدمان المخدرات عن طريق تغيير التفاعلية المناعية لكل من ΔFosB أو c-Fos في الجسم المخطط أو أجزاء أخرى من نظام المكافأة.[117] التمارين الرياضية تقلل الاعطاء الذاتي للمخدرات، وتقلل من احتمالات الانتكاس، وتحث علي تأثيرات معاكسة على إشارات مستقبلات الدوبامين D2 في الجسم المخطط (DRD2) (زيادة كثافة DRD2) لتلك التي يسببها الإدمان على العديد من فئات الأدوية (انخفاض كثافة DRD2).[33][115] وبالتالي، قد تؤدي التمارين الهوائية المتناغمة إلى نتائج علاجية أفضل عند استخدامها كعلاج مساعد لإدمان المخدرات.[33][115][116]
أدوية
إدمان الكحول
يمكن للكحول، مثل المواد الأفيونية، أن يسبب حالة شديدة من الاعتماد الجسدي وينتج عنه أعراض انسحاب مثل الهذيان الارتعاشي. لهذا السبب، عادةً ما يتضمن علاج إدمان الكحول نهجًا مشتركًا للتعامل مع الاعتماد والإدمان في وقت واحد. البنزوديازيبينات لديها أكبر وأفضل قاعدة دليل في علاج انسحاب الكحول وتعتبر المعيار الذهبي لإزالة سمية الكحول.[118]
تشمل العلاجات الدوائية لإدمان الكحول عقاقير مثل النالتريكسون (مضادات الأفيون) و ديسلفيرام و أكامبروسيت و توبيراميت.[119][120] بدلاً من استبدال الكحول، تهدف هذه الأدوية إلى التأثير على الرغبة في الشرب، إما عن طريق الحد مباشرة من الرغبة الشديدة كما هو الحال مع أكامبروسيت وتوبيراميت، أو عن طريق إحداث تأثيرات غير سارة عند تناول الكحول، كما هو الحال مع ديسفلفرام. يمكن أن تكون هذه الأدوية فعالة إذا استمر العلاج، ولكن الامتثال يمكن أن يكون مشكلة حيث غالبًا ما ينسى مرضى الكحول تناول أدويتهم أو التوقف عن استخدامها بسبب الآثار الجانبية المفرطة.[121][122] وفقًا لمراجعة مؤسسة كوكرين، فقد ثبت أن مضاد الأفيون النالتريكسون هو علاج فعال لإدمان الكحول، حيث تدوم آثاره من ثلاثة إلى اثني عشر شهرًا بعد نهاية العلاج.[123]
الإدمانات السلوكية
إدمان القنب
اعتبارا من 2010[تحديث]،لا توجد تدخلات دوائية فعالة لإدمان القنب.[124] لاحظت مراجعة 2013 حول إدمان القنب أن تطوير ناهضات مستقبلات CB1 التي قللت من التفاعل مع إشاراتβ-arrestin 2 قد يكون مفيدًا علاجيًا.[125]
إدمان النيكوتين
المجال الآخر الذي تم فيه استخدام العلاج الدوائي على نطاق واسع هو علاج إدمان النيكوتين، والذي يتضمن عادةً استخدام معالجة النيكوتين بالإعاضة، أو مضادات مستقبلات النيكوتين، أو ناهضات جزئية لمستقبل النيكوتين.[126][127] من الأمثلة على الأدوية التي تعمل على مستقبلات النيكوتين والتي تم استخدامها في علاج إدمان النيكوتين مضادات مثل البوبروبيون ومضاد الفارينيكلين الجزئي.[126][127]
إدمان الأفيون
تسبب المواد الأفيونية الاعتماد الجسدي، وعادة ما يعالج العلاج كلا من الاعتماد والإدمان.
يتم علاج الاعتماد الجسدي باستخدام أدوية بديلة مثل سوبوكسون أو سوبوتكس (كلاهما يحتوي على المكونات النشطة البوپرنورفين ) والميثادون.[128][129] على الرغم من أن هذه الأدوية تديم الاعتماد الجسدي، فإن الهدف من استمرار الأفيون هو توفير قدر من السيطرة على كل من الألم والرغبة الشديدة. يزيد استخدام الأدوية البديلة من قدرة الفرد المدمن على العمل بشكل طبيعي ويزيل العواقب السلبية للحصول على المواد الخاضعة للرقابة بشكل غير مشروع. بمجرد استقرار الجرعة الموصوفة، يدخل العلاج في مراحل المداومة أو التناقص التدريجي. في الولايات المتحدة، يتم تنظيم العلاج ببدائل الأفيون بإحكام في عيادات الميثادون وبموجب تشريع DATA 2000. في بعض البلدان، تُستخدم المشتقات الأفيونية الأخرى مثل ثنائي هيدرو كودين،[130] ثنائي هيدرو إيتورفين[131] وحتى الهيروين[132][133] كعقاقير بديلة للمواد الأفيونية غير المشروعة في الشوارع، مع إعطاء وصفات مختلفة اعتمادًا على احتياجات المريض الفردية. أدى استخدام باكلوفين إلى تقليل الرغبة الشديدة في تناول المنشطات والكحول والمواد الأفيونية، كما أنه يخفف أيضًا من متلازمة انسحاب الكحول. صرح العديد من المرضى أنهم "أصبحوا غير مبالين بالكحول" أو "غير مبالين بالكوكايين" بين عشية وضحاها بعد بدء العلاج بالباكلوفين.[134] تظهر بعض الدراسات الترابط بين إزالة سمية العقاقير الأفيونية والوفيات بجرعات زائدة.[135]
إدمان المحفزات النفسية
اعتبارا من May 2014[تحديث]، لا يوجد علاج دوائي فعال لأي شكل من أشكال إدمان المنبهات النفسية.[8][136][137][138] أشارت المراجعات من 2015 و 2016 و 2018 إلى أن الناهضات الانتقائية TAAR1 لها إمكانات علاجية كبيرة كعلاج لإدمان المنبهات النفسية[139][140][141] ومع ذلك، اعتبارا من 2018[تحديث]، فإن المركبات الوحيدة المعروفة بأنها تعمل كمنبهات انتقائية TAAR1 هي عقاقير تجريبية.[139][140][141]
بحث
This section requires expansion. (April 2016) |
تشير الأبحاث إلى أن اللقاحات التي تستخدم الأجسام المضادة وحيدة النسيلة المضادة للأدوية يمكن أن تخفف من التعزيز الإيجابي الذي يسببه الدواء عن طريق منع الدواء من التحرك عبر الحاجز الدموي الدماغي;[142] ومع ذلك، فإن العلاجات الحالية القائمة على اللقاح فعالة فقط في مجموعة فرعية صغيرة نسبيًا من الأفراد.[142][143] اعتبارا من November 2015[تحديث]، يتم اختبار العلاجات القائمة على اللقاحات في التجارب السريرية البشرية كعلاج للإدمان وتدبير وقائي ضد الجرعات الزائدة من المخدرات التي تشمل النيكوتين والكوكايين والميثامفيتامين.[142]
تظهر الدراسة الجديدة أن اللقاح قد ينقذ الأرواح أيضًا أثناء تناول جرعة زائدة من المخدرات. في هذه الحالة، الفكرة هي أن الجسم سيستجيب للقاح عن طريق إنتاج الأجسام المضادة بسرعة لمنع المواد الأفيونية من الوصول إلى الدماغ.[144]
نظرًا لأن الإدمان يتضمن شذوذًا في الگلوتامات والناقل العصبي الجابايرجيك،[145][146] المستقبلات المرتبطة بهذه النواقل العصبية (على سبيل المثال، مستقبلات AMPA، مستقبلات ن-مثيل-د-أسبارتات، و مستقبلات GABA B ) هي أهداف علاجية محتملة للإدمان.[145][146][147][148] أظهر N-أسيتيل سيستئين، الذي يؤثر على مستقبلات الگلوتامات الاستقلابية ومستقبلات NMDA، بعض الفوائد في الدراسات قبل السريرية والسريرية التي تنطوي على إدمان الكوكايين والهيروين والقنب.[145] قد يكون مفيدًا أيضًا كعلاج مساعد للإدمان على المنبهات من نوع الأمفيتامين، ولكن يلزم إجراء المزيد من الأبحاث السريرية.[145]
حددت المراجعات الطبية الحالية للبحوث التي تشمل حيوانات المختبر فئة الأدوية - مثبطات هيستون ديستيلاز من الفئة الأولي[note 7] التي تثبط الوظيفة بشكل غير مباشر وتزيد من التعبير عن ΔFosB المتراكم عن طريق تحفيز تعبير G9a في النواة المتكئة بعد الاستخدام المطول.[70][82][149][105] تشير هذه المراجعات والأدلة الأولية اللاحقة التي استخدمت عن طريق الفم أو الإعطاء داخل الصفاق لملح الصوديوم لحمض الزبد أو مثبطاتHDAC من الفئة 1 أخري لفترة طويلة إلى أن هذه الأدوية لها فعالية في الحد من السلوك الإدماني في حيوانات المختبر[note 8]التي تم تطويرها الإدمان على الإيثانول والمنشطات النفسية (مثل الأمفيتامين والكوكايين) والنيكوتين والمواد الأفيونية;[82][105][150][151] ومع ذلك، فقد تم إجراء عدد قليل من التجارب السريرية على البشر الذين يعانون من الإدمان وأي من مثبطات HDAC من الفئة الأولى لاختبار فعالية العلاج لدى البشر أو تحديد نظام الجرعات الأمثل.[note 9]
العلاج الجيني للإدمان مجال بحث نشط. يتضمن أحد خطوط أبحاث العلاج الجيني استخدام ناقلات فيروسية لزيادة التعبير عن بروتينات مستقبل الدوبامين D2 في الدماغ.[153][154][155][156][157]
علم الأوبئة
بسبب الاختلافات الثقافية، فإن نسبة الأفراد الذين يطورون إدمانًا لعقار أو سلوكي خلال فترة زمنية محددة (أي الانتشار ) يختلف بمرور الوقت، حسب البلد، وعبر الديموغرافية السكانية الوطنية (على سبيل المثال، حسب الفئة العمرية، والوضع الاجتماعي والاقتصادي، إلخ. ).[41]
آسيا
انتشار الإعتماد علي الكحول ليس مرتفعا كما هو ملاحظ في مناطق أخرى. في آسيا، لا تؤثر العوامل الاجتماعية والاقتصادية فحسب، بل العوامل البيولوجية أيضًا على سلوك الشرب.[158]
تبلغ نسبة انتشار ملكية الهواتف الذكية 62٪، وتتراوح من 41٪ في الصين إلى 84٪ في كوريا الجنوبية. علاوة على ذلك، تتراوح المشاركة في الألعاب عبر الإنترنت من 11٪ في الصين إلى 39٪ في اليابان. يوجد في هونغ كونغ أكبر عدد من المراهقين الذين يبلغون عن استخدام الإنترنت يوميًا أو أعلى (68٪). يعد اضطراب إدمان الإنترنت في أعلى مستوياته في الفلبين، وفقًا لكل من IAT (اختبار إدمان الإنترنت) - 5٪ و CIAS-R (مقياس تشن المعدل لإدمان الإنترنت) - 21٪.[159]
أستراليا
تم الإبلاغ عن انتشار اضطراب تعاطي المخدرات بين الأستراليين بنسبة 5.1٪ في عام 2009.[160]
أوروبا
في عام 2015، كان معدل الانتشار المقدر بين السكان البالغين 18.4٪ لتعاطي الكحول بصورة نوباتية بكثرة (في الثلاثين يومًا الماضية) ؛ 15.2٪ تدخين التبغ اليومي ؛ و 3.8 و 0.77 و 0.37 و 0.35 في المائة في عام 2017 القنب والأمفيتامين والمواد الأفيونية وتعاطي الكوكايين. كانت معدلات الوفيات بسبب الكحول والعقاقير غير المشروعة أعلى في أوروبا الشرقية.[161]
الولايات المتحدة
استنادًا إلى عينات تمثيلية لسكان الشباب في الولايات المتحدة في عام 2011، قُدِّر معدل انتشار متوسط الحياة[note 10] بحوالي 8٪ و 2-3٪ على التوالي.[25] بناءً على عينات تمثيلية من السكان البالغين في الولايات المتحدة في عام 2011، تم تقدير معدل انتشار لمدة 12 شهرًا لإدمان الكحول والمخدرات بحوالي 12 ٪ و 2-3 ٪ على التوالي.[25] يبلغ معدل انتشار إدمان العقار الموصوف حاليًا حوالي 4.7٪.[162]
اعتبارا من 2016[تحديث] يحتاج حوالي 22 مليون شخص في الولايات المتحدة إلى علاج من إدمان الكحول أو النيكوتين أو غيره من العقاقير.[26][163] فقط حوالي 10٪، أو ما يزيد قليلاً عن 2 مليون، يتلقون أي شكل من أشكال العلاج، وأولئك الذين لا يتلقون بشكل عام رعاية مبنية على الأدلة.[26][163] ثلث تكاليف المستشفيات الداخلية و 20٪ من جميع الوفيات في الولايات المتحدة كل عام ناتجة عن الإدمان غير المعالج وتعاطي المخدرات المحفوف بالمخاطر.[26][163] على الرغم من التكلفة الاقتصادية الإجمالية الهائلة التي يتحملها المجتمع، والتي تفوق تكلفة مرض السكري وجميع أشكال السرطان مجتمعة، فإن معظم الأطباء في الولايات المتحدة يفتقرون إلى التدريب اللازم للتعامل مع إدمان المخدرات بشكل فعال.[26][163]
أدرجت مراجعة أخرى تقديرات لمعدلات الانتشار مدى الحياة للعديد من الإدمان السلوكي في الولايات المتحدة، بما في ذلك 1-2٪ للمقامرة القهرية، و 5٪ للإدمان الجنسي، و 2.8٪ لإدمان الطعام، و5-6٪ للتسوق الإجباري.[33] أشارت مراجعة منهجية إلى أن معدل الانتشار الثابت للوقت للإدمان الجنسي والسلوك الجنسي القهري ذي الصلة (على سبيل المثال، الاستمناء القهري مع المواد الإباحية أو بدونها، والجنس السيبراني القهري، وما إلى ذلك) داخل الولايات المتحدة يتراوح من 3 إلى 6 ٪ من السكان.[35]
وفقًا لاستطلاع أجراه مركز بيو للأبحاث عام 2017، فإن ما يقرب من نصف البالغين الأمريكيين يعرفون أحد أفراد العائلة أو صديقًا مقربًا يعاني من إدمان المخدرات في مرحلة ما من حياتهم.[164]
في عام 2019، تم الاعتراف بإدمان المواد الأفيونية كأزمة وطنية في الولايات المتحدة.[165] ذكر مقال في صحيفة واشنطن پوست أن "أكبر شركات الأدوية الأمريكية أغرقت البلاد بأقراص الألم من عام 2006 حتى عام 2012، حتى عندما أصبح من الواضح أنها كانت تغذي الإدمان والجرعات الزائدة".
جنوب أمريكا
قد تكون حقائق استخدام المواد الأفيونية المفعول وإساءة استخدامها في أمريكا اللاتينية خادعة إذا اقتصرت الملاحظات على النتائج الوبائية. في تقرير مكتب الأمم المتحدة المعني بالمخدرات والجريمة،[166] على الرغم من أن أمريكا الجنوبية تنتج 3٪ من المورفين والهيروين في العالم و 0.01٪ من الأفيون، إلا أن انتشار الاستخدام غير متكافئ. وفقًا للجنة البلدان الأمريكية لمكافحة تعاطي المخدرات، فإن استهلاك الهيروين منخفض في معظم بلدان أمريكا اللاتينية، على الرغم من أن كولومبيا هي أكبر منتج للأفيون في المنطقة. المكسيك، بسبب حدودها مع الولايات المتحدة، لديها أعلى معدل استخدام.[167]
النظريات الشخصية
نظريات الشخصية للإدمان هي نماذج نفسية تربط سمات الشخصية أو أنماط التفكير (أي الحالات العاطفية ) بميل الفرد لتطوير الإدمان. يوضح تحليل البيانات أن هناك اختلافًا كبيرًا في الملامح النفسية لمتعاطي المخدرات وغير المتعاطين وقد يكون الاستعداد النفسي لاستخدام الأدوية المختلفة مختلفًا.[168] تتضمن نماذج مخاطر الإدمان التي تم اقتراحها في منشورات علم النفس نموذجًا يؤثر على خلل التنظيم للعاطفة للتأثيرات الوجدانية الإيجابية والسلبية، ونموذج نظرية حساسية التعزيز للاندفاع والتثبيط السلوكي، ونموذج الاندفاع لحساسية المكافأة والاندفاع.[169][170][171][172][173]
اللواحق "-holic" و "-holism"
في اللغة الإنجليزية الحديثة المعاصرة "-holic" هي لاحقة يمكن إضافتها إلى موضوع للإشارة إلى إدمان عليه. تم استخراجه من كلمة إدمان الكحول (واحدة من أولى أنواع الإدمان التي تم تحديدها على نطاق واسع من الناحيتين الطبية والاجتماعية) (بشكل صحيح الجذر " wikt: alcohol " بالإضافة إلى اللاحقة "-ism") عن طريق تقسيمها أو إعادة أقواسها إلى "alco" و " - holism ". (هناك خطأ آخر هو تفسير " الهليكوبتر " على أنها "heli-copter" بدلاً من "helico-pter" الصحيح اشتقاقيًا، مما أدى إلى ظهور كلمات مشتقة مثل " heliport.[174]) هناك مصطلحات طبية وقانونية صحيحة لمثل هذه الإدمان: هوس الشراب هو المصطلح الطبي القانوني للكحولية;[175] أمثلة أخرى في هذا الجدول:
| مصطلح عام | مدمن ل | المصطلح القانوني الطبي |
|---|---|---|
| ادمان الرقص | رقص | هوس الرقص |
| مدمن عمل | عمل | مهوس بالعمل |
| مدمن للجنس | جنس | هوس شبقي، شباق، الشهوة |
| مدمن للسكريات | سكر | هوس سكري |
| مدمن للشوكولاتة | شوكولاتة | |
| مدمن للغضب | غيظ / غضب |
مرئيات
| شم الكوكايين حسن فايق. |
انظر ايضاً
الهوامش
- ^ According to a review of experimental animal models that examined the transgenerational epigenetic inheritance of epigenetic marks that occur in addiction, alterations in histone acetylation – specifically, di-acetylation of lysine residues 9 and 14 on histone 3 (i.e., H3K9ac2 and H3K14ac2) in association with BDNF gene promoters – have been shown to occur within the medial prefrontal cortex (mPFC), testes, and sperm of cocaine-addicted male rats.[41] These epigenetic alterations in the rat mPFC result in increased BDNF gene expression within the mPFC, which in turn blunts the rewarding properties of cocaine and reduces cocaine self-administration.[41] The male but not female offspring of these cocaine-exposed rats inherited both epigenetic marks (i.e., di-acetylation of lysine residues 9 and 14 on histone 3) within mPFC neurons, the corresponding increase in BDNF expression within mPFC neurons, and the behavioral phenotype associated with these effects (i.e., a reduction in cocaine reward, resulting in reduced cocaine-seeking by these male offspring).[41] Consequently, the transmission of these two cocaine-induced epigenetic alterations (i.e., H3K9ac2 and H3K14ac2) in rats from male fathers to male offspring served to reduce the offspring's risk of developing an addiction to cocaine.[41] اعتبارا من 2018[تحديث] neither the heritability of these epigenetic marks in humans nor the behavioral effects of the marks within human mPFC neurons has been established.[41]
- ^ أ ب A decrease in aversion sensitivity, in simpler terms, means that an individual's behavior is less likely to be influenced by undesirable outcomes.
- ^ In other words, c-Fos repression allows ΔFosB to more rapidly accumulate within the D1-type medium spiny neurons of the nucleus accumbens because it is selectively induced in this state.[3] Prior to c-Fos repression, all Fos family proteins (e.g., c-Fos, Fra1, Fra2, FosB, and ΔFosB) are induced together, with ΔFosB expression increasing to a lesser extent.[3]
- ^ According to two medical reviews, ΔFosB has been implicated in causing both increases and decreases in dynorphin expression in different studies;[69][99] this table entry reflects only a decrease.
- ^ Incentive salience, the "motivational salience" for a reward, is a "desire" or "want" attribute, which includes a motivational component, that the brain assigns to a rewarding stimulus.[100][101] As a consequence, incentive salience acts as a motivational "magnet" for a rewarding stimulus that commands attention, induces approach, and causes the rewarding stimulus to be sought out.[100]
- ^ In simplest terms, this means that when either amphetamine or sex is perceived as more alluring or desirable through reward sensitization, this effect occurs with the other as well.
- ^ Inhibitors of class I histone deacetylase (HDAC) enzymes are drugs that inhibit four specific histone-modifying enzymes: HDAC1, HDAC2, HDAC3, and HDAC8. Most of the animal research with HDAC inhibitors has been conducted with four drugs: butyrate salts (mainly sodium butyrate), trichostatin A, valproic acid, and SAHA;[149][105] butyric acid is a naturally occurring short-chain fatty acid in humans, while the latter two compounds are FDA-approved drugs with medical indications unrelated to addiction.
- ^ Specifically, prolonged administration of a class I HDAC inhibitor appears to reduce an animal's motivation to acquire and use an addictive drug without affecting an animals motivation to attain other rewards (i.e., it does not appear to cause motivational anhedonia) and reduce the amount of the drug that is self-administered when it is readily available.[82][105][150]
- ^ Among the few clinical trials that employed a class I HDAC inhibitor, one utilized valproate for methamphetamine addiction.[152]
- ^ The lifetime prevalence of an addiction is the percentage of individuals in a population that developed an addiction at some point in their life.
- مفتاح الصور
- ^ (Text color) Transcription factors
المصادر
- ^ أ ب "Facing Addiction in America: The Surgeon General's Report on Alcohol, Drugs, and Health" (PDF). Office of the Surgeon General. US Department of Health and Human Services. November 2016. pp. 35–37, 45, 63, 155, 317, 338. Retrieved 28 January 2017.
- ^ أ ب ت ث Volkow ND, Koob GF, McLellan AT (January 2016). "Neurobiologic Advances from the Brain Disease Model of Addiction". N. Engl. J. Med. 374 (4): 363–371. doi:10.1056/NEJMra1511480. PMID 26816013.
Substance-use disorder: A diagnostic term in the fifth edition of the Diagnostic and Statistical Manual of Mental Disorders (DSM-5) referring to recurrent use of alcohol or other drugs that causes clinically and functionally significant impairment, such as health problems, disability, and failure to meet major responsibilities at work, school, or home. Depending on the level of severity, this disorder is classified as mild, moderate, or severe.
Addiction: A term used to indicate the most severe, chronic stage of substance-use disorder, in which there is a substantial loss of self-control, as indicated by compulsive drug taking despite the desire to stop taking the drug. In the DSM-5, the term addiction is synonymous with the classification of severe substance-use disorder. - ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع غ ف ق Nestler EJ (December 2013). "Cellular basis of memory for addiction". Dialogues Clin. Neurosci. 15 (4): 431–443. PMC 3898681. PMID 24459410.
Despite the importance of numerous psychosocial factors, at its core, drug addiction involves a biological process: the ability of repeated exposure to a drug of abuse to induce changes in a vulnerable brain that drive the compulsive seeking and taking of drugs, and loss of control over drug use, that define a state of addiction. ... A large body of literature has demonstrated that such ΔFosB induction in D1-type [nucleus accumbens] neurons increases an animal's sensitivity to drug as well as natural rewards and promotes drug self-administration, presumably through a process of positive reinforcement ... Another ΔFosB target is cFos: as ΔFosB accumulates with repeated drug exposure it represses c-Fos and contributes to the molecular switch whereby ΔFosB is selectively induced in the chronic drug-treated state.41. ... Moreover, there is increasing evidence that, despite a range of genetic risks for addiction across the population, exposure to sufficiently high doses of a drug for long periods of time can transform someone who has relatively lower genetic loading into an addict.
- ^
{{cite book}}: Empty citation (help) - ^ أ ب "Glossary of Terms". Mount Sinai School of Medicine. Department of Neuroscience. Retrieved 9 February 2015.
- ^ Angres DH, Bettinardi-Angres K (October 2008). "The disease of addiction: origins, treatment, and recovery". Disease-a-Month. 54 (10): 696–721. doi:10.1016/j.disamonth.2008.07.002. PMID 18790142.
- ^ أ ب Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 15: Reinforcement and Addictive Disorders". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 364–65, 375. ISBN 978-0-07-148127-4.
The defining feature of addiction is compulsive, out-of-control drug use, despite negative consequences. ...
compulsive eating, shopping, gambling, and sex – so-called "natural addictions" – Indeed, addiction to both drugs and behavioral rewards may arise from similar dysregulation of the mesolimbic dopamine system. - ^ أ ب ت Taylor SB, Lewis CR, Olive MF (February 2013). "The neurocircuitry of illicit psychostimulant addiction: acute and chronic effects in humans". Subst. Abuse Rehabil. 4: 29–43. doi:10.2147/SAR.S39684. PMC 3931688. PMID 24648786.
Initial drug use can be attributed to the ability of the drug to act as a reward (ie, a pleasurable emotional state or positive reinforcer), which can lead to repeated drug use and dependence.8,9 A great deal of research has focused on the molecular and neuroanatomical mechanisms of the initial rewarding or reinforcing effect of drugs of abuse. ... At present, no pharmacological therapy has been approved by the FDA to treat psychostimulant addiction. Many drugs have been tested, but none have shown conclusive efficacy with tolerable side effects in humans.172 ... A new emphasis on larger-scale biomarker, genetic, and epigenetic research focused on the molecular targets of mental disorders has been recently advocated.212 In addition, the integration of cognitive and behavioral modification of circuit-wide neuroplasticity (ie, computer-based training to enhance executive function) may prove to be an effective adjunct-treatment approach for addiction, particularly when combined with cognitive enhancers.198,213–216 Furthermore, in order to be effective, all pharmacological or biologically based treatments for addiction need to be integrated into other established forms of addiction rehabilitation, such as cognitive behavioral therapy, individual and group psychotherapy, behavior-modification strategies, twelve-step programs, and residential treatment facilities.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب ت ث "Drugs, Brains, and Behavior: The Science of Addiction – Drug Misuse and Addiction". www.drugabuse.gov. North Bethesda, Maryland: National Institute on Drug Abuse. 13 July 2020. Retrieved 23 December 2021.
- ^ Hammer R, Dingel M, Ostergren J, Partridge B, McCormick J, Koenig BA (2013-07-01). "Addiction: Current Criticism of the Brain Disease Paradigm". AJOB Neuroscience. 4 (3): 27–32. doi:10.1080/21507740.2013.796328. PMC 3969751. PMID 24693488.
- ^ Heather N, Best D, Kawalek A, Field M, Lewis M, Rotgers F, Wiers RW, Heim D (2018-07-04). "Challenging the brain disease model of addiction: European launch of the addiction theory network". Addiction Research & Theory (in الإنجليزية). 26 (4): 249–255. doi:10.1080/16066359.2017.1399659.
- ^ Heather N (2017-04-01). "Q: Is Addiction a Brain Disease or a Moral Failing? A: Neither". Neuroethics. 10 (1): 115–124. doi:10.1007/s12152-016-9289-0. PMC 5486515. PMID 28725283.
- ^ Satel S, Lilienfeld SO (2014). "Addiction and the brain-disease fallacy". Frontiers in Psychiatry (in الإنجليزية). 4: 141. doi:10.3389/fpsyt.2013.00141. PMC 3939769. PMID 24624096.
- ^ Peele S (December 2016). "People Control Their Addictions: No matter how much the "chronic" brain disease model of addiction indicates otherwise, we know that people can quit addictions - with special reference to harm reduction and mindfulness". Addictive Behaviors Reports. 4: 97–101. doi:10.1016/j.abrep.2016.05.003. PMC 5836519. PMID 29511729.
- ^ Henden E (2017). "Addiction, Compulsion, and Weakness of the Will: A Dual-Process Perspective.". In Heather N, Gabriel S (eds.). Addiction and Choice: Rethinking the Relationship. Oxford, UK: Oxford University Press. pp. 116–132.
- ^ Morse RM, Flavin DK (August 1992). "The definition of alcoholism. The Joint Committee of the National Council on Alcoholism and Drug Dependence and the American Society of Addiction Medicine to Study the Definition and Criteria for the Diagnosis of Alcoholism". JAMA. 268 (8): 1012–14. doi:10.1001/jama.1992.03490080086030. PMID 1501306.
- ^ Marlatt GA, Baer JS, Donovan DM, Kivlahan DR (1988). "Addictive behaviors: etiology and treatment". Annu Rev Psychol. 39: 223–52. doi:10.1146/annurev.ps.39.020188.001255. PMID 3278676.
- ^ ME (2019-09-12). "Gaming Addiction in ICD-11: Issues and Implications". Psychiatric Times (in الإنجليزية). Retrieved 2020-03-03.
- ^ أ ب American Psychiatric Association (2013). "Substance-Related and Addictive Disorders" (PDF). American Psychiatric Publishing. pp. 1–2. Archived from the original (PDF) on 15 August 2015. Retrieved 10 July 2015.
Additionally, the diagnosis of dependence caused much confusion. Most people link dependence with "addiction" when in fact dependence can be a normal body response to a substance.
- ^ أ ب Malenka RC, Nestler EJ, Hyman SE, Holtzman DM (2015). "Chapter 16: Reinforcement and Addictive Disorders". Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (3rd ed.). New York: McGraw-Hill Medical. ISBN 978-0-07-182770-6.
The official diagnosis of drug addiction by the Diagnostic and Statistic Manual of Mental Disorders (2013), which uses the term substance use disorder, is flawed. Criteria used to make the diagnosis of substance use disorders include tolerance and somatic dependence/withdrawal, even though these processes are not integral to addiction as noted. It is ironic and unfortunate that the manual still avoids use of the term addiction as an official diagnosis, even though addiction provides the best description of the clinical syndrome.
- ^ أ ب Rosenthal, Richard; Faris, Suzanne (2019). "The etymology and early history of 'addiction'". Addiction Research & Theory. 27 (5): 437. doi:10.1080/16066359.2018.1543412. S2CID 150418396.
- ^ Institute of Medicine (1996). Pathways of Addiction: Opportunities in Drug Abuse Research. Washington: National Academies Press.
- ^ Bettinardi-Angres, Kathy; Angres, Daniel (2015). "Understanding the Disease of Addiction". Journal of Nursing Regulation. 1 (2): 31–37. doi:10.1016/S2155-8256(15)30348-3.
- ^ أ ب Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 1: Basic Principles of Neuropharmacology". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. p. 4. ISBN 978-0-07-148127-4.
Drug abuse and addiction exact an astoundingly high financial and human toll on society through direct adverse effects, such as lung cancer and hepatic cirrhosis, and indirect adverse effects –for example, accidents and AIDS – on health and productivity.
- ^ أ ب ت ث Merikangas KR, McClair VL (June 2012). "Epidemiology of Substance Use Disorders". Hum. Genet. 131 (6): 779–89. doi:10.1007/s00439-012-1168-0. PMC 4408274. PMID 22543841.
- ^ أ ب ت ث ج ح خ "American Board of Medical Specialties recognizes the new subspecialty of addiction medicine" (PDF). American Board of Addiction Medicine. 14 March 2016. Archived from the original (PDF) on 21 March 2021. Retrieved 3 April 2016.
Sixteen percent of the non-institutionalized U.S. population age 12 and over – more than 40 million Americans – meets medical criteria for addiction involving nicotine, alcohol or other drugs. This is more than the number of Americans with cancer, diabetes or heart conditions. In 2014, 22.5 million people in the United States needed treatment for addiction involving alcohol or drugs other than nicotine, but only 11.6 percent received any form of inpatient, residential, or outpatient treatment. Of those who do receive treatment, few receive evidence-based care. (There is no information available on how many individuals receive treatment for addiction involving nicotine.)
Risky substance use and untreated addiction account for one-third of inpatient hospital costs and 20 percent of all deaths in the United States each year, and cause or contribute to more than 100 other conditions requiring medical care, as well as vehicular crashes, other fatal and non-fatal injuries, overdose deaths, suicides, homicides, domestic discord, the highest incarceration rate in the world and many other costly social consequences. The economic cost to society is greater than the cost of diabetes and all cancers combined. Despite these startling statistics on the prevalence and costs of addiction, few physicians have been trained to prevent or treat it. - ^ "Economic consequences of drug abuse" (PDF). International Narcotics Control Board Report: 2013 (PDF). United Nations – International Narcotics Control Board. 2013. ISBN 978-92-1-148274-4. Retrieved 28 September 2018.
- ^ "Overdose Death Rates". National Institute on Drug Abuse. 9 August 2018. Retrieved 17 September 2018.
- ^ "Overdose Deaths Accelerating During Covid-19". Centers For Disease Control Prevention. 18 December 2020. Retrieved 10 February 2021.
- ^ Washburn DA (2016). "The Stroop effect at 80: The competition between stimulus control and cognitive control". J Exp Anal Behav. 105 (1): 3–13. doi:10.1002/jeab.194. PMID 26781048.
Today, arguably more than at any time in history, the constructs of attention, executive functioning, and cognitive control seem to be pervasive and preeminent in research and theory. Even within the cognitive framework, however, there has long been an understanding that behavior is multiply determined, and that many responses are relatively automatic, unattended, contention-scheduled, and habitual. Indeed, the cognitive flexibility, response inhibition, and self-regulation that appear to be hallmarks of cognitive control are noteworthy only in contrast to responses that are relatively rigid, associative, and involuntary.
- ^ Diamond A (2013). "Executive functions". Annu Rev Psychol. 64: 135–68. doi:10.1146/annurev-psych-113011-143750. PMC 4084861. PMID 23020641.
Core EFs are inhibition [response inhibition (self-control – resisting temptations and resisting acting impulsively) and interference control (selective attention and cognitive inhibition)], working memory, and cognitive flexibility (including creatively thinking "outside the box," seeing anything from different perspectives, and quickly and flexibly adapting to changed circumstances). ... EFs and prefrontal cortex are the first to suffer, and suffer disproportionately, if something is not right in your life. They suffer first, and most, if you are stressed (Arnsten 1998, Liston et al. 2009, Oaten & Cheng 2005), sad (Hirt et al. 2008, von Hecker & Meiser 2005), lonely (Baumeister et al. 2002, Cacioppo & Patrick 2008, Campbell et al. 2006, Tun et al. 2012), sleep deprived (Barnes et al. 2012, Huang et al. 2007), or not physically fit (Best 2010, Chaddock et al. 2011, Hillman et al. 2008). Any of these can cause you to appear to have a disorder of EFs, such as ADHD, when you do not. You can see the deleterious effects of stress, sadness, loneliness, and lack of physical health or fitness at the physiological and neuroanatomical level in prefrontal cortex and at the behavioral level in worse EFs (poorer reasoning and problem solving, forgetting things, and impaired ability to exercise discipline and self-control). ...
EFs can be improved (Diamond & Lee 2011, Klingberg 2010). ... At any age across the life cycle EFs can be improved, including in the elderly and in infants. There has been much work with excellent results on improving EFs in the elderly by improving physical fitness (Erickson & Kramer 2009, Voss et al. 2011) ... Inhibitory control (one of the core EFs) involves being able to control one's attention, behavior, thoughts, and/or emotions to override a strong internal predisposition or external lure, and instead do what's more appropriate or needed. Without inhibitory control we would be at the mercy of impulses, old habits of thought or action (conditioned responses), and/or stimuli in the environment that pull us this way or that. Thus, inhibitory control makes it possible for us to change and for us to choose how we react and how we behave rather than being unthinking creatures of habit. It doesn't make it easy. Indeed, we usually are creatures of habit and our behavior is under the control of environmental stimuli far more than we usually realize, but having the ability to exercise inhibitory control creates the possibility of change and choice. ... The subthalamic nucleus appears to play a critical role in preventing such impulsive or premature responding (Frank 2006). - ^ أ ب Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 13: Higher Cognitive Function and Behavioral Control". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 313–21. ISBN 978-0-07-148127-4.
• Executive function, the cognitive control of behavior, depends on the prefrontal cortex, which is highly developed in higher primates and especially humans.
• Working memory is a short-term, capacity-limited cognitive buffer that stores information and permits its manipulation to guide decision-making and behavior. ...
These diverse inputs and back projections to both cortical and subcortical structures put the prefrontal cortex in a position to exert what is often called "top-down" control or cognitive control of behavior. ... The prefrontal cortex receives inputs not only from other cortical regions, including association cortex, but also, via the thalamus, inputs from subcortical structures subserving emotion and motivation, such as the amygdala (Chapter 14) and ventral striatum (or nucleus accumbens; Chapter 15). ...
In conditions in which prepotent responses tend to dominate behavior, such as in drug addiction, where drug cues can elicit drug seeking (Chapter 15), or in attention deficit hyperactivity disorder (ADHD; described below), significant negative consequences can result. ... ADHD can be conceptualized as a disorder of executive function; specifically, ADHD is characterized by reduced ability to exert and maintain cognitive control of behavior. Compared with healthy individuals, those with ADHD have diminished ability to suppress inappropriate prepotent responses to stimuli (impaired response inhibition) and diminished ability to inhibit responses to irrelevant stimuli (impaired interference suppression). ... Functional neuroimaging in humans demonstrates activation of the prefrontal cortex and caudate nucleus (part of the striatum) in tasks that demand inhibitory control of behavior. Subjects with ADHD exhibit less activation of the medial prefrontal cortex than healthy controls even when they succeed in such tasks and utilize different circuits. ... Early results with structural MRI show thinning of the cerebral cortex in ADHD subjects compared with age-matched controls in prefrontal cortex and posterior parietal cortex, areas involved in working memory and attention. - ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع غ ف ق ك ل م ن هـ و ي أأ أب أت أث أج أح أخ أد أذ أر Olsen CM (December 2011). "Natural rewards, neuroplasticity, and non-drug addictions". Neuropharmacology. 61 (7): 1109–22. doi:10.1016/j.neuropharm.2011.03.010. PMC 3139704. PMID 21459101.
Functional neuroimaging studies in humans have shown that gambling (Breiter et al, 2001), shopping (Knutson et al, 2007), orgasm (Komisaruk et al, 2004), playing video games (Koepp et al, 1998; Hoeft et al, 2008) and the sight of appetizing food (Wang et al, 2004a) activate many of the same brain regions (i.e., the mesocorticolimbic system and extended amygdala) as drugs of abuse (Volkow et al, 2004). ... Cross-sensitization is also bidirectional, as a history of amphetamine administration facilitates sexual behavior and enhances the associated increase in NAc DA ... As described for food reward, sexual experience can also lead to activation of plasticity-related signaling cascades. The transcription factor delta FosB is increased in the NAc, PFC, dorsal striatum, and VTA following repeated sexual behavior (Wallace et al., 2008; Pitchers et al., 2010b). This natural increase in delta FosB or viral overexpression of delta FosB within the NAc modulates sexual performance, and NAc blockade of delta FosB attenuates this behavior (Hedges et al, 2009; Pitchers et al., 2010b). Further, viral overexpression of delta FosB enhances the conditioned place preference for an environment paired with sexual experience (Hedges et al., 2009). ... In some people, there is a transition from "normal" to compulsive engagement in natural rewards (such as food or sex), a condition that some have termed behavioral or non-drug addictions (Holden, 2001; Grant et al., 2006a). ... In humans, the role of dopamine signaling in incentive-sensitization processes has recently been highlighted by the observation of a dopamine dysregulation syndrome in some patients taking dopaminergic drugs. This syndrome is characterized by a medication-induced increase in (or compulsive) engagement in non-drug rewards such as gambling, shopping, or sex (Evans et al, 2006; Aiken, 2007; Lader, 2008)."
Table 1: Summary of plasticity observed following exposure to drug or natural reinforcers" - ^ أ ب ت ث ج ح خ د ذ ر ز س ش Robison AJ, Nestler EJ (November 2011). "Transcriptional and epigenetic mechanisms of addiction". Nat. Rev. Neurosci. 12 (11): 623–37. doi:10.1038/nrn3111. PMC 3272277. PMID 21989194.
ΔFosB has been linked directly to several addiction-related behaviors ... Importantly, genetic or viral overexpression of ΔJunD, a dominant negative mutant of JunD which antagonizes ΔFosB- and other AP-1-mediated transcriptional activity, in the NAc or OFC blocks these key effects of drug exposure14,22–24. This indicates that ΔFosB is both necessary and sufficient for many of the changes wrought in the brain by chronic drug exposure. ΔFosB is also induced in D1-type NAc MSNs by chronic consumption of several natural rewards, including sucrose, high fat food, sex, wheel running, where it promotes that consumption14,26–30. This implicates ΔFosB in the regulation of natural rewards under normal conditions and perhaps during pathological addictive-like states.
- ^ أ ب ت ث Karila L, Wéry A, Weinstein A, Cottencin O, Petit A, Reynaud M, Billieux J (2014). "Sexual addiction or hypersexual disorder: different terms for the same problem? A review of the literature". Curr. Pharm. Des. 20 (25): 4012–20. doi:10.2174/13816128113199990619. PMID 24001295.
Sexual addiction, which is also known as hypersexual disorder, has largely been ignored by psychiatrists, even though the condition causes serious psychosocial problems for many people. A lack of empirical evidence on sexual addiction is the result of the disease's complete absence from versions of the Diagnostic and Statistical Manual of Mental Disorders. ... Existing prevalence rates of sexual addiction-related disorders range from 3% to 6%. Sexual addiction/hypersexual disorder is used as an umbrella construct to encompass various types of problematic behaviors, including excessive masturbation, cybersex, pornography use, sexual behavior with consenting adults, telephone sex, strip club visitation, and other behaviors. The adverse consequences of sexual addiction are similar to the consequences of other addictive disorders. Addictive, somatic and psychiatric disorders coexist with sexual addiction. In recent years, research on sexual addiction has proliferated, and screening instruments have increasingly been developed to diagnose or quantify sexual addiction disorders. In our systematic review of the existing measures, 22 questionnaires were identified. As with other behavioral addictions, the appropriate treatment of sexual addiction should combine pharmacological and psychological approaches.
- ^ أ ب ت ث ج Pitchers KK, Vialou V, Nestler EJ, Laviolette SR, Lehman MN, Coolen LM (February 2013). "Natural and drug rewards act on common neural plasticity mechanisms with ΔFosB as a key mediator". The Journal of Neuroscience. 33 (8): 3434–42. doi:10.1523/JNEUROSCI.4881-12.2013. PMC 3865508. PMID 23426671.
Drugs of abuse induce neuroplasticity in the natural reward pathway, specifically the nucleus accumbens (NAc), thereby causing development and expression of addictive behavior. ... Together, these findings demonstrate that drugs of abuse and natural reward behaviors act on common molecular and cellular mechanisms of plasticity that control vulnerability to drug addiction, and that this increased vulnerability is mediated by ΔFosB and its downstream transcriptional targets. ... Sexual behavior is highly rewarding (Tenk et al., 2009), and sexual experience causes sensitized drug-related behaviors, including cross-sensitization to amphetamine (Amph)-induced locomotor activity (Bradley and Meisel, 2001; Pitchers et al., 2010a) and enhanced Amph reward (Pitchers et al., 2010a). Moreover, sexual experience induces neural plasticity in the NAc similar to that induced by psychostimulant exposure, including increased dendritic spine density (Meisel and Mullins, 2006; Pitchers et al., 2010a), altered glutamate receptor trafficking, and decreased synaptic strength in prefrontal cortex-responding NAc shell neurons (Pitchers et al., 2012). Finally, periods of abstinence from sexual experience were found to be critical for enhanced Amph reward, NAc spinogenesis (Pitchers et al., 2010a), and glutamate receptor trafficking (Pitchers et al., 2012). These findings suggest that natural and drug reward experiences share common mechanisms of neural plasticity
- ^ أ ب ت ث ج Beloate LN, Weems PW, Casey GR, Webb IC, Coolen LM (February 2016). "Nucleus accumbens NMDA receptor activation regulates amphetamine cross-sensitization and deltaFosB expression following sexual experience in male rats". Neuropharmacology. 101: 154–64. doi:10.1016/j.neuropharm.2015.09.023. PMID 26391065. S2CID 25317397.
- ^ Nehlig A (2004). Coffee, tea, chocolate, and the brain. Boca Raton: CRC Press. pp. 203–218. ISBN 9780429211928.
- ^ Meule A, Gearhardt AN (September 2014). "Food addiction in the light of DSM-5". Nutrients. 6 (9): 3653–71. doi:10.3390/nu6093653. PMC 4179181. PMID 25230209.
- ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةBehavioral addictions - ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط Vassoler FM, Sadri-Vakili G (2014). "Mechanisms of transgenerational inheritance of addictive-like behaviors". Neuroscience. 264: 198–206. doi:10.1016/j.neuroscience.2013.07.064. PMC 3872494. PMID 23920159.
However, the components that are responsible for the heritability of characteristics that make an individual more susceptible to drug addiction in humans remain largely unknown given that patterns of inheritance cannot be explained by simple genetic mechanisms (Cloninger et al., 1981; Schuckit et al., 1972). The environment also plays a large role in the development of addiction as evidenced by great societal variability in drug use patterns between countries and across time (UNODC, 2012). Therefore, both genetics and the environment contribute to an individual's vulnerability to become addicted following an initial exposure to drugs of abuse. ...
The evidence presented here demonstrates that rapid environmental adaptation occurs following exposure to a number of stimuli. Epigenetic mechanisms represent the key components by which the environment can influence genetics, and they provide the missing link between genetic heritability and environmental influences on the behavioral and physiological phenotypes of the offspring. - ^ Mayfield, R D; Harris, R A; Schuckit, M A (May 2008). "Genetic factors influencing alcohol dependence: Genetic factors and alcohol dependence". British Journal of Pharmacology. 154 (2): 275–287. doi:10.1038/bjp.2008.88. PMC 2442454. PMID 18362899.
- ^ أ ب Kendler KS, Neale MC, Heath AC, Kessler RC, Eaves LJ (May 1994). "A twin-family study of alcoholism in women". Am J Psychiatry. 151 (5): 707–15. doi:10.1176/ajp.151.5.707. PMID 8166312.
- ^ Crowe JR. "Genetics of alcoholism". Alcohol Health and Research World: 1–11. Retrieved 13 December 2017.
- ^ Melemis SM. "The Genetics of Addiction – Is Addiction a Disease?". I Want to Change My Life. Retrieved 17 September 2018.
- ^ Clarke TK, Crist RC, Kampman KM, Dackis CA, Pettinati HM, O'Brien CP, Oslin DW, Ferraro TN, Lohoff FW, Berrettini WH (2013). "Low frequency genetic variants in the μ-opioid receptor (OPRM1) affect risk for addiction to heroin and cocaine". Neuroscience Letters. 542: 71–75. doi:10.1016/j.neulet.2013.02.018. PMC 3640707. PMID 23454283.
- ^ Hall FS, Drgonova J, Jain S, Uhl GR (December 2013). "Implications of genome wide association studies for addiction: are our a priori assumptions all wrong?". Pharmacology & Therapeutics. 140 (3): 267–79. doi:10.1016/j.pharmthera.2013.07.006. PMC 3797854. PMID 23872493.
- ^ Yang H, Ma J (August 2021). "How the COVID-19 pandemic impacts tobacco addiction: Changes in smoking behavior and associations with well-being". Addictive Behaviors. 119: 106917. doi:10.1016/j.addbeh.2021.106917. PMID 33862579. S2CID 233278782.
- ^ أ ب "What are risk factors and protective factors?". National Institute on Drug Abuse. Retrieved 13 December 2017.
- ^ "Understanding Drug Use and Addiction". www.drugabuse.gov (in الإنجليزية). National Institute on Drug Abuse. 6 June 2018. Retrieved 29 May 2020.
- ^ Lewis M (October 2018). Longo DL (ed.). "Brain Change in Addiction as Learning, Not Disease". The New England Journal of Medicine. 379 (16): 1551–1560. doi:10.1056/NEJMra1602872. PMID 30332573. S2CID 205117578.
Addictive activities are determined neither solely by brain changes nor solely by social conditions ... the narrowing seen in addiction takes place within the behavioral repertoire, the social surround, and the brain — all at the same time.
- ^ أ ب "Adverse Childhood Experiences". samhsa.gov. Rockville, Maryland, United States: Substance Abuse and Mental Health Services Administration. Archived from the original on 9 October 2016. Retrieved 26 September 2016.
- ^ أ ب Enoch MA (March 2011). "The role of early life stress as a predictor for alcohol and drug dependence". Psychopharmacology. 214 (1): 17–31. doi:10.1007/s00213-010-1916-6. PMC 3005022. PMID 20596857.
- ^ "Environmental Risk Factors". learn.genetics.utah.edu. Archived from the original on 17 September 2018. Retrieved 17 September 2018.
- ^ Spear LP (June 2000). "The adolescent brain and age-related behavioral manifestations". Neuroscience and Biobehavioral Reviews. 24 (4): 417–63. CiteSeerX 10.1.1.461.3295. doi:10.1016/s0149-7634(00)00014-2. PMID 10817843. S2CID 14686245.
- ^ Hammond CJ, Mayes LC, Potenza MN (April 2014). "Neurobiology of adolescent substance use and addictive behaviors: treatment implications". Adolescent Medicine. 25 (1): 15–32. PMC 4446977. PMID 25022184.
- ^ Catalano RF, Hawkins JD, Wells EA, Miller J, Brewer D (1990). "Evaluation of the effectiveness of adolescent drug abuse treatment, assessment of risks for relapse, and promising approaches for relapse prevention". The International Journal of the Addictions. 25 (9A–10A): 1085–140. doi:10.3109/10826089109081039. PMID 2131328.
- ^ Perepletchikova F, Krystal JH, Kaufman J (November 2008). "Practitioner review: adolescent alcohol use disorders: assessment and treatment issues". Journal of Child Psychology and Psychiatry, and Allied Disciplines. 49 (11): 1131–54. doi:10.1111/j.1469-7610.2008.01934.x. PMC 4113213. PMID 19017028.
- ^ "Age and Substance Abuse – Alcohol Rehab".
- ^ أ ب ت "Nationwide Trends". National Institute on Drug Abuse. June 2015. Retrieved 15 December 2017.
- ^ أ ب "Addiction Statistics – Facts on Drug and Alcohol Addiction". AddictionCenter. Retrieved 17 September 2018.
- ^ SAMHSA. "Risk and Protective Factors". Substance Abuse and Mental Health Administration. Archived from the original on 8 December 2016. Retrieved 19 December 2016.
- ^ "Infographic – Risk Factors of Addiction | Recovery Research Institute". www.recoveryanswers.org. Archived from the original on 17 December 2016. Retrieved 19 December 2016.
- ^ "Drug addiction Risk factors – Mayo Clinic". www.mayoclinic.org. Retrieved 19 December 2016.
- ^ "The Connection Between Mental Illness and Substance Abuse | Dual Diagnosis". Dual Diagnosis. Retrieved 17 September 2018.
- ^ أ ب ت Yuan TF, Li A, Sun X, Ouyang H, Campos C, Rocha NB, Arias-Carrión O, Machado S, Hou G, So KF (2015). "Transgenerational Inheritance of Paternal Neurobehavioral Phenotypes: Stress, Addiction, Ageing and Metabolism". Mol. Neurobiol. 53 (9): 6367–76. doi:10.1007/s12035-015-9526-2. hdl:10400.22/7331. PMID 26572641. S2CID 25694221.
- ^ أ ب "Drug abuse liability". www.cambridgecognition.com (in الإنجليزية). Retrieved 2021-03-09.
- ^ National Institute on Drug Abuse (2020-08-20). "Commonly Used Drugs Charts". National Institute on Drug Abuse (in الإنجليزية). Retrieved 2021-03-09.
- ^ أ ب ت ث ج ح خ د ذ ر Ruffle JK (November 2014). "Molecular neurobiology of addiction: what's all the (Δ)FosB about?". Am. J. Drug Alcohol Abuse. 40 (6): 428–37. doi:10.3109/00952990.2014.933840. PMID 25083822. S2CID 19157711.
ΔFosB is an essential transcription factor implicated in the molecular and behavioral pathways of addiction following repeated drug exposure. The formation of ΔFosB in multiple brain regions, and the molecular pathway leading to the formation of AP-1 complexes is well understood. The establishment of a functional purpose for ΔFosB has allowed further determination as to some of the key aspects of its molecular cascades[…]As a consequence of our improved understanding of ΔFosB in addiction, it is possible to evaluate the addictive potential of current medications (119), as well as use it as a biomarker for assessing the efficacy of therapeutic interventions (121,122,124). Some of these proposed interventions have limitations (125) or are in their infancy (75). However, it is hoped that some of these preliminary findings may lead to innovative treatments, which are much needed in addiction.
- ^ أ ب ت ث ج ح Biliński P, Wojtyła A, Kapka-Skrzypczak L, Chwedorowicz R, Cyranka M, Studziński T (2012). "Epigenetic regulation in drug addiction". Ann. Agric. Environ. Med. 19 (3): 491–96. PMID 23020045.
[…]ΔFosB is considered a primary and causative transcription factor in creating new neural connections in the reward centre, prefrontal cortex, and other regions of the limbic system. This is reflected in the increased, stable and long-lasting level of sensitivity to cocaine and other drugs, and tendency to relapse even after long periods of abstinence.
- ^ أ ب ت Renthal W, Nestler EJ (September 2009). "Chromatin regulation in drug addiction and depression". Dialogues Clin. Neurosci. 11 (3): 257–268. PMC 2834246. PMID 19877494.
[Psychostimulants] increase cAMP levels in striatum, which activates protein kinase A (PKA) and leads to phosphorylation of its targets. This includes the cAMP response element binding protein (CREB), the phosphorylation of which induces its association with the histone acetyltransferase, CREB binding protein (CBP) to acetylate histones and facilitate gene activation. This is known to occur on many genes including fosB and c-fos in response to psychostimulant exposure. ΔFosB is also upregulated by chronic psychostimulant treatments, and is known to activate certain genes (eg, cdk5) and repress others (eg, c-fos) where it recruits HDAC1 as a corepressor. ... Chronic exposure to psychostimulants increases glutamatergic [signaling] from the prefrontal cortex to the NAc. Glutamatergic signaling elevates Ca2+ levels in NAc postsynaptic elements where it activates CaMK (calcium/calmodulin protein kinases) signaling, which, in addition to phosphorylating CREB, also phosphorylates HDAC5.
Figure 2: Psychostimulant-induced signaling events - ^ Broussard JI (January 2012). "Co-transmission of dopamine and glutamate". J. Gen. Physiol. 139 (1): 93–96. doi:10.1085/jgp.201110659. PMC 3250102. PMID 22200950.
Coincident and convergent input often induces plasticity on a postsynaptic neuron. The NAc integrates processed information about the environment from basolateral amygdala, hippocampus, and prefrontal cortex (PFC), as well as projections from midbrain dopamine neurons. Previous studies have demonstrated how dopamine modulates this integrative process. For example, high frequency stimulation potentiates hippocampal inputs to the NAc while simultaneously depressing PFC synapses (Goto and Grace, 2005). The converse was also shown to be true; stimulation at PFC potentiates PFC–NAc synapses but depresses hippocampal–NAc synapses. In light of the new functional evidence of midbrain dopamine/glutamate co-transmission (references above), new experiments of NAc function will have to test whether midbrain glutamatergic inputs bias or filter either limbic or cortical inputs to guide goal-directed behavior.
- ^ Kanehisa Laboratories (10 October 2014). "Amphetamine – Homo sapiens (human)". KEGG Pathway. Retrieved 31 October 2014.
Most addictive drugs increase extracellular concentrations of dopamine (DA) in nucleus accumbens (NAc) and medial prefrontal cortex (mPFC), projection areas of mesocorticolimbic DA neurons and key components of the "brain reward circuit". Amphetamine achieves this elevation in extracellular levels of DA by promoting efflux from synaptic terminals. ... Chronic exposure to amphetamine induces a unique transcription factor delta FosB, which plays an essential role in long-term adaptive changes in the brain.
- ^ Cadet JL, Brannock C, Jayanthi S, Krasnova IN (2015). "Transcriptional and epigenetic substrates of methamphetamine addiction and withdrawal: evidence from a long-access self-administration model in the rat". Mol. Neurobiol. 51 (2): 696–717. doi:10.1007/s12035-014-8776-8. PMC 4359351. PMID 24939695.
Figure 1
{{cite journal}}: External link in|quote= - ^ أ ب ت Robison AJ, Nestler EJ (November 2011). "Transcriptional and epigenetic mechanisms of addiction". Nat. Rev. Neurosci. 12 (11): 623–637. doi:10.1038/nrn3111. PMC 3272277. PMID 21989194.
ΔFosB serves as one of the master control proteins governing this structural plasticity. ... ΔFosB also represses G9a expression, leading to reduced repressive histone methylation at the cdk5 gene. The net result is gene activation and increased CDK5 expression. ... In contrast, ΔFosB binds to the c-fos gene and recruits several co-repressors, including HDAC1 (histone deacetylase 1) and SIRT 1 (sirtuin 1). ... The net result is c-fos gene repression.
Figure 4: Epigenetic basis of drug regulation of gene expression - ^ أ ب ت ث Nestler EJ (December 2012). "Transcriptional mechanisms of drug addiction". Clin. Psychopharmacol. Neurosci. 10 (3): 136–143. doi:10.9758/cpn.2012.10.3.136. PMC 3569166. PMID 23430970.
The 35-37 kD ΔFosB isoforms accumulate with chronic drug exposure due to their extraordinarily long half-lives. ... As a result of its stability, the ΔFosB protein persists in neurons for at least several weeks after cessation of drug exposure. ... ΔFosB overexpression in nucleus accumbens induces NFκB ... In contrast, the ability of ΔFosB to repress the c-Fos gene occurs in concert with the recruitment of a histone deacetylase and presumably several other repressive proteins such as a repressive histone methyltransferase
- ^ Nestler EJ (October 2008). "Review. Transcriptional mechanisms of addiction: role of DeltaFosB". Philos. Trans. R. Soc. Lond., B, Biol. Sci. 363 (1507): 3245–3255. doi:10.1098/rstb.2008.0067. PMC 2607320. PMID 18640924.
Recent evidence has shown that ΔFosB also represses the c-fos gene that helps create the molecular switch—from the induction of several short-lived Fos family proteins after acute drug exposure to the predominant accumulation of ΔFosB after chronic drug exposure
- ^ أ ب Hyman SE, Malenka RC, Nestler EJ (2006). "Neural mechanisms of addiction: the role of reward-related learning and memory". Annu. Rev. Neurosci. 29: 565–98. doi:10.1146/annurev.neuro.29.051605.113009. PMID 16776597.
- ^ Steiner H, Van Waes V (January 2013). "Addiction-related gene regulation: risks of exposure to cognitive enhancers vs. other psychostimulants". Prog. Neurobiol. 100: 60–80. doi:10.1016/j.pneurobio.2012.10.001. PMC 3525776. PMID 23085425.
- ^ Kanehisa Laboratories (2 August 2013). "Alcoholism – Homo sapiens (human)". KEGG Pathway. Retrieved 10 April 2014.
- ^ Kim Y, Teylan MA, Baron M, Sands A, Nairn AC, Greengard P (February 2009). "Methylphenidate-induced dendritic spine formation and DeltaFosB expression in nucleus accumbens". Proc. Natl. Acad. Sci. USA. 106 (8): 2915–20. Bibcode:2009PNAS..106.2915K. doi:10.1073/pnas.0813179106. PMC 2650365. PMID 19202072.
- ^ أ ب ت ث ج ح خ د Nestler EJ (January 2014). "Epigenetic mechanisms of drug addiction". Neuropharmacology. 76 Pt B: 259–68. doi:10.1016/j.neuropharm.2013.04.004. PMC 3766384. PMID 23643695.
Short-term increases in histone acetylation generally promote behavioral responses to the drugs, while sustained increases oppose cocaine's effects, based on the actions of systemic or intra-NAc administration of HDAC inhibitors. ... Genetic or pharmacological blockade of G9a in the NAc potentiates behavioral responses to cocaine and opiates, whereas increasing G9a function exerts the opposite effect (Maze et al., 2010; Sun et al., 2012a). Such drug-induced downregulation of G9a and H3K9me2 also sensitizes animals to the deleterious effects of subsequent chronic stress (Covington et al., 2011). Downregulation of G9a increases the dendritic arborization of NAc neurons, and is associated with increased expression of numerous proteins implicated in synaptic function, which directly connects altered G9a/H3K9me2 in the synaptic plasticity associated with addiction (Maze et al., 2010).
G9a appears to be a critical control point for epigenetic regulation in NAc, as we know it functions in two negative feedback loops. It opposes the induction of ΔFosB, a long-lasting transcription factor important for drug addiction (Robison and Nestler, 2011), while ΔFosB in turn suppresses G9a expression (Maze et al., 2010; Sun et al., 2012a). ... Also, G9a is induced in NAc upon prolonged HDAC inhibition, which explains the paradoxical attenuation of cocaine's behavioral effects seen under these conditions, as noted above (Kennedy et al., 2013). GABAA receptor subunit genes are among those that are controlled by this feedback loop. Thus, chronic cocaine, or prolonged HDAC inhibition, induces several GABAA receptor subunits in NAc, which is associated with increased frequency of inhibitory postsynaptic currents (IPSCs). In striking contrast, combined exposure to cocaine and HDAC inhibition, which triggers the induction of G9a and increased global levels of H3K9me2, leads to blockade of GABAA receptor and IPSC regulation. - ^ أ ب ت ث Blum K, Werner T, Carnes S, Carnes P, Bowirrat A, Giordano J, Oscar-Berman M, Gold M (2012). "Sex, drugs, and rock 'n' roll: hypothesizing common mesolimbic activation as a function of reward gene polymorphisms". Journal of Psychoactive Drugs. 44 (1): 38–55. doi:10.1080/02791072.2012.662112. PMC 4040958. PMID 22641964.
It has been found that deltaFosB gene in the NAc is critical for reinforcing effects of sexual reward. Pitchers and colleagues (2010) reported that sexual experience was shown to cause DeltaFosB accumulation in several limbic brain regions including the NAc, medial pre-frontal cortex, VTA, caudate, and putamen, but not the medial preoptic nucleus. Next, the induction of c-Fos, a downstream (repressed) target of DeltaFosB, was measured in sexually experienced and naive animals. The number of mating-induced c-Fos-IR cells was significantly decreased in sexually experienced animals compared to sexually naive controls. Finally, DeltaFosB levels and its activity in the NAc were manipulated using viral-mediated gene transfer to study its potential role in mediating sexual experience and experience-induced facilitation of sexual performance. Animals with DeltaFosB overexpression displayed enhanced facilitation of sexual performance with sexual experience relative to controls. In contrast, the expression of DeltaJunD, a dominant-negative binding partner of DeltaFosB, attenuated sexual experience-induced facilitation of sexual performance, and stunted long-term maintenance of facilitation compared to DeltaFosB overexpressing group. Together, these findings support a critical role for DeltaFosB expression in the NAc in the reinforcing effects of sexual behavior and sexual experience-induced facilitation of sexual performance. ... both drug addiction and sexual addiction represent pathological forms of neuroplasticity along with the emergence of aberrant behaviors involving a cascade of neurochemical changes mainly in the brain's rewarding circuitry.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 15: Reinforcement and addictive disorders". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 384–85. ISBN 978-0-07-148127-4.
- ^ Salamone JD (1992). "Complex motor and sensorimotor functions of striatal and accumbens dopamine: involvement in instrumental behavior processes". Psychopharmacology. 107 (2–3): 160–74. doi:10.1007/bf02245133. PMID 1615120. S2CID 30545845.
- ^ Kauer JA, Malenka RC (November 2007). "Synaptic plasticity and addiction". Nature Reviews. Neuroscience. 8 (11): 844–58. doi:10.1038/nrn2234. PMID 17948030. S2CID 38811195.
- ^ Witten IB, Lin SC, Brodsky M, Prakash R, Diester I, Anikeeva P, et al. (December 2010). "Cholinergic interneurons control local circuit activity and cocaine conditioning". Science. 330 (6011): 1677–81. Bibcode:2010Sci...330.1677W. doi:10.1126/science.1193771. PMC 3142356. PMID 21164015.
- ^ أ ب Nestler EJ, Barrot M, Self DW (September 2001). "DeltaFosB: a sustained molecular switch for addiction". Proc. Natl. Acad. Sci. U.S.A. 98 (20): 11042–46. Bibcode:2001PNAS...9811042N. doi:10.1073/pnas.191352698. PMC 58680. PMID 11572966.
Although the ΔFosB signal is relatively long-lived, it is not permanent. ΔFosB degrades gradually and can no longer be detected in brain after 1–2 months of drug withdrawal ... Indeed, ΔFosB is the longest-lived adaptation known to occur in adult brain, not only in response to drugs of abuse, but to any other perturbation (that doesn't involve lesions) as well.
- ^ أ ب Jones S, Bonci A (2005). "Synaptic plasticity and drug addiction". Current Opinion in Pharmacology. 5 (1): 20–25. doi:10.1016/j.coph.2004.08.011. PMID 15661621.
- ^ أ ب Eisch AJ, Harburg GC (2006). "Opiates, psychostimulants, and adult hippocampal neurogenesis: Insights for addiction and stem cell biology". Hippocampus. 16 (3): 271–86. doi:10.1002/hipo.20161. PMID 16411230. S2CID 23667629.
- ^ Rang HP (2003). Pharmacology. Edinburgh: Churchill Livingstone. p. 596. ISBN 978-0-443-07145-4.
- ^ Kourrich S, Rothwell PE, Klug JR, Thomas MJ (2007). "Cocaine experience controls bidirectional synaptic plasticity in the nucleus accumbens". J. Neurosci. 27 (30): 7921–28. doi:10.1523/JNEUROSCI.1859-07.2007. PMC 6672735. PMID 17652583.
- ^ أ ب Kalivas PW, Volkow ND (August 2005). "The neural basis of addiction: a pathology of motivation and choice". The American Journal of Psychiatry. 162 (8): 1403–13. doi:10.1176/appi.ajp.162.8.1403. PMID 16055761.
- ^ أ ب Floresco SB, Ghods-Sharifi S (February 2007). "Amygdala-prefrontal cortical circuitry regulates effort-based decision making". Cerebral Cortex. 17 (2): 251–60. CiteSeerX 10.1.1.335.4681. doi:10.1093/cercor/bhj143. PMID 16495432.
- ^ Perry CJ, Zbukvic I, Kim JH, Lawrence AJ (October 2014). "Role of cues and contexts on drug-seeking behaviour". British Journal of Pharmacology. 171 (20): 4636–72. doi:10.1111/bph.12735. PMC 4209936. PMID 24749941.
- ^ أ ب ت Volkow ND, Fowler JS, Wang GJ, Swanson JM, Telang F (2007). "Dopamine in drug abuse and addiction: results of imaging studies and treatment implications". Arch. Neurol. 64 (11): 1575–79. doi:10.1001/archneur.64.11.1575. PMID 17998440.
- ^ "Drugs, Brains, and Behavior: The Science of Addiction". National Institute on Drug Abuse.
- ^ "Understanding Drug Abuse and Addiction". National Institute on Drug Abuse. November 2012. Archived from the original on 23 August 2011. Retrieved 12 February 2015.
- ^ أ ب ت Nestler EJ (October 2008). "Review. Transcriptional mechanisms of addiction: role of DeltaFosB". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 363 (1507): 3245–55. doi:10.1098/rstb.2008.0067. PMC 2607320. PMID 18640924.
Recent evidence has shown that ΔFosB also represses the c-fos gene that helps create the molecular switch – from the induction of several short-lived Fos family proteins after acute drug exposure to the predominant accumulation of ΔFosB after chronic drug exposure – cited earlier (Renthal et al. in press). The mechanism responsible for ΔFosB repression of c-fos expression is complex and is covered below. ...
Examples of validated targets for ΔFosB in nucleus accumbens ... GluR2 ... dynorphin ... Cdk5 ... NFκB ... c-Fos
Table 3 - ^ أ ب ت ث ج ح Berridge KC (April 2012). "From prediction error to incentive salience: mesolimbic computation of reward motivation". Eur. J. Neurosci. 35 (7): 1124–43. doi:10.1111/j.1460-9568.2012.07990.x. PMC 3325516. PMID 22487042.
Here I discuss how mesocorticolimbic mechanisms generate the motivation component of incentive salience. Incentive salience takes Pavlovian learning and memory as one input and as an equally important input takes neurobiological state factors (e.g. drug states, appetite states, satiety states) that can vary independently of learning. Neurobiological state changes can produce unlearned fluctuations or even reversals in the ability of a previously learned reward cue to trigger motivation. Such fluctuations in cue-triggered motivation can dramatically depart from all previously learned values about the associated reward outcome. ... Associative learning and prediction are important contributors to motivation for rewards. Learning gives incentive value to arbitrary cues such as a Pavlovian conditioned stimulus (CS) that is associated with a reward (unconditioned stimulus or UCS). Learned cues for reward are often potent triggers of desires. For example, learned cues can trigger normal appetites in everyone, and can sometimes trigger compulsive urges and relapse in individuals with addictions.
Cue-triggered 'wanting' for the UCS
A brief CS encounter (or brief UCS encounter) often primes a pulse of elevated motivation to obtain and consume more reward UCS. This is a signature feature of incentive salience.
Cue as attractive motivational magnets
When a Pavlovian CS+ is attributed with incentive salience it not only triggers 'wanting' for its UCS, but often the cue itself becomes highly attractive – even to an irrational degree. This cue attraction is another signature feature of incentive salience ... Two recognizable features of incentive salience are often visible that can be used in neuroscience experiments: (i) UCS-directed 'wanting' – CS-triggered pulses of intensified 'wanting' for the UCS reward; and (ii) CS-directed 'wanting' – motivated attraction to the Pavlovian cue, which makes the arbitrary CS stimulus into a motivational magnet. - ^ أ ب Malenka RC, Nestler EJ, Hyman SE (2009). Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 147–48, 366–67, 375–76. ISBN 978-0-07-148127-4.
VTA DA neurons play a critical role in motivation, reward-related behavior (Chapter 15), attention, and multiple forms of memory. This organization of the DA system, wide projection from a limited number of cell bodies, permits coordinated responses to potent new rewards. Thus, acting in diverse terminal fields, dopamine confers motivational salience ("wanting") on the reward itself or associated cues (nucleus accumbens shell region), updates the value placed on different goals in light of this new experience (orbital prefrontal cortex), helps consolidate multiple forms of memory (amygdala and hippocampus), and encodes new motor programs that will facilitate obtaining this reward in the future (nucleus accumbens core region and dorsal striatum). In this example, dopamine modulates the processing of sensorimotor information in diverse neural circuits to maximize the ability of the organism to obtain future rewards. ...
The brain reward circuitry that is targeted by addictive drugs normally mediates the pleasure and strengthening of behaviors associated with natural reinforcers, such as food, water, and sexual contact. Dopamine neurons in the VTA are activated by food and water, and dopamine release in the NAc is stimulated by the presence of natural reinforcers, such as food, water, or a sexual partner. ...
The NAc and VTA are central components of the circuitry underlying reward and memory of reward. As previously mentioned, the activity of dopaminergic neurons in the VTA appears to be linked to reward prediction. The NAc is involved in learning associated with reinforcement and the modulation of motoric responses to stimuli that satisfy internal homeostatic needs. The shell of the NAc appears to be particularly important to initial drug actions within reward circuitry; addictive drugs appear to have a greater effect on dopamine release in the shell than in the core of the NAc. ... If motivational drive is described in terms of wanting, and hedonic evaluation in terms of liking, it appears that wanting can be dissociated from liking and that dopamine may influence these phenomena differently. Differences between wanting and liking are confirmed in reports by humans with addictions, who state that their desire for drugs (wanting) increases with continued use even when pleasure (liking) decreases because of tolerance. - ^ أ ب ت ث Edwards, Scott (2016). "Reinforcement principles for addiction medicine; from recreational drug use to psychiatric disorder". Neuroscience for Addiction Medicine: From Prevention to Rehabilitation - Constructs and Drugs. Progress in Brain Research. Vol. 223. pp. 63–76. doi:10.1016/bs.pbr.2015.07.005. ISBN 978-0-444-63545-7. PMID 26806771.
An important dimension of reinforcement highly relevant to the addiction process (and particularly relapse) is secondary reinforcement (Stewart, 1992). Secondary reinforcers (in many cases also considered conditioned reinforcers) likely drive the majority of reinforcement processes in humans. In the specific case of drug addition, cues and contexts that are intimately and repeatedly associated with drug use will often themselves become reinforcing ... A fundamental piece of Robinson and Berridge's incentive-sensitization theory of addiction posits that the incentive value or attractive nature of such secondary reinforcement processes, in addition to the primary reinforcers themselves, may persist and even become sensitized over time in league with the development of drug addiction (Robinson and Berridge, 1993).
- ^ أ ب Berridge KC, Kringelbach ML (May 2015). "Pleasure systems in the brain". Neuron. 86 (3): 646–64. doi:10.1016/j.neuron.2015.02.018. PMC 4425246. PMID 25950633.
- ^ Traynor J (March 2012). "μ-Opioid receptors and regulators of G protein signaling (RGS) proteins: from a symposium on new concepts in mu-opioid pharmacology". Drug Alcohol Depend. 121 (3): 173–80. doi:10.1016/j.drugalcdep.2011.10.027. PMC 3288798. PMID 22129844.
- ^ أ ب ت ث ج ح خ د Walker DM, Cates HM, Heller EA, Nestler EJ (February 2015). "Regulation of chromatin states by drugs of abuse". Curr. Opin. Neurobiol. 30: 112–21. doi:10.1016/j.conb.2014.11.002. PMC 4293340. PMID 25486626.
Studies investigating general HDAC inhibition on behavioral outcomes have produced varying results but it seems that the effects are specific to the timing of exposure (either before, during or after exposure to drugs of abuse) as well as the length of exposure
- ^ Petry NM, Rehbein F, Gentile DA, Lemmens JS, Rumpf HJ, Mößle T, Bischof G, Tao R, Fung DS, Borges G, Auriacombe M, González Ibáñez A, Tam P, O'Brien CP (September 2014). "An international consensus for assessing internet gaming disorder using the new DSM-5 approach". Addiction. 109 (9): 1399–406. doi:10.1111/add.12457. PMID 24456155.
- ^ Torres G, Horowitz JM (1999). "Drugs of abuse and brain gene expression". Psychosom Med. 61 (5): 630–50. CiteSeerX 10.1.1.326.4903. doi:10.1097/00006842-199909000-00007. PMID 10511013.
- ^ Insel T. "Transforming Diagnosis". National Institute of Mental Health. Archived from the original on 29 May 2013. Retrieved 17 June 2015.
- ^ Hampton WH, Hanik I, Olson IR (2019). "Substance Abuse and White Matter: Findings, Limitations, and Future of Diffusion Tensor Imaging Research". Drug and Alcohol Dependence (in الإنجليزية). 197 (4): 288–298. doi:10.1016/j.drugalcdep.2019.02.005. PMC 6440853. PMID 30875650.
Despite this progress, our ability to predict, diagnose, and track addiction in humans based on brain images has been relatively limited. The difficulty elucidating such outcomes may be partly due to a relative dearth of research considering neural white matter, which constitutes over half of human brain volume and plays a vital role in governing communication between cortical areas (Fields, 2008). Diffusion mag- netic resonance imaging has emerged as a method to non-invasively examine white matter in the human brain and relate such connectivity to substance abuse and addictive behaviors (Suckling and Nestor, 2017)
- ^ Magnusson, D, D (1998). Theoretical Models of Human development. New York: John Wiley & sons. pp. 685–759.
- ^ أ ب ت Schlosser, Allison V. (September 2018). "'They Medicated Me Out': Social Flesh and Embodied Citizenship in Addiction Treatment". Contemporary Drug Problems. 45 (3): 188–207. doi:10.1177/0091450918781590. S2CID 149842084.
- ^ Wolfe, Daniel; Saucier, Roxanne (February 2021). "Biotechnologies and the future of opioid addiction treatments". International Journal of Drug Policy. 88: 103041. doi:10.1016/j.drugpo.2020.103041. PMID 33246267. S2CID 227191111.
- ^ Walter, M.; Dürsteler, K.; Petitjean, S.; Wiesbeck, G.; Euler, S.; Sollberger, D.; Lang, U.; Vogel, M. (20 April 2015). "Psychosoziale Behandlungen bei Suchterkrankungen – Suchtspezifische Psychotherapieformen und ihre Wirksamkeit" [Psychosocial Treatment of Addictive Disorders – An Overview of Psychotherapeutic Options and their Efficacy]. Fortschritte der Neurologie · Psychiatrie (in الألمانية). 83 (4): 201–210. doi:10.1055/s-0034-1399338. PMID 25893493.
- ^ Carroll ME, Smethells JR (February 2016). "Sex Differences in Behavioral Dyscontrol: Role in Drug Addiction and Novel Treatments". Front. Psychiatry. 6: 175. doi:10.3389/fpsyt.2015.00175. PMC 4745113. PMID 26903885.
Environmental Enrichment ...
In humans, non-drug rewards delivered in a contingency management (CM) format successfully reduced drug dependence ... In general, CM programs promote drug abstinence through a combination of positive reinforcement for drug-free urine samples. For instance, voucher-based reinforcement therapy in which medication compliance, therapy session attendance, and negative drug screenings reinforced with vouchers to local business (e.g., movie theater, restaurants, etc.) directly reinforces drug abstinence, provides competing reinforcers, enriches the environment, and it is a robust treatment across a broad range of abused drugs (189). ...
Physical Exercise
There is accelerating evidence that physical exercise is a useful treatment for preventing and reducing drug addiction ... In some individuals, exercise has its own rewarding effects, and a behavioral economic interaction may occur, such that physical and social rewards of exercise can substitute for the rewarding effects of drug abuse. ... The value of this form of treatment for drug addiction in laboratory animals and humans is that exercise, if it can substitute for the rewarding effects of drugs, could be self-maintained over an extended period of time. Work to date in [laboratory animals and humans] regarding exercise as a treatment for drug addiction supports this hypothesis. ... However, a RTC study was recently reported by Rawson et al. (226), whereby they used 8 weeks of exercise as a post-residential treatment for METH addiction, showed a significant reduction in use (confirmed by urine screens) in participants who had been using meth 18 days or less a month. ... Animal and human research on physical exercise as a treatment for stimulant addiction indicates that this is one of the most promising treatments on the horizon. [emphasis added] - ^ أ ب ت ث Lynch WJ, Peterson AB, Sanchez V, Abel J, Smith MA (September 2013). "Exercise as a novel treatment for drug addiction: a neurobiological and stage-dependent hypothesis". Neurosci Biobehav Rev. 37 (8): 1622–44. doi:10.1016/j.neubiorev.2013.06.011. PMC 3788047. PMID 23806439.
[exercise] efficacy may be related to its ability to normalize glutamatergic and dopaminergic signaling and reverse drug-induced changes in chromatin via epigenetic interactions with brain-derived neurotrophic factor (BDNF) in the reward pathway. ... these data show that exercise can affect dopaminergic signaling at many different levels, which may underlie its ability to modify vulnerability during drug use initiation. Exercise also produces neuroadaptations that may influence an individual's vulnerability to initiate drug use. Consistent with this idea, chronic moderate levels of forced treadmill running blocks not only subsequent methamphetamine-induced conditioned place preference, but also stimulant-induced increases in dopamine release in the NAc (Chen et al., 2008) and striatum (Marques et al., 2008). ... [These] findings indicate the efficacy of exercise at reducing drug intake in drug-dependent individuals ... wheel running [reduces] methamphetamine self-administration under extended access conditions (Engelmann et al., 2013) ... These findings suggest that exercise may "magnitude"-dependently prevent the development of an addicted phenotype possibly by blocking/reversing behavioral and neuro-adaptive changes that develop during and following extended access to the drug. ... Exercise has been proposed as a treatment for drug addiction that may reduce drug craving and risk of relapse. Although few clinical studies have investigated the efficacy of exercise for preventing relapse, the few studies that have been conducted generally report a reduction in drug craving and better treatment outcomes (see Table 4). ... Taken together, these data suggest that the potential benefits of exercise during relapse, particularly for relapse to psychostimulants, may be mediated via chromatin remodeling and possibly lead to greater treatment outcomes.
- ^ أ ب Linke SE, Ussher M (2015). "Exercise-based treatments for substance use disorders: evidence, theory, and practicality". Am J Drug Alcohol Abuse. 41 (1): 7–15. doi:10.3109/00952990.2014.976708. PMC 4831948. PMID 25397661.
The limited research conducted suggests that exercise may be an effective adjunctive treatment for SUDs. In contrast to the scarce intervention trials to date, a relative abundance of literature on the theoretical and practical reasons supporting the investigation of this topic has been published. ... numerous theoretical and practical reasons support exercise-based treatments for SUDs, including psychological, behavioral, neurobiological, nearly universal safety profile, and overall positive health effects.
- ^ أ ب Zhou Y, Zhao M, Zhou C, Li R (July 2015). "Sex differences in drug addiction and response to exercise intervention: From human to animal studies". Front. Neuroendocrinol. 40: 24–41. doi:10.1016/j.yfrne.2015.07.001. PMC 4712120. PMID 26182835.
Collectively, these findings demonstrate that exercise may serve as a substitute or competition for drug abuse by changing ΔFosB or cFos immunoreactivity in the reward system to protect against later or previous drug use. ... As briefly reviewed above, a large number of human and rodent studies clearly show that there are sex differences in drug addiction and exercise. The sex differences are also found in the effectiveness of exercise on drug addiction prevention and treatment, as well as underlying neurobiological mechanisms. The postulate that exercise serves as an ideal intervention for drug addiction has been widely recognized and used in human and animal rehabilitation. ... In particular, more studies on the neurobiological mechanism of exercise and its roles in preventing and treating drug addiction are needed.
- ^ Sachdeva, Ankur; Choudhary, M; Chandra, M (2015). "Alcohol Withdrawal Syndrome: Benzodiazepines and Beyond". Journal of Clinical and Diagnostic Research. 9 (9): VE01–VE07. doi:10.7860/JCDR/2015/13407.6538. PMC 4606320. PMID 26500991.
- ^ Soyka M, Roesner S (December 2006). "New pharmacological approaches for the treatment of alcoholism". Expert Opinion on Pharmacotherapy. 7 (17): 2341–53. doi:10.1517/14656566.7.17.2341. PMID 17109610. S2CID 2587029.
- ^ Pettinati HM, Rabinowitz AR (October 2006). "Choosing the right medication for the treatment of alcoholism". Current Psychiatry Reports. 8 (5): 383–88. doi:10.1007/s11920-006-0040-0. PMID 16968619. S2CID 39826013.
- ^ Bouza C, Angeles M, Magro A, Muñoz A, Amate JM (July 2004). "Efficacy and safety of naltrexone and acamprosate in the treatment of alcohol dependence: a systematic review". Addiction. 99 (7): 811–28. doi:10.1111/j.1360-0443.2004.00763.x. PMID 15200577.
- ^ Williams SH (November 2005). "Medications for treating alcohol dependence". American Family Physician. 72 (9): 1775–80. PMID 16300039.
- ^ Rösner S, Hackl-Herrwerth A, Leucht S, Vecchi S, Srisurapanont M, Soyka M (December 2010). Srisurapanont M (ed.). "Opioid antagonists for alcohol dependence". The Cochrane Database of Systematic Reviews (12): CD001867. doi:10.1002/14651858.CD001867.pub2. PMID 21154349.
- ^ Sofuoglu M, Sugarman DE, Carroll KM (April 2010). "Cognitive function as an emerging treatment target for marijuana addiction". Exp Clin Psychopharmacol. 18 (2): 109–19. doi:10.1037/a0019295. PMC 2909584. PMID 20384422.
Cannabis is the most widely used illicit substance in the world, and demand for effective treatment is increasing. However, abstinence rates following behavioral therapies have been modest, and there are no effective pharmacotherapies for the treatment of cannabis addiction.
- ^ Fratta W, Fattore L (August 2013). "Molecular mechanisms of cannabinoid addiction". Curr. Opin. Neurobiol. 23 (4): 487–92. doi:10.1016/j.conb.2013.02.002. PMID 23490548. S2CID 40849553.
14. Nguyen PT, Schmid CL, Raehal KM, Selley DE, Bohn LM, Sim-Selley LJ: b-Arrestin2 regulates cannabinoid CB1 receptor signaling and adaptation in a central nervous system region dependent manner. Biol Psychiatry 2012, 71:714–24.
A pioneering study revealing both positive and negative modulatory effects of beta-arrestin2 on THC tolerance. By demonstrating that tolerance to antinociception is reduced whereas tolerance to catalepsy is enhanced in beta-arrestin2 knockout mice, authors suggest that development of cannabinoid agonists that minimize interactions between CB1Rs and beta-arrestin2 might produce improved cannabinoid analgesics with reduced motor suppression, and be therapeutically beneficial. - ^ أ ب Garwood CL, Potts LA (2007). "Emerging pharmacotherapies for smoking cessation". Am J Health Syst Pharm. 64 (16): 1693–98. doi:10.2146/ajhp060427. PMID 17687057.
- ^ أ ب Crooks, Peter A.; Bardo, Michael T.; Dwoskin, Linda P. (2014). "Nicotinic Receptor Antagonists as Treatments for Nicotine Abuse". Emerging Targets & Therapeutics in the Treatment of Psychostimulant Abuse. Advances in Pharmacology. Vol. 69. pp. 513–551. doi:10.1016/B978-0-12-420118-7.00013-5. ISBN 978-0-12-420118-7. PMC 4110698. PMID 24484986.
- ^ Johnson RE, Chutuape MA, Strain EC, Walsh SL, Stitzer ML, Bigelow GE (November 2000). "A comparison of levomethadyl acetate, buprenorphine, and methadone for opioid dependence". The New England Journal of Medicine. 343 (18): 1290–7. doi:10.1056/NEJM200011023431802. PMID 11058673.
- ^ Connock M, Juarez-Garcia A, Jowett S, Frew E, Liu Z, Taylor RJ, et al. (March 2007). "Methadone and buprenorphine for the management of opioid dependence: a systematic review and economic evaluation". Health Technology Assessment. 11 (9): 1–171, iii–iv. doi:10.3310/hta11090. PMID 17313907.
- ^ Robertson JR, Raab GM, Bruce M, McKenzie JS, Storkey HR, Salter A (December 2006). "Addressing the efficacy of dihydrocodeine versus methadone as an alternative maintenance treatment for opiate dependence: A randomized controlled trial". Addiction. 101 (12): 1752–9. doi:10.1111/j.1360-0443.2006.01603.x. PMID 17156174.
- ^ Qin BY (1998). "Advances in dihydroetorphine: From analgesia to detoxification". Drug Development Research. 39 (2): 131–34. doi:10.1002/(SICI)1098-2299(199610)39:2<131::AID-DDR3>3.0.CO;2-Q.
- ^ Metrebian N, Shanahan W, Wells B, Stimson GV (June 1998). "Feasibility of prescribing injectable heroin and methadone to opiate-dependent drug users: associated health gains and harm reductions". The Medical Journal of Australia. 168 (12): 596–600. doi:10.5694/j.1326-5377.1998.tb141444.x. PMID 9673620. S2CID 43302721.
- ^ Metrebian N, Mott J, Carnwath Z, Carnwath T, Stimson GV, Sell L (2007). "Pathways into receiving a prescription for diamorphine (heroin) for the treatment of opiate dependence in the United kingdom". European Addiction Research. 13 (3): 144–7. doi:10.1159/000101550. PMID 17570910. S2CID 7397513.
- ^ Kenna GA, Nielsen DM, Mello P, Schiesl A, Swift RM (2007). "Pharmacotherapy of dual substance abuse and dependence". CNS Drugs. 21 (3): 213–37. doi:10.2165/00023210-200721030-00003. PMID 17338593. S2CID 25979050.
- ^ Strang J, McCambridge J, Best D, Beswick T, Bearn J, Rees S, Gossop M (May 2003). "Loss of tolerance and overdose mortality after inpatient opiate detoxification: follow up study". BMJ (Clinical Research Ed.). 326 (7396): 959–60. doi:10.1136/bmj.326.7396.959. PMC 153851. PMID 12727768.
- ^ Stoops WW, Rush CR (May 2014). "Combination pharmacotherapies for stimulant use disorder: a review of clinical findings and recommendations for future research". Expert Rev Clin Pharmacol. 7 (3): 363–74. doi:10.1586/17512433.2014.909283. PMC 4017926. PMID 24716825.
Despite concerted efforts to identify a pharmacotherapy for managing stimulant use disorders, no widely effective medications have been approved.
- ^ Perez-Mana C, Castells X, Torrens M, Capella D, Farre M (September 2013). "Efficacy of psychostimulant drugs for amphetamine abuse or dependence". Cochrane Database Syst. Rev. 9 (9): CD009695. doi:10.1002/14651858.CD009695.pub2. PMID 23996457.
To date, no pharmacological treatment has been approved for [addiction], and psychotherapy remains the mainstay of treatment. ... Results of this review do not support the use of psychostimulant medications at the tested doses as a replacement therapy
- ^ Forray A, Sofuoglu M (February 2014). "Future pharmacological treatments for substance use disorders". Br. J. Clin. Pharmacol. 77 (2): 382–400. doi:10.1111/j.1365-2125.2012.04474.x. PMC 4014020. PMID 23039267.
- ^ أ ب Grandy DK, Miller GM, Li JX (February 2016). ""TAARgeting Addiction" – The Alamo Bears Witness to Another Revolution: An Overview of the Plenary Symposium of the 2015 Behavior, Biology and Chemistry Conference". Drug Alcohol Depend. 159: 9–16. doi:10.1016/j.drugalcdep.2015.11.014. PMC 4724540. PMID 26644139.
When considered together with the rapidly growing literature in the field a compelling case emerges in support of developing TAAR1-selective agonists as medications for preventing relapse to psychostimulant abuse.
- ^ أ ب Jing L, Li JX (August 2015). "Trace amine-associated receptor 1: A promising target for the treatment of psychostimulant addiction". Eur. J. Pharmacol. 761: 345–52. doi:10.1016/j.ejphar.2015.06.019. PMC 4532615. PMID 26092759.
Taken together, the data reviewed here strongly support that TAAR1 is implicated in the functional regulation of monoaminergic systems, especially dopaminergic system, and that TAAR1 serves as a homeostatic "brake" system that is involved in the modulation of dopaminergic activity. Existing data provided robust preclinical evidence supporting the development of TAAR1 agonists as potential treatment for psychostimulant abuse and addiction. ... Given that TAAR1 is primarily located in the intracellular compartments and existing TAAR1 agonists are proposed to get access to the receptors by translocation to the cell interior (Miller, 2011), future drug design and development efforts may need to take strategies of drug delivery into consideration (Rajendran et al., 2010).
- ^ أ ب Liu JF, Li JX (December 2018). "Drug addiction: a curable mental disorder?". Acta Pharmacologica Sinica. 39 (12): 1823–1829. doi:10.1038/s41401-018-0180-x. PMC 6289334. PMID 30382181.
- ^ أ ب ت Zalewska-Kaszubska J (November 2015). "Is immunotherapy an opportunity for effective treatment of drug addiction?". Vaccine. 33 (48): 6545–51. doi:10.1016/j.vaccine.2015.09.079. PMID 26432911.
- ^ Laudenbach M, Baruffaldi F, Vervacke JS, Distefano MD, Titcombe PJ, Mueller DL, Tubo NJ, Griffith TS, Pravetoni M (June 2015). "The frequency of naive and early-activated hapten-specific B cell subsets dictates the efficacy of a therapeutic vaccine against prescription opioid abuse". J. Immunol. 194 (12): 5926–36. doi:10.4049/jimmunol.1500385. PMC 4458396. PMID 25972483.
Translation of therapeutic vaccines for addiction, cancer, or other chronic noncommunicable diseases has been slow because only a small subset of immunized subjects achieved effective Ab levels.
- ^ Painter A. (2019) "Researchers working to develop vaccines to fight opioid addiction" Vtnews.vt.edu
- ^ أ ب ت ث Cao DN, Shi JJ, Hao W, Wu N, Li J (March 2016). "Advances and challenges in pharmacotherapeutics for amphetamine-type stimulants addiction". Eur. J. Pharmacol. 780: 129–35. doi:10.1016/j.ejphar.2016.03.040. PMID 27018393.
- ^ أ ب Moeller SJ, London ED, Northoff G (February 2016). "Neuroimaging markers of glutamatergic and GABAergic systems in drug addiction: Relationships to resting-state functional connectivity". Neurosci Biobehav Rev. 61: 35–52. doi:10.1016/j.neubiorev.2015.11.010. PMC 4731270. PMID 26657968.
- ^ Agabio R, Colombo G (April 2015). "[GABAB receptor as therapeutic target for drug addiction: from baclofen to positive allosteric modulators]". Psychiatr. Pol. (in البولندية). 49 (2): 215–23. doi:10.12740/PP/33911. PMID 26093587.
- ^ Filip M, Frankowska M, Sadakierska-Chudy A, Suder A, Szumiec L, Mierzejewski P, Bienkowski P, Przegaliński E, Cryan JF (January 2015). "GABAB receptors as a therapeutic strategy in substance use disorders: focus on positive allosteric modulators". Neuropharmacology. 88: 36–47. doi:10.1016/j.neuropharm.2014.06.016. PMID 24971600. S2CID 207229988.
- ^ أ ب McCowan TJ, Dhasarathy A, Carvelli L (February 2015). "The Epigenetic Mechanisms of Amphetamine". J. Addict. Prev. 2015 (Suppl 1). PMC 4955852. PMID 27453897.
Epigenetic modifications caused by addictive drugs play an important role in neuronal plasticity and in drug-induced behavioral responses. Although few studies have investigated the effects of AMPH on gene regulation (Table 1), current data suggest that AMPH acts at multiple levels to alter histone/DNA interaction and to recruit transcription factors which ultimately cause repression of some genes and activation of other genes. Importantly, some studies have also correlated the epigenetic regulation induced by AMPH with the behavioral outcomes caused by this drug, suggesting therefore that epigenetics remodeling underlies the behavioral changes induced by AMPH. If this proves to be true, the use of specific drugs that inhibit histone acetylation, methylation or DNA methylation might be an important therapeutic alternative to prevent and/or reverse AMPH addiction and mitigate the side effects generate by AMPH when used to treat ADHD.
- ^ أ ب Primary references involving sodium butyrate:
• Kennedy PJ, Feng J, Robison AJ, Maze I, Badimon A, Mouzon E, Chaudhury D, Damez-Werno DM, Haggarty SJ, Han MH, Bassel-Duby R, Olson EN, Nestler EJ (April 2013). "Class I HDAC inhibition blocks cocaine-induced plasticity by targeted changes in histone methylation". Nat. Neurosci. 16 (4): 434–40. doi:10.1038/nn.3354. PMC 3609040. PMID 23475113.While acute HDAC inhibition enhances the behavioral effects of cocaine or amphetamine1,3,4,13,14, studies suggest that more chronic regimens block psychostimulant-induced plasticity3,5,11,12. ... The effects of pharmacological inhibition of HDACs on psychostimulant-induced plasticity appear to depend on the timecourse of HDAC inhibition. Studies employing co-administration procedures in which inhibitors are given acutely, just prior to psychostimulant administration, report heightened behavioral responses to the drug1,3,4,13,14. In contrast, experimental paradigms like the one employed here, in which HDAC inhibitors are administered more chronically, for several days prior to psychostimulant exposure, show inhibited expression3 or decreased acquisition of behavioral adaptations to drug5,11,12. The clustering of seemingly discrepant results based on experimental methodologies is interesting in light of our present findings. Both HDAC inhibitors and psychostimulants increase global levels of histone acetylation in NAc. Thus, when co-administered acutely, these drugs may have synergistic effects, leading to heightened transcriptional activation of psychostimulant-regulated target genes. In contrast, when a psychostimulant is given in the context of prolonged, HDAC inhibitor-induced hyperacetylation, homeostatic processes may direct AcH3 binding to the promoters of genes (e.g., G9a) responsible for inducing chromatin condensation and gene repression (e.g., via H3K9me2) in order to dampen already heightened transcriptional activation. Our present findings thus demonstrate clear cross talk among histone PTMs and suggest that decreased behavioral sensitivity to psychostimulants following prolonged HDAC inhibition might be mediated through decreased activity of HDAC1 at H3K9 KMT promoters and subsequent increases in H3K9me2 and gene repression.
• Simon-O'Brien E, Alaux-Cantin S, Warnault V, Buttolo R, Naassila M, Vilpoux C (July 2015). "The histone deacetylase inhibitor sodium butyrate decreases excessive ethanol intake in dependent animals". Addict Biol. 20 (4): 676–89. doi:10.1111/adb.12161. PMID 25041570. S2CID 28667144.Altogether, our results clearly demonstrated the efficacy of NaB in preventing excessive ethanol intake and relapse and support the hypothesis that HDACi may have a potential use in alcohol addiction treatment.
• Castino MR, Cornish JL, Clemens KJ (April 2015). "Inhibition of histone deacetylases facilitates extinction and attenuates reinstatement of nicotine self-administration in rats". PLOS ONE. 10 (4): e0124796. Bibcode:2015PLoSO..1024796C. doi:10.1371/journal.pone.0124796. PMC 4399837. PMID 25880762.treatment with NaB significantly attenuated nicotine and nicotine + cue reinstatement when administered immediately ... These results provide the first demonstration that HDAC inhibition facilitates the extinction of responding for an intravenously self-administered drug of abuse and further highlight the potential of HDAC inhibitors in the treatment of drug addiction.
- ^ Kyzar EJ, Pandey SC (August 2015). "Molecular mechanisms of synaptic remodeling in alcoholism". Neurosci. Lett. 601: 11–19. doi:10.1016/j.neulet.2015.01.051. PMC 4506731. PMID 25623036.
Increased HDAC2 expression decreases the expression of genes important for the maintenance of dendritic spine density such as BDNF, Arc, and NPY, leading to increased anxiety and alcohol-seeking behavior. Decreasing HDAC2 reverses both the molecular and behavioral consequences of alcohol addiction, thus implicating this enzyme as a potential treatment target (Fig. 3). HDAC2 is also crucial for the induction and maintenance of structural synaptic plasticity in other neurological domains such as memory formation [115]. Taken together, these findings underscore the potential usefulness of HDAC inhibition in treating alcohol use disorders ... Given the ability of HDAC inhibitors to potently modulate the synaptic plasticity of learning and memory [118], these drugs hold potential as treatment for substance abuse-related disorders. ... Our lab and others have published extensively on the ability of HDAC inhibitors to reverse the gene expression deficits caused by multiple models of alcoholism and alcohol abuse, the results of which were discussed above [25,112,113]. This data supports further examination of histone modifying agents as potential therapeutic drugs in the treatment of alcohol addiction ... Future studies should continue to elucidate the specific epigenetic mechanisms underlying compulsive alcohol use and alcoholism, as this is likely to provide new molecular targets for clinical intervention.
- ^ Kheirabadi GR, Ghavami M, Maracy MR, Salehi M, Sharbafchi MR (2016). "Effect of add-on valproate on craving in methamphetamine depended patients: A randomized trial". Advanced Biomedical Research. 5: 149. doi:10.4103/2277-9175.187404. PMC 5025910. PMID 27656618.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ "Gene Therapy For Addiction: Flooding Brain With 'Pleasure Chemical' Receptors Works On Cocaine, As On Alcohol".
- ^ "Gene Transfer Therapy for Cocaine Addiction Passes Tests in Animals". National Institute on Drug Abuse. 14 January 2016.
- ^ Murthy V, Gao Y, Geng L, LeBrasseur NK, White TA, Parks RJ, Brimijoin S (2014). "Physiologic and metabolic safety of butyrylcholinesterase gene therapy in mice". Vaccine. 32 (33): 4155–62. doi:10.1016/j.vaccine.2014.05.067. PMC 4077905. PMID 24892251.
- ^ "Using Adeno-Associated Virus (AAV) Mediated Sustained Expression of an Anti-methamphetamine Antibody Fragment to Alter Methamphetamine Disposition in Mice" (PDF). Archived from the original (PDF) on 3 March 2018. Retrieved 25 June 2017.
- ^ "ATTC – Addiction Science Made Easy". www.attcnetwork.org. Archived from the original on 27 September 2018. Retrieved 25 June 2017.
- ^ Chen, Chiao-Chicy; Yin, Shih-Jiun (January 2008). "Alcohol abuse and related factors in Asia". International Review of Psychiatry. 20 (5): 425–433. doi:10.1080/09540260802344075. PMID 19012127. S2CID 24571763.
- ^ Mak, Kwok-Kei; Lai, Ching-Man; Watanabe, Hiroko; Kim, Dong-Il; Bahar, Norharlina; Ramos, Milen; Young, Kimberly S.; Ho, Roger C.M.; Aum, Na-Rae; Cheng, Cecilia (November 2014). "Epidemiology of Internet Behaviors and Addiction Among Adolescents in Six Asian Countries". Cyberpsychology, Behavior, and Social Networking. 17 (11): 720–728. doi:10.1089/cyber.2014.0139. PMID 25405785.
- ^ Slade T, Johnston A, Teesson M, Whiteford H, Burgess P, Pirkis J, Saw S (May 2009). "The Mental Health of Australians 2: Substance Use Disorders in Australia" (PDF). Department of Health and Ageing, Canberra.
- ^ Peacock, Amy; Leung, Janni; Larney, Sarah; Colledge, Samantha; Hickman, Matthew; Rehm, Jürgen; Giovino, Gary A.; West, Robert; Hall, Wayne; Griffiths, Paul; Ali, Robert; Gowing, Linda; Marsden, John; Ferrari, Alize J.; Grebely, Jason; Farrell, Michael; Degenhardt, Louisa (October 2018). "Global statistics on alcohol, tobacco and illicit drug use: 2017 status report". Addiction. 113 (10): 1905–1926. doi:10.1111/add.14234. PMID 29749059. S2CID 13674349.
- ^ Manubay JM, Muchow C, Sullivan MA (March 2011). "Prescription drug abuse: epidemiology, regulatory issues, chronic pain management with narcotic analgesics". Primary Care. 38 (1): 71–90. doi:10.1016/j.pop.2010.11.006. PMC 3328297. PMID 21356422.
- ^ أ ب ت ث Volkow N (31 March 2016). "A Major Step Forward for Addiction Medicine". National Institute on Drug Abuse. National Institutes of Health. Retrieved 3 April 2016.
Only about 10 percent of the 21 million Americans who meet the need for care for an alcohol or drug use disorder receive any form of treatment, and much of the treatment available does not meet standards for evidence-based care. There are many attitudinal and systemic reasons for this treatment gap, including stigma against treating people with addictions and institutional barriers to providing or funding addiction treatment. ... A major milestone was reached on March 14, 2016, when the American Board of Medical Specialties (ABMS) formally announced recognition of the field of Addiction Medicine as a medical subspecialty. ... In a statement issued to mark this milestone, ABAM President Robert J. Sokol summed up its significance: 'This landmark event, more than any other, recognizes addiction as a preventable and treatable disease, helping to shed the stigma that has long plagued it. It sends a strong message to the public that American medicine is committed to providing expert care for this disease and services designed to prevent the risky substance use that precedes it.'
- ^ Gramlich J (26 October 2017). "Nearly half of Americans have a family member or close friend who's been addicted to drugs". Pew Research Center. Retrieved 14 January 2018.
- ^ "We were addicted to their pill, but they were addicted to the money". The Washington Post (in الإنجليزية). Retrieved 22 July 2019.
- ^ World Drug Report 2012 (PDF). United Nations. June 2012. ISBN 978-92-1-148267-6.
{{cite book}}:|work=ignored (help) - ^ Pacurucu-Castillo SF, Ordóñez-Mancheno JM, Hernández-Cruz A, Alarcón RD (April 2019). "World opioid and substance use epidemic: a Latin American perspective". Psychiatric Research and Clinical Practice. 1 (1): 32–8. doi:10.1176/appi.prcp.20180009.
- ^ Fehrman E, Egan V, Gorban AN, Levesley J, Mirkes EM, Muhammad AK (2019). Personality Traits and Drug Consumption. A Story Told by Data. Springer, Cham. arXiv:2001.06520. doi:10.1007/978-3-030-10442-9. ISBN 978-3-030-10441-2. S2CID 151160405.
- ^ Cheetham A, Allen NB, Yücel M, Lubman DI (August 2010). "The role of affective dysregulation in drug addiction". Clin Psychol Rev. 30 (6): 621–34. doi:10.1016/j.cpr.2010.04.005. PMID 20546986.
- ^ Franken IH, Muris P (2006). "BIS/BAS personality characteristics and college students' substance use". Personality and Individual Differences. 40 (7): 1497–503. doi:10.1016/j.paid.2005.12.005.
- ^ Genovese JE, Wallace D (December 2007). "Reward sensitivity and substance abuse in middle school and high school students". J Genet Psychol. 168 (4): 465–69. doi:10.3200/GNTP.168.4.465-469. PMID 18232522. S2CID 207640075.
- ^ Kimbrel NA, Nelson-Gray RO, Mitchell JT (April 2007). "Reinforcement sensitivity and maternal style as predictors of psychopathology". Personality and Individual Differences. 42 (6): 1139–49. doi:10.1016/j.paid.2006.06.028.
- ^ Dawe S, Loxton NJ (May 2004). "The role of impulsivity in the development of substance use and eating disorders". Neurosci Biobehav Rev. 28 (3): 343–51. doi:10.1016/j.neubiorev.2004.03.007. PMID 15225976. S2CID 24435589.
- ^ jetcopter
- ^ Online Etymology Dictionary : alcohol
قراءات إضافية
- Szalavitz M (2016). Unbroken Brain. St. Martin's Press. ISBN 978-1-250-05582-8.
وصلات خارجية
| Classification |
|
|---|---|
| External resources |
- "The Science of Addiction: Genetics and the Brain". learn.genetics.utah.edu. Learn.Genetics – University of Utah.
- Why do our brains get addicted? – a TEDMED 2014 talk by Nora Volkow، the director of the National Institute on Drug Abuse at NIH.
- Gordon, Harold W. (April 2016). "Laterality of Brain Activation for Risk Factors of Addiction". Current Drug Abuse Reviews. 9 (1): 1–18. doi:10.2174/1874473709666151217121309. PMC 4811731. PMID 26674074.
Kyoto Encyclopedia of Genes and Genomes (KEGG) signal transduction pathways:
- مقالات فيها عبارات متقادمة منذ 2018
- جميع المقالات التي فيها عبارات متقادمة
- CS1 errors: empty citation
- CS1 maint: unflagged free DOI
- CS1 الألمانية-language sources (de)
- CS1 البولندية-language sources (pl)
- CS1 errors: periodical ignored
- الصفحات بخصائص غير محلولة
- Short description is different from Wikidata
- Articles with hatnote templates targeting a nonexistent page
- Articles containing إنگليزية-language text
- Pages using Lang-xx templates
- نطاق جغرافي مبهم from December 2020
- Articles to be expanded from August 2015
- All articles to be expanded
- Articles to be expanded from June 2018
- مقالات فيها عبارات متقادمة منذ 2010
- مقالات فيها عبارات متقادمة منذ May 2014
- Articles to be expanded from April 2016
- مقالات فيها عبارات متقادمة منذ November 2015
- مقالات فيها عبارات متقادمة منذ 2016
- إدمان
- إدمان سلوكي
- اضطرابات المخ
- اضطرابات متعلقة بالمواد