نقل عصبي
النقل العصبي (لاتيني: ممر الإرسال ، العبور "من المرسل " الإرسال ، السماح بالمرور ") هو العملية التي يتم من خلالها إطلاق جزيئات الإشارة المسماة بالناقلات العصبية بواسطة النهاية المحورية للخلايا العصبية (العصبون قبل المشبكي) ، والارتباط والتفاعل مع مستقبلات على تغصنات عصبون آخر (العصبون بعد المشبكي) على مسافة قصيرة. تحدث عملية مماثلة في النقل العصبي الرجعي ، حيث تطلق التغصنات للخلايا العصبية ما بعد المشبكي نواقل عصبية رجعية (على سبيل المثال ، كانابينويد ؛ تم تصنيعها استجابة لارتفاع مستويات الكالسيوم داخل الخلايا ) التي تشير من خلال المستقبلات الموجودة على النهاية المحورية للخلايا العصبية قبل المشبكي ، بشكل رئيسي في مشابك حمض الغاما-أمينوبيوتيريك و حمض الجلوتاميك[1][2][3][4]
يتم تنظيم النقل العصبي من خلال عدة عوامل مختلفة: توافر ومعدل تخليق الناقل العصبي ، وإطلاق هذا الناقل العصبي ، والنشاط الأساسي لخلية ما بعد المشبكي ، وعدد مستقبلات ما بعد المشبكي المتاحة للارتباط بالناقل العصبي ، والإزالة اللاحقة أو إلغاء تنشيط الناقل العصبي بواسطة الإنزيمات أو امتصاصه قبل المشبكي.[5][6]
استجابة لعتبة كمونات الفعلل أو الجهد الكهربائي المتدرج ، يتم اطلاق الناقل العصبي في النهاية ماقبل المشبكية . قد يتحرك الناقل العصبي الذي تم إطلاقه عبر المشبك ليتم اكتشافه بواسطة المستقبلات الموجودة في العصبون ما بعد المشبكي والارتباط بها. قد يؤثر ارتباط الناقلات العصبية على الخلايا العصبية بعد المشبكية إما بطريقة مثبطة أو مثيرة . يمكن أن يؤدي ارتباط النواقل العصبية بالمستقبلات في الخلايا العصبية ما بعد المشبكية إما إلى تغييرات قصيرة المدى ، مثل التغيرات في جهود الغشاء التي تسمى جهود (كمونات) ما بعد المشبكي ، أو التغييرات طويلة المدى عن طريق تنشيط تحويل الإشارة .
تشكل الخلايا العصبية شبكات عصبية بيولوجية معقدة تنتقل من خلالها النبضات العصبية (كمون الفعل). لا تلمس الخلايا العصبية بعضها البعض (إلا في حالة المشبك الكهربائي من خلال موصل فجوة ) ؛ بدلاً من ذلك ، تتفاعل الخلايا العصبية عند نقاط اتصال قريبة تسمى نقاط الاشتباك العصبي. ينقل العصبون معلوماته عن طريق كمون فعل. عندما يصل النبض العصبي إلى المشبك ، فقد يتسبب ذلك في إطلاق نواقل عصبية تؤثر على عصبون آخر (ما بعد المشبكي). قد تتلقى الخلايا العصبية بعد المشبكي مدخلات من العديد من الخلايا العصبية الإضافية ، سواء الإثارة أو المثبطة. يتم تلخيص التأثيرات الاستثارية والمثبطة ، وإذا كان التأثير الصافي مثبطًا ، فسيقل احتمال إطلاق العصبون (أي توليد كمون فعل) ، وإذا كان التأثير الصافي مثيرًا ، فسيكون من المرجح أن يطلق. يعتمد مدى احتمالية إطلاق العصبون على مدى تواجد جهد الغشاء عن جهد العتبة ، والجهد الذي يتم عنده تشغيل جهد الفعل بسبب تنشيط قنوات صوديوم كافية تعتمد على الجهد بحيث يتجاوز صافي تيار الصوديوم الداخلي جميع التيارات الخارجية.[7] تقرب المدخلات المثيرة الخلايا العصبية من العتبة ، في حين أن المدخلات المثبطة تجعل العصبون بعيدًا عن العتبة. كمون الفعل هي حدث "الكل أو لا شيء" ؛ لن تنطلق الخلايا العصبية التي لم تصل أغشيتها إلى العتبة ، بينما يجب أن تطلق تلك التي تفعل ذلك. بمجرد بدء كمون الفعل (تقليديا عند بروز المحوار ) ، سوف تنتشر على طول المحور العصبي ، مما يؤدي إلى إطلاق النواقل العصبية في الحبة المشبكية لتمرير المعلومات إلى خلية عصبية مجاورة أخرى..
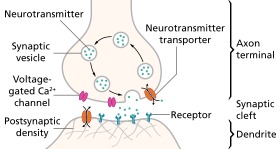
مراحل النقل العصبي على المشبك
- تخليق الناقل العصبي. يمكن أن يحدث هذا في جسم الخلية أو في محور عصبي أو في طرف المحور العصبي .
- تخزين الناقل العصبي في حبيبات التخزين أو الحويصلات في النهاية المحورية.
- يدخل الكالسيوم إلى النهاية المحورية أثناء كمون الفعل ، مما يتسبب في إطلاق الناقل العصبي في الشق المشبكي.
- بعد إطلاقه ، يرتبط المرسل بمستقبل في الغشاء ما بعد المشبكي وينشطه.
- تعطيل الناقل العصبي. إما أن يتم تدمير الناقل العصبي إنزيميًا ، أو يتم إعادته إلى الطرف الذي أتى منه ، حيث يمكن إعادة استخدامه ، أو تدهوره وإزالته.[8]
وصف عام
يتم تعبئة الناقلات العصبية تلقائيًا في حويصلات ويتم إطلاقها في حزم الكم فردية مستقلة عن كمونات الفعل قبل المشبكي. هذا الإصدار البطيء يمكن اكتشافه وينتج تأثيرات مثبطة دقيقة أو إثارة دقيقة على الخلايا العصبية بعد المشبكية. يقوم كمون الفعل بتضخيم هذه العملية لفترة وجيزة. يتجمع الناقل العصبي الذي يحتوي على حويصلات حول المواقع النشطة ، وبعد إطلاقه يمكن إعادة تدويره بواحدة من ثلاث آليات مقترحة. تتضمن الآلية المقترحة الأولى فتحًا جزئيًا للحويصلة ثم إعادة إغلاقها. يتضمن النوعان الثانيان الاندماج الكامل للحويصلة مع الغشاء ، متبوعًا بإعادة التدوير أو إعادة التدوير في الجسيم الداخلي. الاندماج الحويصلي مدفوع إلى حد كبير بتركيز الكالسيوم في النطاقات الدقيقة الموجودة بالقرب من قنوات الكالسيوم ، مما يسمح فقط بالميكروثانية لإطلاق الناقل العصبي ، بينما تستغرق العودة إلى تركيز الكالسيوم الطبيعي بضع مئات من الميكروثانية. يُعتقد أن خروج الخلايا الحويصلة ناتج عن مركب بروتيني يسمى SNARE ، وهو الهدف لذيفان الوشيقية . بمجرد إطلاقه ، يدخل ناقل عصبي في المشبك ويواجه مستقبلات. يمكن أن تكون مستقبلات الناقلات العصبية إما موجه بالايونات أومقترنة بالبروتين G. تسمح مستقبلات الموجه للأيونات بالمرور عندما تتستثار بواسطة مركب كيميائي. يتضمن النموذج الرئيسي مستقبلًا يتكون من وحدات فرعية متعددة تسمح بتنسيق تفضيل الأيونات. المستقبلات المقترنة بالبروتين G ، والتي تسمى أيضًا المستقبلات الأيضية ، عند ارتباطها بالرابط تخضع لتغيرات توافقية تؤدي إلى الاستجابة داخل الخلايا. عادة ما يتم إنهاء نشاط الناقل العصبي بواسطة ناقل ، ومع ذلك فإن التعطيل الأنزيمي يكون مقبولًا أيضًا..[9]
التراكم
كل خلية عصبية تتصل بالعديد من الخلايا العصبية الأخرى ، وتتلقى العديد من النبضات منها. التجميع (التراكم) هو جمع هذه النبضات معًا عند بروز المحوار. إذا كان العصبون يحصل فقط على نبضات مثيرة ، فإنه سيولد كمون فعل. إذا كانت الخلايا العصبية تحصل بدلاً من ذلك على نفس عدد النبضات المثبطة ، فإن التثبيط يلغي الإثارة وسيتوقف التدفع العصبي عند هذا الحد.[10] يتناسب توليد كمون الفعل مع احتمالية ونمط إطلاق الناقل العصبي ، وتحسس مستقبلات ما بعد المشبكي.[11][12][13]
الجمع الحيزي يعني أن تأثيرات النبضات المتلقاة في أماكن مختلفة على الخلايا العصبية تتراكم ، بحيث يمكن للخلايا العصبية أن تشتعل عندما يتم تلقي مثل هذه النبضات في وقت واحد ، حتى لو لم يكن كل نبضة من تلقاء نفسها كافية لإحداث إطلاق.
الجمع الزمني يعني أن تأثيرات النبضات المستلمة في نفس المكان يمكن أن تتراكم إذا تم تلقي النبضات (التدفعات) في تتابع زمني قريب. وبالتالي ، يمكن للخلايا العصبية أن يطلق الناقلات عند تلقي نبضات متعددة ، حتى لو لم تكن كل نبضة بمفردها كافية للتسبب في إطلاق النبضات.[14]
التقارب والتباعد
يشير النقل العصبي إلى كل من التقارب والاختلاف في المعلومات. أول خلية عصبية واحدة تتأثر بالعديد من الخلايا الأخرى ، مما يؤدي إلى تقارب المدخلات. عندما العصبون يطلق اشاراته ، يتم إرسال الإشارة إلى العديد من الخلايا العصبية الأخرى ، مما يؤدي إلى تباعد الإخر. تتأثر العديد من الخلايا العصبية الأخرى بهذه العصبون.[citation needed]
النقل المشترك
النقل المشترك هو اطلاق عدة أنواع من الناقلات العصبية من واحد الأعصاب الطرفية .
في الطرف العصبي ، توجد الناقلات العصبية داخل حويصلات مغلفة بغشاء 35-50 نانومتر تسمى الحويصلات المشبكية. لإطلاق النواقل العصبية ، تلتحم الحويصلات المشبكية وتندمج بشكل عابر في قاعدة بنى بروتين دهني متخصصة على شكل كوب 10-15 نانومتر في الغشاء قبل المشبكي المسمى بوروسوم.[15] Tتم حل بروتين بوروسوم بروتيوم الخلايا العصبية ، مما يوفر البنية الجزيئية والتركيب الكامل للآلة.[16]
أظهرت الدراسات الحديثة في عدد لا يحصى من الأنظمة أن معظم ، إن لم يكن كل ، الخلايا العصبية تطلق العديد من الرسائل الكيميائية المختلفة.[17] يسمح النقل المشترك بتأثيرات أكثر تعقيدًا في مستقبلات ما بعد المشبكي ، وبالتالي يسمح بإجراء اتصالات أكثر تعقيدًا بين الخلايا العصبية..
في علم الأعصاب الحديث ، غالبًا ما تُصنف الخلايا العصبية بواسطة ناقلها المشترك. على سبيل المثال ، تستخدم "الخلايا العصبية GABAergic" المخططة الببتيدات الأفيونية أو المادة P كناقلها المشترك الأساسي.
يمكن لبعض الخلايا العصبية أن تطلق ما لا يقل عن اثنين من الناقلات العصبية في نفس الوقت ، والآخر هو ناقل مشترك ، من أجل توفير ردود الفعل السلبية المستقرة المطلوبة للتشفير الهادف ، في غياب الخلايا العصبية البينية الداخلية المثبطة.[18] الامثله تشمل:
- -الإطلاق المشترك عن حمض الغاما-أمينوبيوتيريك- الجلايسين .
- الإطلاق المشترك عن الدوبامين- الجلوتامات .
- الإطلاق المشترك. عن أستايلكولين (Ach) - غلوتامات
- الاطلاق المشترك عن أستايلكولين- الببتيد المعوي الفعال وعائياً (VIP).
- الاطلاق المشترك عنأستايلكولين- ببتيد مرتبط بجين الكالسيتونين (CGRP).
- الإطلاق المشترك عن الجلوتامات والدينورفين (في الحـُصين ).
- نورإپينفرين و ثلاثي فوسفات الأدنوسين هما ناقلان مشتركان للجهاز العصبي الودي . لقد وجد أن قنبيات اناداميد و القنبيات ، WIN 55،212- ، 2 يمكن أن يعدلا الاستجابة العامة لتحفيز العصب الودي ، ويشير إلى أن مستقبلات CB1 السابقة للوظائف تتحكم في العمل التثبيطي الودي . وهكذا يمكن للقنب أن يثبط كلا من مكونات النورأدرينالية والبيورينرجيك من النقل العصبي الودي.[19]
زوج واحد غير معتاد من الناقلات المشتركة هو GABA والغلوتامات التي يتم إطلاقها من نفس المحاور العصبية للخلايا العصبية الناشئة من المنطقة السقيفية البطنية (VTA) ، والكرة الشاحبة الداخلية ، والنواة فوق الثديية ..[20] المشروعان السابقان للعنان بينما من المعروف أن النتوءات من النواة فوق الثديية تستهدف التلفيف المسنن للحصين
.[20]
الارتباط الجيني
يرتبط النقل العصبي وراثيًا بخصائص أو ميزات أخرى. على سبيل المثال ، أدت تحليلات الإغناء لمسارات الإشارات المختلفة إلى اكتشاف ارتباط وراثي بالحجم داخل الجمجمة.[21]
انظر أيضاً
- Autoreceptor
- نموذج خلية عصبية بيولوجية والنقل المشبكي العصبي
- Electrophysiology
- G protein-coupled receptor
- Molecular neuropharmacology
- Neuromuscular transmission
- Neuropsychopharmacology
المصادر
- ^ Melis M, Pistis M (December 2007). "Endocannabinoid signaling in midbrain dopamine neurons: more than physiology?". Current Neuropharmacology. 5 (4): 268–77. doi:10.2174/157015907782793612. PMC 2644494. PMID 19305743.
Thus, it is conceivable that low levels of CB1 receptors are located on glutamatergic and GABAergic terminals impinging on DA neurons [127, 214], where they can fine-tune the release of inhibitory and excitatory neurotransmitter and regulate DA neuron firing.
Consistently, in vitro electrophysiological experiments from independent laboratories have provided evidence of CB1 receptor localization on glutamatergic and GABAergic axon terminals in the VTA and SNc. - ^ Flores A, Maldonado R, Berrendero F (December 2013). "Cannabinoid-hypocretin cross-talk in the central nervous system: what we know so far". Frontiers in Neuroscience. 7: 256. doi:10.3389/fnins.2013.00256. PMC 3868890. PMID 24391536.
Direct CB1-HcrtR1 interaction was first proposed in 2003 (Hilairet et al., 2003). Indeed, a 100-fold increase in the potency of hypocretin-1 to activate the ERK signaling was observed when CB1 and HcrtR1 were co-expressed ... In this study, a higher potency of hypocretin-1 to regulate CB1-HcrtR1 heteromer compared with the HcrtR1-HcrtR1 homomer was reported (Ward et al., 2011b). These data provide unambiguous identification of CB1-HcrtR1 heteromerization, which has a substantial functional impact. ... The existence of a cross-talk between the hypocretinergic and endocannabinoid systems is strongly supported by their partially overlapping anatomical distribution and common role in several physiological and pathological processes. However, little is known about the mechanisms underlying this interaction. ... Acting as a retrograde messenger, endocannabinoids modulate the glutamatergic excitatory and GABAergic inhibitory synaptic inputs into the dopaminergic neurons of the VTA and the glutamate transmission in the NAc. Thus, the activation of CB1 receptors present on axon terminals of GABAergic neurons in the VTA inhibits GABA transmission, removing this inhibitory input on dopaminergic neurons (Riegel and Lupica, 2004). Glutamate synaptic transmission in the VTA and NAc, mainly from neurons of the PFC, is similarly modulated by the activation of CB1 receptors (Melis et al., 2004).
{{cite journal}}: CS1 maint: unflagged free DOI (link)
• Figure 1: Schematic of brain CB1 expression and orexinergic neurons expressing OX1 (HcrtR1) or OX2 (HcrtR2)
• Figure 2: Synaptic signaling mechanisms in cannabinoid and orexin systems
• Figure 3: Schematic of brain pathways involved in food intake - ^ Freund TF, Katona I, Piomelli D (July 2003). "Role of endogenous cannabinoids in synaptic signaling". Physiological Reviews. 83 (3): 1017–66. doi:10.1152/physrev.00004.2003. PMID 12843414.
- ^ Ayakannu, Thangesweran; Taylor, Anthony H.; Marczylo, Timothy H.; Willets, Jonathon M.; Konje, Justin C. (2013). "The Endocannabinoid System and Sex Steroid Hormone-Dependent Cancers". International Journal of Endocrinology. 2013: 259676. doi:10.1155/2013/259676. ISSN 1687-8337. PMC 3863507. PMID 24369462.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Nagatsu, T. (December 2000). "[Molecular mechanisms of neurotransmission]". Rinsho Shinkeigaku = Clinical Neurology. 40 (12): 1185–1188. ISSN 0009-918X. PMID 11464453.
- ^ Andreae, Laura C.; Burrone, Juan (March 2018). "The role of spontaneous neurotransmission in synapse and circuit development". Journal of Neuroscience Research. 96 (3): 354–359. doi:10.1002/jnr.24154. ISSN 0360-4012. PMC 5813191. PMID 29034487.
- ^ Holden, Arun; Winlow, William (1984). The Neurobiology of Pain: Symposium of the Northern Neurobiology Group Held at Leeds on 18 April 1983 (1st ed.). Manchester Univ Pr. p. 111. ISBN 978-0719010613.
{{cite book}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Kolb, Bryan; Whishaw, Ian Q. (2003). Fundamentals of Human Neuropsychology (5th ed.). Worth. pp. 102–104. ISBN 978-0-7167-5300-1.
{{cite book}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) (reference for all five stages) - ^ Squire, Larry; Berg, Darwin; Bloom, Floyd E.; du Lac, Sascha; Ghosh, Anirvan; Spitzer, Nicholas C. (2013). Fundamental neuroscience (4th ed.). Amsterdam: Elsevier/Academic Press. pp. 133–181. ISBN 978-0-12-385870-2.
{{cite book}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Williams SM, McNamara JO, Lamantia A, Katz LC, Fitzpatrick D, Augustine GJ, Purves D (2001). Purves D, Augustine GJ, Fitzpatrick D, et al. (eds.). Summation of Synaptic Potentials (2nd ed.). Sunderland (MA): Sinauer Associates.
{{cite book}}:|work=ignored (help) - ^ Wang JH, Wei J, Chen X, Yu J, Chen N, Shi J (September 2008). "Gain and fidelity of transmission patterns at cortical excitatory unitary synapses improve spike encoding". Journal of Cell Science. 121 (Pt 17): 2951–60. doi:10.1242/jcs.025684. PMID 18697836.
- ^ Yu J, Qian H, Chen N, Wang JH (2011). "Quantal glutamate release is essential for reliable neuronal encodings in cerebral networks". PLOS ONE. 6 (9): e25219. doi:10.1371/journal.pone.0025219. PMC 3176814. PMID 21949885.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Yu J, Qian H, Wang JH (August 2012). "Upregulation of transmitter release probability improves a conversion of synaptic analogue signals into neuronal digital spikes". Molecular Brain. 5 (26): 26. doi:10.1186/1756-6606-5-26. PMC 3497613. PMID 22852823.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Hevern, Vincent W. "PSY 340 Brain and Behavior". Archived from the original on February 19, 2006.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Anderson LL (2006). "Discovery of the 'porosome'; the universal secretory machinery in cells". Journal of Cellular and Molecular Medicine. 10 (1): 126–31. doi:10.1111/j.1582-4934.2006.tb00294.x. PMC 3933105. PMID 16563225.
- ^ Lee JS, Jeremic A, Shin L, Cho WJ, Chen X, Jena BP (July 2012). "Neuronal porosome proteome: Molecular dynamics and architecture". Journal of Proteomics. 75 (13): 3952–62. doi:10.1016/j.jprot.2012.05.017. PMC 4580231. PMID 22659300.
- ^ Trudeau LE, Gutiérrez R (June 2007). "On cotransmission & neurotransmitter phenotype plasticity". Molecular Interventions. 7 (3): 138–46. doi:10.1124/mi.7.3.5. PMID 17609520.
- ^ Thomas EA, Bornstein JC (2003). "Inhibitory cotransmission or after-hyperpolarizing potentials can regulate firing in recurrent networks with excitatory metabotropic transmission". Neuroscience. 120 (2): 333–51. doi:10.1016/S0306-4522(03)00039-3. PMID 12890506.
- ^ Pakdeechote P, Dunn WR, Ralevic V (November 2007). "Cannabinoids inhibit noradrenergic and purinergic sympathetic cotransmission in the rat isolated mesenteric arterial bed". British Journal of Pharmacology. 152 (5): 725–33. doi:10.1038/sj.bjp.0707397. PMC 2190027. PMID 17641668.
- ^ أ ب Dh, Root; S, Zhang; Dj, Barker; J, Miranda-Barrientos; B, Liu; Hl, Wang; M, Morales (2018-06-19). "Selective Brain Distribution and Distinctive Synaptic Architecture of Dual Glutamatergic-GABAergic Neurons". Cell Reports (in الإنجليزية). 23 (12): 3465–3479. doi:10.1016/j.celrep.2018.05.063. PMID 29924991.
- ^ Adams HH, Hibar DP, Chouraki V, Stein JL, Nyquist PA, Rentería ME, et al. (December 2016). "Novel genetic loci underlying human intracranial volume identified through genome-wide association". Nature Neuroscience. 19 (12): 1569–1582. doi:10.1038/nn.4398. PMC 5227112. PMID 27694991.