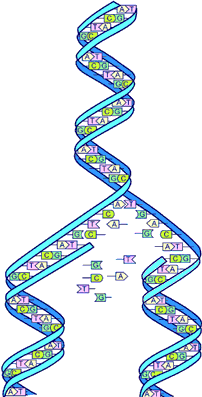
مشروع الجينوم البشري
مشروع الجينوم البشري (إنگليزية: Human Genome Project، اختصاراً HGP)، هو مشروع بحث علمي دولي يهدف إلى تحديد الأزواج القاعدية التي تشكل الدنا البشري، وتحديد، ورسم الخرائط وتتبع جميع جينات الجينوم البشري من الناحيتة الجسدية والوظيفية. بدأ المشروع عام 1990 واكتمل في 2003.[1] لا يزال أكبر مشروع بيولوجي تعاوني في العالم.[2] بدأ التخطيط للمشروع بعد أن اعتمدته الحكومة الأمريكية عام 1984، وأُطلق رسميًا عام 1990. وأعلن اكتماله في 14 أبريل 2003، وشمل حوالي 92٪ من الجينوم.[3] تم تحقيق مستوى "الجينوم الكامل" في مايو 2021، مع تغطية 0.3٪ فقط من القواعد المتبقية من خلال المشكلات المحتملة.[4][5] اكتمل التجميع النهائي بدون فجوات في يناير 2022.[6]
جاء التمويل من حكومة الولايات المتحدة من خلال المعاهد الوطنية للصحة (NIH) بالإضافة إلى العديد من المجموعات الأخرى من جميع أنحاء العالم. نُفذ مشروع موازٍ خارج الحكومة بواسطة شركة سيليرا، أو سيليرا جينوميكس، والذي أُطلق رسميًا عام 1998. تم تنفيذ معظم التسلسل الذي ترعاه الحكومة في عشرين جامعة ومركز أبحاث في الولايات المتحدة والمملكة المتحدة واليابان وفرنسا وألمانيا والصين،[7] العاملة في الاتحاد الدولي لتسلسل الجينوم البشري (IHGSC).
الهدف الأصلي من مشروع الجينوم البشري هو رسم خريطة لمجموعة كاملة من النيوكليوتيدات الموجودة في الجينوم المرجع أحادي الصيغة الصبغية في البشر، والتي يوجد منها أكثر من ثلاثة مليارات. "الجينوم" لأي فرد هو فريد من نوعه. اشتمل رسم خرائط "الجينوم البشري" على عينات متسلسلة جمعت من عدد صغير من الأفراد ثم تجميع الأجزاء المتسلسلة للحصول على تسلسل كامل لكل من 24 كروموسومًا بشريًا (22 جسمًا وراثيًا كروموسومًا جنسيًا). لذلك، فإن الجينوم البشري النهائي عبارة عن فسيفساء، ولا يمثل أي فرد. يأتي الكثير من فائدة المشروع من حقيقة أن الغالبية العظمى من الجينوم البشري هو نفسه في جميع البشر.
التاريخ
كان مشروع الجينوم البشري مشروعًا ممولًا من القطاع العام لخمسة عشر عامًا، بدأ عام 1990 بهدف تحديد تسلسل الحمض النووي للجينوم البشري للكروماتين المفتوح بأكمله في غضون 13 عامًا.[8][9]
في مايو 1985 ، نظم روبرت سينشايمر ورشة عمل في جامعة كاليفورنيا بسانتا كروز لمناقشة جدوى بناء جينوم مرجعي منهجي باستخدام تقنيات التسلسل الجيني.[10] في مارس 1986، نُظمت ورشة عمل سانتا في بواسطة تشارلز ديليسي وديفيد سميث من مكتب الصحة والبحوث البيئية التابع لوزارة الطاقة.[11] في الوقت نفسه، اقترح ريناتو دولبيكو، رئيس معهد سالك للدراسات الحيوية، مفهوم تسلسل الجينوم الكامل في مقالة نشرتها مجلة ساينس.[12] أُختصر العمل المنشور بعنوان "نقطة تحول في أبحاث السرطان: تسلسل الجينوم البشري" من الاقتراح الأصلي باستخدام التسلسل لفهم الأساس الجيني لسرطان الثدي.[13] بعدذلك بشهرين، قام جيمس واطسون، مكتشف الشكل الحلزوني المزدوج للحمض النووي في السبعينيات، بتأسيس ورشة عمل عقدت في مختبر كولد سبرينج هاربر. وهكذا فإن فكرة الحصول على تسلسل مرجعي لها ثلاثة أصول مستقلة: سينشايمر ودولبيكو وديليسي. في النهاية كانت الإجراءات التي اتخذها ديليسي هي التي أطلقت المشروع.[14][15][16][17]
إن حقيقة أن ورشة عمل سانتا في كانت مدفوعة ومدعومة من قبل وكالة فيدرالية فتحت الطريق، وإن كان طريقًا صعبًا ومتعرجًا،[18] لتحويل الفكرة إلى سياسة عامة في الولايات المتحدة. في مذكرة إلى مساعد وزير الطاقة لأبحاث الطاقة ألفين تريفيلبيس، حدد تشارلز ديليسي، مدير مكتب الصحة والبحوث البيئية آنذاك، خطة موسعة للمشروع.[19] بدأ هذا سلسلة طويلة ومعقدة من الأحداث التي أدت إلى إعادة برمجة الأموال المعتمدة التي مكنت مكتب الصحة والبحوث البيئية من إطلاق المشروع عام 1986، والتوصية بالبند الأول لمشروع الجينوم ابشري، والذي كان في عرض ميزانية الرئيس ريجان لعام 1988،[18] وفي النهاية وافق عليه الكونجرس. كانت دعوة بيت دومينيتشي عضو مجلس الشيوخ عن ولاية نيو مكسيكو، الذي كان ديليسي قد أصبح صديقاً له، من الأمور ذات الأهمية الخاصة في موافقة الكونجرس.[20] كان دومينيتشي رئيساً لجنة الطاقة والموارد الطبيعية بمجلس الشيوخ، وكذلك لجنة الميزانية، وكلاهما كان أساسيًا في عملية ميزانية وزارة الطاقة. أضاف الكونجرس مبلغًا مشابهًا لميزانية المعاهد الوطنية للصحة، وبذلك بدأ التمويل الرسمي من كلا الوكالتين.
سعى تريفلبيس وحصل على الموافقة على اقتراح دليسي من قبل نائب الوزير وليام فلين مارتن. هذا الرسم البياني[21] استخدم تريفلبيس هذا الرسم في ربيع 1986 لإطلاع مارتن ووكيل الوزارة جوزيف سالجادو على عزمه إعادة برمجة 4 ملايين دولار لبدء المشروع بموافقة جون هيرينجتون. تلى هذا إعادة البرمجة هذه ميزانية بندية قدرها 16 مليون دولار في ميزانية عام 1987 التي قدمتها إدارة ريجان إلى الكونجرس.[22]
عام 1990، وضعت وكالتا التمويل الرئيسيتان، وزارة الطاقة والمعاهد الوطنية للصحة، مذكرة تفاهم من أجل تنسيق الخطط وتحديد الساعة لبدء المشروع حتى عام 1990.[23] في ذلك الوقت، كان ديفيد جالاس مديرًا للمكتب المعاد تسميته "مكتب الأبحاث الحيوية والبيئية" في مكتب العلوم التابع لوزارة الطاقة الأمريكية، وكان جيمس واطسون يرأس برنامج جينوم المعاهد الوطنية للصحة. عام 1993، خلف أريستيدس باترينوس جالاس وفرانسيس كولينز خلف واطسون، حيث تولى منصب رئيس المشروع العام كمدير للمركز الوطني لأبحاث الجينوم البشري في المعاهد الوطنية للصحة (والذي أصبح فيما بعد المعهد الوطني لبحوث الجينوم البشري). أعلنت مسودة عمل للجينوم عام 2000 ونشرت الأوراق التي تصفها في فبراير 2001. ونشرت مسودة أكثر اكتمالاً عام 2003، واستمر عمل "إنهاء" الجينوم لأكثر من عشر سنوات بعد ذلك.
تأسس المشروع الذي تبلغ تكلفته 3 مليارات دولار رسميًا عام 1990 من قبل وزارة الطاقة الأمريكية والمعاهد الوطنية للصحة، وكان من المتوقع أن يستغرق 15 عامًا.[24]
بالإضافة إلى الولايات المتحدة ، يتألف الكنسورتيوم الدولي من علماء وراثة من المملكة المتحدة وفرنسا وأستراليا والصين وعدد لا يحصى من العلاقات التلقائية الأخرى.[25]
انتهى المشروع بتكلفة أقل من المتوق ، بنحو 2.7 مليار دولار (أي ما يعادل حوالي 5 مليار دولار عام 2021).[7][26][27]
هناك تقنيتان مكنتا المشروع: رسم الخارطة الجينية وتسلسل الحمض النووي. نشأت تقنية رسم الخرائط الجينية لتعدد أطوال جزء الحصر (RFLP) من البحث عن موقع جين سرطان الثدي بواسطة الدكتور مارك سكولنيك من جامعة يوتا،[28] الذي بدأ عام 1974.[29] ليرى علامة ارتباط للجين، بالتعاون مع ديفيد بوتشتاين، راي وايت ورون ديفيز تصور طريقة لبناء خريطة الارتباط الجيني من الجينوم البشري. وقد مكن هذا العلماء من إطلاق جهد أكبر في الجينوم البشري.[30]
بسبب التعاون الدولي الموسع والتقدم في مجال الجينوميات (خاصة في تحليل التسلسل)، بالإضافة إلى التقدم الموازي في تكنولوجيا الحوسبة، اكتملت من "المسودة الأولية" للجينوم عام 2000 (أعلن عنها بواسطة الرئيس الأمريكي بيل كلينتون ورئيس الوزراء البريطاني توني بلير في 26 يونيو 2000).[31][32] تم الانتهاء من أول مسودة أولية متاحة لتجميع الجينوم من قبل مجموعة المعلومات الحيوية للجينوم في جامعة كاليفورنيا بسانتا كروز، بقيادة طالب الدراسات العليا في ذلك الوقت جيم كينت والمشرف عليه ديفيد هوسلر.[33] أدى التسلسل المستمر إلى الإعلان عن الجينوم الكامل أساسًا في 14 أبريل 2003، أي قبل عامين من الموعد المخطط له.[34][35] في مايو 2006، برز إنجاز آخر في الطريق إلى إكمال المشروع عندما نشر تسلسل آخر كروموسوم في مجلة ناتشر.[36]
يوضح الجدول التالي المؤسسات والشركات والمختبرات المختلفة التي شاركت في مشروع الجينوم البشري، بحسب المعاهد الوطنية للصحة:[7]
| الرقم | البلد | الاسم | المؤسسة |
|---|---|---|---|
| 1 | معهد وايتهيد/مركز باحثو معهد مساتشوستس للتكنولوجيا | معهد مساتشوستس للتكنولوجيا | |
| 2 | معهد سانجر التابع لصندوق ويلكم | صندوق ويلكم | |
| 3 | مركز تسلسل الجينوم، كلية الطب، جامعة واشنطن | جامعة واشنطن في سانت لويس | |
| 4 | معهد الجينوم المشترك، وزارة الطاقة الأمريكية | وزارة الطاقة الأمريكية | |
| 5 | مركز تتبع الجينوم البشري، كلية بايلور للطب | كلية بايلور للطب | |
| 6 | مركز ريكن لعلوم الجينوم | ريكن | |
| 7 | Genoscope and CNRS UMR-8030 | اللجنة الفرنسية للطاقات البديلة والطاقة الذرية | |
| 8 | مركز تسلسل GTC | شركة علاجات الجينوم، حيث يدار قسم التسلسل الخاص بها بواسطة أبلايد للنظم الحيوية | |
| 9 | مديرية تحليل الجينوم | معهد فريتز ليبمان، تم تغيير الاسم من معهد التكنولوجيا الحيوية الجزيئية | |
| 10 | معهد بكين لعلم الجينوم/مركز الجينوم البشري | الأكاديمية الصينية للعلوم | |
| 11 | مركز التسلسل متعدد الجسيمات | معهد بيولوجيا النظم | |
| 12 | مركز ستانفورد لتكنولوجيا الجينوم | جامعة ستانفورد | |
| 13 | مركز الجينوم البشري وقسم علم الوراثة | كلية ستانفورد للطب | |
| 14 | مركز الجينوم بجامعة جورج واشنطن | جامعة جورج واشنطن | |
| 15 | قسم علم الأحياء الجزيئي | كلية الطب، جامعة كيئو | |
| 16 | مركز ساوث وسترن الطبي في دالاس، جامعة تكساس | جامعة تكساس | |
| 17 | المركز المتقدم لتكنولوجيا الجينوم، جامعة أوكلاهوما | قسم الكيمياء والكيمياء الحيوية، جامعة أوكلاهوما | |
| 18 | معهد ماكس بلانك للوراثة الجزيئية | جمعية ماكس بلانك | |
| 19 | مركز ليتا أنينبرج هازن للجينوم | معمل كولد سبرينج هاربر | |
| 20 | GBF/المركز الألماني للتكنولوجيا الحيوية | أعيد تنظيمه وتغيير اسمه إلى مركز هلمهولتز لأبحاث العدوى |
بالإضافة إلى ذلك، بدءًا من عام 2000 ولمدة ثلاث سنوات في روسيا، المؤسسة الروسية للأبحاث الأساسية (RFFI؛ روسية: Российский фонд фундаментальных исследований (РФФИ)) قدمت منحة قدرها حوالي 500 ألف روبل لتمويل رسم خرائط الجينوم للروس، ثلاث مجموعات:[citation needed]
- فولوجدا-فياتكا (روسية: Вологда-Вятка)
- إلمن بلوزرسك (روسية: Ильмень-Белозерск)
- فالداي (روسية: Валдай)
بواسطة قبل مختبر علم الوراثة السكانية البشرية Medical Genetics Center التابع للأكاديمية الروسية للعلوم (روسية: лаборатории популяционной генетики человека Медико-генетического центра Российской академии медицинских наук).
حالة الاكتمال
الجدير بالذكر أن المشروع لم يكن قادرًا على تتبع تسلسل جميع الحمض النووي الموجود في الخلايا البشرية؛ بدلاً من ذلك، كان الهدف هو تسلسل المناطق "مفتوحة الكروماتين" فقط من الجينوم النووي، والذي تشكل 92.1٪ من الجينوم البشري. توجد 7.9٪ المتبقية في مناطق متفرقة "متغايرة الكروماتين" مثل تلك الموجودة في السنتروميرات والتيلوميرات. هذه المناطق بطبيعتها أكثر صعوبة بشكل عام في التسلسل وبالتالي لم يتم تضمينها كجزء من الخطط الأصلية للمشروع.[37]
في أبريل 2003 أعلن اكتمال مشروع الجينوم البشري. كانت المسودة الأولية للجينوم البشري متاحة في يونيو 2003 وبحلول فبراير 2001 اكتملت مسودة العمل ونشرت في أعقاب رسم خريطة التسلسل النهائي للجينوم البشري في 14 أبريل 2003. على الرغم من أنه قد ورد أنها تغطي 99٪ من الجينوم البشري متغير الكروماتين بدقة 99.99٪، فقد نُشر تقييم جودة رئيسي لتسلسل الجينوم البشري في 27 مايو 2004، مما يشير إلى أن أكثر من 92٪ من العينات تجاوزت دقتها 99.99٪ والتي كانت ضمن الهدف المقصود.[38]
في مارس 2009، أصدر اتحاد مراجع الجينوم (GRC) نسخة أكثر دقة للجينوم البشري، لكن هذا لا يزال يترك أكثر من 300 فجوة،[39] بينما في 2015 كان هناك 160 فجوة.[40]
رغم أنه في مايو 2020، أفاد اتحاد مراجع الجينوم عن وجود 79 فجوة "لم تُحل"،[41] تمثل ما يصل إلى 5٪ من الجينوم البشري،[42] إلا أنه بعد أشهر، تم تطبيق تقنيات التسلسل طويل المدى وhydatidiform mole - خط خلوي مشتق حيث تكون نسختا كل كروموسوم متطابقتين، أدى إلى تأسيس أول تيلومير-إلى-تيلومير، تسلسل كامل حقًا لكروموسوم بشري، الكروموسوم إكس.[43]
وبالمثل، تم تتبع تسلسل كامل من طرف إلى طرف كروموسوم 8 البشري بعد عدة أشهر.[44]
في 2021، أعلن عن أن كونسورتيوم تيلومير-إلى-تيلومير (T2T) قد ملأ جميع الفجوات باستثناء خمسة في المناطق المتكررة من الحمض النووي الريبوزومي.[45] بعد أشهر، أغلقت هذه الفجوات أيضًا. لا يحتوي التسلسل الكامل على الكروموسوم واي، الذي يتسبب في أن يصبح الجنين ذكرًا، وغيابه في خط الخلية الذي يعمل كمصدر للحمض النووي الذي تم تحليله. ثبت أن حوالي 0.3 ٪ من التسلسل الكامل صعب التحقق من جودته، وبالتالي قد يحتوي على أخطاء،[46] التي تم استهدافها للتأكيد.[47] في أبريل 2022، نُشر التسلسل الكامل للكروموسوم غير واي رسميًا، مما يوفر رؤية لمعظم 8 ٪ من الجينوم الذي تركه مشروع الجينوم البشري.[48] في ديسمبر 2022، زعمت مقالة قبل طباعتها أنه تم تتبع تسلسل المناطق المفقودة المتبقية من الكروموسوم واي، وبالتالي إكمال تسلسل جميع الكروموسومات البشرية الأربعة والعشرين.[49]
الإنجازات

للجينوم البشري حوالي 3.1 بليون زوج قاعدي.[50] بدأ مشروع الجينوم البشري عام 1990 بهدف تترع التسلسل وتحديد جميع الأزواج القاعدية في مجموعة التعليمات الوراثية البشرية، وإيجاد الجذور الجينية للمرض ثم تطوير العلاجات. ويعتبر هذا مشروعاً ضخماً.
تم تقسيم الجينوم إلى قطع أصغر؛ بطول حوالي 150.000 زوج قاعدي تقريباً.[51] تم بعد ذلك ربط هذه القطع بنوع من النواقل يُعرف باسم "الكروموسوم الجرثومي الإصطناعي"، أو BACs، والتي تُشتق من الكروموسومات الجرثومية المهندسة وراثياً. يمكن إدخال النواقل التي تحتوي على الجينات في الجراثيم حيث يتم نسخها بواسطة آلية تكاثر الحمض النووي الجرثومية. بعد ذلك يتم تتبع تسلسل كل من هذه القطع بشكل منفصل كمشروع صغير " بندقية" ثم تم تجميعها. تتجمع الأزواج الأساسية الأكبر ، البالغ عددها 150.000 زوجًا ، معًا لتكوين الكروموسومات. يُعرف هذا باسم نهج "التسلسل الهرمي للبندقية"، لأن الجينوم يقسم أولاً إلى قطع كبيرة نسبيًا، والتي يتم تعيينها بعد ذلك إلى الكروموسومات قبل اختيارها للتسلسل.[52][53]
جاء التمويل من الحكومة الأمريكية من خلال المعاهد الوطنية للصحة بالولايات المتحدة، ومنظمة خيرية بريطانية تسمى ويلكوم ترست، بالإضافة إلى العديد من المجموعات الأخرى من جميع أنحاء العالم. دعم التمويل عددًا من مراكز التسلسل الكبيرة بما في ذلك الموجودة في معهد وايتهيد، معهد ويلكوم سانجر (الذي كان يُسمى آنذاك مركز سانجر) ومقره حرم ويلكوم جينوم، جامعة واشنطن في سانت لويس وكلية بايلور للطب.[24][54]
عملت منظمة الأمم المتحدة للتربية والعلم والثقافة (اليونسكو) كقناة هامةلمشاركة البلدان النامية في مشروع الجينوم البشري.[55]
التطبيقات والفوائد المحتملة
يحمل تسلسل الجينوم البشري فوائد للعديد من المجالات، من الطب الجزيئي إلى التطور البشري. يمكن أن يساعد مشروع الجينوم البشري، من خلال تتبع تسلسل الحمض النووي، الباحثين على فهم الأمراض بما في ذلك: التنميط الجيني لفيروسات معينة لتوجيه العلاج المناسب؛ تحديد الطفرات المرتبطة بأشكال مختلفة من السرطان؛ تصميم الأدوية والتنبؤ الأكثر دقة بآثارها؛ التقدم في العلوم التطبيقية للطب الشرعي؛ الوقود الحيوي وتطبيقات الطاقة الأخرى؛ الزراعة، تربية الماشية، المعالجة الحيوية؛ تقييم المخاطر؛ علم الآثار الحيوي، الأنثروبولوجيا والتطور. فائدة أخرى مقترحة هي التطوير التجاري لبحوث الجينوم المتعلقة بالمنتجات القائمة على الحمض النووي، وهي صناعة تقدر بمليارات الدولارات.
يُخزن تسلسل الحمض النووي في قاعدة بيانات متاحة لأي شخص على الإنترنت. يضم المركز الوطني لمعلومات التكنولوجيا الحيوية بالولايات المتحدة (والمنظمات الشقيقة في أوروبا واليابان) تسلسل الجينات في قاعدة بيانات تُعرف باسم جينبنك، جنبًا إلى جنب مع تسلسل الجينات والبروتينات المعروفة والافتراضية. مؤسسات أخرى، مثل متصفح الجينوم UCSC في جامعة كاليفورنيا-سانتا كروز،[56] ويقدم محرك بحث إنسمبل[57] بيانات إضافية وشروح وأدوات قوية لتصورها والبحث فيها. تم تطوير برامج حاسوب لتحليل البيانات لأن البيانات نفسها يصعب تفسيرها بدون مثل هذه البرامج. بشكل عام، اتبعت التطورات في تكنولوجيا تسلسل الجينوم قانون مور، وهو مفهوم من علوم الحاسوب ينص على أن الدوائر المتكاملة يمكن أن تزيد من التعقيد بمعدل أسي.[58] يعني هذا أن السرعات التي يمكن بها تسلسل الجينوم بأكمله يمكن أن تزيد بمعدل مماثل، كما لوحظ أثناء تطوير مشروع الجينوم البشري.
تقنيات التحليل
عملية تحديد الحدود بين الجينات والسمات الأخرى في تسلسل الحمض النووي الخام تسمى شرح الجينوم وتقع في مجال المعلوماتية الحيوية. بينما يصنع علماء الأحياء الخبراء أفضل المعلقين، فإن عملهم يسير ببطء، وتستخدم برامج الحاسوب بشكل متزايد لتلبية متطلبات الإنتاجية العالية لمشروعات تسلسل الجينوم. ابتداءً من عام 2008، طُرحت تقنية جديدة تُعرف باسم RNA-seq والتي سمحت للعلماء بتسلسل مرسال الحمض النووي الريبوزي مباشرةً في الخلايا. استبدل هذا طرق الشرح السابقة، التي اعتمدت على الخصائص المتأصلة في تسلسل الحمض النووي، مع القياس المباشر، والذي كان أكثر دقة. اليوم ، يعتمد شرح الجينوم البشري والجينومات الأخرى بشكل أساسي على التسلسل العميق للنصوص في كل نسيج بشري باستخدام RNA-seq. كشفت هذه التجارب أن أكثر من 90٪ من الجينات تحتوي على واحد على الأقل وعادةً عدة متغيرات لصق بديلة ، حيث يتم الجمع بين الإكسونات بطرق مختلفة لإنتاج 2 أو أكثر من الجينات من نفس المكان.[59]
لا يمثل الجينوم المنشور بواسطة مشروع الجينوم البشري تسلسل جينوم كل فرد. وهي فسيفساء مجتمعة لعدد صغير من المتبرعين المجهولين، من أصول أفريقية وأوروبية وشرق آسيوية. يعتبر جينوم مشروع الجينوم البشري دعامة للعمل المستقبلي في تحديد الاختلافات بين الأفراد.[citation needed] قامت المشاريع اللاحقة بتسلسل جينومات مجموعات عرقية متميزة متعددة، على الرغم من أنه حتى عام 2019 كان لا يزال هناك "جينوم مرجعي" واحد فقط.[60]
النتائج
النتائج الرئيسية لمسودة (2001) وتسلسل الجينوم الكامل (2004) تشمل:
- لدى البشر حوالي 22.300[61] جينات مرمز-بالبروتين، نفس النطاق لدى الثدييات الأخرى.
- يحتوي الجينوم البشري على عدد أكبر بكثير من الازدواجيات القطاعية (أقسام متطابقة تقريبًا من الحمض النووي) أكثر مما كان يُشتبه سابقًا.[62][63][64]
- في الوقت الذي نُشرت فيه مسودة التسلسل، بدا أن أقل من 7٪ من عائلات البروتين خاص بالفقاريات.[65]
النهج العام مقابل النهج الخاص
عام 1998، أطلق الباحث الأمريكي كريغ فينتر، وشركته سيليرا جينوميكس، بحثًا مشابهًا ممولًا من القطاع الخاص. كان فينتر عالماً في المعاهد الوطنية للصحة في أوائل التسعينيات عندما بدأ المشروع. كان الهدف من جهود سيليرا البالغة 300 مليون دولار المضي قدمًا بوتيرة أسرع وبجزء بسيط من تكلفة ما يقرب من 3 مليار دولار كمشروع ممول من القطاع العام. كان نهج سيليرا قادرًا على المضي قدمًا بمعدل أسرع بكثير وبتكلفة أقل من المشروع العام. في حين أنها استفادت من الخرائط المتاحة للجمهور في جينبنك، إلا أنها كانت منخفضة الجودة وأبطأت المشروع فقط.[62]
استخدمت سيليرا تقنية تسمى تتبع تسلسل بندقية الجينوم الكامل، باستخدام التسلسل الطرفي الزوجي،[66] التي استخدمت لتتبع تسلسل الجينوم الجرثومي لما يصل إلى ستة ملايين زوج قاعدي في الطول، لكن ليس لأي شيء تقريبًا مثل الجينوم البشري البالغ ثلاثة مليارات زوج قاعدي.
أعلنت سيليرا في البداية أنها ستسعى للحصول على حماية براءة اختراع لـ"200-300 جين فقط"، لكنها عدلت لاحقًا هذا للحصول على "حماية الملكية الفكرية" على "بنى هامة كاملة المواصفات" تصل إلى 100-300 هدف. وفي النهاية، قدمت الشركة طلبات براءات اختراع أولية ("مالكها") على 6500 جين كامل أو جزئي. وعدت سيليرا أيضًا بنشر النتائج التي توصلوا إليها وفقًا لشروط "بيان برمودا لعام 1996، من خلال إصدار بيانات جديدة سنويًا (يصدر مشروع الجينوم البشري بياناته الجديدة يوميًا)، على الرغم من أنه على عكس المشروع الممول من القطاع العام، لن يسمحوا بإعادة التوزيع المجاني أو الاستخدام العلمي للبيانات. اضطر المنافسون الممولون من القطاع العام إلى إصدار المسودة الأولى للجينوم البشري قبل سيليرا لهذا السبب. في 7 يوليو 200 ، أصدرت مجموعة UCSC Genome Bioinformatics Group مسودة العمل الأولى على الويب. قام المجتمع العلمي بتنزيل حوالي 500 جيجابايت من المعلومات من خادم الجينوم UCSC في أول 24 ساعة من الوصول المجاني وغير المقيد.[67]
في مارس 2000، حث الرئيس كلينتون، جنبًا إلى جنب مع رئيس الوزراء توني بلير في بيان مزدوج، على أن جميع الباحثين الذين يرغبون في البحث في تتبع التسلسل يجب أن يكون لديهم "وصول غير مقيد" إلى تسلسل الجينوم.[68] أدى البيان إلى انخفاض سهم سيليرا وانخفاض أسهم شركات التكنولوجيا الحيوية الثقيلة على ناسداك. خسر قطاع التكنولوجيا الحيوية حوالي 50 مليار دولار في القيمة السوقية خلال يومين.
على الرغم من الإعلان عن مسودة العمل في يونيو 2000، إلا أن سيليرا وعلماء مشروع الجينوم البشري لم ينشروا تفاصيل مسوداتهم إلا في فبراير 2001. أعداد خاصة من "مجلة ناتشر" (التي نشرت الأبحاث العلمية الخاصة بالمشروع الممول من القطاع العام)[62]
وصفت الطرق المستخدمة لإنتاج تسلسل المسودة وعرض تحليل التسلسل. غطت هذه المسودات حوالي 83٪ من الجينوم (90٪ من المناطق متجانسة اللون مع 150.000 فجوة وترتيب واتجاه العديد من القطاعات التي لم يتم تأسيسها بعد). في فبراير 2001، وقت النشر المشترك، أعلنت بيانات صحفية أن المشروع قد اكتمل من قبل المجموعتين. تم الإعلان عن المسودات المحسنة في عامي 2003 و2005، وتملأ ما يقرب من 92 ٪ من التسلسل حاليًا.
متبرعو الجينوم
في مشروع الجينوم البشري التابع للاتحاد الدولي لتسلسل الجينوم البشري (IHGSC) الممول من القطاع العام، جمع الباحثون عينات دماء (أنثى) أو حيوانات منوية (ذكور) من عدد كبير من المتبرعين. تمت معالجة عدد قليل فقط من العديد من العينات التي جُمعت كمصادر للحمض النووي. وهكذا تمت حماية هويات المتبرع بحيث لا يمكن للمتبرعين ولا العلماء معرفة تسلسل الحمض النووي. استخدمت تقنية استنساخ الحمض النووي المأخوذ من العديد من مكتبات دنا مختلفة، حيث تأسست معظم هذه المكتبات بواسطة الدكتور بيتر ج. دي يونج. الكثير من التسلسل (> 70٪) من الجينوم المرجعي الذي ينتجه مشروع الجينوم البشري العام جاء من متبرع واحد مجهول من بوفالو، نيويورك ، (الاسم الرمزي RP11؛ يشير RP "إلى مركز السرطان الشامل في روزويل بارك).[69][70]

استخدم علماء مشروع الجينوم البشري خلايا دم بيضاء من دماء اثنين من المتبرعين من الذكور واثنتين من المتبرعات (تم اختيارهم عشوائيًا من 20 لكل متبرع) - كل متبرع يقدم مكتبة دنا منفصلة. استخدمت إحدى هذه المكتبات (RP11) بشكل كبير أكثر من غيرها، وذلك لاعتبارات الجودة. تتمثل إحدى المشكلات التقنية البسيطة في أن عينات الذكور تحتوي على ما يزيد قليلاً عن نصف كمية الحمض النووي من الكروموسومات الجنسية (كروموسوم إكس واحد وكروموسوم واي واحد) مقارنةً بالعينات الأنثوية (التي تحتوي على اثنين من كروموسومات إكس). الكروموسومات الـ 22 الأخرى (الجسيمات الذاتية) هي نفسها لكلا الجنسين.
على الرغم من اكتمال مرحلة التسلسل الرئيسية لـمشروع الجينوم ابشري، استمرت دراسات تباين الحمض النووي في مشروع هاب ماب الدولي، الذي كان هدفه تحديد أنماط مجموعات تعدد أشكال النوكليوتيدات المفردة (SNP) (المسمى النمط الفرداني أو "haps"). جاءت عينات الحمض النووي الخاصة بهاب ماب من إجمالي 270 فردًا. شعب اليوروبا في إبادان بنيجيريا؛ الشعب الياباني في طوكيو؛ صينيو الهان في بكين؛ و مركز تعدد الأشكال البشرية الفرنسي (CEPH)، والذي يتألف من سكان الولايات المتحدة الذين ينحدرون من أصول غربية وشمال أوروبية.
في مشروع سيليرا جينومكز الممول من القطاع الخاص، استخدم الحمض النووي من خمسة أفراد مختلفين للتسلسل. اعترف العالم الرئيسي في سيليرا جينومكز في ذلك الوقت، كريغ فينتر، في وقت لاحق (في رسالة عامة إلى مجلة "ساينس") أن الحمض النووي الخاص به كان واحدًا من 21 عينة في المجموعة، اختيرت خمسة منها للاستخدام.[71][72]
التطورات
مع وجود التسلسل في متناول اليد، كانت الخطوة التالية هي تحديد المتغيرات الجينية التي تزيد من خطر الإصابة بأمراض شائعة مثل السرطان والسكري.[23][51]
من المتوقع أن توفر المعرفة التفصيلية للجينوم البشري سبلًا جديدة للتقدم في الطب والتكنولوجيا الحيوية. ظهرت نتائج عملية واضحة للمشروع حتى قبل الانتهاء من العمل. على سبيل المثال، بدأ عدد من الشركات، مثل مايريد جينتكس، في تقديم طرق سهلة لإدارة الاختبارات الجينية التي يمكن أن تظهر الاستعداد لمجموعة متنوعة من الأمراض، بما في ذلك سرطان الثدي، اضطرابات الإرقاء، التليف الكيسي، الكبد وأمراض أخرى كثيرة. كذلك، مسببات السرطان، مرض الزهايمر وغيرها من المجالات ذات الاهتمام السريري من المحتمل أن تستفيد من معلومات الجينوم وربما تؤدي على المدى الطويل إلى تقدم كبير في إدارتها.[73][74]
هناك أيضًا العديد من الفوائد الملموسة لعلماء الأحياء. على سبيل المثال، ربما يكون الباحث الذي يبحث في نوع معين من السرطان قد حصر بحثه في جين معين. من خلال زيارة قاعدة بيانات الجينوم البشري على شبكة الويب العالمية، يمكن لهذا الباحث فحص ما كتبه العلماء الآخرون عن هذا الجين، بما في ذلك (يحتمل) الهيكل ثلاثي الأبعاد لمنتجها ووظائفها وعلاقاتها التطورية مع الآخرين الجينات البشرية، أو الجينات الموجودة في الفئران أو الخميرة أو ذباب الفاكهة، والطفرات الضارة المحتملة، والتفاعلات مع الجينات الأخرى، وأنسجة الجسم التي ينشط فيها هذا الجين، والأمراض المرتبطة بهذا الجين أو أنواع البيانات الأخرى. علاوة على ذلك، فإن الفهم الأعمق لعمليات المرض على مستوى علم الأحياء الجزيئي قد يحدد إجراءات علاجية جديدة. نظرًا للأهمية الراسخة للحمض النووي في علم الأحياء الجزيئية ودورها المركزي في تحديد العملية الأساسية للعمليات الخلوية، فمن المحتمل أن تسهل المعرفة الموسعة في هذا المجال التقدم الطبي في العديد من المجالات ذات الاهتمام السريري التي قد لم يكن ممكناً بدونهم.[75]
كما يفتح تحليل أوجه التشابه بين تسلسلات الحمض النووي من كائنات مختلفة طرقًا جديدة في دراسة التطور. في كثير من الحالات، يمكن الآن تأطير الأسئلة التطورية من حيث علم الأحياء الجزيئي؛ في الواقع، العديد من المعالم التطورية الرئيسية (ظهور الريبوسومات والعضيات، وتطور الجنين مع مخططات الجسم، جهاز المناعة لدى الفقاريات) يمكن أن تكون مرتبطة بالمستوى الجزيئي. من المتوقع إلقاء الضوء على العديد من الأسئلة حول أوجه التشابه والاختلاف بين البشر وأقاربهم من (الرئيسيات، وفي الواقع الثدييات الأخرى من خلال البيانات الواردة في هذا المشروع.[73][76]
ألهم المشروع ومهد الطريق للعمل الجينومي في مجالات أخرى، مثل الزراعة. على سبيل المثال، من خلال دراسة التركيب الجيني "للقمح الطري"، قمح الخبز الأكثر شيوعًا في العالم، تم الحصول على نظرة ثاقبة حول الطرق التي أثر بها التدجين على تطور النبات.[77] يتم التحقيق في أي المواقع أكثر عرضة للتلاعب ، وكيف يتم ذلك من الناحية التطورية. سمح التسلسل الجيني بمعالجة هذه الأسئلة لأول مرة، حيث يمكن مقارنة مواقع محددة في السلالات البرية والمستأنسة للنبات. سيسمح هذا بإحراز تقدم في التعديل الوراثي في المستقبل مما قد ينتج عنه محاصيل قمح أكثر صحة ومقاومة للأمراض، من بين أمور أخرى.
القضايا الأخلاقية والقانونية والاجتماعية
في بداية مشروع الجينوم البشري، أثيرت العديد من المخاوف الأخلاقية والقانونية والاجتماعية فيما يتعلق بكيفية زيادة المعرفة بالجينوم البشري يمكن استخدامه للتمييز ضد الأشخاص. كان أحد الشواغل الرئيسية لمعظم الأفراد هو الخوف من أن كل من أرباب العمل وشركات التأمين الصحي قد يرفضون توظيف الأفراد أو يرفضون توفير التأمين للأشخاص بسبب مخاوف صحية تشير إليها جينات شخص ما.[78] عام 1996، أصدرت الولايات المتحدة قانون نقل التأمين الصحي والمساءلة (HIPAA)، والذي يحمي من الإفراج غير المصرح به وغير التوافقي عن المعلومات الصحية التي يمكن التعرف عليها بشكل فردي إلى أي كيان لا يشارك بنشاط في تقديم خدمات الرعاية الصحية إلى مريض.[79]
جنبًا إلى جنب مع تحديد كل ما يقرب من 20000-25000 جين في الجينوم البشري (يقدر عددها ما بين 80.000 و140.000 في بداية المشروع)، سعى مشروع الجينوم البشري أيضًا إلى معالجة القضايا الأخلاقية والقانونية والاجتماعية التي نشأت مع بدء المشروع.[80] لذلك، تأسس برنامج الآثار الأخلاقية والقانونية والاجتماعية (ELSI) عام 1990. وقد تم تخصيص خمسة بالمائة من الميزانية السنوية لمعالجة البرنامج القضايا الناشئة عن المشروع.[24][81] بدأت هذه الميزانية بحوالي 1.57 مليون دولار في عام 1990 ، لكنها زادت إلى ما يقرب من 18 مليون دولار في عام 2014.[82]
في حين أن المشروع قد يقدم فوائد كبيرة للطب والبحث العلمي، فقد أكد بعض المؤلفين على الحاجة إلى معالجة العواقب الاجتماعية المحتملة لرسم خرائط الجينوم البشري. كتب مؤرخ العلوم هانز-يورج راينبرجر أن "احتمال" تحويل الأمراض إلى جزيئات "وعلاجها المحتمل سيكون له تأثير عميق على ما يتوقعه المرضى من المساعدة الطبية، وعلى تصور جيل جديد من الأطباء للمرض."[83]
انظر أيضاً
- مشروع 1000 جينوم
- مشروع 100.000 جينوم
- مشروع جينوم الشمبانزي
- إنكود
- فيزيوم
- HUGO Gene Nomenclature Committee
- مشروع الدماغ البشري
- مشروع الكونيكتوم البشري
- مشروع السيتوم البشري
- مشروع ما فوق الجينوم البشري
- مشروع المايكروبيوم البشري
- مشروع البروتيوم البشري
- مشروع الفاريوم البشري
- قائمة قواعد بيانات علم الأحياء
- مشروع جينوم النياندرتال
- معهد ويلكوم سانجر
- مشروع الجينوم الجينوغرافي
مرئيات
| تعرف على مشروع الجينوم البشري. |
المصادر
- ^ Robert Krulwich (2003). Cracking the Code of Life (Television Show). PBS.
- ^ "Economic Impact of the Human Genome Project – Battelle" (PDF). Archived from the original (PDF) on 23 December 2012. Retrieved 1 August 2013.
- ^ "Human Genome Project Completion: Frequently Asked Questions". National Human Genome Research Institute (NHGRI).
- ^ "CHM13 T2T v1.1 – Genome – Assembly – NCBI". www.ncbi.nlm.nih.gov. Retrieved 2021-06-16.
- ^ "Genome List – Genome – NCBI". www.ncbi.nlm.nih.gov. Retrieved 2021-06-16.
- ^ "T2T-CHM13v2.0 – Genome – Assembly – NCBI". www.ncbi.nlm.nih.gov. Retrieved 2022-06-14.
- ^ أ ب ت "Human Genome Project Completion: Frequently Asked Questions". genome.gov.
- ^ "Human Genome Project: Sequencing the Human Genome | Learn Science at Scitable". www.nature.com. Retrieved 2016-01-25.
- ^ "History of the Human Genome Project". web.ornl.gov.
- ^ Sinsheimer RL (November 1989). "The Santa Cruz Workshop – May 1985 and". Genomics. 5 (4): 954–956. doi:10.1016/0888-7543(89)90142-0. PMID 2591974.
- ^ DeLisi C (October 2008). "Meetings that changed the world: Santa Fe 1986: Human genome baby-steps". Nature. 455 (7215): 876–877. Bibcode:2008Natur.455..876D. doi:10.1038/455876a. PMID 18923499. S2CID 41637733.
- ^ Dulbecco R (March 1986). "A turning point in cancer research: sequencing the human genome". Science. 231 (4742): 1055–1056. Bibcode:1986Sci...231.1055D. doi:10.1126/science.3945817. PMID 3945817.
- ^ Cook-Deegan, Robert M. (1994). The Gene Wars: Science, Politics, and the Human Genome. New York: W.W. Norton. p. 108.
- ^ "President Clinton Awards the Presidential Citizens Medals". clintonwhitehouse5.archives.gov.
- ^ "File:Plaque commemorating the Human Genome Project, outside Charles DeLisi's former office at DOE.png – Wikimedia Commons".
- ^ Bevatron's Encyclopedia of Inventions: a compendium of technological leaps, ground break discoveries and scientific breakthroughs that changed the world. The Human Genome Project, Charles DeLisi, pp. 360–362.
- ^ Origins of the Human Genome Project: A Political History – Bob Cook-Deegan https://www.youtube.com/watch?v=-opMu4Ld21Q&t=3885s
- ^ أ ب Gene Wars, Op.Cit. p. 102.
- ^ "Search". georgetown.edu.
- ^ "President Clinton Awards the Presidential Citizens Medals". nara.gov. Archived from the original on 2012-08-01. Retrieved 2014-08-06.
- ^ "Archived copy". Archived from the original on 2016-03-03. Retrieved 2013-08-19.
{{cite web}}: CS1 maint: archived copy as title (link) - ^ DeLisi C (1988). "The Human Genome Project". American Scientist. 76 (5): 488. Bibcode:1988AmSci..76..488D.
- ^ أ ب "About the Human Genome Project: What is the Human Genome Project". The Human Genome Management Information System (HGMIS). 2011-07-18. Archived from the original on 2011-09-02. Retrieved 2011-09-02.
- ^ أ ب ت Human Genome Information Archive. "About the Human Genome Project". U.S. Department of Energy & Human Genome Project program. Archived from the original on 2 سبتمبر 2011. Retrieved 1 أغسطس 2013.
- ^ Collins F, Galas D (1993-10-01). "A New Five-Year Plan for the United States: Human Genome Program". National Human Genome Research Institute. Retrieved 1 August 2013.
- ^ "Life on Earth to have its DNA analysed in the name of conservation". Nature. 563 (7730): 155–156. November 2018. Bibcode:2018Natur.563..155.. doi:10.1038/d41586-018-07323-y. PMID 30401859.
- ^ Lewin HA, Robinson GE, Kress WJ, Baker WJ, Coddington J, Crandall KA, et al. (April 2018). "Earth BioGenome Project: Sequencing life for the future of life". Proceedings of the National Academy of Sciences of the United States of America. 115 (17): 4325–4333. Bibcode:2018PNAS..115.4325L. doi:10.1073/pnas.1720115115. PMC 5924910. PMID 29686065.
- ^ Cook-Deegan, Robert M. (1994). The Gene Wars: Science, Politics, and the Human Genome. New York: W.W. Norton. pp. 95–96.
- ^ Bishop, Jerry E.; Waldholz, Michael (1990). Genome: The Story of the Most Astonishing Scientific Adventure of Our Time--the Attempt to Map All the Genes in the Human Body. New York: Simon and Schuster. p. 54.
- ^ Bishop, Jerry E.; Waldholz, Michael (1990). Genome: The Story of the Most Astonishing Scientific Adventure of Our Time – the Attempt to Map All the Genes in the Human Body. New York: Simon and Schuster. p. 201.
- ^ "White House Press Release". Retrieved 2006-07-22.
- ^ "Scientists Complete Rough Draft of Human Genome".
- ^ Gitschier, Jane (2013-01-31). "Life, the Universe, and Everything: An Interview with David Haussler". PLOS Genetics. 9 (1): e1003282. doi:10.1371/journal.pgen.1003282. ISSN 1553-7390. PMC 3561096. PMID 23382705.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Noble I (2003-04-14). "Human genome finally complete". BBC News. Retrieved 2006-07-22.
- ^ Kolata G (15 April 2013). "Human Genome, Then and Now". The New York Times. Retrieved 24 April 2014.
- ^ "Guardian Unlimited |UK Latest | Human Genome Project finalised". The Guardian. London. Retrieved 2006-07-22.[dead link]
- ^ "The Human Genome Project FAQ". Genoscope. Centre National de Séquençage. 2013-10-19. Archived from the original on 22 July 2015. Retrieved 12 February 2015.
- ^ Schmutz J, Wheeler J, Grimwood J, Dickson M, Yang J, Caoile C, et al. (May 2004). "Quality assessment of the human genome sequence". Nature. 429 (6990): 365–368. Bibcode:2004Natur.429..365S. doi:10.1038/nature02390. PMID 15164052.
- ^ Dolgin E (December 2009). "Human genomics: The genome finishers". Nature. 462 (7275): 843–845. doi:10.1038/462843a. PMID 20016572.
- ^ Chaisson MJ, Huddleston J, Dennis MY, Sudmant PH, Malig M, Hormozdiari F, Antonacci F, Surti U, Sandstrom R, Boitano M, Landolin JM, Stamatoyannopoulos JA, Hunkapiller MW, Korlach J, Eichler EE (Jan 2015). "Resolving the complexity of the human genome using single-molecule sequencing". Nature. 517 (7536): 608–611. Bibcode:2015Natur.517..608C. doi:10.1038/nature13907. PMC 4317254. PMID 25383537.
- ^ "Human Genome Issues". Genome Reference Consortium. Retrieved 2019-06-29.
- ^ The (near) complete sequence of a human genome, 2020-10-06, https://genomeinformatics.github.io/CHM13v1/
- ^ Miga, Karen H.; Koren, Sergey; Rhie, Arang; Vollger, Mitchell R.; Gershman, Ariel; Bzikadze, Andrey; Brooks, Shelise; Howe, Edmund; Porubsky, David; Logsdon, Glennis A.; Schneider, Valerie A. (September 2020). "Telomere-to-telomere assembly of a complete human X chromosome". Nature (in الإنجليزية). 585 (7823): 79–84. Bibcode:2020Natur.585...79M. doi:10.1038/s41586-020-2547-7. ISSN 1476-4687. PMC 7484160. PMID 32663838.
- ^ Logsdon, Glennis A.; Vollger, Mitchell R.; Hsieh, PingHsun; Mao, Yafei; Liskovykh, Mikhail A.; Koren, Sergey; Nurk, Sergey; Mercuri, Ludovica; Dishuck, Philip C.; Rhie, Arang; de Lima, Leonardo G. (May 2021). "The structure, function and evolution of a complete human chromosome 8". Nature (in الإنجليزية). 593 (7857): 101–107. Bibcode:2021Natur.593..101L. doi:10.1038/s41586-021-03420-7. ISSN 1476-4687. PMC 8099727. PMID 33828295.
- ^ Wrighton, Katharine (February 2021). "Filling in the gaps telomere to telomere". Nature Milestones: Genomic Sequencing: S21.
- ^ Reardon, Sara (2021-06-04). "A complete human genome sequence is close: how scientists filled in the gaps". Nature (in الإنجليزية). 594 (7862): 158–159. Bibcode:2021Natur.594..158R. doi:10.1038/d41586-021-01506-w. PMID 34089035. S2CID 235346408.
- ^ "GitHub – marbl/CHM13-issues: CHM13 human reference genome issue tracking". GitHub (in الإنجليزية). Retrieved 2021-07-26.
- ^ Special Issue: Completing the human genome, Science, vol. 376, no. 6588 (1 April 2022).
- ^ Rhie; et al. (2022-12-01). "The complete sequence of a human Y chromosome". bioRxiv. doi:10.1101/2022.12.01.518724. S2CID 254181409.
- ^ Piovesan, A.; Pelleri, M. C.; Antonaros, F.; Strippoli, P.; Caracausi, M.; Vitale, L. (2019). "On the length, weight and GC content of the human genome". BMC Research Notes. 12 (1): 106. doi:10.1186/s13104-019-4137-z. PMC 6391780. PMID 30813969.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب Wellcome Sanger Institute. Wellcome Trust Sanger Institute, Genome Research Limited https://web.archive.org/web/20130801231124/http://www.sanger.ac.uk/about/history/hgp/. Archived from the original on 2013-08-01. Retrieved 1 August 2013.
{{cite web}}: Missing or empty|title=(help); Unknown parameter|ttle=ignored (help) - ^ "Celera: A Unique Approach to Genome Sequencing". ocf.berkeley.edu. Biocomputing. 2006. Retrieved 1 August 2013.
- ^ Davidson College (2002). "Sequencing Whole Genomes: Hierarchical Shotgun Sequencing v. Shotgun Sequencing". bio.davidson.edu. Department of Biology, Davidson College. Retrieved 1 August 2013.
- ^ Human Genome Project Information Archive (2013). "U.S. & International HGP Research Sites". U.S. Department of Energy & Human Genome Project. Retrieved 1 August 2013.
- ^ Vizzini C (March 19, 2015). "The Human Variome Project: Global Coordination in Data Sharing". Science & Diplomacy. 4 (1).
- ^ "UCSC Genome Browser Home". genome.ucsc.edu.
- ^ "Ensembl Genome Browser". ensembl.org.
- ^ Mardis ER (March 2008). "The impact of next-generation sequencing technology on genetics". Trends in Genetics. 24 (3): 133–141. doi:10.1016/j.tig.2007.12.007. PMC 2680276. PMID 18262675.
- ^ Liu Y, Gonzàlez-Porta M, Santos S, Brazma A, Marioni JC, Aebersold R, et al. (August 2017). "Impact of Alternative Splicing on the Human Proteome". Cell Reports (in الإنجليزية). 20 (5): 1229–1241. doi:10.1016/j.celrep.2017.07.025. PMC 5554779. PMID 28768205.
- ^ Ballouz S, Dobin A, Gillis JA (August 2019). "Is it time to change the reference genome?". Genome Biology. 20 (1): 159. doi:10.1186/s13059-019-1774-4. PMC 6688217. PMID 31399121.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Pertea M, Salzberg SL (2010). "Between a chicken and a grape: estimating the number of human genes". Genome Biology. 11 (5): 206. doi:10.1186/gb-2010-11-5-206. PMC 2898077. PMID 20441615.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب ت Venter JC, Adams MD, Myers EW, Li PW, Mural RJ, Sutton GG, et al. (February 2001). "The sequence of the human genome". Science. 291 (5507): 1304–1351. Bibcode:2001Sci...291.1304V. doi:10.1126/science.1058040. PMID 11181995.
- ^ Lander ES, Linton LM, Birren B, Nusbaum C, Zody MC, Baldwin J, et al. (International Human Genome Sequencing Consortium (IHGSC)) (October 2004). "Finishing the euchromatic sequence of the human genome". Nature. 431 (7011): 931–945. Bibcode:2004Natur.431..931H. doi:10.1038/nature03001. PMID 15496913.
- ^ Spencer G (20 December 2004). "International Human Genome Sequencing Consortium Describes Finished Human Genome Sequence". NIH Nes Release. National Institutes of Health.
- ^ Bryant JA (2007). Design and information in biology: From molecules to systems. p. 108. ISBN 9781853128530.
...brought to light about 1200 protein families. Only 94 protein families, or 7%, appear to be vertebrate specific
- ^ Roach JC, Boysen C, Wang K, Hood L (March 1995). "Pairwise end sequencing: a unified approach to genomic mapping and sequencing". Genomics. 26 (2): 345–353. doi:10.1016/0888-7543(95)80219-C. PMID 7601461.
- ^ Center for Biomolecular Science & Engineering. "The Human Genome Project Race". Center for Biomolecular Science and Engineering. Retrieved 1 August 2013.
- ^ Gillis, Justin (March 15, 2000). "Clinton, Blair Urge Open Access to Gene Data". Washington Post.
- ^ Osoegawa K, Mammoser AG, Wu C, Frengen E, Zeng C, Catanese JJ, de Jong PJ (March 2001). "A bacterial artificial chromosome library for sequencing the complete human genome". Genome Research. 11 (3): 483–496. doi:10.1101/gr.169601. PMC 311044. PMID 11230172.
- ^ Tuzun E, Sharp AJ, Bailey JA, Kaul R, Morrison VA, Pertz LM, et al. (July 2005). "Fine-scale structural variation of the human genome". Nature Genetics. 37 (7): 727–732. doi:10.1038/ng1562. PMID 15895083. S2CID 14162962.
- ^ Kennedy D (August 2002). "Not wicked, perhaps, but tacky". Science. 297 (5585): 1237. doi:10.1126/science.297.5585.1237. PMID 12193755.
- ^ Venter JC (February 2003). "A part of the human genome sequence". Science. 299 (5610): 1183–1184. doi:10.1126/science.299.5610.1183. PMID 12595674. S2CID 5188811.
- ^ أ ب Naidoo N, Pawitan Y, Soong R, Cooper DN, Ku CS (October 2011). "Human genetics and genomics a decade after the release of the draft sequence of the human genome". Human Genomics. 5 (6): 577–622. doi:10.1186/1479-7364-5-6-577. PMC 3525251. PMID 22155605.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Gonzaga-Jauregui C, Lupski JR, Gibbs RA (2012). "Human genome sequencing in health and disease". Annual Review of Medicine. 63 (1): 35–61. doi:10.1146/annurev-med-051010-162644. PMC 3656720. PMID 22248320.
- ^ Snyder M, Du J, Gerstein M (March 2010). "Personal genome sequencing: current approaches and challenges". Genes & Development. 24 (5): 423–31. doi:10.1101/gad.1864110. PMC 2827837. PMID 20194435.
- ^ Lander ES (February 2011). "Initial impact of the sequencing of the human genome" (PDF). Nature. 470 (7333): 187–97. Bibcode:2011Natur.470..187L. doi:10.1038/nature09792. hdl:1721.1/69154. PMID 21307931. S2CID 4344403.
- ^ Peng JH, Sun D, Nevo E (2011). "Domestication Evolution, Genetics And Genomics In Wheat". Molecular Breeding. 28 (3): 281–301. doi:10.1007/s11032-011-9608-4. S2CID 24886686.
- ^ Greely H (1992). The Code of Codes: Scientific and Social Issues in the Human Genome Project. Cambridge, Massachusetts: Harvard University Press. pp. 264–265. ISBN 978-0-674-13646-5.
- ^ US Department of Health and Human Services (2015-08-26). "Understanding Health Information Privacy".
- ^ Human Genome Information Archive. "Insights Learned from the Human DNA Sequence". U.S. Department of Energy & Human Genome Project program. Archived from the original on 3 سبتمبر 2011. Retrieved 20 فبراير 2021.
- ^ "What were some of the ethical, legal, and social implications addressed by the Human Genome Project?". Genetics Home Reference. U.S. National Library of Medicine. 2013. Retrieved 1 August 2013.
- ^ "ELSI Research Program Fact Sheet – National Human Genome Research Institute (NHGRI)". www.genome.gov. Retrieved 2016-09-27.
- ^ Rheinberger HJ (2000). Living and Working with the New Medical Technologies. Cambridge: Cambridge University Press. p. 20.
قراءات إضافية
- McElheny VK (2010). Drawing the Map of Life: Inside the Human Genome Project. Basic Books. ISBN 978-0-465-03260-0. 361 pages. Examines the intellectual origins, history, and motivations of the project to map the human genome; draws on interviews with key figures.
- Collins F (2006). The Language of God: A Scientist Presents Evidence for Belief. Free Press. ISBN 978-0-7432-8639-8. OCLC 65978711.
- Venter JC (October 18, 2007). A Life Decoded: My Genome: My Life. New York, New York: Viking Adult. ISBN 978-0-670-06358-1. OCLC 165048736.
- Cook-Deegan R (1994). The Gene Wars: Science, Politics, and the Human Genome. New York: W W Norton. ISBN 9780393035728.
- Lone Dog L (1999). "Whose genes are they? The Human Genome Diversity Project". Journal of Health & Social Policy. 10 (4): 51–66. doi:10.1300/J045v10n04_04. PMID 10538186.
وصلات خارجية
- National Human Genome Research Institute (NHGRI). NHGRI led the National Institutes of Health's contribution to the International Human Genome Project. This project, which had as its primary goal the sequencing of the three billion base pairs that make up the human genome, was successfully completed in April 2003.
- Human Genome News. Published from 1989 to 2002 by the US Department of Energy, this newsletter was a major communications method for coordination of the Human Genome Project. Complete online archives are available.
- The HGP information pages Department of Energy's portal to the international Human Genome Project, Microbial Genome Program, and Genomics:GTL systems biology for energy and environment
- yourgenome.org: The Sanger Institute public information pages has general and detailed primers on DNA, genes, and genomes, the Human Genome Project and science spotlights.
- Ensembl project, an automated annotation system and browser for the human genome
- UCSC genome browser, This site contains the reference sequence and working draft assemblies for a large collection of genomes. It also provides a portal to the ENCODE project.
- Nature magazine's human genome gateway, including the HGP's paper on the draft genome sequence
- Wellcome Trust Human Genome website A free resource allowing you to explore the human genome, your health and your future.
- Learning about the Human Genome. Part 1: Challenge to Science Educators. ERIC Digest.
- Learning about the Human Genome. Part 2: Resources for Science Educators. ERIC Digest.
- Patenting Life by Merrill Goozner
- Prepared Statement of Craig Venter of Celera Venter discusses Celera's progress in deciphering the human genome sequence and its relationship to healthcare and to the federally funded Human Genome Project.
- Cracking the Code of Life Companion website to 2-hour NOVA program documenting the race to decode the genome, including the entire program hosted in 16 parts in either QuickTime or RealPlayer format.
- Bioethics Research Library Numerous original documents at Georgetown University.
- أعمال في الأرشيف
- أعمال من Human Genome Project في مشروع گوتنبرگ
- Project Gutenberg hosts e-texts for Human Genome Project, titled Human Genome Project, Chromosome Number # (# denotes 01–22, X and Y). This information is the raw sequence, released in November 2002; access to entry pages with download links is available through Human Genome Project, Chromosome Number 01 for Chromosome 1 sequentially to Human Genome Project, Y Chromosome for the Y Chromosome. Note that this sequence might not be considered definitive because of ongoing revisions and refinements. In addition to the chromosome files, there is a supplementary information file dated March 2004 which contains additional sequence information.
- Works by or about مشروع الجينوم البشري at Internet Archive
- CS1 maint: unflagged free DOI
- Articles with dead external links from August 2014
- CS1 errors: unsupported parameter
- CS1 errors: missing title
- CS1 errors: bare URL
- Short description is different from Wikidata
- Articles containing إنگليزية-language text
- Pages using Lang-xx templates
- Articles containing روسية-language text
- Articles with unsourced statements from December 2022
- Articles with unsourced statements from February 2023
- مشروعات الجينوم ابشري
- علماء مشروع الجينوم البشري
- تكنولوجيا حيوية
- صناعة علوم الحياة
- صندوق ويلكم
- مشروعات تأسست في 1990
- 1990 في التكنولوجيا الحيوية
- 1990 في علم الأحياء
- 1990 في العلوم
- تأسيسات 1990 في الولايات المتحدة
- 2003 في التكنولوجيا الحيوية
- جيمس واطسون
- علم الجينوم
- مشاريع الجينوم
- معلوماتية حيوية