حمض الكبريتيك
| |||

| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
Sulfuric acid
| |||
| أسماء أخرى
زيت الزاج Oil of vitriol
Hydrogen sulfate | |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.763 | ||
| رقم EC |
| ||
| E number | E513 (acidity regulators, ...) | ||
| مرجع Gmelin | 2122 | ||
| KEGG | |||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
| UN number | 1830 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| الخصائص | |||
| الصيغة الجزيئية | H 2SO 4 | ||
| كتلة مولية | 98.079 g/mol | ||
| المظهر | Clear, colorless liquid | ||
| الرائحة | Odorless | ||
| الكثافة | 1.8302 g/cm3, liquid[1] | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | miscible, exothermic | ||
| ضغط البخار | 0.001 mmHg (20 °س)[2] | ||
| الحموضة (pKa) | -2.8 , 1.99 | ||
| اللزوجة | 26.7 cP (20 °س) | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
−814 kJ·mol−1[3] | ||
| Standard molar entropy S |
157 J·mol−1·K−1[3] | ||
| المخاطر | |||
| صفحة بيانات السلامة | External MSDS | ||
| ن.م.ع. مخطط تصويري | 
| ||
| ن.م.ع. كلمة الاشارة | خطر | ||
| H314 | |||
| P260, P264, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P405, P501 | |||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | غير قابل للاشتعال | ||
| 15 مگ/م³ (IDLH), 1 مگ/م³ (TWA), 2 مگ/م³ (STEL) | |||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LD50 (الجرعة الوسطى)
|
2140 mg/kg (فئران، فموياً)[4] | ||
LC50 (التركيز الأوسط)
|
50 مگ/م³ (فأر التجارب، 8 hr) 510 مگ/م³ (rat, 2 hr) 320 مگ/م³ (فئران، 2 hr) 18 مگ/م³ (فأر التجارب)[4] | ||
LCLo (المنشورة الأقل)
|
87 مگ/م³ (فأر التجارب، 2.75 hr)[4] | ||
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |||
PEL (المسموح)
|
TWA 1 مگ/م³[2] | ||
REL (الموصى به)
|
TWA 1 مگ/م³[2] | ||
IDLH (خطر عاجل)
|
15 مگ/م³[2] | ||
| مركبات ذا علاقة | |||
أحماض قوية ذات العلاقة
|
حمض السلينيك حمض الهيدروكلوريك حمض النيتريك حمض الكروميك | ||
مركـّبات ذات علاقة
|
كبريتيد الهيدروجين حمض الكبريتوز حمض پروكسي أحادي الكبريتيك ثالث أكسيد الكبريت أوليوم | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
حمض الكبريتيك (إنجليزية إنجلترا :Sulphuric acid إنجليزية أمريكا :Sulfuric acid), H2SO4, هو حمض معدني قوي، مكون من العناصر كبريت وأكسجين وهيدروجين. وهو سائل عديم اللون ولزج قابل للذوبان في الماء عند كل تركيزاته، ويـُخلـَّق في تفاعلات مولدة للحرارة بكثرة.[5]
The acid's corrosiveness towards other materials can be mainly described due to its strong acidic nature, and if at a high concentration its dehydrating alongside oxidizing properties. It is also hygroscopic, readily absorbing water vapor from the air.[5] Upon contact, sulfuric acid can cause severe chemical burns and even secondary thermal burns due to dehydration; it is very dangerous even at lower concentrations.[6][7]
Sulfuric acid is a very important commodity chemical, and a nation's sulfuric acid production is a good indicator of its industrial strength.[8] It is widely produced with different methods, such as contact process, wet sulfuric acid process, lead chamber process and some other methods.[9]
Sulfuric acid is also a key substance in the chemical industry. It is most commonly used in fertilizer manufacture,[10] but is also important in mineral processing, oil refining, wastewater processing, and chemical synthesis. It has a wide range of end applications including in domestic acidic drain cleaners,[11] as an electrolyte in lead-acid batteries, in dehydrating a compound, and in various cleaning agents.
وكان يـُعرف باسم زيت الزاج oil of vitriol, وهو الاسم الذي صاغه في القرن الثامن العالم المسلم جابر بن حيان (Geber) بعد اكتشافه المركب الكيميائي.[12] حمض الكبريتيك له الكثير من التطبيقات, وهو أحد أهم المنتجات في الصناعات الكيماوية. وبلغ الانتاج العالمي منه سنة 2001 نحو 165 مليون طن, بقيمة $8 بليون دولار. الاستخدامات الرئيسية تتضمن معالجة خامات المعادن, صناعة الأسمدة, تكرير النفط, معالجة مياه المجاري, والتخليق الكيميائي.
العديد من الپروتينات تحتوي على الكبريت في الأحماض الأمينية (مثل سيستين cysteine ومثيونين methionine) اللذان ينتجا حمض الكبريتيك خلال عملية الأيض في الجسم البشري.
وصف
حمض الكبريتيك سائل زيتي كثيف عديم اللون حارق، وآكل جدًا، ويؤدي دورًا مهمًا في إنتاج كثير من السلع المصنعة التي يستخدمها معظم الناس. ويصنف الكيميائيون حمض الكبريتيك بوصفه حمضًا معدنيًا قويًا وصيغته الكيميائية هي: H2 SO4. ويعتبر حمض الكبريتيك واحدًا من أقوى الأحماض ويمكنه حرق الجلد وتهييج النسيج المبطن للأنف، والقصبة الهوائية والرئتين. وتحمي معايير الأمان في كثير من البلاد العمال من التعرض الزائد لحمض الكبريتيك أو لأبخرته.
الخواص الفيزيائية
درجات حمض الكبريتيك
بالرغم من إمكانية تحضير حمض الكبريتيك بتركيز 100% إلا أنه يفقد SO3 عند درجة الغليان ويعطي حمض تركيزه 98.3% ينحل في الماء ناشرا كمية كبيرة من الحرارة نتيجة للتميه لذلك ينصح بالحذر عند تمديد الحمض وذلك بصب الحمض فوق الماء وليس العكس لأنه شره جدا للماء لذلك يستعمل في تجفيف الغازات الرطبة كما يخرب المواد العضوية والخلايا الحية لسحبه الماء منها. The 98.3% grade is more stable in storage, and is the usual form of what is described as "concentrated sulfuric acid". Other concentrations are used for different purposes. Some common concentrations are:[13][14]
| Mass fraction H2SO4 |
الكثافة (kg/L) |
Concentration (mol/L) |
الاسم الشائع |
|---|---|---|---|
| <29% | 1.00-1.25 | <4.2 | diluted sulfuric acid |
| 29–32% | 1.25–1.28 | 4.2–5.0 | battery acid (used in lead–acid batteries) |
| 62–70% | 1.52–1.60 | 9.6–11.5 | chamber acid fertilizer acid |
| 78–80% | 1.70–1.73 | 13.5–14.0 | tower acid Glover acid |
| 93.2% | 1.83 | 17.4 | 66 °Bé ("66-degree Baumé") acid |
| 98.3% | 1.84 | 18.4 | concentrated sulfuric acid |
"Chamber acid" and "tower acid" were the two concentrations of sulfuric acid produced by the lead chamber process, chamber acid being the acid produced in the lead chamber itself (<70% to avoid contamination with nitrosylsulfuric acid) and tower acid being the acid recovered from the bottom of the Glover tower.[13][14] They are now obsolete as commercial concentrations of sulfuric acid, although they may be prepared in the laboratory from concentrated sulfuric acid if needed. In particular, "10M" sulfuric acid (the modern equivalent of chamber acid, used in many titrations) is prepared by slowly adding 98% sulfuric acid to an equal volume of water, with good stirring: the temperature of the mixture can rise to 80 °C (176 °F) or higher.[14]
Sulfuric acid reacts with its anhydride, SO 3, to form H 2S 2O 7, called pyrosulfuric acid, fuming sulfuric acid, Disulfuric acid or oleum or, less commonly, Nordhausen acid. Concentrations of oleum are either expressed in terms of % SO 3 (called % oleum) or as % H 2SO 4 (the amount made if H 2O were added); common concentrations are 40% oleum (109% H 2SO 4) and 65% oleum (114.6% H 2SO 4). Pure H 2S 2O 7 is a solid with melting point of 36 °C.
Pure sulfuric acid has a vapor pressure of <0.001 mmHg at 25 °C and 1 mmHg at 145.8 °C,[15] and 98% sulfuric acid has a <1 mmHg vapor pressure at 40 °C.[16]
Pure sulfuric acid is a viscous clear liquid, like oil, and this explains the old name of the acid ('oil of vitriol').
Commercial sulfuric acid is sold in several different purity grades. Technical grade H 2SO 4 is impure and often colored, but is suitable for making fertilizer. Pure grades, such as USP grade, are used for making pharmaceuticals and dyestuffs. Analytical grades are also available.
Nine hydrates are known, but four of them were confirmed to be tetrahydrate (H2SO4·4H2O), hemihexahydrate (H2SO4·61⁄2H2O) and octahydrate (H2SO4·8H2O).
القطبية والموصلية
| الأنواع | mMol/kg |
|---|---|
| HSO−4 | 15.0 |
| H 3SO+4 | 11.3 |
| H 3O+ | 8.0 |
| HS 2O−7 | 4.4 |
| H 2S 2O 7 | 3.6 |
| H 2O | 0.1 |
Anhydrous H 2SO 4 is a very polar liquid, having a dielectric constant of around 100. It has a high electrical conductivity, caused by dissociation through protonating itself, a process known as autoprotolysis.[17]
- 2 H 2SO 4
 H 3SO+4 + HSO−4
H 3SO+4 + HSO−4
The equilibrium constant for the autoprotolysis is[17]
- Kap (25 °C) = [H 3SO+4][HSO−4] = 2.7×10−4
The comparable equilibrium constant for water, Kw is 10−14, a factor of 1010 (10 billion) smaller.
In spite of the viscosity of the acid, the effective conductivities of the H 3SO+4 and HSO−4 ions are high due to an intramolecular proton-switch mechanism (analogous to the Grotthuss mechanism in water), making sulfuric acid a good conductor of electricity. It is also an excellent solvent for many reactions.
حمض الكبريتيك سائل عديم اللون، زيتي القوام لا رائحة له عندما يكون نقياً، إلا أنه يعطي أحياناً رائحة غاز ثالث أكسيد الكبريت (SO3 ) عند وجود هذا الغاز بنسبة عالية اثناء تحضير الحمض . كما يتميز حامض الكبريتيك المركز بأنه موصل للتيار الكهربائي يتجمد حمض الكبريتيك عند درجة حرارة 10 درجة مئوية، بينما يغلي حامض الكبريتيك المركز (100 % وزناً ) عند درجة حرارة 330 درجة مئوية محرراً ثالث أكسيد الكبريت. تبلغ كثافة حامض الكبريتيك 1.84 جم / ملل
الخواص الكيميائية
التفاعل مع الماء وخاصية نزع الماء
تختلف خواصه الكيماوية بحسب ما يكون ممدداً أو مركزا فحمض الكبريت الممدد يتفاعل مباشرة مع المعادن الواقعة قبل الهيدروجين في سلسلة النشاط الكيماوي (الإزاحة) معطيا كبريتات المعدن ومطلقا الهيدروجين أما المعادن التي تقع بعد الهيدروجين ك النحاس و الفضة فلا يتفاعل معها إلا بدخول مؤكسد قوي كالأوكسجين أو حمض الآزوت ولا يتفاعل أبدا مع الذهب و البلاتين. أما حمض الكبريت المركز فيتفاعل مع جميع المعادن الواقعة قبل وبعد الهيدروجين عدا الذهب والبلاتين ولكن بوجود الحرارة ويعطي كبريتات المعدن وثنائي أكسيد الكبريت والماء . كما يتفاعل الحمض المركز مع اللامعادن معطيا ثنائي اكسيد الكبريت وأكسيد اللافلز والماء.
- يد٢كب أ٤ + يد٢أ ← يد٣أ+ + يد كب أ٤−
- H2SO4 + H2O → H3O+ + HSO4−,
ثم بعد ذلك
- HSO4− + H2O → H3O+ + SO42−.
تفاعلات أخرى لحمض الكبريتيك
الجوانب البيئية
يعتبر حمض الكبريتيك من مكونات الأمطار الحمضية ، حيث يتكون من من أكسدة الأكسجين الجوي لثاني أكسيد الكبريت في وجود الماء. (أكسدة حمض الكبريتوز ). ثاني أكسيد الكبريت هو الناتج الأساسي لعمليات حرق الكبريت أو أحد أنواع الوقود الذي يحتوي على الكبريت مثل الفحم والزيت.
The Fe2+ can be further oxidized to Fe3+, according to:
and the Fe3+ produced can be precipitated as the hydroxide or hydrous oxide. The equation for the formation of the hydroxide is
حمض الكبريتيك في الفضاء الخارجي
حمض الكبريتيك يتم انتاجه في أعلى الغلاف الجوي لكوكب الزهرة بواسطة المفعول الكيميائي الضوئي للشمس على ثاني اكسيد الكربون, ثاني اكسيد الكبريت, و بخار الماء.
تاريخ حمض الكبريتيك

The study of vitriol, a category of glassy minerals from which the acid can be derived, began in ancient times. Sumerians had a list of types of vitriol that they classified according to the substances' color. Some of the earliest discussions on the origin and properties of vitriol is in the works of the Greek physician Dioscorides (first century AD) and the Roman naturalist Pliny the Elder (23–79 AD). Galen also discussed its medical use. Metallurgical uses for vitriolic substances were recorded in the Hellenistic alchemical works of Zosimos of Panopolis, in the treatise Phisica et Mystica, and the Leyden papyrus X.[18]
Medieval Islamic era alchemists, Jābir ibn Hayyān (c. 721 – c. 815 AD, also known as Geber), Muhammad ibn Zakariya al-Razi (865 – 925 AD), and Jamal Din al-Watwat (d. 1318, wrote the book Mabāhij al-fikar wa-manāhij al-'ibar), included vitriol in their mineral classification lists. Ibn Sina focused on its medical uses and different varieties of vitriol.[18] Razi is credited with being the first to produce sulfuric acid.[19][20]
Sulfuric acid was called "oil of vitriol" by medieval European alchemists because it was prepared by roasting "green vitriol" (iron(II) sulfate) in an iron retort. There are references to it in the works of Vincent of Beauvais and in the Compositum de Compositis ascribed to Saint Albertus Magnus. A passage from Pseudo-Geber's Summa Perfectionis was long considered to be a recipe for sulfuric acid, but this was a misinterpretation.[18]
In the seventeenth century, the German-Dutch chemist Johann Glauber prepared sulfuric acid by burning sulfur together with saltpeter (potassium nitrate, KNO 3), in the presence of steam. As saltpeter decomposes, it oxidizes the sulfur to SO 3, which combines with water to produce sulfuric acid. In 1736, Joshua Ward, a London pharmacist, used this method to begin the first large-scale production of sulfuric acid.
In 1746 in Birmingham, John Roebuck adapted this method to produce sulfuric acid in lead-lined chambers, which were stronger, less expensive, and could be made larger than the previously used glass containers. This process allowed the effective industrialization of sulfuric acid production. After several refinements, this method, called the lead chamber process or "chamber process", remained the standard for sulfuric acid production for almost two centuries.[3]
Sulfuric acid created by John Roebuck's process approached a 65% concentration. Later refinements to the lead chamber process by French chemist Joseph Louis Gay-Lussac and British chemist John Glover improved concentration to 78%. However, the manufacture of some dyes and other chemical processes require a more concentrated product. Throughout the 18th century, this could only be made by dry distilling minerals in a technique similar to the original alchemical processes. Pyrite (iron disulfide, FeS 2) was heated in air to yield iron(II) sulfate, FeSO 4, which was oxidized by further heating in air to form iron(III) sulfate, Fe2(SO4)3, which, when heated to 480 °C, decomposed to iron(III) oxide and sulfur trioxide, which could be passed through water to yield sulfuric acid in any concentration. However, the expense of this process prevented the large-scale use of concentrated sulfuric acid.[3]
In 1831, British vinegar merchant Peregrine Phillips patented the contact process, which was a far more economical process for producing sulfur trioxide and concentrated sulfuric acid. Today, nearly all of the world's sulfuric acid is produced using this method.[21]
الإستخدامات
حمض الكبريتيك شديد الأهمية ، لدرجة أنه يقاس تقدم الأمم بحجم إنتاجها لحمض الكبريتيك ويعطي مؤشراً جيداً[22]. الاستخدام الرئيسي(60% من العالم كله) لحمض الكبريتيك يكون في "الطريقة المبتلة" لإنتاج حمض الفوسفوريك ، الذي يستخدم في صناعة الأسمدة الفوسفاتية ، وكذالك فوسفات ثلاثي الصوديوم المستخدم في صناعة المنظفات.
- Ca5F(PO4)3 + 5 H2SO4 + 10 H2O → 5 CaSO4•2 H2O + HF + 3 H3PO4.
يستخدم حمض الكبريتيك بصفة رئيسية في صناعة الأسمدة. وتستخدمه المصانع الأخرى لإنتاج سلع مثل بطاريات السيارات والمتفجرات، ومواد الصباغة والحديد والمعادن الأخرى، ولب الورق.
وتستخدم الصناعات الكيميائية حمض الكبريتيك في إنتاج أنواع كثيرة من المواد العضوية، فهو على سبيل المثال يستخدم في صناعة الكحول من الإيثيلين.
ويتفاعل حمض الكبريتيك مع البنزين وغيره من المركَّبات الأخرى لصنع السلفونات التي تستخدم في المواد المنظفة القوية، كما يستخدم أيضًا في صناعة الأصباغ والأدوية.
وقوة حمض الكبريتيك تجعله مفيدًا في إنتاج الأحماض الأخرى، وفي التخلص من المواد الذائبة في المعادن. وكذلك فإن الكثير من المعادن تذوب في حمض الكبريتيك لتكون الكبريتات (أملاح الحمض) ولها استخدامات مهمة في الصناعة. ويتحد حمض الكبريتيك بسرعة مع الماء. والجاذبية الكيميائية القوية لحمض الكبريتيك للماء تساعده على إزالة الهيدروجين والأكسجين (العنصران المكونان للماء). وفي كثير من المواد تجعله هذه الخاصية، مفيدًا بوصفه عامل تجفيف. ويتضح هذا مع السكر الذي يحتوي على كربون وهيدروجين وأكسجين. فعندما يتم صب حمض الكبريتيك على السكَّر، فإن الخليط يتحلل ويتحول إلى كربون رغوي أسود (فحم نباتي). ويتفاعل الماء وحمض الكبريتيك المركَّز بشدة عند خلطهما، حيث يصبح الخليط في حالة غليان شديد. ويجب إضافة كميات صغيرة من حمض الكبريتيك إلى الماء ببطء وحرص، ولا يضاف الماء إلى حمض الكبريتيك لأن هذا الإجراء ينتج عنه تطاير شديد.
ويحتوي حمض الكبريتيك أحيانًا على مزيد من ثالث أكسيد الكبريت وهي مادة كيميائية ينبعث منها الغاز عندما تتحد مع الرطوبة التي في الجو. ويطلق الكيميائيون على هذا النوع من حمض الكبريتيك الزيت أو حمض الكبريتيك المتبخر، ويتم استخدامه في إحدى طرق تصنيع حمض الكبريتيك.
دورة الكبريت واليود
دورة الكبريت-اليود هي سلسلة من العمليات الكيميائية الحرارية المستخدمة للحصول على الهيدروجين. وتتكون من ثلاث تفاعلات كيميائية مفاعهم الخالص هو الماء ومنتجاتهم الخالصة هي الهيدروجين والأكسجين.
The compounds of sulfur and iodine are recovered and reused, hence the consideration of the process as a cycle. This process is endothermic and must occur at high temperatures, so energy in the form of heat has to be supplied.
The sulfur–iodine cycle has been proposed as a way to supply hydrogen for a hydrogen-based economy. It is an alternative to electrolysis, and does not require hydrocarbons like current methods of steam reforming. But note that all of the available energy in the hydrogen so produced is supplied by the heat used to make it.
The sulfur–iodine cycle is currently being researched as a feasible method of obtaining hydrogen, but the concentrated, corrosive acid at high temperatures poses currently insurmountable safety hazards if the process were built on a large scale.[23][24]
عامل تنظيف صناعي
Sulfuric acid is used in large quantities by the iron and steelmaking industry to remove oxidation, rust, and scaling from rolled sheet and billets prior to sale to the automobile and major appliances industry.[بحاجة لمصدر] Used acid is often recycled using a spent acid regeneration (SAR) plant. These plants combust spent acid[مطلوب توضيح] with natural gas, refinery gas, fuel oil or other fuel sources. This combustion process produces gaseous sulfur dioxide (SO 2) and sulfur trioxide (SO 3) which are then used to manufacture "new" sulfuric acid. SAR plants are common additions to metal smelting plants, oil refineries, and other industries where sulfuric acid is consumed in bulk, as operating a SAR plant is much cheaper than the recurring costs of spent acid disposal and new acid purchases.
Hydrogen peroxide (H 2O 2) can be added to sulfuric acid to produce piranha solution, a powerful but very toxic cleaning solution with which substrate surfaces can be cleaned. Piranha solution is typically used in the microelectronics industry, and also in laboratory settings to clean glassware.
محفز
Sulfuric acid is used for a variety of other purposes in the chemical industry. For example, it is the usual acid catalyst for the conversion of cyclohexanone oxime to caprolactam, used for making nylon. It is used for making hydrochloric acid from salt via the Mannheim process. Much H 2SO 4 is used in petroleum refining, for example as a catalyst for the reaction of isobutane with isobutylene to give isooctane, a compound that raises the octane rating of gasoline (petrol). Sulfuric acid is also often used as a dehydrating or oxidising agent in industrial reactions, such as the dehydration of various sugars to form solid carbon.
كهرل

Sulfuric acid acts as the electrolyte in lead–acid batteries (lead-acid accumulator):
At anode:
- Pb + SO 42− ⇌ PbSO 4 + 2 e−
At cathode:
- PbO 2 + 4 H+ + SO 42− + 2 e− ⇌ PbSO 4 + 2 H2O

Overall:
- Pb + PbO 2 + 4 H+ + 2 SO 42− ⇌ 2 PbSO 4 + 2 H2O
الاستخدامات المنزلية
Sulfuric acid at high concentrations is frequently the major ingredient in acidic drain cleaners[11] which are used to remove grease, hair, tissue paper, etc. Similar to their alkaline versions, such drain openers can dissolve fats and proteins via hydrolysis. Moreover, as concentrated sulfuric acid has a strong dehydrating property, it can remove tissue paper via dehydrating process as well. Since the acid may react with water vigorously, such acidic drain openers should be added slowly into the pipe to be cleaned.
تحصير حمض الكبريتيك
وصفت عملية التحضير التجاري لحمض الكبريتيك في القرن السادس عشر الميلادي. أما اليوم، فيتم تصنيع الحمض أساسًا من الكبريت بإحدى طريقتين: طريقة التلامس وطريقة غرفة الرصاص وهي طريقة قديمة. وتنتج طريقة التلامس حمض الكبريتيك أنقى وأكثر تركيزًا من طريقة غرفة الرصاص. ويتم تصنيع ثالث أكسيد الكبريت بطريقة التلامس عن طريق تمرير غاز ثاني أكسيد الكبريت العديم اللون من خلال أنبوب ساخن يحتوي إما على الفاناديوم أو البلاتين اللذين يقومان بدور الحفَّاز.فيذوب ثالث أكسيد الكبريت في حمض الكبريتيك المركز مكونًا الزيت الذي يضاف إلى الماء لإنتاج حمض الكبريتيك بأي تركيز مطلوب. وتبدأ طريقة غرفة الرصاص بحرق الكبريت لتكوين ثاني أكسيد الكبريت الذي يتفاعل بعد ذلك مع مركبات النيتروجين التي تسمى أكاسيد النتريك وذلك داخل غرفة مبطنة بالرصاص لتنتج حمض الكبريتيك. وهذه الطريقة الثانية ليست مكلفة ولكنها تنتج حمضًا ضعيفًا نسبيًا. ويمكن إنتاج حمض الكبريتيك من ثاني أكسيد الكبريت الذي نحصل عليه كمنتج ثانوي بتحميص النحاس وبيريت الحديد وغيرهما من خامات الكبريت الأخرى، وتستخدم عملية التحميص في فصل وتنقية خامات المعادن عن طريق تسخينها في الهواء.
ويمكن أن تزودنا محطات توليد الكهرباء التي تحرق الفحم كوقود، بمصدر أساسي وعملي لحمض الكبريتيك وذلك في المستقبل، حيث يمكن إنتاج حمض الكبريتيك من ثاني أكسيد الكبريت الناتج عن تنقية الغازات المنطلقة خلال احتراق الفحم. ولكن الشوائب الكثيرة الموجودة بهذه الغازات تجعل من الصعب تجميع ثاني أكسيد الكبريت بهذه الصورة. وكذلك نجد أن المكان البعيد لمحطات توليد الطاقة يُصعِّب مشكلة نقل حمض الكبريتيك الذي هو مادة آكلة وحارقة جدًا.
السلامة
مخاطر المعمل
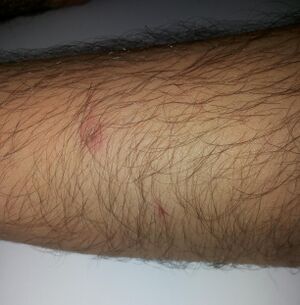
Sulfuric acid is capable of causing very severe burns, especially when it is at high concentrations. In common with other corrosive acids and alkali, it readily decomposes proteins and lipids through amide and ester hydrolysis upon contact with living tissues, such as skin and flesh. In addition, it exhibits a strong dehydrating property on carbohydrates, liberating extra heat and causing secondary thermal burns.[6][7] Accordingly, it rapidly attacks the cornea and can induce permanent blindness if splashed onto eyes. If ingested, it damages internal organs irreversibly and may even be fatal.[5] Protective equipment should hence always be used when handling it. Moreover, its strong oxidizing property makes it highly corrosive to many metals and may extend its destruction on other materials.[6] Because of such reasons, damage posed by sulfuric acid is potentially more severe than that by other comparable strong acids, such as hydrochloric acid and nitric acid.
Sulfuric acid must be stored carefully in containers made of nonreactive material (such as glass). Solutions equal to or stronger than 1.5 M are labeled "CORROSIVE", while solutions greater than 0.5 M but less than 1.5 M are labeled "IRRITANT". However, even the normal laboratory "dilute" grade (approximately 1 M, 10%) will char paper if left in contact for a sufficient time.
The standard first aid treatment for acid spills on the skin is, as for other corrosive agents, irrigation with large quantities of water. Washing is continued for at least ten to fifteen minutes to cool the tissue surrounding the acid burn and to prevent secondary damage. Contaminated clothing is removed immediately and the underlying skin washed thoroughly.
مخاطر التخفيف
Preparation of the diluted acid can be dangerous due to the heat released in the dilution process. To avoid splattering, the concentrated acid is usually added to water and not the other way around. Water has a higher heat capacity than the acid, and so a vessel of cold water will absorb heat as acid is added.
| الخاصية الطبيعية | H2SO4 | Water | Units |
|---|---|---|---|
| الكثافة | 1.84 | 1.0 | kg/L |
| Volumetric heat capacity | 2.54 | 4.18 | kJ/L |
| نقطة الغليان | 337 | 100 | °C |
Also, because the acid is denser than water, it sinks to the bottom. Heat is generated at the interface between acid and water, which is at the bottom of the vessel. Acid will not boil, because of its higher boiling point. Warm water near the interface rises due to convection, which cools the interface, and prevents boiling of either acid or water.
In contrast, addition of water to concentrated sulfuric acid results in a thin layer of water on top of the acid. Heat generated in this thin layer of water can boil, leading to the dispersal of a sulfuric acid aerosol or worse, an explosion.
Preparation of solutions greater than 6 M (35%) in concentration is most dangerous, because the heat produced may be sufficient to boil the diluted acid: efficient mechanical stirring and external cooling (such as an ice bath) are essential.
Reaction rates double for about every 10-degree Celsius increase in temperature.[25] Therefore, the reaction will become more violent as dilution proceeds, unless the mixture is given time to cool. Adding acid to warm water will cause a violent reaction.
On a laboratory scale, sulfuric acid can be diluted by pouring concentrated acid onto crushed ice made from de-ionized water. The ice melts in an endothermic process while dissolving the acid. The amount of heat needed to melt the ice in this process is greater than the amount of heat evolved by dissolving the acid so the solution remains cold. After all the ice has melted, further dilution can take place using water.
المخاطر الصناعية
حمض الكبريتيك هو غير قابل للاشتعال.
The main occupational risks posed by this acid are skin contact leading to burns (see above) and the inhalation of aerosols. Exposure to aerosols at high concentrations leads to immediate and severe irritation of the eyes, respiratory tract and mucous membranes: this ceases rapidly after exposure, although there is a risk of subsequent pulmonary edema if tissue damage has been more severe. At lower concentrations, the most commonly reported symptom of chronic exposure to sulfuric acid aerosols is erosion of the teeth, found in virtually all studies: indications of possible chronic damage to the respiratory tract are inconclusive as of 1997. Repeated occupational exposure to sulfuric acid mists may increase the chance of lung cancer by up to 64 percent.[26] In the United States, the permissible exposure limit (PEL) for sulfuric acid is fixed at 1 mg/m3: limits in other countries are similar. There have been reports of sulfuric acid ingestion leading to vitamin B12 deficiency with subacute combined degeneration. The spinal cord is most often affected in such cases, but the optic nerves may show demyelination, loss of axons and gliosis.
مراجع
- ^ أ ب ت Haynes, William M. (2014). CRC Handbook of Chemistry and Physics (in الإنجليزية) (95 ed.). CRC Press. pp. 4–92. ISBN 9781482208689. Retrieved 18 November 2018.
- ^ أ ب ت ث NIOSH Pocket Guide to Chemical Hazards 0577
- ^ أ ب ت ث Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- ^ أ ب ت "Sulfuric acid". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ أ ب ت "Sulfuric acid safety data sheet" (PDF). arkema-inc.com. Archived from the original (PDF) on 17 June 2012.
Clear to turbid oily odorless liquid, colorless to slightly yellow.
- ^ أ ب ت خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةOA - ^ أ ب "BASF Chemical Emergency Medical Guidelines – Sulfuric acid (H2SO4)" (PDF). BASF Chemical Company. 2012. Archived from the original (PDF) on 2019-06-14. Retrieved 18 December 2014.
- ^ Chenier, Philip J. (1987). Survey of Industrial Chemistry. New York: John Wiley & Sons. pp. 45–57. ISBN 978-0-471-01077-7.
- ^ Hermann Müller "Sulfuric Acid and Sulfur Trioxide" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. 2000 DOI:10.1002/14356007.a25_635
- ^ "Sulfuric acid".
- ^ أ ب "Sulphuric acid drain cleaner" (PDF). herchem.com. Archived from the original (PDF) on 29 October 2013.
- ^ Khairallah, Amin A. Outline of Arabic Contributions to Medicine, chapter 10. Beirut, 1946.
- ^ أ ب "Sulfuric Acid". The Columbia Encyclopedia (6th ed.). 2009. Retrieved 16 March 2010.
- ^ أ ب ت "Sulphuric acid". Encyclopædia Britannica. Vol. 26 (11th ed.). 1910–1911. pp. 65–69.
- ^ "Sulfuric acid" (PDF). Determination of Noncancer Chronic Reference Exposure Levels Batch 2B December 2001. 2001. Archived from the original (PDF) on 22 May 2003. Retrieved 1 October 2012.
- ^ "Sulfuric Acid 98%" (PDF). rhodia.com. 2009. Archived from the original (PDF) on 7 January 2011. Retrieved 2 July 2014.
- ^ أ ب ت Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ أ ب ت Karpenko, Vladimir and Norris, John A. (2001). Vitriol in the history of Chemistry, Charles University
- ^ Modanlou, Houchang D. (November 2008). "A tribute to Zakariya Razi (865 – 925 AD), an Iranian pioneer scholar" (PDF). Archives of Iranian Medicine. 11 (6): 673–677. PMID 18976043. Retrieved 17 May 2018.
Abu Bakr Mohammad Ibn Zakariya al-Razi, known in the West as Rhazes, was born in 865 AD in the ancient city of Rey, Near Tehran. A musician during his youth he became an alchemist. He discovered alcohol and sulfuric acid. He classified substances as plants, organic, and inorganic.
- ^ Schlosser, Stefan (May 2011). "Distillation – from Bronze Age till today". Retrieved 17 May 2018.
Al-Razi (865–925) was the preeminent Pharmacist and physician of his time [5]. The discovery of alcohol, first to produce acids such as sulfuric acid, writing up extensive notes on diseases such as smallpox and chickenpox, a pioneer in ophthalmology, author of first book on pediatrics, making leading contributions in inorganic and organic chemistry, also the author of several philosophical works.
{{cite journal}}: Cite journal requires|journal=(help) - ^ Philip J. Chenier (1 April 2002). Survey of industrial chemistry. Springer. pp. 28–. ISBN 978-0-306-47246-6. Retrieved 23 December 2011.
- ^ Chenier, Philip J. Survey of Industrial Chemistry, pp 45-57. John Wiley & Sons, New York, 1987. ISBN 0-471-01077-4.
- ^ Ngo, Christian; Natowitz, Joseph (2016). Our Energy Future: Resources, Alternatives and the Environment. John Wiley & Sons. pp. 418–419. ISBN 9781119213369.
- ^ https://www.hydrogen.energy.gov/pdfs/review05/pd27_pickard.pdf
- ^ Pauling, L.C. (1988) General Chemistry, Dover Publications
- ^ Beaumont, JJ; Leveton, J; Knox, K; Bloom, T; McQuiston, T; Young, M; Goldsmith, R; Steenland, NK; Brown, DP; Halperin, WE (1987). "Lung cancer mortality in workers exposed to sulfuric acid mist and other acid mists". J Natl Cancer Inst. 79 (5): 911–21. doi:10.1093/jnci/79.5.911. PMID 3479642.
- Institut National de Recherche et de Sécurité. (1997). "Acide sulfurique". Fiche toxicologique n°30, Paris: INRS, 5 pp.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- Agamanolis DP. Metabolic and toxic disorders. In: Prayson R, editor. Neuropathology: a volume in the foundations in diagnostic pathology series. Philadelphia: Elsevier/Churchill Livingstone, 2005; 413-315.
وصلات خارجية
- بطاقة السلامة الكيميائية العالمية 0362
- NIOSH Pocket Guide to Chemical Hazards
- External Material Safety Data Sheet
- Sulfuric acid analysis - titration freeware
المصادر
وصلات خارجية
- بطاقة السلامة الكيميائية العالمية 0362
- Sulfuric acid at The Periodic Table of Videos (University of Nottingham)
- NIOSH Pocket Guide to Chemical Hazards
- CDC – Sulfuric Acid – NIOSH Workplace Safety and Health Topic
- External Material Safety Data Sheet
- Calculators: surface tensions, and densities, molarities and molalities of aqueous sulfuric acid
- Sulfuric acid analysis – titration freeware
- Process flowsheet of sulfuric acid manufacturing by lead chamber process
| أملاح وإستر أيون الكبريتات | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2SO4 | He | ||||||||||||||||||
| Li2SO4 | BeSO4 | B | (RO)2SO3 | (NH4)2SO4 N2H6SO4 (NH3OH)2SO4 |
O | F | Ne | ||||||||||||
| Na2SO4 NaHSO4 |
MgSO4 | Al2(SO4)3 | Si | P | SO42− | Cl | Ar | ||||||||||||
| K2SO4 KHSO4 |
CaSO4 | Sc2(SO4)3 | Ti(SO4)2 | V2(SO4)3 VOSO4 |
CrSO4 Cr2(SO4)3 |
MnSO4 | FeSO4 Fe2(SO4)3 |
CoSO4, Co2(SO4)3 |
NiSO4 | CuSO4 | ZnSO4 | Ga2(SO4)3 | Ge | As | Se | Br | Kr | ||
| Rb2SO4 | SrSO4 | Y | Zr(SO4)2 | Nb | Mo | Tc | Ru | Rh | PdSO4 | Ag2SO4 | CdSO4 | In2(SO4)3 | SnSO4 | Sb2(SO4)3 | Te | I | Xe | ||
| Cs2SO4 | BaSO4 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg2SO4, HgSO4 |
Tl2SO4 | PbSO4 | Bi2(SO4)3 | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |||
| ↓ | |||||||||||||||||||
| La | Ce2(SO4)3 Ce(SO4)2 |
Pr2(SO4)3 | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb2(SO4)3 | Lu | |||||
| Ac | Th | Pa | U(SO4)2 UO2SO4 |
Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||
- Short description is different from Wikidata
- ECHA InfoCard ID from Wikidata
- E number from Wikidata
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Articles with unsourced statements from September 2011
- جميع الصفحات التي تحتاج تنظيف
- مقالات بالمعرفة تحتاج توضيح from February 2015
- حمض الكبريتيك
- كبريتات
- حفازات حمضية
- Dehydrating agents
- كيمياء التوازن
- مركبات الهيدروجين
- مذيبات غير عضوية
- مواد خيميائية
- DEA List II chemicals
- كيماويات التصوير الضوئي
- أحماض مؤكسدة
- أحماض معدنية
- عوامل مؤكسدة
- Sulfur oxoacids
- كبريت
- مضافات غذائية بأرقام أوروپية