معادلة أرنيوس
معادلة أرنيوس أو معادلة أرهنيوس في الكيمياء (بالإنجليزية: Arrhenius equation) هي معادلة مسماة باسم صاحبها العالم الكيميائي سڤانت أرنيوس وهي تصف المسيرة الزمنية للتفاعلات الكيميائية (حركية كيميائية). وتعطي تلك المعادلة مقادير ثابت معدل التفاعل واعتماده على درجة الحرارة.
حيث :
- معامل يسمى معامل التردد (أومعامل اصتدام الجزيئات) ،
- : طاقة تنشيط (بوحدة : جول·مول-1)،
- : = 8,314 J·K-1·mol-1 ثابت الغازات العام
- : درجة الحرارة (بوحدة :كلفن)،
ويلاحظ أن ادالة هنا دالة أسية للأساس الطبيعي e ، وأن كلا من البسط في الأس والمقام لهما نفس الوحدة وهي جول/مول ، وبناءً على ذلك فالوحدات تمحو بعضها ويبقى الأس عددًا حقيقيًا ليست له وحدات (يقال عن ذلك تجانس الوحدات).
اعتبر أرنيوس معامل الاصطدام ثابتا ، ولكن اتضح فيما أن المعادلة تقريبية ، وأن نفسها تعتمد على درجة الحرارة طبقا للعلاقة :
حيث u^* ثابت. ومنها نستنتج أن A تزيد مع الجزر التربيعي لدرجة الحرارة ، وتعمل بدورها هي الأخرى على تزايد سرعة التفاعل مع ارتفاع درجة الحرارة ، لكنه ارتفاعا بطيئا ، وان سرعة التفاعل تتحكم فيها درجة الحرارة بدرجة أشد من خلال الدالة الأسية.
إذن يمكننا كتابة المعادلة الأكثر دقة والتي تأخذ أيضا اعتماد المعامل A على درجة الحرارة كالآتي:
عدد أرنيوس
تكتب "معادلة أرنيوس" كثيرا بالتعويض عن الأس في معادلته بعدد أرنيوس ، وهو عدد ليست له وحدة ، كما بيّنا أعلاه.
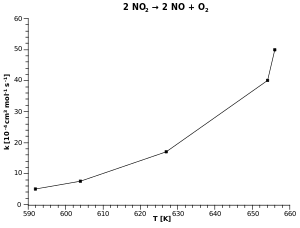
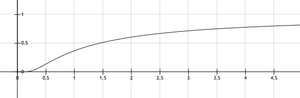
زيادة درجة الحرارة تزيد من المقام في الأس ، أي أن تقترب من الصفر بزيادة درجة الحرارة ، وتقترب الدالة الأسية من 1 ، وهو أكبر قيمة لها. بالتالي تكون k كبيرة ،أي يسير التفاعل سريعا مع ارتفاع درجة الحرارة. في نفس الوقت تتزايد k مع زيادة درجة الحرارة بالدرجة ، ولكن المؤثر الأكبر يكمن في وجود درجة الحرارة في الأس في معادلة أرهينيوس.
علاقة ثابت المعدل بطاقة گيبس الحرة
مع تقدم البحث أصبحنا الآن نكتب معادلة أرنيوس عن سير تفاعل كيميائي مع أخذ نظرية تحول الحالة التي صاغها يوجين ويگنر وزملاؤه عام 1930. وتكتب في أغلب الأحوال على الشكل :
حيث :
- ΔG‡ طاقة جيبس الحرة للتنشيط،
- kB ثابت بولتزمان،
- h ثابت پلانك.
نجد أن ثابت معامل التفاعل عبارة عن حاصل ضرب دالة أسية للاساس e في معامل خطي يعتمد على درجة الحرارة. ولكننا لا بد وأن نتذكر أن الطاقة الحرة هي الأخرى تعتمد على درجة الحرارة. ونقوم بتعيين الطاقة الحرة للتنشيط بأنها الفرق بين شطر المعادلة يدخل فيه الإنثالبي مطروحا منه شطر متعلق بالإنتروبية مضروبة في درجة الحرارة المطلقة. وإذا قمنا بأخذ جميع تلك المتغيرات في الحسبان فإننا نعود إلى معادلة أرنيوس التي تتكون من شطر أسي مضروبا في شطر يتغير بطيئا مع ارتفاع درجة الحرارة T.
اقرأ أيضا
- مخطط أرنيوس
- معادلة إيرنگ
- معامل بولتسمان
- تفاعل كيميائي
- تفاعل ناشر للحرارة
- تفاعل يمتص الحرارة
- تفاعل الثرميت
- تفاعل أكسدة-اختزال
- اختزال
- نظرية تحول الحالة
- قاعدة ڤانت هوفت
- نظرية التصادم
- تفاعل نووي
المراجع
وصلات خارجية
- Carbon Dioxide solubility in Polyethylene – Using Arrhenius equation for calculating species solubility in polymers