نظرية تحول الحالة
في الكيمياء، نظرية تحول الحالة Transition state theory، هي نظرية تفسر معدل التفاعل في تفاعل كيميائي بسيط. وتفترض النظرية نشأة توازن كيميائي بين المواد الداخلة في التفاعل وحالات انتقالية مثارة للجزيئات. [1]
وتستخدم النظرية أساسا لفهم كيفية سير تفاعل كيميائي. ولكنها لم تكن ناجحة كل النجاح لحساب ثابت معدل التفاعل، حيث أن حساب ثابت معدل التفاعل يحتاج معرفة دقيقة لأسطح الجهد الكيميائي أو "أسطح الكمون الكيميائي". [2] ورغما عن ذلك فتنجح النظرية لحساب إنتالبي التنشيط (Δ‡H⦵), وحساب أنتروبيا التنشيط (Δ‡S⦵), وكذلك حساب طاقة جيبس للتنشيط (Δ‡G⦵) لتفاعل معين في حالة تعيين ثابت المعدل التفاعل له مسبقا بطريقة عملية.
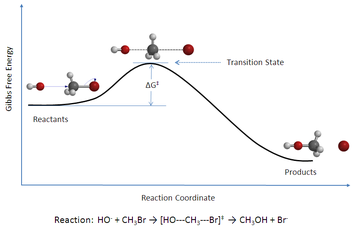
يتبين من الشكل أن الطاقة الكلية للمواد الداخلة في التفاعل تحتاج إلى طاقة إضافية منشطة وقدرها هنا (Δ‡G⦵) لكي تتفاعل. وعند حصولها إلى تلك الطاقة المنشطة تنتج مكونات وسطية مثارة (لأنها تحتوي على الطاقة المنشطة وتصبح فوق الجبل)، ثم تنزلق إلى أسفل مكونة نواتج التفاعل. من الملاحظ أن الطاقة الداخلية للمواد الداخلة في التفاعل أكبر من الطاقة الداخلية للمواد الناتجة من التفاعل، ولكنها تحتاج إلى إثارة بالمقدار (Δ‡G⦵) لكي تعبر جبل طاقة الوضع الحائل بين المواد الداخلة والمواد الناتجة من التفاعل.
النظرية
نستنبطها بافتراص أحد التفاعلات حيث تتفاعل المادتان و لإنتاج المادة . وكما وصفنا من قبل يتكون أولا المركب الانتقالي المثار الذي يفقد الإثارة ويتحول إلى الناتج P.
وتسير سرعة التفاعل ونعرفها بأنها سرعة تكوين الناتج الناتج P ، طبقا للعلاقة:
ويُعرف تركيز المركب الانتقالي المثار عن طريق ثابت معدل التفاعل لحالة توازن المواد الداخلة في التفاعل ، حيث أن
واستبداله بتركيزي A و B.
هذه المعادلة تعطينا معدلة تكوين الناتج P مع الزمن t، ويمكننا اختصارها إلى الصيغة:
ونحصل على ثابت معدل التفاعل :
ونحصل على ثابت معدل التفاعل المثار على الصورة :
ويلزم تعيين المعامل الانتقالي عمليا وإضافته إلى المعادلة.
نجد تلك المعادلة في الصيغة التالية في كتب كثيرة:
حيث ، و الفرق بين طاقة درجة الصفر للمواد الداخلة في التفاعل وطاقة المركب الانتقالي المثار .
تبلغ قيمة
عند درجة حرارة T = 300 كلفن نحو
وهي تسمى معامل التردد ، وهي تعادل تقريبا معدل أصتدام الجزيئات في السائل.
هوامش
- ^ International Union of Pure and Applied Chemistry (IUPAC). Transition State Theory. http://goldbook.iupac.org/T06470.html (accessed November 23, 2008)
- ^ Truhlar, D. G.; Garrett, B. C.; Klippenstein, S. J., Current Status of Transition-State Theory. The Journal of physical chemistry 1996, 100, (31), 12771-12800
انظر أيضا
المصادر
- Laidler, K.; King, C., Development of transition-state theory. The Journal of physical chemistry 1983, 87, (15), 2657
- Laidler, K., A lifetime of transition-state theory. The chemical intelligencer 1998, 4, (3), 39
- Eric V. Anslyn, Dennis A. Doughtery., Transition State Theory and Related Topics. In Modern Physical Organic Chemistry University Science Books: 2006; pp 365–373
- Schramm, VL., Enzymatic Transition States and Transition State Analog Design. Annual Review of Biochemistry 1998, 67, 693-720
- Schramm, V.L., Enzymatic Transition State Theory and Transition State Analogue Design. Journal of Biological Chemistry 2007, 282, (39), 28297-28300
- Radzicka, A.; Woldenden, R., Transition State and Multisubstrate$Analog Inhibitors. Methods in Enzymology 1995, 249, 284-312
- Cleland, W.W., Isotope Effects: Determination of Enzyme Transition State Structure. Methods in Enzymology 1995, 249, 341-373





![{\displaystyle {\frac {d\mathrm {[P]} }{dt}}=k^{\ddagger }\cdot \mathrm {[C^{\ddagger }]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/84c890d2176b65a9f96d1a1b2a8004c6274b2846)
![{\displaystyle \mathrm {[C^{\ddagger }]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a0f99bec1afeb7632554e0efa3914547efa27bbb)
![{\displaystyle K^{\ddagger }=\mathrm {\frac {[C^{\ddagger }]}{[A]\cdot [B]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8adba80c55ab7cd9f24ec8faf606a6b2b3625f7a)
![{\displaystyle {\frac {d\mathrm {[P]} }{dt}}=k^{\ddagger }\cdot K^{\ddagger }\mathrm {\cdot [A]\cdot [B]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/807d9645b22f13d31b299e9e170ba0a5350580e3)
![{\displaystyle {\frac {d\mathrm {[P]} }{dt}}=k\mathrm {\cdot [A]\cdot [B]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/94d7040408558aa13f5d79a5be23ec7edff60764)








