مخطط أرنيوس
في الكيمياء، خطيطة أرنيوس (إنگليزية: Arrhenius plot)، هو رسم بياني تسجل فيه قيم ثابت معدل التفاعل لتفاعل كيميائي لوغاريتمية ومكوس درجة الحرارة. بذلك يظهر المنحنى الذي من المفروض أن يكون منحنيا أسيا في هيئة منحنى خطيا. تستعمل تلك الطريقة في استخدام القيم اللوغاريتمية لتحويل منحنى أسيا إلى منحنى خطيا، حيث تشمل القيم أعدادا كبيرة تصل ليس فقط إلى عشرات وإنما المئات والآلاف، وأكبر من ذلك.
التطبيقات
| EA | طاقة تنشيط التفاعل | جول مول−1 |
| kB | ثابت بولتسمان | 1,381·10−23 جول·كلڤن−1 |
| R | ثابت الغازات العام | 8,314 جول .مول−1·كلڤن−1 |
| NA | ثابت أڤوگادرو | 6,022·1023·مول−1 |
| T | درجة الحرارة المطلقة | كلڤن |
يستخدم رسم بياني أرنيوس بصفة خاصة كرسوم بيانية لتفاعلات كيميائية أو عمليات فيزيائية، تتعلق بدوال يدخل فيها ثابت بولتسمان الذي يصاغ في الشكل:
- ( لجسيم , أنظر معامل بولتزمان )
أو (لنظام من عدد كبير جدا من الجسيمات )
وتظهر منحنى الدالة في رسم بياني أرهينيوس كعلاقة خطية لدرجة الحرارة ، حيث يعطي ميل المنحنى طاقة التنشيط EA .
وذلك لأن في المعادلة الخطية مثل:
يعادل الميل في الصيغة ومعكوس درجة الحرارة يعادل القيمة x في المعادلة.
أمثلة
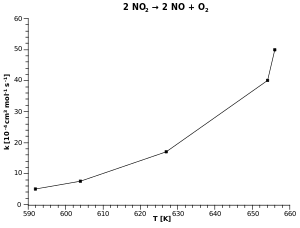
في الشكل العلوي رسمنا تغير ثابت معدل التفاعل مع درجة الحرارة، ونجد منحنيا متزايد الانحناء يعبر عن تلك العلاقة.
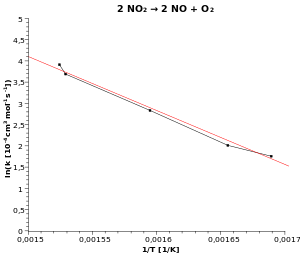
في الشكل الأسفل استعضنا عن تدوين درجة الحرارة على المحور الأفقي ودوّنا علية معكوس درجة الحرارة ، وميزتها أننا نستطيع الآن تعيين ميل العلاقة لخطية على الرسم البياني.
بعض الظواهر الطبيعية تبدوا في هذه الهيئة وتماثل العلاقة بين سرعة التفاعل الكيميائي وبين درجة الحرارة (كما هو الحال هنا). ومن امثال تلك الظواهر اعتماد معامل النفاذية في المواد الصلبة وكذلك كثافة الشحنة الكهربائية في أشباه الموصلات واعتمادهما على درجة الحرارة.
فإذا عينا اللوغاريتم الطبيعي في معادلة أرنيوس:
فيمكننا استنتاج طاقة التنشيط :
عن طريق حساب ميل العلاقة الخطية في الرسم البياني.
وعندما يبدو لنا وجود علاقة من هذا القبيل من خلال تجربة معينة نقوم بها، فيمكننا التحقق منها عن بمساعدة رسم بياني أرنيوس.