حمض الفوسفوريك
| |||
|
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
OrthoPhosphoric acid
| |||
| أسماء أخرى
Phosphoric acid
| |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.758 | ||
| رقم EC |
| ||
| E number | E338 (antioxidants, ...) | ||
| KEGG | |||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
| UN number | 1805 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| الخصائص | |||
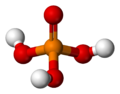
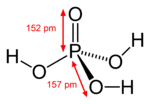
| الصيغة الجزيئية | H3O4P | ||
| كتلة مولية | 97.97 g mol-1 | ||
| الرائحة | Odorless | ||
| الكثافة | 1.6845 g⋅cm−3 (25 °C, 85%),[1] 1.834 g⋅cm−3 (solid)[2] | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | |||
| قابلية الذوبان | Soluble in ethanol | ||
| log P | −2.15[5] | ||
| ضغط البخار | 0.03 mmHg (20 °C)[6] | ||
| القابلية المغناطيسية | −43.8·10−6 cm3/mol[9] | ||
| معامل الانكسار (nD) |
| ||
| اللزوجة | 2.4–9.4 cP (85% aq. soln.) 147 cP (100%) | ||
| البنية | |||
| البنية البلورية | Monoclinic | ||
| الشكل الجزيئي | Tetrahedral | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
−1271.7 kJ/mol | ||
| Standard molar entropy S |
150.8 J/mol⋅K | ||
| سعة الحرارة النوعية، C | 145.0 J/mol⋅K | ||
| المخاطر | |||
| صفحة بيانات السلامة | ICSC 1008 | ||
| ن.م.ع. مخطط تصويري |  [10] [10]
| ||
| ن.م.ع. كلمة الاشارة | Danger | ||
| H290, H314[10] | |||
| P280, P305+P351+P338, P310[10] | |||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | Non-flammable | ||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LD50 (الجرعة الوسطى)
|
1530 mg/kg (rat, oral)[11] | ||
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |||
PEL (المسموح)
|
TWA 1 mg/m3[6] | ||
REL (الموصى به)
|
TWA 1 mg/m3 ST 3 mg/m3[6] | ||
IDLH (خطر عاجل)
|
1000 mg/m3[6] | ||
| مركبات ذا علاقة | |||
phosphorus oxoacids ذات العلاقة
|
| ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
حمض الفوسفوريك إنگليزية: Phosphoric acid ويعرف أيضاً باسم حمض الاورثوفوسفوريك أو حمض الفوسفوريك (5), هو حمض معدني (غير عضوي) صيغته الكيميائية H3PO4. وعلى النقيض, جزيئات حمض الاورثوفوسفوريك يمكن أن تتجمع مع بعضها البعض لتشكل مختلف المركبات التي تسمى أحماض الفوسفوريك بوجه عام. التعبير حمض الفوسفوريك يمكن أيضاً أن يشير إلى مادة كيميائية أو كاشف يتكون من أحماض الفوسفوريك, وعادة في الغالب حمض الاورثوفوسفوريك.
The compound is an acid. Removal of all three H+
ions gives the phosphate ion PO3−
4. Removal of one or two protons gives dihydrogen phosphate ion H
2PO−
4, and the hydrogen phosphate ion HPO2−
4, respectively. Phosphoric acid forms esters, called organophosphates.[12]
The name "orthophosphoric acid" can be used to distinguish this specific acid from other "phosphoric acids", such as pyrophosphoric acid. Nevertheless, the term "phosphoric acid" often means this specific compound; and that is the current IUPAC nomenclature.
الانتاج
ويتم الحصول على حمض الفوسفوريك بواحدة من عمليتين، رطبة وجافة:[13][14][15]
العملية الرطبة
في العملية الرطبة، تعالج معادن الفوسفات التي توجد في الطبيعة، مثل hydroxyapatite الكالسيوم و فلورأپاتيت، بحمض الكبريتيك.[16]
- Ca
5(PO
4)
3OH + 5 H
2SO
4 → 3 H
3PO
4 + 5 [[CaSO
4]] + H
2O - Ca
5(PO
4)
3F + 5 H
2SO
4 → 3 H
3PO
4 + 5 [[CaSO
4]] + HF
Calcium sulfate (gypsum, CaSO
4) is a by-product, which is removed as phosphogypsum. The hydrogen fluoride (HF) gas is streamed into a wet (water) scrubber producing hydrofluoric acid. In both cases the phosphoric acid solution usually contains 23–33% P2O5 (32–46% H
3PO
4). It may be concentrated to produce commercial- or merchant-grade phosphoric acid, which contains about 54–62% P
2O
5 (75–85% H
3PO
4). Further removal of water yields superphosphoric acid with a P
2O
5 concentration above 70% (corresponding to nearly 100% H
3PO
4). The phosphoric acid from both processes may be further purified by removing compounds of arsenic and other potentially toxic impurities.
العملية الجافة
في العملية الحرارية، فإن الفوسفور الخالص يستعمل ليُكون أكسيد الفوسفور الخماسيّ P2O5، الذي ينتج الحمض عندما يتحلل في الماء. ويُكوّن حمض الفوسفوريك الخالص بلورات عديمة اللون تنصهر عند حوالي 42,4° م، وهي سريعة التحلل في الماء. ويطلق على حمض الفوسفوريك تقنيًا حمض الأَرثوفوسفوريك. وصيغته الكيميائية هي H3PO4.
To produce food-grade phosphoric acid, phosphate ore is first reduced with coke in an electric arc furnace, to give elemental phosphorus. Silica is also added, resulting in the production of calcium silicate slag. Elemental phosphorus is distilled out of the furnace and burned with air to produce high-purity phosphorus pentoxide, which is dissolved in water to make phosphoric acid.[17]
الخصائص
الخصائص الحامضية
In aqueous solution phosphoric acid behaves as a triprotic acid.
- H
3PO
4 ⇌ H
2PO−
4 + H+
, pKa1 = 2.14 - H
2PO−
4 ⇌ HPO2−
4 + H+
, pKa2 = 7.20 - HPO2−
4 ⇌ PO3−
4 + H+
, pKa3 = 12.37
The difference between successive pKa values is sufficiently large so that salts of either monohydrogen phosphate, HPO2−
4 or dihydrogen phosphate, H
2PO−
4, can be prepared from a solution of phosphoric acid by adjusting the pH to be mid-way between the respective pK values.
نظام يوتكتي
The phase diagram of the H
3PO
4/H
2O system is complicated. Solutions up to 62.5% H
3PO
4 are eutectic, exhibiting freezing-point depression as low as -85°C. Beyond this freezing-point increases, reaching 21°C by 85% H
3PO
4 (w/w) and a local maximum at 91.6% which corresponds to the hemihydrate 2H3PO4•H2O, freezing at 29.32°C.[18][19] There is a second smaller eutectic depression at a concentration of 94.75% with a freezing point of 23.5°C. At higher concentrations the freezing point rapidly increases.
Concentrated phosphoric acid tends to supercool before crystallization occurs, and may be relatively resistant to crystallisation even when stored below the freezing point.[20] For many industrial uses 85% represents a practical upper limit, where higher concentrations risk the entire mass freezing solid when transported inside of tankers and having to be melted out, although partial crystallisation can still occur in sub-zero temperatures.
التكثيف الذاتي
Phosphoric acid is commercially available as aqueous solutions of various concentrations, not usually exceeding 85%. If concentrated further it undergoes slow self-condensation, forming an equilibrium with pyrophosphoric acid:
- 2 H
3PO
4 ⇌ H
2O + H
4P
2O
7
Even at 90% concentration the amount of pyrophosphoric acid present is negligible, but beyond 95% it starts to increase, reaching 15% at what would have otherwise been 100% orthophosphoric acid.[21]
As the concentration is increased higher acids are formed, culminating in the formation of polyphosphoric acids.[22] It is not possible to fully dehydrate phosphoric acid to phosphorus pentoxide, instead the polyphosphoric acid becomes increasingly polymeric and viscous. Due to the self-condensation, pure orthophosphoric acid can only be obtained by a careful fractional freezing/melting process.[20][23]
القاعدية pH وتكوين المحلول المائي لحمض الفوسفوريك
| [A] (mol/L) | pH | [H3PO4]/[A] (%) | [H2PO4−]/[A] (%) | [HPO42−]/[A] (%) | [PO43−]/[A] (%) |
| 1 | 1.08 | 91.7 | 8.29 | 6.20×10−6 | 1.60×10−17 |
| 10−1 | 1.62 | 76.1 | 23.9 | 6.20×10−5 | 5.55×10−16 |
| 10−2 | 2.25 | 43.1 | 56.9 | 6.20×10−4 | 2.33×10−14 |
| 10−3 | 3.05 | 10.6 | 89.3 | 6.20×10−3 | 1.48×10−12 |
| 10−4 | 4.01 | 1.30 | 98.6 | 6.19×10−2 | 1.34×10−10 |
| 10−5 | 5.00 | 0.133 | 99.3 | 0.612 | 1.30×10−8 |
| 10−6 | 5.97 | 1.34×10−2 | 94.5 | 5.50 | 1.11×10−6 |
| 10−7 | 6.74 | 1.80×10−3 | 74.5 | 25.5 | 3.02×10−5 |
| 10−10 | 7.00 | 8.24×10−4 | 61.7 | 38.3 | 8.18×10−5 |
الاستخدامات
The dominant use of phosphoric acid is for fertilizers, consuming approximately 90% of production.[24]
حَمْض الفوسفوريك أكثر الأحماض الفوسفورية شيوعاً. يستخدمه المصنّعون في صنع تركيبات فوسفورية غير عضوية، وفي الأسمدة، والمشروبات الخفيفة والعصير المركز ذي النكهة، وملح الحمض مع الصوديوم (Na3PO4) مُليِّن مائيّ ممتاز. والأسطح الفلزية المعالجة بحمض الفوسفوريك لها مقاومة عالية ضد التآكل.
| Application | Demand (2006) in thousands of tons | Main phosphate derivatives |
|---|---|---|
| Soaps and detergents | 1836 | STPP |
| Food industry | 309 | STPP (Na 5P 3O 10), SHMP, TSP, SAPP, SAlP, MCP, DSP (Na 2HPO 4), H 3PO 4 |
| Water treatment | 164 | SHMP, STPP, TSPP, MSP (NaH 2PO 4), DSP |
| Toothpastes | 68 | DCP (CaHPO 4), IMP, SMFP |
| Other applications | 287 | STPP (Na 3P 3O 9), TCP, APP, DAP, zinc phosphate (Zn 3(PO 4) 2), aluminium phosphate (AlPO 4), H 3PO 4 |
Food-grade phosphoric acid (additive E338[25]) is used to acidify foods and beverages such as various colas and jams, providing a tangy or sour taste. The phosphoric acid also serves as a preservative.[26] Soft drinks containing phosphoric acid, which would include Coca-Cola, are sometimes called phosphate sodas or phosphates. Phosphoric acid in soft drinks has the potential to cause dental erosion.[27] Phosphoric acid also has the potential to contribute to the formation of kidney stones, especially in those who have had kidney stones previously.[28]
Specific applications of phosphoric acid include:
- in anti-rust treatment by phosphate conversion coating or passivation
- to prevent iron oxidation by means of the Parkerization process
- as an external standard for phosphorus-31 nuclear magnetic resonance
- in phosphoric acid fuel cells
- in activated carbon production[29]
- in compound semiconductor processing, to etch Indium gallium arsenide selectively with respect to indium phosphide[30]
- in microfabrication to etch silicon nitride selectively with respect to silicon dioxide[31]
- in microfabrication to etch aluminium
- as a pH adjuster in cosmetics and skin-care products[32]
- as a sanitizing agent in the dairy, food, and brewing industries[33]
Phosphoric acid may also be used for chemical polishing (etching) of metals like aluminium or for passivation of steel products in a process called phosphatization.[34]
السلامة
Phosphoric acid is not a strong acid. However, at moderate concentrations phosphoric acid solutions are irritating to the skin. Contact with concentrated solutions can cause severe skin burns and permanent eye damage.[35]
A link has been shown between long-term regular cola intake and osteoporosis in later middle age in women (but not men).[36]
انظر أيضاً
- Phosphate fertilizers, such as ammonium phosphate fertilizers
المصادر
- ^
Christensen, J. H. and Reed, R. B. (1955). "Design and Analysis Data—Density of Aqueous Solutions of Phosphoric Acid Measurements at 25 °C". Ind. Eng. Chem. 47 (6): 1277–1280. doi:10.1021/ie50546a061.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ "CAMEO Chemicals Datasheet - Phosphoric Acid".
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. Retrieved 2 June 2014.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةcrc - ^ "phosphoric acid_msds".
- ^ أ ب ت ث NIOSH Pocket Guide to Chemical Hazards 0506
- ^ Haynes, p. 5.92
- ^
Edwards, O. W.; Dunn, R. L. and Hatfield, J. D. (1964). "Refractive Index of Phosphoric Acid Solutions at 25 C.". J. Chem. Eng. Data. 9 (4): 508–509. doi:10.1021/je60023a010.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Haynes, p. 4.134
- ^ أ ب ت Sigma-Aldrich Co., Phosphoric acid. Retrieved on 9 May 2014.
- ^ "Phosphoric acid". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Westheimer, F.H. (6 June 1987). "Why nature chose phosphates". Science. 235 (4793): 1173–1178 (see pp. 1175–1176). Bibcode:1987Sci...235.1173W. CiteSeerX 10.1.1.462.3441. doi:10.1126/science.2434996. PMID 2434996.
- ^ Becker, Pierre (1988). Phosphates and phosphoric acid. New York: Marcel Dekker. ISBN 978-0824717124.
- ^ Gilmour, Rodney (2014). Phosphoric acid: purification, uses, technology, and economics. Boca Raton: CRC Press. pp. 44–61. ISBN 9781439895108.
- ^ Jupp, Andrew R.; Beijer, Steven; Narain, Ganesha C.; Schipper, Willem; Slootweg, J. Chris (2021). "Phosphorus recovery and recycling – closing the loop". Chemical Society Reviews. 50 (1): 87–101. doi:10.1039/D0CS01150A. PMID 33210686.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 520–522. ISBN 978-0-08-037941-8.
- ^ Geeson, Michael B.; Cummins, Christopher C. (2020). "Let's Make White Phosphorus Obsolete". ACS Central Science. 6 (6): 848–860. doi:10.1021/acscentsci.0c00332. PMC 7318074. PMID 32607432.
- ^ Ross, William H.; Jones, Russell M. (August 1925). "The Solubility and Freezing-Point Curves of Hydrated and Anhydrous Orthophosphoric Acid". Journal of the American Chemical Society. 47 (8): 2165–2170. doi:10.1021/ja01685a015.
- ^ "Purified Phosphoric Acid H3PO4 Technical Information Bulletin" (PDF). PotashCorp. Retrieved 11 February 2023.
- ^ أ ب Ross, Wm. H.; Jones, R. M.; Durgin, C. B. (October 1925). "The Purification of Phosphoric Acid by Crystallization". Industrial & Engineering Chemistry (in الإنجليزية). 17 (10): 1081–1083. doi:10.1021/ie50190a031. ISSN 0019-7866.
- ^ Korte, Carsten; Conti, Fosca; Wackerl, Jürgen; Lehnert, Werner (2016), Li, Qingfeng; Aili, David; Hjuler, Hans Aage et al., eds. (in en), Phosphoric Acid and its Interactions with Polybenzimidazole-Type Polymers, Cham: Springer International Publishing, pp. 169–194, doi:, ISBN 978-3-319-17081-7, http://link.springer.com/10.1007/978-3-319-17082-4_8, retrieved on 2023-02-12
- ^ Jameson, R. F. (1 January 1959). "151. The composition of the "strong" phosphoric acids". Journal of the Chemical Society (Resumed): 752–759. doi:10.1039/JR9590000752.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةGreenwood - ^ Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). "Phosphoric Acid and Phosphates". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3.
{{cite encyclopedia}}: Cite has empty unknown parameter:|authors=(help) - ^ "Current EU approved additives and their E Numbers". Foods Standards Agency. 14 March 2012. Archived from the original on 21 August 2013. Retrieved 22 July 2012.
- ^ "Why is phosphoric acid used in some Coca‑Cola drinks?| Frequently Asked Questions | Coca-Cola GB". www.coca-cola.co.uk (in الإنجليزية البريطانية). Archived from the original on 2 August 2021. Retrieved 2021-08-31.
- ^ Moynihan, P. J. (23 November 2002). "Dietary advice in dental practice". British Dental Journal. 193 (10): 563–568. doi:10.1038/sj.bdj.4801628. PMID 12481178.
- ^ Qaseem, A; Dallas, P; Forciea, MA; Starkey, M; et al. (4 November 2014). "Dietary and pharmacologic management to prevent recurrent nephrolithiasis in adults: A clinical practice guideline from the American College of Physicians". Annals of Internal Medicine. 161 (9): 659–67. doi:10.7326/M13-2908. PMID 25364887.
- ^ Toles, C.; Rimmer, S.; Hower, J. C. (1996). "Production of activated carbons from a washington lignite using phosphoric acid activation". Carbon. 34 (11): 1419. doi:10.1016/S0008-6223(96)00093-0.
- ^ Wet chemical etching. Archived 25 سبتمبر 2012 at the Wayback Machine umd.edu.
- ^ Wolf, S.; R. N. Tauber (1986). Silicon processing for the VLSI era: Volume 1 – Process technology. p. 534. ISBN 978-0-9616721-6-4.
- ^ "Ingredient dictionary: P". Cosmetic ingredient dictionary. Paula's Choice. Archived from the original on 18 يناير 2008. Retrieved 16 نوفمبر 2007.
- ^ "Star San" (PDF). Five Star Chemicals. Archived (PDF) from the original on 8 February 2016. Retrieved 17 August 2015.
- ^ "Phosphates - Metal Finishing" (PDF). Phospates for Americas. February 2021.
- ^ "Phosphoric Acid, 85 wt.% SDS". Sigma-Aldrich. 5 May 2016. Archived from the original on 18 January 2017. Retrieved 16 January 2017.
- ^ Tucker KL, Morita K, Qiao N, Hannan MT, Cupples LA, Kiel DP (1 October 2006). "Colas, but not other carbonated beverages, are associated with low bone mineral density in older women: The Framingham Osteoporosis Study". American Journal of Clinical Nutrition. 84 (4): 936–942. doi:10.1093/ajcn/84.4.936. PMID 17023723.
وصلات خارجية
| phosphoric acid
]].- CS1 الإنجليزية البريطانية-language sources (en-gb)
- Short description is different from Wikidata
- Articles with hatnote templates targeting a nonexistent page
- ECHA InfoCard ID from Wikidata
- E number from Wikidata
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Articles containing إنگليزية-language text
- Pages using Lang-xx templates
- نكهات
- منظمو حموضة الغذاء
- مضادات الأكسدة في الغذاء
- سوائل ومذابات تشكيل الزجاج
- فوسفاتات
- أحماض معدنية
- Food acidity regulators
- Glassforming liquids and melts
- Phosphates
- Phosphorus oxoacids
- Hydrogen compounds
- Acid catalysts
- مضافات غذائية بأرقام أوروپية
- Phosphorus(V) compounds