لزوجة
| Viscosity | |
|---|---|
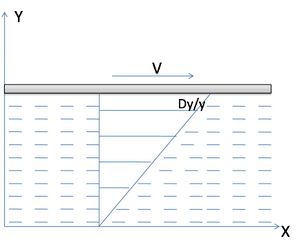
 محاكاة لمادتين ذاتا لزوجتين مختلفتين. المادة العليا لها لزوجة أقل من المادة السفلى | |
الرموز الشائعة | η، μ |
| الوحدة الدولية | پا·ث = كج/(ث·م) |
اشتقاقات من كميات أخرى | μ = G·t |
| جزء من سلسلة عن |
| ميكانيكا الاستمرارية |
|---|
اللزوجة Viscosity هي مقياس يوصف به قابلية سائل ما للجريان، ومقدار مقاومته لضغط يجبره على التحرك والسيلان. كلما زادت لزوجة سائل ما، قلّت قابليته للجريان. وكلما قلت اللزوجة، زاد مقدار ميوعة هذا السائل.
تكون جزئيات سائل عالي اللزوجة مرتبطة ببعضها بشكل قوي ، و بذلك تكون أقل قدرة على التحرك. ويكبر احتكاكها بالجسم الصلب الملامس لها ، ويمكن وصف اللزوجة بأنها إحتكاك داخلي بين جزيئات السائل.
وهي خاصية مهمة من خصائص الموائع وبها يقاوم المائع التغير في الشكل الناتج من تأثير قوى القص المؤثره عليه. فإذا افترضنا وجود طبقه من المائع بين لوحين مستويين متوازيين كما بالشكل بحيث يثبت اللوح السفلى و يتحرك العلوى بسرعه V تحت تأثير قوه مقدارها F .
ويمكن تشبيه هذا الإحتكاك الداخلي للجزيئات بطبقات مسننة و ممددة على بعضها البعض. وعند الجريان، تنزلق الجزيئات المكونة لهذه الطبقات على بعضها، وتحاول أن تتغلّب على هذه المسننات بواسطة قوة. مقدار لزوجة السائل يتحدد بواسطة هذه القوة بالإضافة إلى خواص السائل.
اللزوجة الحركية للسائل
أما اللزوجة الحركية لسائل ما، فهي تبين مقدار مقاومة السائل للجريان (السيلان) عند حركتة و علاقة هذه المقاومة بدرجة حرارة السائل. فكلما زادت الحرارة ، تقل اللزوجة الحركية ويصبح السائل أكثر ميوعة.
ومن جهة أخرى، كلما زادت سرعة التدفق إرتفعت اللزوجة ، أي أن مقاومة السائل للسير بالحركة تزداد مع إزدياد الضغط.
نفترض وجود لوحين متوازيين بينهما مسافة x ومساحة كل منهما A، ونقترض وجود سائل يملأ المكان بين اللوحين . فإذا بدأنا تحريك اللوح 2 يسرعة ثابتة v فتتحرك طبقة السائل الملاصقة للوح 2 أيضا بالسرعة v . وبما أن اللوح 1 ثابت لا يتحرك فإن طبقة السائل الملاصقة له تبقى لا تتحرك . أي أن طبقات السائل بين اللوحين ستتحرك بسرعات متناسبة طرديا مع المسافة بين اللوحين (أنظر الشكل ، حيث يتناسب كول كل سهم مع سرعته) .
ويمكن أن تبين التجربة أن القوة F التي تحرك اللوح 2 تتناسب تناسبا طرديا مه مساحة اللوح A ، كما تتناسب تناسبا طرديا مع سرعة اللوح v ، وتتناسب تناسبا عكسيا مع المسافة x بين اللوحين ، أي أن :
ويمكن تحويل العلاقة إلى معادلة بوساطة ثابت التناسب :
ويسمى ثابت التناسب اللزوجة الحركية واحيانا يقال لها اللزوجة .
ووحدة اللزوجة هي نيوتن. ثانية / متر 2
- أي = (N.s/m² )
ويقال أن ادة معينة يكون لها اللزوجة 1Ns/m² عندما تكون مساحة اللوحين 1 متر 2 وأن نكون المسافة بينهما 1 متر ، فتكون القوة المطلوبة 1 نيوتن ( 1N) لكي نحرك اللوح بالنسبة للأخر بسرعة 1 متر / ثانية .
وبالنسبة إلى الوحدة نجد أن:
وعندما نكون لا تعتمد على السرعة v يسمى السائل سائل نيوتوني إشارة إلى نيوتن. وبالنسبة لهذا السائل تتناسب سرعة كل طبقة سائل بين اللوحين تناسبا طرديا . أما إذا كانت تتغير بتغير السرعة v (دالة للسرعة) فيسمى السائل سائل لا نيوتوني .
القياس
قياس اللزوجة إذن يتم عبر القيام بتجربة يتم فيها ضغط سائل معين تحت تأثير قوة خارجية عبر أنبوب ذو قطر محدد، و يقاس عندها كمية السائل الذي يخرج في وقت معين. لتكون وحدة قياس اللزوجة بال النيوتن ثانية بالمتر المربع. أو بالباسكال ثانية حيث النيوتن بالمتر المربع يساوي 1 باسكال.
قيم اللزوجة لبعض السوائل:
| مادة السائل | قيمة اللزوجة بال mPa s |
|---|---|
| ماء | 1 |
| ماء (25°) | 0.891 |
| زيت إحتراق | 0.65 |
| إسفلت | 105 |
| دم (37°) | 4 حتى 25 |
| زيت زيتون | 102 |
| عسل | 104 |
| زجاج | 102 حتى 104 |
هذه القيم تقريبية. قيمة حرارة التجربة 20°
لزوجة الغازات
و للغازات أيضا لزوجة يمكن مراقبة نبض جريانها تحت المجهر. حيث أن لزوجة الغازات لا تتعلق بالضغط بل بمعدل الطول البعدي لجزيئات الغاز.
وهذا الجدول يعطي لزوجة بعض الغازات :
بالنسبة إلى ثابت سترلاند C أنظر أسفله .
| الغاز |
[K] |
[K] |
[10-6 Pa s] |
|---|---|---|---|
| هواء | 120 | 291.15 | 18.27 |
| نيتروجين | 111 | 300.55 | 17.81 |
| أكسجين | 127 | 292.25 | 20.18 |
| ثاني أكسيد الكربون | 240 | 293.15 | 14.8 |
| أول أكسيد الكربون | 118 | 288.15 | 17.2 |
| هيدروجين | 72 | 293.85 | 8.76 |
| أمونيا | 370 | 293.15 | 9.82 |
| ثاني أكسيد الكبريت | 416 | 293.65 | 12.54 |
| هيليوم | 79.4 [1] | 273 | 19 [2] |
- اعتماد لزوجة الغازات على درجة الحرارة
صاغ سترلاند علاقة يمكن بواسطتها حساب لزوجة الغاز عند درجات الحرارة المختلفة (باعتبار أن الغاز غازا مثالياً، والعلاقة هي حيث C ثابت سترلاند :
حيث:
- الزوجة الحركية بوحدة باسكال. ثانية عند درجة الحرارة المطلوبة T،
- = reference viscosity in (Pa·s) اللزوجة المرجعية باسكال. ثانية عند درجة الحرارة المرجعية ،
- درجة الحرارة المطلوبة كلفن ،
- درجة الحرارة المرجعية كلفن ،
- ثابت سترلاند للغاز المراد حساب لزوجته.
وتنطبق تلك المعادلة على الغازات عند درجة حرارة T بين 0 كلفن و 555 كلفن عند ضغط أقل من 3.45 ميجا باسكال (مليون باسكال) ، ويبلغ الخطأ الناشئ عن التقريب 10% .
- أنظر المرجع الخارجي [1].