قرنية
| القرنية | |
|---|---|
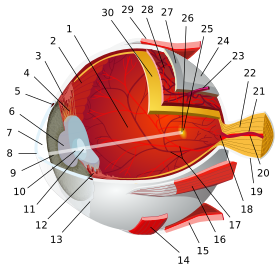
 رسم تخطيطي للعين البشرية يوضح القرنية مفصولة عن الصلبة بواسطة حوفة القرنية. | |
| Details | |
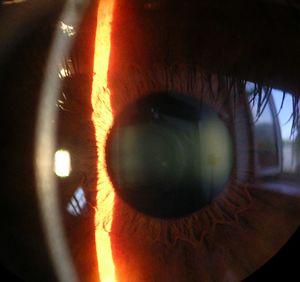
| جزء من | صورة أمامية للعين. |
| الجهاز | الجهاز البصري |
| الوظيفة | كسر الضوء |
| المُعرفات | |
| اللاتينية | cornea |
| MeSH | D003315 |
| TA98 | A15.2.02.012 |
| TA2 | 6744 |
| FMA | 58238 |
| المصطلحات التشريحية | |
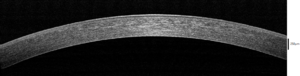
القرنية (Cornea)، هي نسيج شفاف مقوس موجود في العين. تتكون من ثلاثة طبقات، يفصل بينهما غشائان. ينكسر الضوء عند القرنية قبل أن يدخل العين. لا تحتوي على الأوعية الدموية، وتأخذ ما تحتاجه من الأكسجين مباشرة من الهواء الجوي، فهي تقع خارج العين. القرنية ، مع الغرفة الأمامية والعدسة ، تكسر الضوء ، حيث تمثل القرنية ما يقرب من ثلثي الطاقة البصرية الإجمالية للعين. .[1][2] في البشر ، تبلغ قوة الانكسار للقرنية حوالي 43 ديوبتر .[3] يمكن إعادة تشكيل القرنية عن طريق العمليات الجراحية مثل الليزك .[4]
بينما تساهم القرنية في معظم قوة تركيز العين ، إلا أن تركيزها ثابت. يتم تحقيق التأقلم (إعادة تركيز الضوء لعرض أفضل بالقرب من الأشياء) عن طريق تغيير هندسة العدسة. غالبًا ما تبدأ المصطلحات الطبية المتعلقة بالقرنية بالبادئة "kerat-" من الكلمة اليونانية κέρας ، القرن.
البُنية
القرنية لها نهايات عصبية غير ميالينية حساسة للمس ودرجة الحرارة والمواد الكيميائية. يؤدي لمسة القرنية إلى منعكس لا إرادي لإغلاق الجفن . لأن الشفافية ذات أهمية قصوى ، فإن القرنية السليمة لا تحتوي على أو تحتاج إلى أوعية دموية داخلها. بدلاً من ذلك ، يذوب الأكسجين في الدموع ثم ينتشر في جميع أنحاء القرنية للحفاظ على صحته.[5] وبالمثل ، يتم نقل العناصر الغذائية عن طريق الانتشار من السائل المسيل للدموع عبر السطح الخارجي والخلط المائي من خلال السطح الداخلي. تأتي المغذيات أيضًا عن طريق المغذيات العصبية التي توفرها أعصاب القرنية. في البشر ، يبلغ قطر القرنية حوالي 11.5 مم وسمك 0.5-0.6 مم في المركز و0.6-0.8 مم في المحيط. الشفافية والوعائية ووجود خلايا مناعية مقيمة غير ناضجة وامتياز مناعي يجعل القرنية نسيجًا خاصًا جدً.
الألبومين هو أكثر بروتين قابل للذوبان في القرنية الثديية .[6]
القرنية البشرية تحدها الصلبة من خلال حوف القرنية . في الجلكيات ، تكون القرنية مجرد امتداد للصلبة ، وهي منفصلة عن الجلد فوقها ، ولكن في الفقاريات الأكثر تقدمًا ، يتم دمجها دائمًا مع الجلد لتشكيل بنية واحدة ، وإن كانت مكونة من طبقات متعددة. في الأسماك والفقاريات المائية بشكل عام ، لا تلعب القرنية أي دور في تركيز الضوء ، حيث أن لها نفس معامل الانكسار تقريبًا مثل الماء.[7]
التشريح الدقيق
تحتوي القرنية البشرية على خمس طبقات (ربما ست ، إذا تم تضمين طبقة دوا ) .[8] قرنيات الرئيسيات الأخرى لها خمس طبقات معروفة. قرنيات القطط والكلاب والذئاب وغيرها من آكلات اللحوم لديها أربعة فقط .[9]من الأمام إلى الخلف طبقات القرنية البشرية هي:
- ظهارة القرنية : وهي طبقة نسيج ظهاري متعدد الخلايا رقيق جدا (غير الكيراتينية-طبقية ظهارة الحرشفية) من نمو سريع و إعادة إحياء الخلايا بسهولة ، وتبقى رطبة مع الدموع . عدم انتظام أو وذمة ظهارة القرنية يعطل نعومة واجهة الهواء / الفيلم المسيل للدموع ، وهو العنصر الأكثر أهمية لقوة الانكسار الكلي للعين ، مما يقلل من حدة البصر. وهو مستمر مع الظهارة الملتحمة ، ويتكون من حوالي 6 طبقات من الخلايا التي يتم تسليطها باستمرار على الطبقة المكشوفة ويتم تجديدها عن طريق التضاعف في الطبقة القاعدية
- طبقة بومان (المعروفة أيضًا باسم الغشاء الامامي المحدد ): عند مناقشتها بدلاً من غشاء قاعدي تحت الظهارة ، فإن طبقة بومان عبارة عن طبقة صلبة تتكون من الكولاجين (بشكل رئيسي من النوع الأول من ألياف الكولاجين) ، واللامينين ، والنيدوجين ، والبيرليكان وغيرها من هيباران سلفات بروتوجليكان التي تحمي سدى القرنية. عند مناقشتها ككيان منفصل عن الغشاء القاعدي تحت الظهاري ، يمكن وصف طبقة بومان بأنها منطقة خلوية مكثفة من السدى القمي ، تتكون في المقام الأول من ألياف الكولاجين المنظمة بشكل عشوائي ولكنها محبوكة بإحكام. تتفاعل هذه الألياف مع بعضها وتلتصق ببعضها البعض. يبلغ سمك هذه الطبقة من 8 إلى 14 ميكرومتر (1 ميكرومتر)[10] وهي غائبة أو رفيعة جدًا في غير الرئيسيات.[9][11]
- سدى القرنية (أيضًا مادة بروبريا (المادة المخصوصة) ): طبقة متوسطة سميكة وشفافة ، تتكون من ألياف الكولاجين المرتبة بانتظام جنبًا إلى جنب مع الخلايا القرنية المترابطة بالكاد الموزعة ، والتي هي خلايا للإصلاح والصيانة العامة.[10] فهي متوازية ومتراكبة مثل صفحات الكتاب. يتكون سدى القرنية من حوالي 200 طبقة من ألياف الكولاجين من النوع الأول بشكل رئيسي. كل طبقة 1.5-2.5 ميكرومتر. يتكون ما يصل إلى 90٪ من سمك القرنية من السدى.[10] هناك نظريتان لكيفية حدوث الشفافية في القرنية::
- ترتيبات شبكية من ألياف الكولاجين في السدى. يتم إلغاء تشتت الضوء بواسطة الألياف الفردية عن طريق التداخل المدمر من الضوء المتناثر من الألياف الفردية الأخرى.[12]
- يجب أن تكون تباعد ألياف الكولاجين المجاورة في السدى أقل من 200 نانومتر ليكون هناك الشفافية. (جولدمان و بينيدك)
- غشاء ديسميت (أيضًا التحديد الخلفي): طبقة رقيقة خلوية تعمل بمثابة غشاء قاعدي معدل للبطانة القرنية ، والتي يتم اشتقاقها من الخلايا. تتكون هذه الطبقة بشكل رئيسي من ألياف كولاجين من النوع الرابع ، أقل صلابة من ألياف كولاجين من النوع الأول ، ويبلغ سمكها حوالي 5-20 ميكرومتر ، اعتمادًا على عمر الشخص. فقط أمام غشاء ديسميت ، طبقة رقيقة وقوية للغاية ، طبقة دوا ، سماكة 15 ميكرون وقادرة على تحمل 1.5 إلى 2 بار من الضغط.[13]
- البطانة القرنية : طبقة أحادية حرشفية أو مكعبة بسيطة ، سمكها حوالي 5 ميكرومتر ، من الخلايا الغنية بالميتوكوندريا. هذه الخلايا مسؤولة عن تنظيم نقل السوائل والمذاب بين حجرات اللحمة المائية والقرنية.[14] (مصطلح البطانة هو تسمية خاطئة هنا. البطانة القرنية مغمورة بالخلط المائي ، وليس بالدم أو اللمف ، ولها أصل ووظيفة ومظهر مختلف للغاية عن البطانة الوعائية . ) على عكس ظهارة القرنية ، لا تتجدد خلايا البطانة. وبدلاً من ذلك ، فإنها تمدد لتعويض الخلايا الميتة مما يقلل من كثافة الخلايا البطانية الشاملة ، مما يؤثر على تنظيم السوائل. إذا لم يعد بإمكان البطانة الحفاظ على توازن سائل مناسب ، فسيحدث تورم السدي بسبب السوائل الزائدة وفقدان الشفافية اللاحق ، وقد يتسبب ذلك في وذمة القرنية والتدخل في شفافية القرنية وبالتالي يضعف الصورة المكونة.[14] يمكن في بعض الأحيان غسل الخلايا الصبغية القزحية المودعة على البطانة القرنية إلى نمط رأسي مميز بواسطة التيارات المائية - وهذا ما يعرف باسم مغزل كروكينبرج .
امدادات الاعصاب
القرنية هي واحدة من أكثر أنسجة الجسم حساسية ، حيث يتم تعصيبها بشكل كثيف بألياف الأعصاب الحسية عبر الانقسام البصري للعصب الثلاثي التوائم عن طريق 70-80 من الأعصاب الهدبية الطويلة . تشير الأبحاث إلى أن كثافة مستقبلات الألم في القرنية أكبر بـ 300-600 مرة من الجلد و 20-40 مرة من لب الأسنان,[15] مما يجعل أي إصابة في الهيكل مؤلمة بشكل كبير .[16]
تسير الأعصاب الهدبية تحت البطانة وتخرج من العين من خلال ثقوب في الصلبة باستثناء العصب البصري (الذي ينقل الإشارات البصرية فقط) .[10] تدخل الأعصاب القرنية عبر ثلاثة مستويات ؛ الصلبة ، وفوق الصلبة والملتحمة . معظم الحزم تؤدي إلى التقسيم الفرعي لشبكة في السدى ، والتي تمد الألياف منها المناطق المختلفة. الشبكات الثلاث هي الطبقة الوسطى ، تحت الظهارية / تحت القاعدية ، والظهارية. الحقول الاستقبالية لكل نهاية عصبية كبيرة جدًا ، وقد تتداخل.
تنتهي الأعصاب القرنية للطبقة تحت الظهارية بالقرب من الطبقة الظهارية السطحية للقرنية بنمط حلزوني لوغاريتمي .[17] تنخفض كثافة الأعصاب الظهارية مع تقدم العمر ، خاصة بعد العقد السابع .[18]
الوظيفة
الانكسار
يهتم المكون البصري بإنتاج صورة معكوسة مخفضة على الشبكية. لا يتألف النظام البصري للعين من سطحين فقط بل أربعة سطحين - اثنان على القرنية واثنان على العدسة. تنكسر الأشعة نحو خط الوسط. تتقارب الأشعة البعيدة ، بسبب طبيعتها الموازية ، إلى نقطة على الشبكية. القرنية تعترف بالضوء بأكبر زاوية. يحتوي الخلط المائي والزجاجي على معامل انكسار 1.336-1.339 ، بينما تحتوي القرنية على معامل انكسار 1.376. نظرًا لأن التغيير في معامل الانكسار بين القرنية والخلط المائي صغير نسبيًا مقارنة بالتغيير في واجهة الهواء - القرنية ، فإن له تأثير انكسار ضئيل ، عادة -6 ديوبتر .[10] تعتبر القرنية عدسة هلالة إيجابية .[19] في بعض الحيوانات ، مثل أنواع الطيور والحرباء وأنواع من الأسماك ، يمكن أن تركز القرنية أيضًا .[20]
الشفافية
عند موت أو إزالة العين ، تمتص القرنية الخلط المائي وتثخن وتصبح ضبابية. يمكن استعادة الشفافية عن طريق وضعها في غرفة دافئة جيدة التهوية في 31 درجة مئوية (88 ° F ، درجة الحرارة العادية) ، مما يسمح للسائل بمغادرة القرنية ويصبح شفافًا. تأخذ القرنية سوائل من الخلط المائي والأوعية الدموية الصغيرة في الحوف ، لكن المضخة تطرد السائل فور الدخول. عندما تكون الطاقة ناقصة ، قد تفشل المضخة ، أو تعمل ببطء شديد للتعويض ، مما يؤدي إلى التورم. ينشأ هذا عند الموت ، ولكن يمكن وضع العين الميتة في غرفة دافئة مع خزان من السكر والجليكوجين يحافظ بشكل عام على القرنية شفافة لمدة 24 ساعة على الأقل[10]
تتحكم البطانة في عمل الضخ هذا ، وكما نوقش أعلاه ، فإن تلفه أكثر خطورة ، وهو سبب في التعتيم والتورم. عندما يحدث تلف للقرنية ، كما هو الحال في العدوى الفيروسية ، لا يتم ترتيب الكولاجين المستخدم لإصلاح العملية بانتظام ، مما يؤدي إلى بقعة غير شفافة (سرطان الدم). عندما تكون هناك حاجة إلى القرنية للزرع ، كما هو الحال من بنك العيون ، فإن أفضل إجراء هو إزالة القرنية من مقلة العين ، مما يمنع القرنية من امتصاص الخلط المائي .[10]
الأهمية السريرية
أكثر اضطرابات القرنية شيوعاً هي التالية:
- تآكل القرنية - حالة طبية تنطوي على فقدان الطبقة الظهارية السطحية لقرنية العين نتيجة لصدمة على سطح العين.
- ضمور القرنية - حالة يفقد فيها جزء أو أكثر من القرنية وضوحها الطبيعي بسبب تراكم مادة غائمة.
- قرحة القرنية - حالة التهابية أو عدوى في القرنية تنطوي على اضطراب في الطبقة الظهارية مع سدى القرنية.
- توسع الأوعية الدموية في القرنية - فرط الأوعية الدموية من الضفيرة الوعائية الطرفية في القرنية ، بسبب حرمان الأكسجين من الهواء.
- حثل فوكس - رؤية الصباح الغائمة.
- التهاب القرنية - التهاب في القرنية.
- القرنية المخروطية - مرض تنكسي ، القرنية تتغير وتغير شكلها ليكون أشبه بالمخروط.
- جسم غريب في القرنية - أحد أكثر الأخطار المهنية التي يمكن الوقاية منها..[21]
العلاجات
اجراءات جراحية
تغير تقنيات جراحة العين الانكسارية المختلفة شكل القرنية لتقليل الحاجة إلى العدسات التصحيحية أو تحسين حالة الانكسار للعين. في العديد من التقنيات المستخدمة اليوم ، يتم إجراء إعادة تشكيل القرنية عن طريق التقطيع الضوئي باستخدام ليزر إكسيمر
إذا كان سدى القرنية يعاني من عتامة أو عدم انتظام أو وذمة كبيرة بصريًا ، فيمكن زرع قرنية متبرع متوفى. نظرًا لعدم وجود أوعية دموية في القرنية ، هناك أيضًا مشاكل قليلة في رفض القرنية الجديدة.
هناك أيضا قرنيات اصطناعية (keratoprostheses) قيد التطوير. معظمها عبارة عن إدخالات بلاستيكية فقط ، ولكن هناك أيضًا تلك التي تتكون من مواد اصطناعية متوافقة حيويًا تشجع نمو الأنسجة في القرنية الاصطناعية ، وبالتالي تعزيز التكامل الحيوي. لا تزال الطرق الأخرى ، مثل الأغشية المغناطيسية القابلة للتشوهوالتحفيز المغناطيسي عبر الجمجمة المتماسك بصريًا لشبكية الإنسان [22] في مراحل مبكرة جدًا من البحث.
اجراءات اخري
Orthokeratology هي طريقة تستخدم عدسات لاصقة صلبة أو جامدة نفاذة للغاز لإعادة تشكيل القرنية بشكل عابر من أجل تحسين حالة الانكسار للعين أو تقليل الحاجة إلى النظارات والعدسات اللاصقة.
في عام 2009 ، أظهر باحثون في المركز الطبي بجامعة بيتسبرغ أن الخلايا الجذعية التي تم جمعها من القرنيات البشرية يمكن أن تعيد الشفافية دون إثارة استجابة الرفض لدى الفئران مع تلف القرنية .[23] بالنسبة لأمراض الظهارة القرنية مثل متلازمة ستيفنس جونسون ، وقرحة القرنية المستمرة وما إلى ذلك ، فإن الحوف الذاتي المقابل (الطبيعي) فوق الحويصلي المشتق في الخلايا الجذعية الطرفية الموسعة القرنية تم العثور عليه ليكون فعالًا[24] حيث أن التوسع القائم على غشاء السلوي مثير للجدل .[25] بالنسبة لأمراض البطانة ، مثل اعتلال القرنية الفقاعي ، فقد ثبت أن خلايا السلائف البطانية القرنية الجثث فعالة. من المتوقع مؤخرًا أن تكون تقنيات هندسة الأنسجة الناشئة قادرة على جعل خلايا القرنية التي تتبرع بمتبرع جثث واحدة قابلة للتوسيع وقابلة للاستخدام في أكثر من مريض واحد .[26][27]
احتباس القرنية والنفاذية في توصيل الدواء الموضعي للعين
يتم إعطاء غالبية العوامل العلاجية للعين عبر الطريق الموضعي. القرنية هي أحد العوائق الرئيسية لانتشار المخدرات بسبب طبيعتها الشديدة. ينتج عن الري المستمر بسائل الدمع احتباس ضعيف للعوامل العلاجية على سطح العين. ضعف نفاذية القرنية والغسل السريع للعوامل العلاجية من سطح العين يؤدي إلى توفر حيوي منخفض للغاية للأدوية التي يتم تناولها عبر الطريق الموضعي (عادة أقل من 5 ٪). من المحتمل أن يتم تحسين الاحتفاظ بسوء التركيبات على أسطح العين باستخدام البوليمرات المخاطية .[28] يمكن تسهيل نفاذية الدواء من خلال القرنية بإضافة معززات الاختراق في التركيبات الموضعية .[29]
الكي
في أغسطس 2025 أعلن عن إمكانية استخدام الكي كبديل جديد عن جراحة الليزك لعلاج مشكلات القرنية. على الرغم من أن جراحة العيون بالليزر ناجحة بشكل عام، إلا أنها تنطوي على قطع العين ويمكن أن تسبب مضاعفات بما في ذلك جفاف العين ومشاكل في الرؤية، وفي حالات نادرة، آثار جانبية شديدة. قد يوفر هذا الاكتشاف الأمل لملايين الأشخاص الذين يعانون من ضعف البصر والذين يرغبون في بديل للنظارات والعدسات اللاصقة لكنهم يخشون مخاطر عملية الليزك.
في التجارب الأولية، استعيدت الرؤية في غضون دقائق، وأظهرت هذه التقنية علامات على إصلاح تلف العين الذي كان يُعتقد سابقًا أنه لا رجعة فيه. جاء هذا الاكتشاف بالصدفة عندما ارتكب أستاذ الكيمياء خطأً أثناء محاولته تسخين الغضروف بالكهرباء، وهو خطأ قد يغير جراحة العيون. استخدم مايكل هيل من كلية أوكسيدنتال تياراً منخفضاً جداً عن طريق الخطأ في تجربته - وعثر على اكتشاف قد يحل محل عملية الليزك بعلاج أكثر لطفاً يعيد تشكيل القرنية دون التدخل الجراحي في العين على الإطلاق. حدث هذا الإنجاز بالصدفة تماماً عندما شعر هيل وزميله الدكتور برايان وونگ، أستاذ جراحة الأنف والأذن والحنجرة وجراحة الرأس والرقبة في جامعة كاليفورنيا-إرڤاين، بالإحباط من محاولاتهم لإعادة تشكيل الغضروف باستخدام الليزر. قال هيل إنهم قرروا تجربة تسخين المادة باستخدام تيار كهربائي، لكنهم استخدموا عن طريق الخطأ تياراً أقل بكثير مما كانوا ينوون. توقعوا أن يروا الغضروف يغلي ويهتز. ومع ذلك، عندما لمس وونگ الغضروف، لم يكن ساخناً، مما يشير إلى وجود تأثير آخر.[30]
بينما يعمل وونگ كأخصائي طبي، فإن هيل كيميائي فيزيائي، وكانت شراكتهم هي التي سمحت لهم بربط النقاط. تؤدي التيارات الكهربائية المنخفضة إلى تغيير درجة حموضة الغضروف، مما يؤدي إلى إضعاف الروابط الجزيئية وجعل الأنسجة أكثر مرونة. وقال وونگ: "الأمر أشبه بالكيمياء الكهربائية. هذا هو الهيدروجين والأكسجين اللذان يتم إنتاجهما، لذا كان الاكتشاف محض صدفة على الغضروف - محض صدفة بنسبة 100%". قام فريق هيل بتطوير تقنية تسمى إعادة التشكيل الكهروميكانيكي (EMR) والتي تستخدم تيارات كهربائية صغيرة لجعل القرنية - الجزء الأمامي الشفاف ذو الشكل المقبب من العين - أكثر مرونة، ثم تشكيلها بالشكل الصحيح. جعل التيار الكهربائي نسيج القرنية أكثر قابلية للتشكيل، مثل الطين. وبمجرد توقف التيار الكهربائي، يستقر النسيج في شكله الجديد.
في الاختبارات التي أجريت على عيون الأرانب، استغرقت العملية حوالي دقيقة واحدة - وهي سرعة مماثلة لسرعة الليزك ولكن بدون شقوق أو معدات ليزر باهظة الثمن أو إزالة الأنسجة. تُركّز القرنية الضوء على الشبكية. إذا كانت مشوهة، تصبح الرؤية ضبابية. تُصحّح جراحة الليزك هذا الخلل باستخدام الليزر لحرق كمية صغيرة من مادة القرنية لإعادة تشكيلها، لكنها عملية جراحية تنطوي على مخاطر محتملة. قال هيل في بيان صحفي: "عملية الليزك ليست سوى طريقة متطورة لإجراء الجراحة التقليدية. إنها لا تزال عملية نحت للأنسجة، ولكنها تتم باستخدام الليزر". وقدم هيل نتائج بحثه في الاجتماع الخريفي للجمعية الكيميائية الأمريكية في أغسطس 2025.
قام الفريق بتكرار العملية على 12 عين أرنب، 10 منها كانت تعاني من قصر نظر محاكى. في جميع الحالات، حسّن العلاج قدرة العين على التركيز، مما يشير إلى إمكانية تصحيح النظر. وقد نجت خلايا مقلة العين لأن الباحثين تحكموا بدقة في مستويات حموضة الأنسجة. كما أثبتوا أن هذه التقنية قد تعكس بعض عتامة القرنية الناتجة عن التلف الكيميائي، والتي تتطلب حالياً عمليات زرع القرنية. يقوم هيل وونگ الآن بالتحقيق فيما إذا كان من الممكن إعادة تشكيل القرنية بدون شقوق، باستخدام تقنية استئصال الغشاء المخاطي بالمنظار.
قال الدكتور جيمس كيلي، طبيب العيون في كيلي ڤيجن ومدير قسم تعليم جراحة الانكسار في نورثويل هيلث بنيويورك، والذي لم يشارك في الدراسة: يمكن "نظرياً" أن تقلل بشكل كبير من مخاطر بعض المضاعفات عن طريق تجنب الشقوق أو الاستئصال. وأضاف: "لا توجد سديلة قابلة للخلع، ولا إزالة للأنسجة باستخدام الليزر، كما أن هناك اضطرابًا أقل في تغذية الأعصاب القرنية". وهذا قد يعني أعراضًا أقل لجفاف العين بعد الجراحة. وأضاف: "بالإضافة إلى ذلك، إذا ثبت أن العلاج بالاستئصال الكهرومغناطيسي قابل للعكس، فسيكون ذلك ميزة أمان كبيرة مقارنة بالتقنيات الحالية القائمة على الليزر". وأشار هيل إلى أن هدف الفريق كان التوصل إلى تقنية أكثر سهولة وأماناً من العلاجات الحالية القائمة على الليزر. ومع ذلك، فإن العلاج بالإشعاع الكهرومغناطيسي يغير درجة حموضة الأنسجة مؤقتًا، وهناك "مخاطر محتملة" متضمنة - ولا يمكن تحديد هذه المخاطر إلا من خلال دراسة حية، كما قال.
وقال هيل: "لدينا بيانات عن عينات خارج الجسم الحي تشير إلى أن التقنية الكهروكيميائية لا تسبب تغييرات حادة في بنية الكولاجين الأساسية للقرنية، كما أنها لا تسبب نخراً خلوياً على الفور، لكن هذه البيانات محدودة للغاية". قال كيلي إن أكبر مخاوفه هي ما إذا كانت عملية إعادة التشكيل ستصمد بمرور الوقت وستبقى موحدة. وأشار إلى أن القرنية "نشطة بيولوجياً"، وأن بنية الكولاجين فيها وترطيبها قد يتغيران مع التئام الجروح أو التقدم في السن أو الالتهاب. وبدون بيانات طويلة الأمد من دراسات حية، "لا نعلم ما إذا كان التأثير الانكساري سيتراجع، أو يتغير بشكل غير متوقع، أو يؤثر على شفافية القرنية". وأضاف كيلي أن "المتانة والاستقرار والجودة البصرية" على مدى سنوات عديدة ستكون اختبارات أساسية لتقنية EMR قبل أن يمكن اعتبارها بديلاً قابلاً للتطبيق لعملية الليزك، ويعتقد أنه قد يمر 20 عاماً أو أكثر قبل أن تصبح هذه التقنية متاحة تجارياً - إن حدث ذلك على الإطلاق.
على الرغم من أن عدم اليقين بشأن التمويل قد أوقف التقدم مؤقتاً، إلا أن هيل لا يزال متفائلاً، مشيراً إلى أن هناك "طريقًاً طويلاً" بين ما تم إنجازه والاستخدام السريري. "خطواتنا التالية هي بالتأكيد إجراء دراسة على الحيوانات الحية".
انظر ايضاً
المصادر
- ^ Cassin, B.; Solomon, S. (1990). Dictionary of Eye Terminology. Gainesville, Florida: Triad Publishing Company.[صفحة مطلوبة]
- ^ Goldstein, E. Bruce (2007). Sensation & Perception (7th ed.). Canada: Thompson Wadsworth.[صفحة مطلوبة]
- ^ Najjar, Dany. "Clinical optics and refraction". Archived from the original on 2012-05-29.قالب:MEDRS
- ^ Finn, Peter (20 December 2012). "Medical Mystery: Preparation for surgery revealed cause of deteriorating eyesight". The Washington Post.
- ^ "Why does the cornea need oxygen?". The Association of Contact Lens Manufacturers.قالب:MEDRS
- ^ Nees, David W.; Fariss, Robert N.; Piatigorsky, Joram (2003). "Serum Albumin in Mammalian Cornea: Implications for Clinical Application". Investigative Ophthalmology & Visual Science. 44 (8): 3339–45. doi:10.1167/iovs.02-1161. PMID 12882779.
- ^ Romer, Alfred Sherwood; Parsons, Thomas S. (1977). The Vertebrate Body. Philadelphia: Holt-Saunders International. pp. 461–2. ISBN 0-03-910284-X.
- ^ "Scientists discover new layer of the human cornea". sciencedaily.com. Retrieved 14 April 2018.
- ^ أ ب Merindano Encina, María Dolores; Potau, J. M.; Ruano, D.; Costa, J.; Canals, M. (2002). "A comparative study of Bowman's layer in some mammals Relationships with other constituent corneal structures". European Journal of Anatomy. 6 (3): 133–40.
- ^ أ ب ت ث ج ح خ "eye, human."Encyclopædia Britannica from Encyclopædia Britannica 2006 Ultimate Reference Suite DVD 2009
- ^ Hayashi, Shuichiro; Osawa, Tokuji; Tohyama, Koujiro (2002). "Comparative observations on corneas, with special reference to bowman's layer and descemet's membrane in mammals and amphibians". Journal of Morphology. 254 (3): 247–58. doi:10.1002/jmor.10030. PMID 12386895.
- ^ Maurice, DM (1957). "The structure and transparency of the cornea". J Physiol 136(2): 263-286.[1]
- ^ Dua, Harminder S.; Faraj, Lana A.; Said, Dalia G.; Gray, Trevor; Lowe, James (2013). "Human Corneal Anatomy Redefined". Ophthalmology. 120 (9): 1778–85. doi:10.1016/j.ophtha.2013.01.018. PMID 23714320.
- ^ أ ب Yanoff, Myron; Cameron, Douglas (2012). "Diseases of the Visual System". In Goldman, Lee; Schafer, Andrew I. (eds.). Goldman's Cecil Medicine (24th ed.). Elsevier Health Sciences. pp. 2426–42. ISBN 978-1-4377-1604-7.
{{cite book}}: External link in|chapterurl=|chapterurl=ignored (|chapter-url=suggested) (help) - ^ Belmonte, Carlos; Gallar Juana (1996). "6: Corneal Nociceptors". Neurobiology of Nociceptors. Oxford University Press. p. 146. doi:10.1093/acprof:oso/9780198523345.001.0001. ISBN 9780198523345.
- ^ Karmel, Miriam (July 2010). "Addressing the Pain of Corneal Neuropathy". EyeNet. American Academy of Ophthalmology. Retrieved 30 December 2017.
- ^ Yu, C. Q.; Rosenblatt, M. I. (2007). "Transgenic Corneal Neurofluorescence in Mice: A New Model for in Vivo Investigation of Nerve Structure and Regeneration". Investigative Ophthalmology & Visual Science. 48 (4): 1535–42. doi:10.1167/iovs.06-1192. PMID 17389482.
- ^ He, Jiucheng; Bazan, Nicolas G.; Bazan, Haydee E.P. (2010). "Mapping the entire human corneal nerve architecture". Experimental Eye Research. 91 (4): 513–23. doi:10.1016/j.exer.2010.07.007. PMC 2939211. PMID 20650270.
- ^ Herman, Irving P. (2007). Physics of the human body with 135 tables. Berlin: Springer. p. 642. ISBN 978-3540296041.
- ^ Ivan R. Schwab; Richard R. Dubielzig; Charles Schobert (5 January 2012). Evolution's Witness: How Eyes Evolved. OUP USA. p. 106. ISBN 978-0-19-536974-8.
- ^ Onkar A. Commentary: Tackling the corneal foreign body. Indian J Ophthalmol 2020;68:57-8.
- ^ Richter, Lars; Bruder, Ralf; Schlaefer, Alexander; Schweikard, Achim (2010). "Towards direct head navigation for robot-guided Transcranial Magnetic Stimulation using 3D laserscans: Idea, setup and feasibility". 2010 Annual International Conference of the IEEE Engineering in Medicine and Biology. Vol. 2010. pp. 2283–86. doi:10.1109/IEMBS.2010.5627660. ISBN 978-1-4244-4123-5. PMID 21097016.
{{cite book}}:|journal=ignored (help) - ^ Du, Yiqin; Carlson, Eric C.; Funderburgh, Martha L.; Birk, David E.; Pearlman, Eric; Guo, Naxin; Kao, Winston W.-Y.; Funderburgh, James L. (2009). "Stem Cell Therapy Restores Transparency to Defective Murine Corneas". Stem Cells. 27 (7): 1635–42. doi:10.1002/stem.91. PMC 2877374. PMID 19544455.
{{cite journal}}: Unknown parameter|lay-url=ignored (help); Unknown parameter|laydate=ignored (help); Unknown parameter|laysource=ignored (help) - ^ Sitalakshmi, G.; Sudha, B.; Madhavan, H.N.; Vinay, S.; Krishnakumar, S.; Mori, Yuichi; Yoshioka, Hiroshi; Abraham, Samuel (2009). "Ex Vivo Cultivation of Corneal Limbal Epithelial Cells in a Thermoreversible Polymer (Mebiol Gel) and Their Transplantation in Rabbits: An Animal Model". Tissue Engineering Part A. 15 (2): 407–15. doi:10.1089/ten.tea.2008.0041. PMID 18724830.
- ^ Schwab, Ivan R.; Johnson, NT; Harkin, DG (2006). "Inherent Risks Associated with Manufacture of Bioengineered Ocular Surface Tissue". Archives of Ophthalmology. 124 (12): 1734–40. doi:10.1001/archopht.124.12.1734. PMID 17159033.
- ^ Hitani, K; Yokoo, S; Honda, N; Usui, T; Yamagami, S; Amano, S (2008). "Transplantation of a sheet of human corneal endothelial cell in a rabbit model". Molecular Vision. 14: 1–9. PMC 2267690. PMID 18246029.
- ^ Parikumar, Periyasamy; Haraguchi, Kazutoshi; Ohbayashi, Akira; Senthilkumar, Rajappa; Abraham, Samuel J. K. (2014). "Successful Transplantation of In Vitro Expanded Human Cadaver Corneal Endothelial Precursor Cells On to a Cadaver Bovine's Eye Using a Nanocomposite Gel Sheet". Current Eye Research. 39 (5): 522–6. doi:10.3109/02713683.2013.838633. PMID 24144454.
- ^ Ludwig, Annick (2005-11-03). "The use of mucoadhesive polymers in ocular drug delivery". Advanced Drug Delivery Reviews. Mucoadhesive Polymers: Strategies, Achievements and Future Challenges. 57 (11): 1595–1639. doi:10.1016/j.addr.2005.07.005. ISSN 0169-409X. PMID 16198021.
- ^ Khutoryanskiy, Vitaliy V.; Steele, Fraser; Morrison, Peter W. J.; Moiseev, Roman V. (July 2019). "Penetration Enhancers in Ocular Drug Delivery". Pharmaceutics. 11 (7): 321. doi:10.3390/pharmaceutics11070321. PMC 6681039. PMID 31324063.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ "A Lab Mistake Could Save Millions From Laser Eye Surgery". theepochtimes.com. 2025-08-20. Retrieved 2026-01-17.
مصادر عامة
- Daxer, Albert; Misof, Klaus; Grabner, Barbara; Ettl, Armin; Fratzl, Peter (1998). "Collagen fibrils in the human corneal stroma: Structure and aging". Investigative Ophthalmology & Visual Science. 39 (3): 644–8. PMID 9501878.
- Daxer, Albert; Fratzl, Peter (1997). "Collagen fibril orientation in the human corneal stroma and its implication in keratoconus". Investigative Ophthalmology & Visual Science. 38 (1): 121–9. PMID 9008637.
- Fratzl, Peter; Daxer, Albert (1993). "Structural transformation of collagen fibrils in corneal stroma during drying. An x-ray scattering study". Biophysical Journal. 64 (4): 1210–4. Bibcode:1993BpJ....64.1210F. doi:10.1016/S0006-3495(93)81487-5. PMC 1262438. PMID 8494978.
وصلات خارجية
- Facts About The Cornea and Corneal Disease National Eye Institute (NEI)