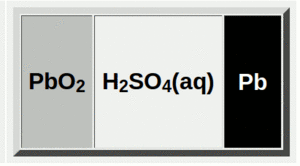
بطارية الرصاص-الحمض
 بطارية الرصاص-الحمض 12 فولت الخاصة بالسيارات | |
| الطاقة المحددة | 35–40 Wh/kg[1] |
|---|---|
| كثافة الطاقة | 80–90 Wh/L[1] |
| القدرة المحددة | 180 W/kg[2] |
| كفاءة الشحن/التفريغ | 50%–95%[3] |
| سعر-الطاقة/المستهلك | 7 (sld) إلى 18 (fld) Wh/US$[4] |
| معدل التفريغ الذاتي | 3%–20%/بالشهر[5] |
| تحمل الدورة | <350 دورة شحن[6] |
| جهد الخلية الإسمي | 2.1 V[7] |
| فترة درجة الحرارة الشحن | الدنيا. −35 درجة مئوية، العليا. 45 درجة مئوية |
بطارية الرصاص أو مركم الرصاص) Lead–acid battery هي بطارية يستخدم فيها الأقطاب في هيئة ألواح من الرصاص وأكسيد الرصاص منغمسة في كهرل من حامض الكبريتيك المخفف .
وهي نوع من البطاريات الزهيدة الثمن. ولكن بمقارنتها بالأنواع الأخرى من البطاريات فهي ثقيلة الوزن وتحتوي على كثافة طاقية منخفضة لا تتعدى 30 واط ساعة لكل كيلوجرام .
وتستعمل من بين استعمالاتها العديدة في السيارات الكهربائية. وأغلب استعمالاتها كبطارية لبدء تشغيل بادئ الاشتعال في سيارات الاحتراق الداخلي.
ويعود الفضل في اكتشاف خلية الحمض - رصاص إلى العالم الفرنسي گاستون پلانتيه Gaston Planté عام 1859. وهي تعدّ من أهم الخلايا الثانوية secondary cells وأوسعها انتشاراً؛ لإمكانية شحنها بعد تفريغها. وتستخدم في عربات النقل والشاحنات والطائرت ومحطات توليد الطاقة الاحتياطية وآليات البناء.
بطارية الرصاص-الحمض هي النوع الأول من البطاريات القابلة لإعادة الشحن التي تم إنشاؤها على الإطلاق. بالمقارنة مع البطاريات الحديثة القابلة لإعادة الشحن، تتميز بطاريات الرصاص-الحمض بكثافة طاقة منخفضة نسبياً. على الرغم من ذلك، فإن قدرتها على توفير تيار اندفاع عالي تعني أن للخلايا نسبة القدرة إلى الوزن كبيرة نسبياً. هذه الميزات، إلى جانب تكلفتها المنخفضة، تجعلها جذابة للاستخدام في السيارات لتوفير التيار العالي المطلوب بواسطة مفتاح التشغيل. تعاني بطاريات الرصاص الحمضية من عمر تشغيلي قصير نسبياً (عادة أقل من 500 دورة تفريغ عميق) وعمر افتراضي إجمالي (بسبب "الكبرتة المضاعفة" في حالة التفريغ).
نظراً لأن بطارية الرصاص-الحمض غير مكلفة مقارنة بالتقنيات الأحدث، تُستخدم هذه البطاريات على نطاق واسع حتى عندما لا يكون التيار الاندفاع مهماً ويمكن أن توفر التصميمات الأخرى كثافة طاقة أعلى. في عام 1999، شكلت مبيعات بطاريات الرصاص-الحمض 40-50٪ من قيمة البطاريات المباعة في جميع أنحاء العالم (باستثناء الصين وروسيا)، أي ما يعادل القيمة السوقية للتصنيع بحوالي 15 مليار دولار أمريكي.[8]تُستخدم تصميمات بطاريات الرصاص-الحمض كبيرة الحجم على نطاق واسع للتخزين في مصادر الطاقة الاحتياطية في أبراج الهاتف الخلوي، والتوافر العالي لنظم الطاقة في حالات الطوارئ مثل المستشفيات، ونظم الطاقة المستقلة. بالنسبة لهذه الأدوار، يمكن استخدام الإصدارات المعدلة من الخلايا القياسية لتحسين أزمنة التخزين وتقليل متطلبات الصيانة. أما بالنسبة لبطاريات الخلايا الهلامية والحشوية الزجاجية الممتصة فهي شائعة في هذه الأدوار، والمعروفة مجتمعة باسم بطاريات حمض الرصاص المُنظمة بصمام.
في حالة الشحن، يتم تخزين الطاقة الكيميائية للبطارية في فرق الجهد بين معدن الرصاص في الجانب السالب و PbO2 على الجانب الموجب.
التاريخ
لاحظ العالم الفرنسي نيكولا گوثرو في عام 1801 أن الأسلاك التي تم استخدامها في تجارب التحليل الكهربائي ستوفر بحد ذاتها كمية صغيرة من التيار "الثانوي" بعد فصل البطارية الرئيسية.[9]في عام 1859، كانت بطارية الرصاص الحمضية أول بطارية يمكن إعادة شحنها عن طريق تمرير تيار عكسي من خلالها. يتكون النموذج الأول لـ پلانتيه من لوحين رصاص مفصولين بشرائط مطاطية وملفوفان في لولب.[10]وقد تم استخدام بطارياته لأول مرة لتشغيل الأضواء في عربات القطار أثناء توقفها في المحطة. وفي عام 1881، اخترع كميل ألفونس فور نسخة محسنة تتكون من شبكة شعرية من الرصاص، يتم فيها ضغط معجون أكسيد الرصاص، مكوناً صفيحة. كان هذا التصميم أسهل في الإنتاج على كميات كبيرة. وكانت هنري تودور من أوائل الشركات المصنعة (من 1886) لبطاريات الرصاص-الحمض.[citation needed]
يسمح استخدام الكهرل الهلامي بدلاً من السائل باستخدام البطارية في أوضاع مختلفة دون تسريب. تم استخدام بطاريات الكهارل الهلامية لأي موضع لأول مرة في ثلاثينيات القرن الماضي، وفي أواخر عشرينيات القرن الماضي، سمحت أجهزة الراديو المحمولة بتركيب الخلية رأسياً أو أفقياً (ولكن ليس معكوساً) بسبب تصميم الصمام.[11] في سبعينيات القرن الماضي، تم تطوير بطارية الرصاص-الحمض المنظمة بصمام (VRLA، أو "مختومة")، بما في ذلك أنواع الحشوة الزجاجية الممتصة الحديثة (AGM)، مما يسمح بالتشغيل في أي موضع.
اكتُشف في أوائل عام 2011 أن بطاريات الرصاص-الحمض في الواقع تستخدم بعض جوانب النسبية لتعمل، وبدرجة أقل من المعدن السائل و بطاريات الملح المنصهر مثل Ca-Sb وتستخدم Sn–Bi أيضاً هذا التأثير.[12][13]
الكيمياء الكهربائية
التفريغ
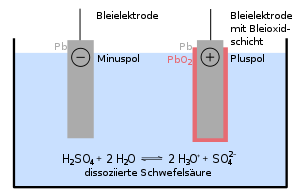
في حالة التفريغ، تصبح كل من الصفائح الموجبة والسالبة كبريتات الرصاص الثنائي (PbSO 4)، ويفقد الكهرل الكثير من حمض الكبريتيك المذاب ويصبح في الأساس ماء.
- تفاعل اللوح السالب
- Pb(s) + HSO−4(aq) → PbSO 4(s) + H+ (aq) + 2e−
إن إطلاق إلكترونين موصلين يعطي القطب الرئيسي شحنة سالبة.
عندما تتراكم الإلكترونات فإنها تخلق مجالاً كهربائياً يجذب أيونات الهيدروجين ويطرد أيونات الكبريتات، مما يؤدي إلى طبقة مزدوجة بالقرب من السطح. تقوم أيونات الهيدروجين بفحص القطب المشحون من المحلول مما يحد من التفاعل الإضافي ما لم يُسمح بتدفق الشحنة خارج القطب.
- تفاعل اللوح الموجب
- PbO 2(s) + HSO−4(aq) + 3H+ (aq) + 2e− → PbSO 4(s) + 2H 2O(l)
الاستفادة من الموصلية المعدنية لـ PbO 2.
- التفاعل الكلي يمكن كتابته كالتالي
- Pb(s) + PbO 2(s) + 2H 2SO 4(aq) → 2PbSO 4(s) + 2H 2O(l)
صافي الطاقة المنبعثة لكل مول (207 جم) من Pb(s) محولة إلى PbSO 4(s)، مهايئ التيار الكهربائي 400 كيلو جول، الموافق لتكوين 36 g من الماء. مجموع الكتل الجزيئية للمواد المتفاعلة هو 642.6 جم/مول، لذلك نظرياً يمكن للخلية أن تنتج شحنتين (192,971 كولوم] من 642.6 جم من المواد المتفاعلة، أو 83.4 أمپير ساعي لكل كيلوغرام (أو 13.9 أمبير ساعي لكل كيلوغرام لبطارية 12 فولت) لخلية 2 فولت. يصل هذا إلى 167 واط/ساعة لكل كيلوغرام من المواد المتفاعلة، ولكن من الناحية العملية، تعطي خلية الرصاص-الحمض فقط 30-40 واط/ساعة لكل كيلوغرام من البطارية، بسبب كتلة الماء والأجزاء المكونة الأخرى.
الشحن
في حالة الشحن الكامل، تتكون الصفيحة السالبة من الرصاص، واللوحة الموجبة هي أكسيد الرصاص الرباعي. يحتوي محلول الكهرل على تركيز أعلى من حمض الكبريتيك المائي، والذي يخزن معظم الطاقة الكيميائية.
يولد الشحن الزائد مع جهد الشحن العالي الأكسجين وغاز الهيدروجينعن طريق التحليل الكهربائي للماء، والذي يتفقع ويتشتت. يسمح تصميم بعض أنواع بطاريات الرصاص-الحمض بفحص مستوى الكهرل وتعبئته بالمياه النقية لاستبدال أي بطارية متعطلة بهذه الطريقة.
أثر مستوى الشحن على نقطة التجمد
بسبب انخفاض نقطة التجمد، من المرجح أن يتجمد الكهرل في بيئة باردة عندما تكون البطارية منخفضة الشحنة وبالتالي يكون تركيز حامض الكبريتيك منخفضاً.
حركة الأيونات
أثناء التفريغ، ينتقل H+ المُنتَج عند الصفائح السالبة إلى محلول الكهرل ثم يتم استهلاكه عند الصفائح الموجبة، بينما يتم استهلاك HSO−4 في كلا الصفيحتين. يحدث العكس أثناء الشحن. يمكن أن تكون هذه الحركة مدفوعة كهربائياً بتدفق البروتون أو آلية گروتوس، أو عن طريق الانتشار عبر الوسط، أو عن طريق تدفق وسط الكهرل. نظراً لأن كثافة الكهرل تكون أكبر عندما يكون تركيز حامض الكبريتيك أعلى، فإن السائل يميل إلى الدوران بواسطة الحمل الحراري. لذلك، تميل الخلية المتوسطة السائلة إلى التفريغ السريع والشحن بسرعة أكثر كفاءة من خلية هلامية مماثلة.
قياس مستوى الشحن
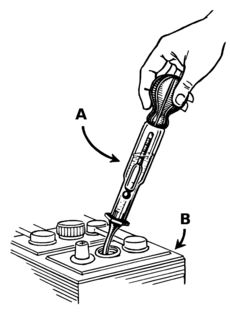
نظراً لأن الكهرل يشارك في تفاعل تفريغ الشحنات، فإن هذه البطارية لها ميزة رئيسية واحدة مقارنة بالكيمياء الأخرى: من السهل نسبياً تحديد حالة الشحنة بمجرد قياس الجاذبية النوعية للكهرل؛ تنخفض الجاذبية النوعية مع تفريغ البطارية. وتشتمل بعض تصميمات البطاريات على هيدرومتر باستخدام كرات ملونة عائمة مختلفة الكثافة. عند استخدامها في الغواصة التي تعمل بالديزل والكهرباء، تم قياس الجاذبية النوعية وكتابتها بانتظام على لوح تسجيل في غرفة التحكم للإشارة إلى المدة التي يمكن أن يظل القارب مغموراً فيها.[14]
يمكن أيضاً استخدام جهد الدائرة المفتوحة للبطارية لقياس حالة الشحن.[15] إذا كان من الممكن الوصول إلى التوصيلات بالخلايا الفردية، فيمكن تحديد حالة الشحن لكل خلية والتي يمكن أن توفر دليلًا لحالة البطارية ككل، وإلا يمكن تقييم الجهد الكلي للبطارية.
الجهد للاستخدام الشائع
شحن بطارية IUoU هو إجراء شحن ثلاثي المراحل لبطاريات الرصاص-الحمض. الجهد الاسمي لبطارية الرصاص الحمضية هو 2.2 ڤولت لكل خلية. بالنسبة لخلية واحدة، يمكن أن يتراوح الجهد الكهربائي من 1.8 ڤولت تم التحميل عند التفريغ الكامل، إلى 2.10 ڤولت في دائرة مفتوحة عند الشحن الكامل.
يختلف الجهد العائم حسب نوع البطارية (أي الخلايا المغمورة، الكهرل الجل، حشوة الزجاج الممتص)، ويتراوح من 1.8 ڤولت إلى 2.27 ڤولت. يمكن أن يتراوح جهد المعادلة، وجهد الشحن للخلايا المكبرتة، من 2.67 ڤولت إلى ما يقرب من 3 ڤولت.[16](فقط حتى يتدفق تيار الشحن)[17][18]تعتمد القيم المحددة لبطارية معينة على التصميم وتوصيات الشركة المصنعة، وعادة ما يتم تقديمها عند درجة حرارة أساسية تبلغ 20 °C (68 °F)، والتي تتطلب تعديلًا للظروف المحيطة. نُشر معيار IEEE 485-2020 (لأول مرة في عام 1997) هو الممارسة الموصى بها في الصناعة لحجم بطاريات الرصاص-الحمض في التطبيقات الثابتة. [19]
تركيبها
الصفائح
يمكن عرض خلية الرصاص-الحمض باستخدام ألواح من الرصاص للقطبين. ومع ذلك، فإن مثل هذا البناء ينتج حوالي أمپير واحد فقط للوحات بحجم البطاقة البريدية تقريباً، ولدقائق قليلة فقط.
وجد گاستون پلانتي طريقة لتوفير مساحة سطح فعالة أكبر بكثير. في تصميم پلانتي، تم تشكيل الألواح الموجبة والسالبة من لوحين من رقائق الرصاص، مفصولة بقطعة قماش وملفوفة. كانت الخلايا في البداية ذات سعة منخفضة، لذلك كانت هناك حاجة لعملية بطيئة من "التشكيل" لتآكل رقائق الرصاص، مما ينتج عنه ثاني أكسيد الرصاص على الألواح ويخشنها لزيادة مساحة السطح. في البداية، استخدمت هذه العملية الكهرباء من البطاريات الأولية؛ عندما أصبحت المولدات متاحة بعد عام 1870، انخفضت تكلفة إنتاج البطاريات بشكل كبير.[8]لا تزال ألواح پلانتي مستخدمة في بعض التطبيقات الثابتة، حيث يتم حفر الألواح ميكانيكياً لزيادة مساحة سطحها.
في عام 1880، حصل كميل ألفونس فور على براءة اختراع طريقة لطلاء شبكة الرصاص (التي تعمل كموصل حالي) بعجينة من أكاسيد الرصاص وحمض الكبريتيك والماء، تليها مرحلة المعالجة التي تم فيها تعريض الألواح لحرارة لطيفة في بيئة عالية الرطوبة. غيرت عملية المعالجة العجينة إلى خليط من كبريتات الرصاص التي تلتصق بلوحة الرصاص. بعد ذلك، أثناء الشحن الأولي للبطارية (يسمى "التكوين")، تم تحويل العجينة المعالجة على الألواح إلى مادة فعالة كهروكيميائياً ("الكتلة النشطة"). قللت عملية فور بشكل كبير من الوقت والتكلفة لتصنيع بطاريات الرصاص-الحمض، وأعطت زيادة كبيرة في السعة مقارنة ببطارية پلانتي.[20] لا تزال طريقة فور مستخدمة حتى الآن، مع إدخال تحسينات تدريجية فقط على تكوين العجينة، والمعالجة (التي لا تزال تتم بالبخار، ولكنها الآن عملية محكومة بإحكام شديد)، وهيكل وتكوين الشبكة التي يتم تطبيق العجينة عليها.
كانت الشبكة التي طورها فور من الرصاص النقي مع قضبان توصيل من الرصاص بزوايا قائمة. في المقابل، تم تصميم الشبكات الحالية لتحسين القوة الميكانيكية وتحسين التدفق الحالي. بالإضافة إلى أنماط الشبكة المختلفة (من الناحية المثالية، تكون جميع النقاط الموجودة على اللوحة على مسافة متساوية من موصل الطاقة)، تطبق العمليات الحديثة أيضاً واحدة أو اثنتين من حصائر الألياف الزجاجية الرقيقة على الشبكة لتوزيع الوزن بشكل متساوٍ. وبينما استخدم فور الرصاص النقي لشبكاته، في غضون عام (1881) تم استبدالها بسبائك الرصاص - الأنتيمون (8-12٪) لإعطاء الهياكل صلابة إضافية. ومع ذلك، تتمتع الشبكات عالية الأنتيمون بتطور هيدروجين أعلى (والذي يتسارع أيضاً مع تقدم عمر البطارية)، وبالتالي زيادة إطلاق الغازات وتكاليف صيانة أعلى. كما تم تحديد هذه المشكلات من قبل يو بي توماس و دبليو إي هارنگ في مختبرات بيل في ثلاثينيات القرن الماضي وأدت في النهاية إلى تطوير سبائك شبكية من الرصاص الكالسيوم في عام 1935 لبطاريات الطاقة الاحتياطية على شبكة الهاتف الأمريكية. وقد أدت الأبحاث ذات الصلة إلى تطوير سبائك شبكية من الرصاص-السلنيوم في أوروبا بعد بضع سنوات. لا تزال سبائك شبكة الرصاص والكالسيوم والسلنيوم الرصاص تضيف الأنتيمون، وإن كانت بكميات أقل بكثير من شبكات الأنتيمون القديمة: تحتوي شبكات الرصاص والكالسيوم على 4-6٪ أنتيمون بينما تحتوي شبكات الرصاص والسلنيوم على 1-2٪. تمنح هذه التحسينات المعدنية الشبكة مزيداً من القوة، مما يسمح لها بحمل المزيد من الوزن، أي مادة أكثر نشاطاً، وبالتالي يمكن أن تكون الألواح أكثر سمكاً، مما يساهم بدوره في زيادة عمر البطارية نظراً لوجود المزيد من المواد المتاحة للتخلص منها قبل أن تصبح البطارية غير صالحة للاستعمال. لا تزال شبكات السبائك عالية الأنتيمون مستخدمة في البطاريات المخصصة للدراجات المتكررة، على سبيل المثال في تطبيقات بدء تشغيل المحرك حيث يلزم تعويض التمدد/الانكماش المتكرر للصفائح، ولكن عندما لا يكون إطلاق الغازات كبيراً لأن تيارات الشحن تظل منخفضة. منذ الخمسينيات من القرن الماضي، أصبحت البطاريات المصممة لتطبيقات الدراجات غير المتكررة (مثل بطاريات الطاقة الاحتياطية) تحتوي بشكل متزايد على الرصاص والكالسيوم أو شبكات سبائك الرصاص والسلنيوم لأن هذه لديها تطور أقل للهيدروجين وبالتالي أقل صيانة. تعتبر شبكات سبائك الرصاص والكالسيوم أرخص في التصنيع (وبالتالي فإن الخلايا لها تكاليف مقدمة أقل)، ولها معدل تفريغ ذاتي أقل، ومتطلبات تزويد بالمياه أقل، ولكن لديها موصلية أقل قليلاً، وأضعف ميكانيكياً (وبالتالي تتطلب المزيد من الأنتيمون للتعويض)، وأكثر عرضة للتآكل (وبالتالي عمر أقصر) من الخلايا التي تحتوي على شبكات من سبائك الرصاص والسلنيوم.
تأثير الدائرة المفتوحة هو خسارة كبيرة في عمر دورة البطارية والذي لوحظ عندما تم استبدال الكالسيوم بالأنتيمون. يُعرف أيضاً باسم التأثير الخالي من الأنتيمون.[21]
الطرق الحديثة
يحتوي المعجون المستحدث على أسود الكربون و"بلانك فيكس" (كبريتات الباريوم) وليگنو سلفونات. يعمل بلاك فيكس بمثابة بلورة بذرة لتفاعل الرصاص إلى كبريتات الرصاص. يجب أن يتم تفريق بلاك فيكس بالكامل في المعجون حتى يكون فعالاً. يمنع ليگنو سلفونات الصفيحة السالبة من تكوين كتلة صلبة أثناء دورة التفريغ، وبدلاً من ذلك يتيح تكوين إبرة طويلة تشبه التغصنات. تحتوي البلورات الطويلة على مساحة سطح أكبر ويمكن تحويلها بسهولة إلى الحالة الأصلية عند الشحن. ويمنع أسود الكربون تأثير تثبيط التكوين الناجم عن ليگنو سلفونات. يكون النفثالين المشتت المكثف المسلفن الموسع الأكثر فاعلية من ليگنو سلفونات ويسرع التكوين. يعمل هذا المشتت على تحسين تشتت كبريتات الباريوم في العجينة، ويقلل من وقت المجموعة المائية، وينتج صفيحة أكثر مقاومة للكسر، ويقلل من جزيئات الرصاص الدقيقة، وبالتالي يحسن خصائص المناولة واللصق. يعمل على إطالة عمر البطارية عن طريق زيادة جهد نهاية الشحن. يتطلب النفثالين المسلفن حوالي ثلث إلى نصف كمية الليگنو سلفونات المستقر عند درجات حرارة أعلى.[22]
بمجرد أن تجف، يتم تكديس الصفائح بفواصل مناسبة وإدخالها في حاوية خلية. تشكل الألواح البديلة بعد ذلك أقطاباً كهربائية موجبة وسالبة متناوبة، وداخل الخلية يتم توصيلها لاحقاً ببعضها البعض (سالب إلى سالب، موجب إلى موجب) بالتوازي. تمنع الفواصل الصفائح من ملامسة بعضها البعض، مما قد يشكل دائرة قصر. في الخلايا المغمورة والخلايا الهلامية، تكون الفواصل عبارة عن قضبان أو مسامير عازلة، كانت من الزجاج أو السيراميك سابقاً، والآن من البلاستيك. في خلايا AGM، يكون الفاصل هو السجادة الزجاجية نفسها، ويتم ضغط رف الألواح مع الفواصل معاً قبل إدخالها في الخلية؛ مرة واحدة في الزنزانة، تتوسع الحصائر الزجاجية قليلاً، مما يؤدي إلى قفل الألواح في مكانها بشكل فعال. في البطاريات متعددة الخلايا، يتم بعد ذلك توصيل الخلايا ببعضها البعض في سلسلة، إما من خلال موصلات عبر جدران الخلايا، أو عن طريق جسر فوق جدران الخلايا. جميع التوصيلات داخل الخلايا وبين الخلايا هي من سبيكة الرصاص نفسها المستخدمة في الشبكات ذلك ضروري لمنع التآكل الگلڤاني.
للبطاريات ذات دورة التفريغ العميق هندسة مختلفة لأقطابها الموجبة. فتكوين القطب الموجب مغاير لصفيحة مسطحة فهو عبارة عن صف من أسطوانات أو أنابيب أكسيد الرصاص أو الأنابيب معلقة جنباً إلى جنب، لذلك تسمى هندستها الأنبوبية أو الأسطوانية. وتتمثل ميزة ذلك في زيادة مساحة السطح الملامسة للكهرل، مع تيارات تفريغ وشحنة أعلى من خلية مسطحة من نفس الحجم وعمق الشحن. لخلايا القطب الأنبوبي كثافة الطاقة أعلى من خلايا اللوح المسطح. هذا ما يجعل الألواح الأنبوبية/الأسطوانية مناسبة بشكل خاص لتطبيقات التيار العالي مع قيود الوزن أو المساحة، مثل الرافعات الشوكية أو لتشغيل محركات الديزل البحرية. ومع ذلك، نظراً لأن الأنابيب/الأسطوانات تحتوي على مادة أقل نشاطاً في نفس الحجم، فإنها تتمتع أيضاً بكثافة طاقة أقل من خلايا الألواح المسطحة. كما أن المواد الأقل نشاطاً في القطب الكهربي تعني أيضاً أن لديها مواد أقل متاحة للتخلص منها قبل أن تصبح الخلية غير صالحة للاستعمال. الأقطاب الأنبوبية/الأسطوانية أكثر تعقيداً أيضاً في التصنيع بشكل موحد، مما يجعلها أغلى ثمناً من الخلايا المسطحة. تحد هذه المقايضات من نطاق التطبيقات التي تكون فيها البطاريات الأنبوبية/الأسطوانية ذات مغزى للحالات التي لا توجد فيها مساحة كافية لتركيب وحدات مسطحة ذات سعة أعلى (وبالتالي أكبر).
حوالي 60٪ من وزن بطارية الرصاص-الحمض المصنّفة حوالي 60 أمبير في الساعة عبارة عن رصاص أو أجزاء داخلية مصنوعة من الرصاص؛ التوازن هو الكهرل، والفواصل، والعبوة.[8] على سبيل المثال، يوجد حوالي 8.7 كجم (19 رطل) من الرصاص في بطارية نموذجية يبلغ وزنها 14.5 كجم (32 رطل).
الفواصل
تمنع الفواصل بين الصفائح الموجبة والسالبة حدوث ماس كهربائي من خلال التلامس الفيزيائي، غالباً من خلال التغصنات ("التشجير")، ولكن أيضاً من خلال سيلان المادة الفعالة. تسمح الفواصل بتدفق الأيونات بين صفائح الخلية الكهروكيميائية لتشكيل دائرة مغلقة. تم استخدام الخشب والمطاط وحصيرة الألياف الزجاجية والسليولوز وپي ڤي سي أو الپوليإثيلين بلاستيك لصنع الفواصل. كان الخشب هو الخيار الأصلي، لكنه ينحل في الكهرل الحمضي.
يجب أن يمتلك الفاصل الفعال عدداً من الخصائص الميكانيكية؛ مثل النفاذية، المسامية، توزيع حجم المسام، مساحة السطح النوعية، التصميم الميكانيكي والقوة، المقاومة الكهربائية، الموصلية الأيونية، والتوافق الكيميائي مع الكهرل. أثناء العمل، يجب أن يتمتع الفاصل بمقاومة جيدة للأحماض والأكسدة. يجب أن تكون مساحة الفاصل أكبر قليلاً من مساحة الألواح لمنع قصر المواد بين الألواح. يجب أن تظل الفواصل ثابتة على مدى درجة حرارة التشغيل للبطارية.
الحشوة الزجاجية الماصة (AGM)
في تصميم الحشوة الزجاجية الماصة، أو AGM باختصار، يتم استبدال الفواصل بين الألواح بحشوة ألياف زجاجية مغموسة في كهرل. كما أن كمية الكهرل كافية في الحشوة لإبقائها رطبة، وإذا تم ثقب البطارية، فلن يتدفق الكهرل من الحشوة. يتمثل الغرض الأساسي من استبدال الكهرل في بطارية مغمورة بحشوة من الألياف الزجاجية شبه المشبعة في زيادة نقل الغاز بشكل كبير عبر الفاصل؛ غاز الهيدروجين أو الأكسجين الناتج أثناء الشحن الزائد أو الشحن (إذا كان تيار الشحن مفرطاً) قادر على المرور بحرية عبر الحشوة الزجاجية وتقليل أو أكسدة اللوح المقابل على التوالي. في خلية مغمورة، تطفو فقاعات الغاز إلى أعلى البطارية وتضيع في الغلاف الجوي. تتيح هذه الآلية للغاز المنتج لإعادة الاتحاد والميزة الإضافية لخلية شبه مشبعة عدم وجود تسرب كبير للكهرل عند الثقب المادي لعلبة البطارية، مما يجعل البطارية مغلقة تماماً، مما يجعلها مفيدة في الأجهزة المحمولة والأدوار المماثلة. بالإضافة إلى ذلك، يمكن تثبيت البطارية في أي اتجاه، على الرغم من أنه إذا تم تركيبها رأساً على عقب، فقد ينفجر الحمض من خلال فتحة الضغط الزائد.
لتقليل معدل فقد الماء، يتم خلط الكالسيوم مع الألواح؛ ومع ذلك، يظل تراكم الغاز مشكلة عندما يتم شحن البطارية أو تفريغها بعمق أو بسرعة. لمنع الإفراط في الضغط على غلاف البطارية، تشتمل بطاريات AGM على صمام تفجير أحادي الاتجاه، وغالباً ما تُعرف باسم تصميمات "بطارية الرصاص-الحمض المنظمة بصمام" أو VRLA.
ميزة أخرى لتصميم AGM هي أن الكهرل يصبح مادة الفصل، وقوياً ميكانيكياً. يسمح ذلك بضغط مجموعة الألواح معاً في غلاف البطارية، مما يزيد بشكل طفيف من كثافة الطاقة مقارنة بالإصدارات السائلة أو الهلامية. غالباً ما تُظهر بطاريات AGM "انتفاخاً" مميزاً في غلافها عندما يتم بناؤها في أشكال مستطيلة مشتركة، بسبب تمدد الصفائح الموجبة.
تمنع الحشوة أيضاً الحركة العمودية للكهرل داخل البطارية. عندما يتم تخزين خلية رطبة عادية في حالة تفريغ، تميل جزيئات الحمض الأثقل إلى الاستقرار في الجزء السفلي من البطارية، مما يتسبب في ترقق الكهرل. عند استخدام البطارية بعد ذلك، فإن غالبية التيار يتدفق فقط في هذه المنطقة، ويميل الجزء السفلي من الألواح إلى التلف بسرعة. هذا هو أحد أسباب إتلاف بطارية السيارة التقليدية من خلال تركها مخزنة لفترة طويلة ثم استخدامها وإعادة شحنها. تمنع الحصيرة هذا التقسيم بشكل كبير، مما يلغي الحاجة إلى هز البطاريات بشكل دوري، أو غليها، أو تشغيل "شحنة معادلة" من خلالها لخلط الكهرل. يتسبب التقسيم الطبقي أيضاً في أن تصبح الطبقات العليا من البطارية مياهاً بالكامل تقريباً، والتي يمكن أن تتجمد في الطقس البارد، وتكون AGMs أقل عرضة للتلف بسبب الاستخدام في درجات الحرارة المنخفضة.
بينما لا تسمح خلايا AGM بإضافة الماء (عادةً ما يكون من المستحيل إضافة الماء دون حفر ثقب في البطارية)، فإن عملية إعادة التركيب الخاصة بهم محدودة بشكل أساسي بالعمليات الكيميائية المعتادة. سينتشر غاز الهيدروجين عبر الغلاف البلاستيكي نفسه. وجد البعض أنه من المربح إضافة الماء إلى بطارية AGM، ولكن يجب أن يتم ذلك ببطء للسماح للماء بالاختلاط عبر الانتشار في جميع أنحاء البطارية. عندما تفقد بطارية الرصاص الحمضية الماء، يزداد تركيز الحمض، مما يزيد من معدل تآكل الألواح بشكل كبير. تحتوي خلايا AGM بالفعل على محتوى حمضي مرتفع في محاولة لخفض معدل فقد الماء وزيادة الجهد الاحتياطي، وهذا يؤدي إلى عمر أقصر مقارنة ببطارية الرصاص والأنتيمون المغمورة. إذا كان جهد الدائرة المفتوحة لخلايا AGM أعلى بكثير من 2.093 فولت، أو 12.56 فولت لبطارية 12 V، فهذا يعني أنها تحتوي على محتوى حمضي أعلى من الخلية المغمورة؛ في حين أن هذا أمر طبيعي بالنسبة لبطارية AGM، إلا أنه غير مرغوب فيه للعمل لعمر طويل.
ستظهر خلايا AGM التي يتم شحنها بشكل زائد عمداً أو عرضاً جهداً أعلى للدائرة المفتوحة وفقاً للمياه المفقودة (وزيادة تركيز الحمض). سيؤدي الشحن الزائد بمقدار أمبير في الساعة إلى تحلل 0.335 جراماً من الماء لكل خلية؛ بعض من الهيدروجين والأكسجين المحررين سوف يتحدان، ولكن ليس كله.
الكهارل الهلامية
خلال السبعينيات، طور الباحثون النسخة المُحكمة أو بطارية الهلام، والتي تمزج عامل هلام السيليكا في الكهرل (بطارية الهلام بطاريات الرصاص-الحمض المستخدمة في أجهزة الراديو المحمولة من أوائل الثلاثينيات لم تكن مُحكمة بشكل كامل). هذا ما يحول الجزء الداخلي السائل للخلايا إلى عجينة شبه صلبة، مما يوفر العديد من نفس مزايا AGM. هذه التصاميم أقل عرضة للتبخر وغالباً ما تستخدم في الحالات التي يكون فيها القليل من الصيانة الدورية أو لا يكون ممكناً. تحتوي خلايا الهلام أيضاً على درجات تجميد أقل ونقاط غليان أعلى من الشوارد السائلة المستخدمة في الخلايا الرطبة التقليدية وAGMs، مما يجعلها مناسبة للاستخدام في الظروف القاسية.
الجانب السلبي الوحيد لتصميم الهلام هو أن الهلام يمنع الحركة السريعة للأيونات في الكهرل، مما يقلل من حركة الناقل وبالتالي زيادة القدرة الحالية. لهذا السبب، توجد خلايا الهلام بشكل شائع في تطبيقات تخزين الطاقة مثل الأنظمة خارج الشبكة.
"من دون صيانة" و"محكمة الغلق" و"VRLA" ( الرصاص-الحمض المنظمة بصمام)
كل من تصميمات الهلام وAGM المُحكمة، ولا تتطلب تزويداً بالماء، ويمكن استخدامها في أي اتجاه، وتستخدم صماماً لتفجير الغاز. لهذا السبب، يمكن تسمية كلا التصميمين بأنه لا يحتاج إلى صيانة ومُحكم وVRLA. ومع ذلك، فمن الشائع جداً العثور على موارد تفيد بأن هذه المصطلحات تشير إلى واحد أو آخر من هذه التصميمات على وجه التحديد.
في بطاريات الرصاص-الحمض المنظمة بصمام (VRLA)، يتحد الهيدروجين والأكسجين المنتج في الخلايا إلى حد كبير في الماء. يكون التسرب ضئيلاً، على الرغم من أن بعض الكهرل لا يزال يفلت إذا لم تتمكن إعادة التركيب من مواكبة تطور الغاز. نظراً لأن بطاريات VRLA لا تتطلب (وتجعل من المستحيل) الفحص المنتظم لمستوى الكهرل، فقد أطلق عليها اسم "بطاريات لا تحتاج إلى صيانة". ومع ذلك، فهذه تسمية خاطئة إلى حد ما. تتطلب خلايا VRLA الصيانة. عند فقدان الكهرل، "تجف" خلايا VRLA وتفقد قدرتها. يمكن الكشف عن ذلك عن طريق أخذ القياسات الداخلية المنتظمة المقاومة، الموصلية، أو المعاوقة. ويكشف الاختبار المنتظم عما إذا كان يلزم إجراء المزيد من الاختبارات المتضمنة والصيانة. كما تم تطوير إجراءات الصيانة الحديثة للسماح بـ "إعادة التميؤ"، وغالباً ما يتم استعادة كميات كبيرة من السعة المفقودة.
أصبحت أنواع VRLA شائعة على الدراجات النارية حوالي عام 1983،[23]لأنه يتم امتصاص االكهرل الحمضي في الفاصل، لذلك لا يمكن أن ينسكب.[24] يساعد الفاصل أيضاً على تحمل الاهتزازات بشكل أفضل. كما أنها تحظى بشعبية في التطبيقات الثابتة مثل مواقع الاتصالات، نظراً لصغر حجمها ومرونة التثبيت.[25]
التفاعلات الكيميائية في بطارية الرصاص
تبلغ كثافة الطاقة في بطارية الرصاص 11و0 مليون جول/ كيلوجرام ، في حين أن البطاريات الحديثة مثل بطارية النيكل- هيدريد المعدنية NiMH تحوي اربعة أضعاف تلك الكثافة .
وعند تشغيل البطارية تجري التفاعلات الكيميائية التالية :
القطب السالب:
القطب الموجب:
في هاتين المعادلتين تعني :
- Pb لوح الرصاص
- PbO_2 أكسيد الرصاص
- SO_4-2 أيون الكبريتات
- PbSO_4 كبريتات الرصاص
- H3O+ أيون ماء موجب الشحنة ،
- e- إلكترون
- H2O ماء
هذان التفاعلان يجريان أثناء تشغيل البطارية وسحب التيار منها ، أما أثناء عملية شحن البطارية فتجري تلك التفاعلات في الاتجاه المضاد .
وبجمع تفاعلي القطب الموجب والقطب السالب يمكن كتابة التفاعل الكلي بالمعادلة :
وطبقا لسير ذلك التفاعل من اليسار إلى اليمين أثناء تشغيل البطارية يتحول كلا من الرصاص وأكسيد الرصاص بالتفاعل مع حمض الكبريتيك إلى كبريتات الرصاص وينتج عن ذلك ماء وطاقة كهربية، ويسير التفاعل من اليمين إلى اليسار أثناء شحن البطارية بوساطة مصدر كهربائي خارجي.
ويمكننا تعيين فرق جهد البطارية الناتج بوساطة جدول جهد القطب القياسي:
نجد في الجدول الجهد الكهربي للوح الرصاص Pb يساوي (- 36و0) فولت، والجهد الكهربي للوح أكسيد الرصاص PbO_2 يساوي (+ 68و1) فولت.
ونحصل على فرق الجهد بطرح الجهدين من بعضهما، أي :
أي أن القوة الدافعة الكهربائية للبطارية تبلغ 04و2 فولت، وهذا هو فرق جهد البطارية عندما يكون التيار مساو للصفر. وعند تشغيل البطارية وسحب تيار منها فإن فرق الجهد بين القطبين ينخفض عن القوة الدافعة الكهربية المحسوبة.
التفريغ الذاتي
يتفاعل أكسيد الرصاص مع حمض الكبريتيك حمتى في حالة عدم سحب التيار من البطارية فهو ليس خاملا بالنسبة لحمض الكبريتيك. إلا أن الجهد الذي يمارسه الهيدروجين في المحلول الحامضي يعمل على تخفيض سرعة هذا التفاعل الغير مرغوب فيه نظراW لأنه يعمل على التفريغ البطيء للبطارية رغم عدم استعمالها.
الدورات
بدء البطاريات
لم تُصمم بطاريات الرصاص-الحمض المصممة لبدء تشغيل محركات السيارات لتفريغ عميق. لديها عدد كبير من الألواح الرقيقة المصممة لأقصى مساحة للسطح، وبالتالي أقصى تيار ناتج، والذي يمكن أن يتلف بسهولة بسبب التفريغ العميق. وسيؤدي التفريغ العميق المتكرر إلى فقد السعة وفي النهاية فشل سابق لأوانه، حيث يتفكك القطب بسبب الإجهاد الميكانيكي الذي ينشأ من دورة العمل. ستعاني بطاريات البدء التي يتم الاحتفاظ بها على شحنة عائمة مستمرة من تآكل الأقطاب الكهربائية مما يؤدي أيضاً إلى حدوث عطل سابق لأوانه. لذلك يجب أن تبقى البطاريات البادئة في دائرة مفتوحة ولكن يتم شحنها بانتظام (مرة واحدة على الأقل كل أسبوعين) لمنع الكبرتة.
بطاريات البدء أخف وزناً من بطاريات الدورة العميقة من نفس الحجم، لأن لوحات الخلايا الأرق والأخف وزناً لا تمتد إلى الجزء السفلي من علبة البطارية. هذا يسمح للمواد المفككة السائبة بالتساقط من الألواح والتجمع في الجزء السفلي من الخلية، مما يطيل عمر خدمة البطارية. إذا ارتفع هذا الحطام السائب بدرجة كافية، فقد يلامس الجزء السفلي من الألواح ويسبب عطلاً في الخلية، مما يؤدي إلى فقدان جهد البطارية وقدرتها.
بطاريات الدورة العميقة
خلايا بطاريات الدورة العميقة المصممة خصيصاً أقل عرضة للتلف بسبب دورات التفريغ، وهي مطلوبة للتطبيقات التي يتم فيها تفريغ البطاريات بانتظام، مثل الأنظمة الكهروضوئية، المركبات الكهربائية (رافعة شوكية و عربة الگولف والسيارات الكهربائية وغيرها) و مزودات الطاقة اللامنقطعة. تحتوي هذه البطاريات على ألواح أكثر سمكاً يمكنها توفير تيار ذروة أقل، ولكن يمكنها تحمل التفريغ المتكرر.[26]
تم تصميم بعض البطاريات كحل وسط بين البادئ (التيار العالي) والدورة العميقة. يمكن تفريغها بدرجة أكبر من بطاريات السيارات، ولكن بدرجة أقل من بطاريات الدورة العميقة. قد يشار إليها على أنها بطاريات للاستخدام في "البحرية/المنازل المتنقلة" أو "البطاريات الترفيهية".
الشحن والتفريغ السريع والبطيء
سعة بطارية الرصاص-الحمض ليست ثابتة ولكنها تختلف وفقاً لمدى سرعة تفريغها. تُعرف العلاقة التجريبية بين معدل التفريغ والسعة باسم قانون بويكرت.
عندما يتم شحن البطارية أو تفريغها، تتأثر المواد الكيميائية المتفاعلة الموجودة في الواجهة بين الأقطاب الكهربائية والكهرل. بمرور الوقت، تنتشر الشحنة المخزنة في المواد الكيميائية في الواجهة، والتي يطلق عليها غالباً "الشحن البيني" أو "شحن السطح"، عن طريق انتشار هذه المواد الكيميائية عبر حجم المادة الفعالة.
لنضع في الاعتبار بطارية تم تفريغها تماماً (مثلما يحدث عند ترك أضواء السيارة مضاءة طوال الليل، وسحب التيار يبلغ حوالي 6 أمبير). إذا تم شحنها سريعاً لبضع دقائق فقط، فسيتم شحن لوحات البطارية فقط بالقرب من الواجهة بين الألواح والكهرل. في هذه الحالة، قد يرتفع جهد البطارية إلى قيمة قريبة من جهد الشاحن؛ هذا يؤدي إلى انخفاض تيار الشحن بشكل ملحوظ. بعد بضع ساعات، ستنتشر هذه الشحنة البينية إلى حجم القطب والكهارل؛ يؤدي هذا إلى انخفاض رسوم الواجهة بحيث قد لا يكون كافياً لبدء تشغيل السيارة.[27] طالما ظل جهد الشحن أقل من جهد الغاز (حوالي 14.4 فولت في بطارية الرصاص-الحمض العادية)، فإن تلف البطارية غير محتمل، وفي الوقت المناسب يجب أن تعود البطارية إلى حالة الشحن الاسمي.
الكبرتة وإزالة الكبريت
تفقد بطاريات الرصاص-الحمض القدرة على قبول الشحن عند تفريغها لفترة طويلة جداً بسبب الكبرتة، وتبلور كبريتات الرصاص.[28]وتولد الكهرباء من خلال تفاعل كيميائي مزدوج كبريتات. ويتفاعل الرصاص وثاني أكسيد الرصاص، المواد الفعالة الموجودة على ألواح البطارية، مع حمض الكبريتيك في الكهرل لتكوين كبريتات الرصاص. تتشكل كبريتات الرصاص أولاً في حالة غير متبلور منقسمة بدقة وتتحول بسهولة إلى الرصاص وثاني أكسيد الرصاص وحمض الكبريتيك عند إعادة شحن البطارية. أثناء دورة عمل البطاريات خلال عمليات التفريغ والشحن العديدة، لا يتم إعادة اتحاد بعض كبريتات الرصاص إلى الكهرل وتتحول ببطء إلى شكل بلوري مستقر لا يذوب عند إعادة الشحن. وبالتالي، لا يتم إرجاع كل الرصاص إلى لوحات البطارية، وتنخفض كمية المواد الفعالة القابلة للاستخدام والضرورية لتوليد الكهرباء بمرور الزمن.
تحدث الكبرتة في بطاريات الرصاص-الحمض عندما تتعرض للشحن غير الكافي أثناء التشغيل العادي. والتي تعوق إعادة الشحن؛ تتوسع رواسب الكبريتات في النهاية، مما يؤدي إلى تكسير الصفائح وتدمير البطارية. في النهاية، يتعذر على جزء كبير من منطقة لوحة البطارية توفير التيار مما يؤدي إلى انخفاض سعة البطارية بشكل كبير. بالإضافة إلى ذلك، لا يتم إرجاع جزء الكبريتات (من كبريتات الرصاص) إلى المنحل بالكهرباء في صورة حمض الكبريتيك. يُعتقد أن البلورات الكبيرة تمنع الكهرل فعلياً من دخول مسام الصفائح. قد يظهر طلاء أبيض على الألواح في البطاريات ذات الأغلفة الشفافة أو بعد تفكيك البطارية. تُظهر البطاريات التي تحتوي على كبريتات مقاومة داخلية عالية ويمكن أن تقدم جزءاً صغيراً فقط من تيار التفريغ العادي. تؤثر الكبرتة أيضاً على دورة الشحن، مما يؤدي إلى فترات شحن أطول، وشحن أقل كفاءة وغير مكتمل، ودرجات حرارة أعلى للبطارية.
تتعرض بطاريات SLI (بدء التشغيل، والإضاءة، والإشعال؛ على سبيل المثال، بطاريات السيارات) لأكبر قدر من التدهور لأن المركبات عادة ما تكون غير مستخدمة لفترات طويلة نسبياً. تخضع بطاريات الدورة العميقة والطاقة المحركة لشحن زائد منتظم يتم التحكم فيه، وتفشل في النهاية بسبب تآكل شبكات الألواح الموجبة بدلاً من الكبريت.
يمكن تجنب الكبرتة إذا تم إعادة شحن البطارية بالكامل فور انتهاء دورة التفريغ.[29] لا توجد طرق معروفة تم التحقق منها بشكل مستقل لإزالة الكبريت.[8][30]هناك منتجات تجارية تدعي أنها تحقق إزالة الكبريت من خلال تقنيات مختلفة مثل الشحن النبضي، ولكن لا توجد منشورات تمت مراجعتها من قِبل النظراء للتحقق من ادعاءاتهم. يظل منع الكبرتة هو أفضل مسار للعمل، من خلال الشحن الدوري الكامل لبطاريات الرصاص-الحمض.
تقسيم الطبقات
تحتوي بطارية الرصاص-الحمض النموذجية على خليط بتركيزات مختلفة من الماء والحمض. كثافة حمض الكبريتيك أعلى من الماء، مما يتسبب في تدفق الحمض المتشكل في الصفائح أثناء الشحن إلى أسفل وتجمع في الجزء السفلي من البطارية. في النهاية سيصل الخليط مرة أخرى إلى تركيبة موحدة عن طريق الانتشار، لكن هذه عملية بطيئة للغاية. ستؤدي الدورات المتكررة من الشحن والتفريغ الجزئي إلى زيادة التقسيم الطبقي للكهارل، مما يقلل من قدرة البطارية وأدائها بسبب نقص الحمض في أعلى مستويات تنشيط اللوحة. يعزز التقسيم الطبقي أيضاً التآكل في النصف العلوي من الألواح والكبريت في الأسفل.[31]
ينتج عن الشحن الزائد الدوري منتجات تفاعل غازية على اللوح، مما يتسبب في تيارات الحمل التي تمزج الكهرل وتحل التقسيم الطبقي. التحريك الميكانيكي للكهرل سيكون له نفس التأثير. كما أن البطاريات في السيارات المتحركة عرضة للسكب والرش في الخلايا، حيث تتسارع السيارة، وتتفرمل، وتنعطف.
خطر الانفجار

Excessive charging causes electrolysis, emitting hydrogen and oxygen. This process is known as "gassing". Wet cells have open vents to release any gas produced, and VRLA batteries rely on valves fitted to each cell. Catalytic caps are available for flooded cells to recombine hydrogen and oxygen. A VRLA cell normally recombines any hydrogen and oxygen produced inside the cell, but malfunction or overheating may cause gas to build up. If this happens (for example, on overcharging) the valve vents the gas and normalizes the pressure, producing a characteristic acid smell. However, valves can fail, such as if dirt and debris accumulate, allowing pressure to build up.
Accumulated hydrogen and oxygen sometimes ignite in an internal explosion. The force of the explosion can cause the battery's casing to burst, or cause its top to fly off, spraying acid and casing fragments. An explosion in one cell may ignite any combustible gas mixture in the remaining cells. Similarly, in a poorly ventilated area, connecting or disconnecting a closed circuit (such as a load or a charger) to the battery terminals can also cause sparks and an explosion, if any gas was vented from the cells.
Individual cells within a battery can also short circuit, causing an explosion.
The cells of VRLA batteries typically swell when the internal pressure rises, so giving a warning to users and mechanics. The deformation varies from cell to cell, and is greatest at the ends where the walls are unsupported by other cells. Such over-pressurized batteries should be carefully isolated and discarded. Personnel working near batteries at risk for explosion should protect their eyes and exposed skin from burns due to spraying acid and fire by wearing a face shield, overalls, and gloves. Using goggles instead of a face shield sacrifices safety by leaving the face exposed to possible flying acid, case or battery fragments, and heat from a potential explosion.
البيئة
المخاوف البيئية
According to a 2003 report entitled "Getting the Lead Out", by Environmental Defense and the Ecology Center of Ann Arbor, Michigan, the batteries of vehicles on the road contained an estimated 2،600،000 metric ton (2،600،000 long ton; 2،900،000 short ton) of lead. Some lead compounds are extremely toxic. Long-term exposure to even tiny amounts of these compounds can cause brain and kidney damage, hearing impairment, and learning problems in children.[32] The auto industry uses over 1،000،000 metric ton (980،000 long ton; 1،100،000 short ton) of lead every year, with 90% going to conventional lead–acid vehicle batteries. While lead recycling is a well-established industry, more than 40،000 metric ton (39،000 long ton; 44،000 short ton) ends up in landfills every year. According to the federal Toxic Release Inventory, another 70،000 metric ton (69،000 long ton; 77،000 short ton) are released in the lead mining and manufacturing process.[33]
Attempts are being made to develop alternatives (particularly for automotive use) because of concerns about the environmental consequences of improper disposal and of lead smelting operations, among other reasons. Alternatives are unlikely to displace them for applications such as engine starting or backup power systems, since the batteries, although heavy, are low-cost.
التدوير
According to the Battery Council, an industry group, lead–acid battery recycling is one of the most successful recycling programs in the world. In the United States 99% of all battery lead was recycled between 2014 and 2018.[34][محل شك][مطلوب مصدر أفضل] However, documents of the U.S. Environmental Protection Administration, since 1982, have indicated rates varying between 60% and 95%.[35][36]
Lead is highly toxic to humans, and recycling it can result in pollution and contamination of people resulting in numerous and lasting health problems.[37][38] One ranking cites lead–acid battery recycling as the world's most deadly industrial process, in terms of Disability-adjusted life years lost—resulting in 2,000,000 to 4,800,000 estimated years of individual human life lost, globally.[39]
Lead–acid battery-recycling sites, themselves, have become a source of lead pollution, and by 1992, the EPA had selected 29 such sites for its Superfund clean-up, with 22 on its National Priority List.[36]
An effective pollution control system is a necessity to prevent lead emission. Continuous improvement in battery recycling plants and furnace designs is required to keep pace with emission standards for lead smelters.
المضافات
Chemical additives have been used ever since the lead–acid battery became a commercial item, to reduce lead sulfate build-up on plates and improve battery condition when added to the electrolyte of a vented lead–acid battery. Such treatments are rarely, if ever, effective.[40]
Two compounds used for such purposes are Epsom salts and EDTA. Epsom salts reduce the internal resistance in a weak or damaged battery and may allow a small amount of extended life. EDTA can be used to dissolve the sulfate deposits of heavily discharged plates. However, the dissolved material is then no longer available to participate in the normal charge-discharge cycle, so a battery temporarily revived with EDTA will have a reduced life expectancy. Residual EDTA in the lead–acid cell forms organic acids which will accelerate corrosion of the lead plates and internal connectors.
The active materials change physical form during charge/discharge, resulting in growth and distortion of the electrodes, and shedding of electrodes into the electrolyte. Once the active material has fallen out of the plates, it cannot be restored into position by any chemical treatment. Similarly, internal physical problems such as cracked plates, corroded connectors, or damaged separators cannot be restored chemically.
مشاكل التآكل
Corrosion of the external metal parts of the lead–acid battery results from a chemical reaction of the battery terminals, plugs, and connectors.
Corrosion on the positive terminal is caused by electrolysis, due to a mismatch of metal alloys used in the manufacture of the battery terminal and cable connector. White corrosion is usually lead or zinc sulfate crystals. Aluminum connectors corrode to aluminum sulfate. Copper connectors produce blue and white corrosion crystals. Corrosion of a battery's terminals can be reduced by coating the terminals with petroleum jelly or a commercially available product made for the purpose.[41]
If the battery is overfilled with water and electrolyte, thermal expansion can force some of the liquid out of the battery vents onto the top of the battery. This solution can then react with the lead and other metals in the battery connector and cause corrosion.
The electrolyte can seep from the plastic-to-lead seal where the battery terminals penetrate the plastic case.
Acid fumes that vaporize through the vent caps, often caused by overcharging, and insufficient battery box ventilation can allow the sulfuric acid fumes to build up and react with the exposed metals.
المصادر
- ^ أ ب May, Geoffrey J.; Davidson, Alistair; Monahov, Boris (February 2018). "Lead batteries for utility energy storage: A review". Journal of Energy Storage. 15: 145–157. doi:10.1016/j.est.2017.11.008.
- ^ "Product Specification Guide" (PDF). Trojan Battery Company. 2008. Archived from the original (PDF) on 2013-06-04. Retrieved 2014-01-09.
- ^ Technical Manual: Sealed Lead Acid Batteries, Power-Sonic Corporation, 2018-12-17, p. 19, https://www.power-sonic.com/wp-content/uploads/2018/12/Technical-Manual.pdf#page=21, retrieved on 2014-01-09
- ^ Cowie, Ivan (13 January 2014). "All About Batteries, Part 3: Lead–acid Batteries". UBM Canon. Retrieved 3 November 2015.
- ^ PS and PSG General Purpose Battery Specifications, https://www.power-sonic.com/batteries/sealed-lead-acid/
- ^ PS Series - VRLA, AGM Battery, Valve Regulated, https://www.power-sonic.com/batteries/ps-series
- ^ Crompton, Thomas Roy (2000). Battery Reference Book (3rd ed.). Newnes. p. 1/10. ISBN 07506-4625-X.
- ^ أ ب ت ث Linden, David; Reddy, Thomas B., eds. (2002). Handbook Of Batteries (3rd ed.). New York: McGraw-Hill. p. 23.5. ISBN 978-0-07-135978-8.
- ^ "Lead Acid Battery History".
- ^ "Gaston Planté (1834-1889)", Corrosion-doctors.org; Last accessed on Jan 3, 2007,
- ^ Camm, Frederick James. "Lead–acid battery". Wireless Constructor's Encyclopaedia (third ed.).
- ^ Schirber, Michael (2011-01-14). "Focus: Relativity Powers Your Car Battery". Physics. American Physical Society. 27. Retrieved 2019-12-25.
- ^ "Liquid Tin Bismuth Battery for Grid-Scale Energy Storage". InternationalTin.org. International Tin Association. 2018-01-09. Retrieved 2019-12-25.
- ^ For one example account of the importance of battery specific gravity to submariners, see Ruhe, William J. (1996). War in the Boats: My World War II Submarine Battles. Brassey's. p. 112. ISBN 978-1-57488-028-1.
- ^ "Deep Cycle Battery FAQ". WindSun.com. sec. "Battery voltages". Archived from the original on 2010-07-22. Retrieved 2010-06-30.
- ^ "Handbook for stationary lead–acid batteries Part 1: basics, design, operation modes and applications" (PDF). Edition 6. GNB Industrial Power, Exide Technologies. February 2012. Archived from the original (PDF) on January 18, 2020.
- ^ "Recommended voltage settings for 3 phase charging of flooded lead acid batteries.", Rolls Battery, Retrieved on 17 April 2015.
- ^ Moderne Akkumulatoren, Page 55, ISBN 3-939359-11-4
- ^ "IEEE 485-2020 Standard".<
- ^ Dell, Ronald; David Anthony; James Rand (2001). Understanding Batteries. Royal Society of Chemistry. ISBN 978-0-85404-605-8.
- ^ "LABD". www.labatscience.com. Archived from the original on 2008-08-20.
- ^ United States Patent 5,948,567
- ^ Sudhan S. Misra (25 May 2007). "Advances in VRLAnext term battery technology for telecommunications". Journal of Power Sources. 168 (1): 40–8. Bibcode:2007JPS...168...40M. doi:10.1016/j.jpowsour.2006.11.005.[dead link]
- ^ Paper on recent VRLA developments from the Japanese Technical Center (SLI), Yuasa Corporation
- ^ EU Aviation News website Archived 2009-08-13 at the Wayback Machine tells about history, usage and recent developments for VRLA.
- ^ ""Battery FAQ" at Northern Arizona Wind & Sun, visited 2006-07-23". Archived from the original on 2010-07-22. Retrieved 2006-07-23.
- ^ Saslow, Wayne M. (2002). Electricity, Magnetism, and Light. Toronto: Thomson Learning. pp. 302–4. ISBN 978-0-12-619455-5.
- ^ J W Simms. The Boy Electrician. George G Haerrap & Co. p. 65.
- ^ Equalize charging can prevent sulfation if performed prior to the lead sulfate forming crystals. Broussely, Michel; Pistoia, Gianfranco, eds. (2007). Industrial applications of batteries: from cars to aerospace and energy storage. Elsevier. pp. 502–3. ISBN 978-0-444-52160-6.
- ^ "Sulfation Remedies Demystified". Batteryvitamin.net. Retrieved August 29, 2020.
- ^ Henry A. Catherino; Fred F. Feres; Francisco Trinidad (2004). "Sulfation in lead–acid batteries". Journal of Power Sources. 129 (1): 113–120. Bibcode:2004JPS...129..113C. doi:10.1016/j.jpowsour.2003.11.003.
- ^ "2.3 LEAD DOSE-RESPONSE RELATIONSHIPS", TOXICOLOGICAL PROFILE FOR LEAD, USA: CDC Agency for Toxic Substances and Disease Registry, August 2007, p. 31, "These data suggest that certain subtle neurobehavioral effects in children may occur at very low PbBs. (PbB means lead blood level)"
- ^ DeCicco, John M.; Kliesch, James (February 2001). ACEEE's Green Book: The Environmental Guide to Cars and Trucks. ISBN 978-0-918249-45-6.
- ^ "Battery Council International" (PDF). Battery Council. Retrieved 25 August 2020.
- ^ "Conclusions" in The Impacts of Lead Industry Economics and Hazardous Waste Regulations on Lead-Acid Battery Recycling: Revision and Update,, September 1987, prepared for the Office of Policy Analysis, U.S. Environmental Protection Agency, by Putnam, Hayes & Bartlett, Inc., Cambridge, Massachusetts, (also at nepis.epa.gov) retrieved May 15, 2021
- ^ أ ب "Engineering Bulletin: Selection of Control Technologies for Remediation of Lead Battery Recycling Sites", September 1992, Superfund: EPA/540/S-95/011, U.S. Environmental Protection Agency, (also at: nepis.epa.gov) retrieved May 15, 2021
- ^ Ericson, Bret; Howard Hu; Emily Nash; Greg Ferraro; Julia Sinitsky; Mark Patrick Taylor: "Blood lead levels in low-income and middle-income countries: a systematic review,", March 2021 The Lancet Planetary Health, of The Lancet, DOI:https://doi.org/10.1016/S2542-5196(20)30278-3•, as cited in "Pure Earth, USC and Macquarie University Publish Landmark Lead Study in The Lancet Planetary Health Journal," The Pollution Blog, Pure Earth, retrieved May 15, 2021
- ^ Pearce, Fred: "Getting the Lead Out: Why Battery Recycling Is a Global Health Hazard," November 2, 2020, Yale Environment 360, Yale School of the Environment, Yale University, retrieved May 15, 2021
- ^ Ballantyne, Andrew D.; Hallett, Jason P.; Riley, D. Jason; Shah, Nilay; Payne, David J. (2018). "Lead acid battery recycling for the twenty-first century". Royal Society Open Science. 5 (5): 171368. Bibcode:2018RSOS....571368B. doi:10.1098/rsos.171368. PMC 5990833. PMID 29892351.
- ^ http://museum.nist.gov/exhibits/adx2/partii.htm Archived 2016-03-14 at the Wayback Machine A dispute on battery additives when Dr. Vinal of the National Bureau of Standards reported on this for the National Better Business Bureau.
- ^ Horst Bauer, ed. (1996). Automotive Handbook (4th ed.). Robert Bosch. p. 805. ISBN 0-8376-0333-1.
انظر أيضاً
المراجع
وصلات خارجية
عامة
- magnalabs.com, battery plate sulfation
- reuk.co.uk, battery desulfation
- reuk.co.uk, lead acid batteries
- cbcdesign.co.uk, DC supply (April 2002)
- comcast.net, sme technical details on lead acid batteries
- btterycouncil.org (BCI), lead–acid battery manufacturers' trade organization.
- batteryfaq.org, car and deep-cycle battery FAQ
- atsdr.cdc.gov, lead (Pb) toxicity: key concepts | ATSDR - environmental medicine & environmental health education - CSEM case studies in environmental medicine (CSEM), agency for toxic substances and disease registry
- alton-moore.net, lead acid battery desulfator (Home Power #77 June/July 2000)]
- Articles with dead external links from March 2019
- Short description is different from Wikidata
- Articles with hatnote templates targeting a nonexistent page
- مقالات ذات عبارات محل شك
- كل المقالات بدون مراجع موثوقة
- كل المقالات بدون مراجع موثوقة from May 2019
- Lead
- Motor vehicle batteries
- بطاريات يعاد شحنها
- Sulfuric acid
- 1859 introductions