بيكربونات الكالسيوم
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Calcium hydrogencarbonate
| |
| اسم أيوپاك النظامي
Calcium bicarbonate | |
| أسماء أخرى
Cleansing lime
Bicarbonate of lime Rain salt | |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChemSpider | |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
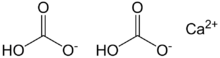
| الصيغة الجزيئية | Ca(HCO3)2 |
| كتلة مولية | 162.11464 g/mol |
| قابلية الذوبان في الماء | 16.1 g/100 mL (0 °C) 16.6 g/100 mL (20 °C) 18.5 g/100 mL (100 °C)[بحاجة لمصدر] |
| المخاطر | |
| خطر رئيسي | Irritant |
| نقطة الوميض | Non-flammable |
| مركبات ذا علاقة | |
كاتيونات أخرى
|
بيكربونات المغنيسيوم |
مركـّبات ذات علاقة
|
بيكربونات الصوديوم |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
بيكربونات الكالسيوم Calcium bicarbonate، وتسمى أيضاً كربونات الكالسيوم هيدروجين، صيغتها الكيميائية هي Ca(HCO3)2. المصطلح لا يشير إلى مركـّب صلب معروف؛ فهو يتواجد فقط في محلول مائي يحتوي أيونات الكالسيوم (Ca2+)، والبيكربونات (HCO3−)، والكربونات (CO32−) معاً مع ثاني أكسيد كربون (CO2) مذاب. التركزات النسبية لتلك الأنواع الحاوية للكربون تعتمد على درجة الحامضية pH؛ فتتسيّد البيكربونات في نطاق 6.36-10.25 في الماء العذب.
All waters in contact with the atmosphere absorb carbon dioxide, and as these waters come into contact with rocks and sediments they acquire metal ions, most commonly calcium and magnesium, so most natural waters that come from streams, lakes, and especially wells, can be regarded as dilute solutions of these bicarbonates. هذا الماء العسر ينحى لتشكيل قشور كربونات في الأنابيب والغلايات ويتفاعلوا مع الصابون ليشكلوا سخام غير مرغوب فيه.
محاولات اعداد مركبات مثل بيكربونات الكالسيوم بتبخير محلوله إلى الجفاف ينتج دوماً كربونات الكالسيوم الصلبة بدلاً منها: Ca(HCO3)2(aq) → CO2(g) + H2O(l) + CaCO3(s).[1] وقليلة جداً هي البيكربونات الصلبة المعروف وجودها عدا أولئك للفلزات القلوية وأيون الأمونيوم.
The above reaction is very important to the formation of stalactites, stalagmites, columns, and other speleothems في الكهوف and, for that matter, in the formation of the caves themselves. As water containing carbon dioxide (including extra CO2 acquired from soil organisms) passes through limestone or other calcium carbonate containing minerals, it dissolves part of the calcium carbonate and hence becomes richer in bicarbonate. As the groundwater enters the cave, the excess carbon dioxide is released from the solution of the bicarbonate, causing the much less soluble calcium carbonate to be deposited.
في العملية العكسية، فإن ثاني أكسيد الكربون (CO2) المذاب في ماء المطر (H2O) يتفاعل مع الحجر الجيري، كربونات الكالسيوم (CaCO3) ليشكل بيكربونات كالسيوم قابلة للذوبان (Ca(HCO3)2). هذا المركب القابل للذوبان يُشطف بعيداً بماء المطر. هذا النوع من التعرية يسمى 'كربنة'.
في الطب، فإن بيكربونات الكالسيوم أحياناً تـُعطى للمرضي وريدياً للتصحيح الفوري للآثار المخفضة لنشاط القلب في حالة مرض نقص بوتاسيوم الدم بزيادة تركيز الكالسيوم في المصل، وفي نفس الوقت، تصحيح الحماض الذي يتواجد في العادة.
الهامش
| H2CO3 | He | |||||||||||||||||
| Li2CO3 | BeCO3 | B | C | N | O | F | Ne | |||||||||||
| Na2CO3 | MgCO3 | Al | Si | P | S | Cl | Ar | |||||||||||
| K2CO3 | CaCO3 | Sc | Ti | V | Cr | MnCO3 | FeCO3 | CoCO3 | NiCO3 | CuCO3 | ZnCO3 | Ga | Ge | As | Se | Br | Kr | |
| Rb2CO3 | SrCO3 | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag2CO3 | CdCO3 | In | Sn | Sb | Te | I | Xe | |
| Cs2CO3 | BaCO3 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl2CO3 | PbCO3 | Bi | Po | At | Rn | ||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||
| ↓ | ||||||||||||||||||
| La2(CO3)3 | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||