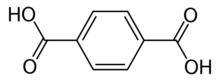
حمض الترفتاليك
(تم التحويل من Terephthalic acid)
| |
| |
| الأسماء | |
|---|---|
| اسم أيوپاك المفضل
Benzene-1,4-dicarboxylic acid | |
| أسماء أخرى
1,4-Benzenedioic acid
Benzene-1,4-dioic acid Terephthalic acid para-Phthalic acid TPA PTA BDC | |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.002.573 |
| رقم RTECS |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | C8H6O4 |
| كتلة مولية | 166.11 g mol-1 |
| المظهر | بلورات أو مسحوق أبيض |
| الكثافة | 1.522 g/cm3 |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | 0.0015 g/100 م/ل عند 20 °س |
| قابلية الذوبان | مذيبات عضوية قطبية مائية |
| الحموضة (pKa) | 3.51, 4.82[1] |
| القابلية المغناطيسية | −83.51×10−6 cm3/mol |
| البنية | |
| Dipole moment | 0 |
| المخاطر | |
| صفحة بيانات السلامة | MSDS sheet |
تبويب الاتحاد الاوروپي (DSD)
|
Not listed |
| مركبات ذا علاقة | |
الأحماض الكربوكسيلية ذات العلاقة
|
حمض الفتاليك حمض الأيزوفتاليك حمض البنزويك حمض پ-تولويك |
مركـّبات ذات علاقة
|
پ-زايلين Polyethylene terephthalate Dimethyl terephthalate |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
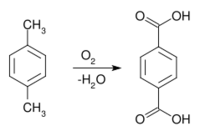
حمض الترفتاليك، هو مركب عضوي صيغته الكيميائية C6H4(CO2H)2. هذا السائل الأبيض هو سلعة أساسية كيميائية، يستخدم بصفة اساسية كمركب طليعي للپوليإستر PET، الذي يستخدم في صناعة الملابس، الزجاجات البلاستيكية. وينتج منه ملايين الأطنان سنوياً.[2]
التاريخ
القابلية للذوبان
حمض الترفتاليك ضعيف الذوبان في الماء والكحول؛ وحتى حوا عام 1970 كان حمض الترفتاليك ينقى كإسترات ثنائي الميثيل. وهو سام عند تسخينه.
|
|
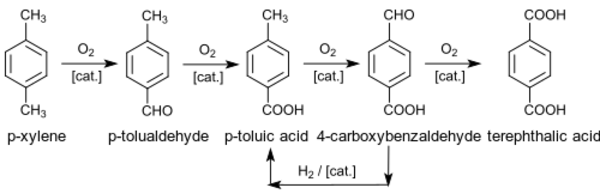
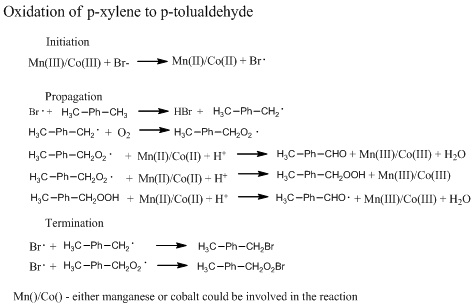
الإنتاج
عملية أموكو
الاكسدة المشتركة
الأكسدة متعددة المراحل
عملية هنكل
التقنيات البديلة والسابقة
التطبيقات
السمية
حمض الترفتاليك وإستر ثنائي الميثيل لديهم سمية منخفضة للغاية بأكثر ج.م.50 لكل 1 گ/كگ (الفم، الفئران).[2]
انظر أيضاً
- Polycyclohexylenedimethylene terephthalate a thermoplastic polyester formed from terephthalic acid
المصادر
- ^ Brown, H. C. (1955). Baude, E. A.; Nachod, F. C. (eds.). Determination of Organic Structures by Physical Methods. New York, NY: Academic Press.
{{cite book}}: Unknown parameter|displayauthors=ignored (|display-authors=suggested) (help) - ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةUllmann
وصلات خارجية
- Tedder, J. M.; Nechvatal, A.; Tubb, A. H., eds. (1975). Basic Organic Chemistry: Part 5, Industrial Products. Chichester, UK: John Wiley & Sons.
- International Chemical Safety Card 0330
الكلمات الدالة:
This article contains content from Wikimedia licensed under CC BY-SA 4.0. Please comply with the license terms.