منڤيو
| وصف اللقاح | |
|---|---|
| Target | Neisseria meningitidis |
| نوع اللقاح | Conjugate or polysaccharide |
| البيانات السريرية | |
| الأسماء التجارية | Menactra, Menveo, Menomune, Others |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a607020 |
| License data | |
| فئة السلامة أثناء الحمل |
|
| مسارات الدواء | Conjugate: intramuscular Polysaccharide: subcutaneous |
| رمز ATC | |
| الحالة القانونية | |
| الحالة القانونية | |
| المعرفات | |
| رقم CAS | |
| DrugBank | |
| ChemSpider |
|
| KEGG | |
| | |
مـِنـْـڤيو Menveo هو لقاح لالتهاب السحايا من انتاج نوڤارتس يظهر تفوق في الاستجابة المناعية ضد أربعة أنواع من مرض التهاب السحايا محوريا في المرحلة الثالثة للإختبارات أول المرحلة الثالثة ، من الرأس إلى الرأس وتظهر البيانات Menveo يمكن أن يوفر حماية أكبر للمراهقين بالمقارنة مع Menactra * نوفارتيس يتوقع أن Menveo سيكون أول لقاح ضد مرض السحايا الرباعي للحماية من الطفولة المبكرة إلى سن الرشد أكثر من 8 ملايين من الأطفال الرضع والمراهقين في الولايات المتحدة وعدد كبير من الأطفال والمسافرين على مستوى العالم يمكن أن تستفيد من Menveo (1)
بازل ، 6 مايو 2008 -- المرحلة الثالثة الجديدة من البيانات لMenveo ® (MenACWY - إدارة علاقات العملاء) تبين أن اللقاح أنتج المزيد من الاستجابة المناعية ضد المجموعات المصلية السحائية أ ، ج ، ث - 135 ونعم في المراهقين 11-18 سنة من العمر بالمقارنة مع Menactra ®. العدوى مع أي من هذه العدوى المصلية ناللقاحات الأربع التي يمكن الوقاية منها يمكن أن يؤدي إلى التهاب السحايا الجرثومي ، التهاب الغشاء حول المخ والحبل الشوكي ، أو تسمم الدم ، وعدوى خطيرة لمجرى الدم.
نتائج هذه اول دراسة مقارنة رئيسة لإختبار Menveo مقارنة مع Menactra ، وتبين ان المراهقين الذين تم تحصينهم ب Menveo ولدت مستويات أعلى من الأجسام المضادة ضد جميع السلالات الأربع مجتمعة [2].
نعم لا سيما للمجموعة المصليةy ، بين المراهقين مع مستويات منخفضة من الحصانة في وقت التطعيم ، فإن 81 ٪ من الأفراد تلقوا Menveo وقد ولد المصل رد فعل مناعي وقائي في مقابل 54 ٪ مع Menactra [2] ، كما يقاس بتقييم hSBA. المجموعة المصلية Y سببت ما يقرب من 39 ٪ من حالات داء المكورة السحائية في الولايات المتحدة [3].
"لحماية الأطفال من جميع السلالات الرئيسية من داء المكورة السحائية ، نحن بحاجة إلى أن اللقاحات توفر تغطية واسعة النطاق والتي يمكن استخدامها في جميع الفئات العمرية المعرضة للخطر" ، وقال كيث S. Reisinger ، دكتوراه في الطب ، MPH، والمدير الطبي, قال أطباءالبحوث الأولية ،قى بيتسبرغ بنسلفانيا. "إن هذه البيانات مشجعة لأنها تظهر أن Menveo يمكن أن يوفر قدرا أكبر من الحماية لأكثر من8 ملايين من الأطفال الرضع والمراهقين في الولايات المتحدة, وهذا لقاح ضد هذه السلالات الأربع التي يمكن الوقاية منها من لقاح متوفر حاليا. "
Menveo هو لقاح رباعي إستكشافى ضد المكورات السحائية في المرحلة الثالثة من التطوير السريري أنتج من قبل شركة نوفارتيس للقاحات. وكانت البيانات التي قدمت في وقت متأخر من منصة breaker في الدورة يوم 5 مايو عام 2008 خلال جمعيات طب الأطفال الأكاديمي (باس) لدى الاجتماع السنوي في هونولولو ، هاواي.
مرض المكورة السحائية ، من الأسباب الرئيسية لالتهاب السحايا الجرثومي ، وهو نادر ولكنه معد ويمكن أن يشكل عدوى مهددة للحياة. الرضع والمراهقين يشكلون أعلى معدلات المرض [4a] ، والتي يمكن أن تكون قاتلة. في كل عام يوجد ما يقرب من 1،400 إلى 2،800 حالة من حالات المرض في الولايات المتحدة [4b] ، وحوالي 10-14 ٪ من المرضى يموتون [4c]. واللقاحات المتوافرة حاليا ليست مرخصة للاستخدام عند الرضع ، ويشكلون أعلى معدلات مرض إلتهاب السحايا الجرثومى .
المرحلة الثانية من البيانات التي نشرت في عدد يناير 9 ، 2008 ، من مجلة الرابطة الطبية الأمريكية أثبتت أن Menveo سيكون أول لقاح ضد السحايا لإنتاج استجابة مناعية قوية لدى الرضع [5].
المراكز الأميركية لمكافحة الأمراض والوقاية منها) توصي بإجراء عمليات التحصين الروتينية باللقاح الرباعي للمكورات السحائية لجميع المراهقين 11-18 سنة من العمر ، وطلاب الكليات المبتدئون الذين يعيشون في مساكن والسكان في مجموعات أخرى يتعرضون لمخاطر مرتفعة والذين تتراوح أعمارهم من عشرة او 19 ل 55 سنة من العمر [6،7].
وقال يورج راينهارت الرئيس التنفيذي لشركة نوفارتيس "حاجة المريض للحصول على لقاحات داء المكورة السحائية ، لا تزال كبيرة. نحن على ما يبدو سنعمل بسرعة لتحقيق هدفنا المتمثل في توفير تغطية واسعة النطاق ضد جميع المجموعات المصلية لداء المكورة السحائية في جميع الفئات العمرية ".
ويستطرد الرئيس التنفيذي لشركة نوفارتيس للقاحات ووسائل التشخيص. "وبالنظر إلى مجموعة واسعة من الفئات العمرية هذا اللقاح ومن المتوقع أن يشكل حماية ، ويمكن حقا أن يحقق Menveo حاجة غير ملباة للقاح التهاب السحايا في السوق".
تفاصيل دراسة [2]
هذه المرحلة الثالثة من التجارب شارك فيها أكثر من 2،100 الذين تتراوح أعمارهم بين 11-18 سنة الذين حصلوا على تطعيم واحد إما مع Menveo أو من Menactra. وفى مدى شهر واحد بعد التطعيم ، فإن بيانات رياضية أظهرت أن التتر (كمية الاستجابة المناعية)التى تخص Menveo مقابل Menactra كانت: مجموعات مصلية A, 29 18; مجموعات مصلية C, 59 بالمقارنة. 47; مجموعات مصلية W-135, 87 بالمقارنة. 44; و مجموعات مصلية Y, 51 vs. 18. بالإضافة إلى, النسبة المئوية من المشاركين الذين حققوا رد فعل مناعي وقائي ، المقررة للتتر الخاص بالمصل البشرى الحامل للأجسام المضادة القاتلة للبكتيريا (hSBA) > 1:8, ومع Menveo مقارنة ب. Menactra كان: مجموعات مصلية A, 75% vs. 67%;مجموعات مصليةC, 84% مقارنة ب. 84%; مجموعات مصلية W-135, 96% مقارنة ب 88%; و مجموعات مصلية Y, 88% مقارنة ب. 69%. كما ظهرت نتائج مماثلة في مجموعة فرعية واسعة من المشاركين ذوى مجموعات مصلية سلبية ، هم المشاركون دون أي مناعة طبيعية للبكتيريا قبل التطعيم. و معايرة أو معايير hSBA الخاصة بالتدابير الواقية للجسم بالاستجابة المناعية للمكورة السحائية على أساس قدرة الأجسام المضادة لقتل البكتيريا.
حول Menveo هذه البيانات جاءت بناء على الدراسات السابقة التي أثبتت أن Menveo يولد استجابة مناعية قوية وقائية ضد هذه السلالات الأربع للقاح الوقاية منها والناس في مختلف الفئات العمرية من مرحلة الطفولة إلى مرحلة البلوغ. شركة نوفارتيس تتوقع أن تقدم طلبات للحصول على تراخيص بيولوجية (BLA) لمنظمة الاغذية والعقاقير الامريكية في وقت لاحق من هذا العام. Menveo حاليا في تجارب سريرية متعددة في المرحلة الثالثة التي تشمل الرضع وصغار الأطفال والمراهقين والبالغين. إنه لقاح يستند نفس تقنية نوفارتيس الرائدة لانتاج Menjugate ® ، وهو اللقاح ضد السحائية من الزمرة المصلية المقترنة (C) وهو قد أجيز خارج الولايات المتحدة منذ عام 2000 لاستخدامه في الأفراد من شهرين من العمر خلال مرحلة البلوغ. حول داء المكورة السحائية من الأسباب الرئيسية لالتهاب السحايا الجرثومي:
السحائية هو المرض الذى يعبر عن التهاب السحايا الجرثومي -- التهاب في الأغشية حول المخ والحبل الشوكي -- أو تعفن الدم ، وعدوى مجرى الدم. فمن الناجمة عن جرثومة النيسرية السحائية (المكورة السحائية). الأعراض : يمكن أن تشمل ظهور مفاجئ لحمى وإرتفاع في درجة الحرارة، ويمكن أن يظهر طفح جلدي ، وصداع ، وتصلب في الرقبة و يتقدم المرض بسرعة. حتى مع العلاج المبكر والمناسب ، بعض الحالات هي قاتلة [4b] ، وعادة في غضون 24-48 ساعة [8]. بالنسبة لأولئك الذين يبقون على قيد الحياة ، ما يصل الى 19 في المئة سوف يعانون من خطورة العواقب الطويلة الأجل مثل الصمم وتلف الأعصاب أو فقدان ألأطراف.
حول نوفارتيس نوفارتيس للقاحات ووسائل التشخيص هو تقسيم لشركة نوفارتيس ركزت على تطوير علاجات وقائية. ويوجد تقسيم لإثنتين من الشركات : شركة نوفارتيس اللقاحات وشيرون. نوفارتيس للقاحات في العالم هى خامس أكبر مصنع للقاحات في العالم ، وثاني أكبر مورد للقاحات الانفلونزا في الولايات المتحدة. تقسيم المنتجات تشمل الأنفلونزا ، المكورة السحائية ، لقاحات الاطفال ولقاحات السفر. تشيرون ، وفحص الدم والتشخيص الجزيئي الأعمال التجارية ، وتكرس نفسها لمنع انتشار الأمراض المعدية من خلال تطوير أساليب رائدة لفحوصات الدم التي تحمي إمدادات الدم العالمية .
نوفارتيس توفر حلول الرعاية الصحية التي تلبي الاحتياجات المتنامية للمرضى والمجتمعات. وتركز على النمو في مجالات الرعاية الصحية ، وشركة نوفارتيس تمتلك عروضا متنوعة لأفضل تلبية لهذه الاحتياجات : الأدوية المبتكرة توفير في تكاليف الأدوية الجينية ، واللقاحات الوقائية وأدوات التشخيص ، والمنتجات الصحية الاستهلاكية. نوفارتيس هي الشركة الوحيدة الرائدة في هذه المجالات. في عام 2007 ، ومجموعة من العمليات المستمرة (باستثناء التصفيات في عام 2007) حققت مبيعات صافية قدرها 38.1 مليار دولار ودخلا صافيا قدره 6.5 مليار دولار. ما يقرب من 6.4 مليار دولار تم استثمارها في أنشطة البحث والتطوير في جميع أنحاء المجموعة. يوجد مقرها في بازل ، سويسرا ، نوفارتيس تقوم بتوظيف ما يقرب من 98،000 موظفا كامل الوقت وتعمل في أكثر من 140 بلدا في جميع أنحاء العالم. لمزيد من المعلومات ، يرجى زيارة http://www.novartis.com.
Side effects
Common side effects include pain and redness around the site of injection (up to 50% of recipients). A small percentage of people develop a mild fever. A small proportion of people develop a severe allergic reaction.[6] In 2016 Health Canada warned of an increased risk of anemia or hemolysis in people treated with eculizumab (Soliris). The highest risk was when individuals "received a dose of Soliris within 2 weeks after being vaccinated with Bexsero".[7]
Despite initial concerns about Guillain-Barré syndrome, subsequent studies in 2012 have shown no increased risk of GBS after meningococcal conjugate vaccination.[8]
Travel requirements
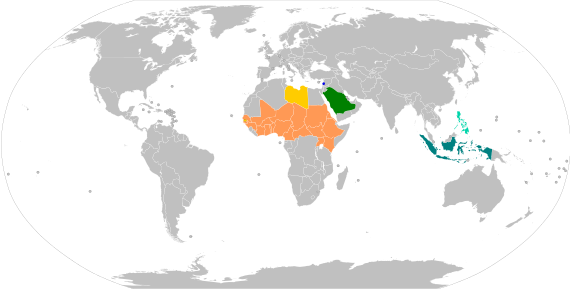
Travellers who wish to enter or leave certain countries or territories must be vaccinated against meningococcal meningitis, preferably 10–14 days before crossing the border, and be able to present a vaccination record/certificate at the border checks.[9] Countries with required meningococcal vaccination for travellers include The Gambia, Indonesia, Lebanon, Libya, the Philippines and, most importantly and extensively, Saudi Arabia for Muslims visiting or working in Mecca during the Hajj or Umrah pilgrimages.[10] For some countries in African meningitis belt, vaccinations prior to entry are not required, but highly recommended.[9]
| Meningococcal vaccination requirements for international travel[10] | |
|---|---|
| Country or territory | Details |
| All travellers must show proof of vaccination with quadrivalent meningococcal vaccine (ACYW135) upon arrival.[11] | |
| Travellers arriving from or departing to Saudi Arabia must show proof of vaccination with quadrivalent ACYW-135.[12] | |
| Proof of vaccination with quadrivalent ACYW-135 is required for travellers departing Lebanon and going to Hajj, Umrah, and to certain African countries.[13] | |
| All travellers must show proof of vaccination with quadrivalent ACYW-135 upon arrival.[14] | |
| Proof of vaccination with quadrivalent ACYW-135 is required for travellers going to Hajj and Umrah (in Saudi Arabia).[15] | |
| |
References
- ^ "TGA eBS - Product and Consumer Medicine Information Licence". Archived from the original on 13 يونيو 2021. Retrieved 13 يونيو 2021.
- ^ "Prescription medicines: registration of new chemical entities in Australia, 2017". Therapeutic Goods Administration (TGA). 21 يونيو 2022. Archived from the original on 10 أبريل 2023. Retrieved 9 أبريل 2023.
- ^ "Regulatory Decision Summary - MenQuadfi". Health Canada. 23 أكتوبر 2014. Archived from the original on 5 يونيو 2022. Retrieved 4 يونيو 2022.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةMenveo EPAR - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةMenQuadfi EPAR - ^ "Vaccines: Vac-Gen/Side Effects". Centers for Disease Control and Prevention. National Center for Immunization and Respiratory Diseases. Archived from the original on 17 مارس 2017. Retrieved 27 مارس 2017.
- ^ Health Canada "Summary Safety Review – SOLIRIS (eculizumab) and BEXSERO - Assessing the Potential Risk of Hemolysis and Low Hemoglobin in Patients Treated with Soliris and Vaccinated with Bexsero". 23 أكتوبر 2014. Archived from the original on 11 أغسطس 2017. Retrieved 11 أغسطس 2017. 16 September 2016
- ^ Yih WK, Weintraub E, Kulldorff M (ديسمبر 2012). "No risk of Guillain-Barré syndrome found after meningococcal conjugate vaccination in two large cohort studies". Pharmacoepidemiology and Drug Safety. 21 (12): 1359–1360. doi:10.1002/pds.3353. PMID 23225672. S2CID 43096082.
- ^ أ ب "International Travel and Health. Chapter 6 - Vaccine-preventable diseases and vaccines (2019 update)" (PDF). World Health Organization. United Nations. 2020. Archived (PDF) from the original on 11 أبريل 2020. Retrieved 2 ديسمبر 2020.
- ^ أ ب "Countries with risk of yellow fever transmission and countries requiring yellow fever vaccination (July 2019)". World Health Organization. United Nations. 4 يوليو 2019. Archived from the original on 8 مارس 2021. Retrieved 2 ديسمبر 2020.
- ^ "Gambia Required Vaccinations: Meningococcal Meningitis". iamat.org. International Association for Medical Assistance to Travellers (IAMAT). 20 أغسطس 2020. Archived from the original on 31 أكتوبر 2020. Retrieved 2 ديسمبر 2020.
- ^ "Indonesia Required Vaccinations: Meningococcal Meningitis". iamat.org. International Association for Medical Assistance to Travellers (IAMAT). 20 أغسطس 2020. Archived from the original on 27 فبراير 2021. Retrieved 2 ديسمبر 2020.
- ^ "Lebanon Required Vaccinations: Meningococcal Meningitis". iamat.org. International Association for Medical Assistance to Travellers (IAMAT). 20 أغسطس 2020. Archived from the original on 26 أكتوبر 2020. Retrieved 2 ديسمبر 2020.
- ^ "Libya Required Vaccinations: Meningococcal Meningitis". iamat.org. International Association for Medical Assistance to Travellers (IAMAT). 20 أغسطس 2020. Archived from the original on 16 يناير 2021. Retrieved 2 ديسمبر 2020.
- ^ "Philippines Required Vaccinations: Meningococcal Meningitis". iamat.org. International Association for Medical Assistance to Travellers (IAMAT). 20 أغسطس 2020. Archived from the original on 26 أكتوبر 2020. Retrieved 2 ديسمبر 2020.
- ^ أ ب "Saudi Arabia Required Vaccinations: Meningococcal Meningitis". iamat.org. International Association for Medical Assistance to Travellers (IAMAT). 20 أغسطس 2020. Archived from the original on 27 فبراير 2021. Retrieved 2 ديسمبر 2020.
Further reading
- Conterno LO, Silva Filho CR, Rüggeberg JU, Heath PT (2006). Conterno LO (ed.). "Conjugate vaccines for preventing meningococcal C meningitis and septicaemia". Cochrane Database Syst Rev. 3 (3): CD001834. doi:10.1002/14651858.CD001834.pub2. PMID 16855979.
- Patel M, Lee CK (2005). Patel M (ed.). "Polysaccharide vaccines for preventing serogroup A meningococcal meningitis". Cochrane Database Syst Rev (1): CD001093. doi:10.1002/14651858.CD001093.pub2. PMID 15674874.
- Hall E, Wodi AP, Hamborsky J, Morelli V, Schillie S, eds. (2021). "Chapter 14: Meningococcal Disease". Epidemiology and Prevention of Vaccine-Preventable Diseases (14th ed.). Washington D.C.: U.S. Centers for Disease Control and Prevention (CDC).
وصلات خارجية
- "Meningococcal ACWY Vaccine Information Statement". U.S. Centers for Disease Control and Prevention (CDC). أغسطس 2021.
- "Meningococcal B Vaccine Information Statement". U.S. Centers for Disease Control and Prevention (CDC). أغسطس 2021.
- "Meningococcal (Groups A, C, Y and W-135) Polysaccharide Diphtheria Toxoid Conjugate Vaccine". U.S. Food and Drug Administration (FDA). 17 أبريل 2019.
- "Meningococcal Polysaccharide Vaccine, Groups A, C, Y and W-135 Combined". U.S. Food and Drug Administration (FDA). 25 أبريل 2019.
- "Menveo". U.S. Food and Drug Administration (FDA). 28 يوليو 2020.
- "Bexsero". U.S. Food and Drug Administration (FDA). 18 نوفمبر 2019.
- "Trumenba". U.S. Food and Drug Administration (FDA). 18 نوفمبر 2019.
- MeSH Vaccines Meningococcal Vaccines
- Short description matches Wikidata
- Use dmy dates from November 2022
- Template:drugs.com link with non-standard subpage
- Drugs with non-standard legal status
- Chemicals that do not have a ChemSpider ID assigned
- Articles without EBI source
- Articles without InChI source
- Articles without UNII source
- Drug has EMA link
- Drugboxes which contain changes to verified fields
- Drugboxes which contain changes to watched fields
- Drugs that are a vaccine
- Articles with hatnote templates targeting a nonexistent page
- Meningococcal vaccines
- GSK plc brands
- Novartis brands
- سانوفي
- الأدوية الأساسية حسب منظمة الصحة العالمية (لقاحات)
- Wikipedia medicine articles ready to translate