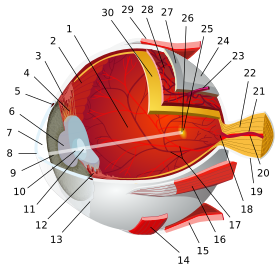
خلية عقدية شبكية
| الخلية العقدية الشبكية | |
|---|---|
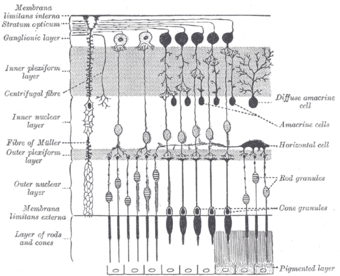 مخطط يوضح قطاع مستعرض من طبقات الشبكية. تحتوي المنطقة المشار إليها بالطبقة العقدية على الخلايا العقدية الشبكية. | |
| Identifiers | |
| MeSH | D012165 |
| NeuroLex ID | nifext_17 |
| المصطلحات التشريحية | |
الخلاية العقدية الشبكية (إنگليزية: retinal ganglion cell، اختصاراً RGC)، هي نوع من الخلايا العصبية الموجودة بالقرب من السطح الداخلي ( طبقة الخلايا العقدية ) لشبكية العين . تتلقى معلومات بصرية من المستقبلات الضوئية عبر نوعين من الخلايا العصبية الوسيطة: الخلايا ثنائية القطب وخلايا أماكرين الشبكية . تعتبر خلايا أماكرين الشبكية ، وخاصة الخلايا ذات المجال الضيق ، مهمة لإنشاء وحدات فرعية وظيفية داخل طبقة الخلايا العقدية وجعلها بحيث يمكن للخلايا العقدية مراقبة نقطة صغيرة تتحرك مسافة صغيرة.[1] تنقل الخلايا العقدية للشبكية بشكل جماعي المعلومات البصرية المكونة للصورة وغير المكونة للصورة من شبكية العين في شكل جهد فعل إلى عدة مناطق في المهاد ، وتحت المهاد ، والدماغ المتوسط ، أو الدماغ الاوسط.
تختلف خلايا العقدة الشبكية اختلافًا كبيرًا من حيث حجمها واتصالاتها واستجاباتها للتحفيز البصري ولكنها تشترك جميعًا في الخاصية المحددة لامتلاك محور عصبي طويل يمتد إلى الدماغ. تشكل هذه المحاور العصب البصري والتصالبة البصرية والجهاز البصري .
تساهم نسبة صغيرة من الخلايا العقدية الشبكية بشكل ضئيل أو لا تساهم في الرؤية ، ولكنها هي نفسها حساسة للضوء ؛ تشكل محاورها السبيل الشبكي المهادي وتساهم في إيقاعات الساعة البيولوجية ومنعكس الحدقة الضوئية ، وتغيير حجم حدقة العين.
الوظيفة
يوجد حوالي 0.7 إلى 1.5 مليون خلية عقدية شبكية في شبكية العين البشرية.[2] مع حوالي 4.6 مليون خلية مخروطية و 92 مليون خلية عصوية ، أو 96.6 مليون مستقبل ضوئي لكل شبكية,[3] في المتوسط ، تتلقى كل خلية عقدة شبكية مدخلات من حوالي 100 عصوية ومخروط . ومع ذلك ، فإن هذه الأرقام تختلف اختلافًا كبيرًا بين الأفراد وكوظيفة لموقع الشبكية. في النقرة (مركز الشبكية) ، ستتواصل خلية عقدية واحدة مع ما لا يزيد عن خمسة مستقبلات ضوئية. في الأطراف البعيدة (حافة شبكية العين) ، ستتلقى خلية عقدية واحدة معلومات من عدة آلاف من المستقبلات الضوئية.[بحاجة لمصدر]
تطلق الخلايا العقدية الشبكية تلقائيًا جهود الفعل بمعدل أساسي أثناء الراحة. يؤدي إثارة الخلايا العقدية الشبكية إلى زيادة معدل الإطلاق بينما يؤدي التثبيط إلى انخفاض معدل الإطلاق.
الأنواع
هناك تنوع كبير في أنواع الخلايا العقدية عبر الأنواع. في الرئيسيات ، بما في ذلك البشر ، توجد بشكل عام ثلاث فئات من الخلايا العقدية الشبكية:
- W- العقدة: صغيرة ، 40٪ من المجموع ، واسعة في شبكية العين ، إثارة من عصويات. كشف حركة الاتجاه في أي مكان في المجال.
- العقدة -X: القطر المتوسط ، 55٪ من الإجمالي ، المجال الصغير ، رؤية الألوان. استجابة مستمرة.
- Y- العقدة: أكبر ، 5٪ ، مجال تغصني واسع للغاية ، تستجيب لحركة العين السريعة أو التغير السريع في شدة الضوء. استجابة عابرة.
بناءً على نتوئاتهم ووظائفهم ، هناك خمس فئات رئيسية على الأقل من الخلايا العقدية الشبكية:
- خلية قزمة (صغير الخلايا ، أو مسار P ؛ خلايا P )
- خلية مظلية (كبير الخلايا أو مسار M ؛ الخلايا M )
- خلية ثنائية الطبقة ( خلية كونية ، أو مسار K)
- الخلايا العقدية الحساسة للضوء
- تظهر الخلايا العقدية الأخرى على الأكيمة العلوية من أجل حركات العين ( حركة رمش العين ))[4]
نوع-پ
تمتد الخلايا العقدية الشبكية من النوع P بنتوء على طبقات الخلايا الصغيرة للنواة الركبية الوحشية . تُعرف هذه الخلايا باسم الخلايا العقدية الشبكية القزمة ، بناءً على الأحجام الصغيرة لأشجارها التغصنية وأجسامها الخلوية. حوالي 80٪ من جميع الخلايا العقدية الشبكية هي خلايا قزمة في مسار الخلايا الصغيرة . يتلقون مدخلات من عدد قليل نسبيا من العصويات والمخاريط. لديهم سرعة توصيل بطيئة ، ويستجيبون للتغيرات في اللون ولكن يستجيبون بشكل ضعيف فقط للتغيرات في المقابل ما لم يكن التغيير كبيرًا. لديهم مجالات استقبال بسيطة محيطية مركزية ، حيث قد يكون المركز إما في وضع التشغيل أو إيقاف التشغيل بينما المحيط هو عكس ذلك.
نوع-م
تمتد الخلايا العقدية الشبكية من النوع M بنتوء على طبقات الخلايا الكبيرة للنواة الركبية الوحشية. تُعرف هذه الخلايا باسم الخلايا العقدية الشبكية المظلة ، بناءً على الأحجام الكبيرة لأشجارها المتغصنة وأجسامها الخلوية. حوالي 10 ٪ من جميع الخلايا العقدية الشبكية هي خلايا مظلية ، وهذه الخلايا هي جزء من مسار الخلايا الكبيرة. يتلقون مدخلات من عدد كبير نسبيا من العصويات و المخاريط. لديهم سرعة توصيل سريعة ، ويمكن أن تستجيب للمنبهات منخفضة التباين ، لكنها ليست حساسة للغاية للتغيرات في اللون. لديهم مجالات استقبالية أكبر بكثير والتي مع ذلك هي أيضًا محيط مركزي.
نوع-ك
تمتد الخلايا العقدية الشبكية من النوع BiK بنتوء على الطبقات الخلوية الكونية للنواة الركبية الوحشية. تم تحديد خلايا العقدة الشبكية من النوع K مؤخرًا نسبيًا فقط. خلية كونية تعني "خلايا صغيرة مثل الغبار" ؛ صغر حجمها جعل من الصعب العثور عليها. حوالي 10 ٪ من جميع الخلايا العقدية الشبكية هي خلايا ثنائية الطبقات ، وهذه الخلايا تمر عبر المسار الخلوي الكوني. يتلقون مدخلات من أعداد وسيطة من العصويات والمخاريط. قد يشاركون في رؤية الألوان. لديهم حقول استقبالية كبيرة جدًا لها مراكز فقط (بدون محيط) وتكون دائمًا في وضع التشغيل للمخروط الأزرق ومطفأة لكل من المخروط الأحمر والأخضر.
الخلية العقدية الحساسة للضوء
تحتوي الخلايا العقدية الحساسة للضوء ، بما في ذلك على سبيل المثال لا الحصر الخلايا العقدية العملاقة للشبكية ، على صبغها الضوئي ، الميلانوبسين ، مما يجعلها تستجيب مباشرة للضوء حتى في حالة عدم وجود عصويات ومخاريط. إنهم يتمددون بنتوء ، من بين مناطق أخرى ، للنواة فوق التصالبية (SCN) عبر السبيل الشبكي الوطائي لتحديد إيقاع يوماوي والحفاظ عليها. تشمل الخلايا العقدية الشبكية الأخرى التي تظهر على النواة الركبية الوحشية (LGN) الخلايا التي تربطها بنواة إيدينجر-يستفال (EW) ، للتحكم في منعكس الحدقة للضوء ، وخلايا العقدية الشبكية العملاقة.
الفسيولوجيا
معظم الخلايا العقدية الناضجة قادرة على إطلاق جهود الفعل بتردد عالٍ بسبب تعبيرها عن قنوات البوتاسيوم K v 3..[5][6][7]
علم الأمراض
إن تنكس محاور الخلايا العقدية للشبكية ( العصب البصري ) هو السمة المميزة للزرق.[8]
علم الأحياء التطوري
نمو الشبكية: البداية
تولد الخلايا العقدية الشبكية (RGCs) بين اليوم الجنيني 11 واليوم صفر بعد الولادة في الفئران وبين الأسبوع الخامس والأسبوع 18 في الرحم في نمو الإنسان.[9][10][11] في الثدييات ، تضاف الخلايا العقدية الشبكية عادةً في البداية في الجانب المركزي الظهري للقديح البصري ، أومنشم العين. ثم يكتسح نمو الخلايا الشبكية بطنيًا ومحيطيًا من هناك في نمط يشبه الموجة..[12] تعتمد هذه العملية على مجموعة من العوامل ، بدءًا من عوامل الاشارة مثل FGF3 و FGF8 إلى التثبيط المناسب لمسار إشارات Notch. الأهم من ذلك ، أن المجال bHLH (الحلقة الحلزونية الأساسية) - الذي يحتوي على عامل النسخ Atoh7 ومؤثراته النهائية ، مثل Brn3b و Isl-1 ، تعمل على تعزيز بقاء الخلايا العقدية الشبكية والتمايز ..[9] يتم أيضًا تنظيم "موجة التمايز" التي تدفع تطور الخلايا العقدية الشبكية عبر شبكية العين بشكل خاص إلى عوامل bHLH Neurog2 و Ascl1 و FGF / Shh المشتقة من الاطراف.[9][12][13]
النمو داخل طبقة الخلية العقدية الشبكية (الألياف الصوئية)
عادةً ما تقوم الخلايا السلفية المبكرة للخلايا العقدية الشبكية بتمديد نتوئات المتصلة بالأغشية المقيدة الداخلية والخارجية للشبكية مع الطبقة الخارجية المجاورة للظهارة الصبغية للشبكية والداخلية المجاورة للخلط الزجاجي المستقبلي. سوف تسحب جسم الخلية نحو الظهارة الصباغية ، وتخضع لانقسام وتمايز نهائي للخلية ، ثم تهاجر للخلف نحو الغشاء المحدد الداخلي في عملية تسمى الانتقال الجسدي . من الأفضل فهم حركية الانتقال الجسدي للخلايا العقدية الشبكية والآليات الأساسية في الدانيو المخطط.[14] ستقوم الخلايا العقدية الشبكية بعد ذلك بتمديد محور عصبي في طبقة الخلية العقدية الشبكية ، والتي يتم توجيهها عن طريق ملامسة اللامينين.[15] من المحتمل أن يتم التوسط في تراجع النتوء القمية للخلايا العقدية الشبكية عن طريق إشارات Slit-Robo ..[9]
سوف تنمو الخلايا العقدية الشبكية على طول الأقدام الطرفية الدبقية الموضوعة على السطح الداخلي (الجانب الأقرب إلى الخلط الزجاجي المستقبلي). سوف يتوسط جزيء التصاق الخلايا العصبية (N-CAM) هذا الارتباط عبر التفاعلات المحبة للمثلية بين جزيئات الأشكال الإسوية المتشابهة (A أو B). تلعب إشارات الشق أيضًا دورًا ، حيث تمنع الخلايا العقدية الشبكية من النمو إلى طبقات خارج طبقة الألياف البصرية.[16]
سوف تنمو المحاور من الخلايا العقدية الشبكية وتمتد نحو القرص البصري ، حيث تخرج من العين. بمجرد التمايز ، فإنها تحدها منطقة طرفية مثبطة ومنطقة مركزية جذابة ، وبالتالي تعزيز امتداد المحور العصبي نحو القرص البصري. توجد سلفات الكوندروتين بروتيوغليكان على طول الظهارة العصبية في شبكية العين (السطح الذي تقع فوقه الخلايا الجذعية الجنينية) في تدرج منخفض محيطي مركزي مرتفع.[9] يتم التعبير عن الشق أيضًا بنمط مشابه ، يُفرز من الخلايا في العدسة.[16] ستعزز جزيئات الالتصاق ، مثل N-CAM و L1 ، النمو مركزيًا وستساعد أيضًا على تحزيم (تجميع) محاور الخلية العقدية الشبكية معًا بشكل صحيح. يتم التعبير عن Shh بتدرج محيطي مرتفع مركزي منخفض ، مما يعزز امتداد محاور الخلية العقدية الشبكية ذات الإسقاط المركزي عبر Patched-1 ، المستقبل الرئيسي لـ Shh ، الإشارات الوسيطة.[17]
النمو إلى وعبر العصب البصري
تخرج الخلايا العقدية الشبكية من طبقة الخلية العقدية الشبكية من خلال القرص البصري ، الأمر الذي يتطلب دوران 45 درجة.[9] يتطلب ذلك تفاعلات معقدة مع الخلايا الدبقية للقرص البصري والتي ستعبر عن التدرجات المحلية لـ Netrin-1 ، وهو مورفوجين يتفاعل مع المستقبلات المحذوفة في سرطان القولون والمستقيم (DCC) على مخاريط النمو لمحور الخلية العقدية الشبكية. يجذب هذا المُورِفوجين في البداية محاور الخلية العقدية الشبكية ، ولكن بعد ذلك ، من خلال التغيير الداخلي في مخروط النمو الخاص بـ الخلية العقدية الشبكية ، يصبح netrin-1 تنفري ، مما يدفع المحور العصبي بعيدًا عن القرص البصري.[18] يتم ذلك من خلال آلية تعتمد على ادينوزين احادي الفوسفات الحلقي. بالإضافة إلى ذلك ، قد تشارك أيضًا سلفات الكوندروتين بروتيوغليكان وإشارات Eph – ephrin..
ستنمو الخلايا العقدية الشبكية على طول أقدام طرف الخلية الدبقية في العصب البصري. سوف تفرز هذه الخلايا الدبقية semaphorin 5a و Slit التنافري بطريقة محيطية ، تغطي العصب البصري مما يضمن بقائها في العصب البصري. يتم التعبير عن Vax1 ، وهو عامل نسخ ، بواسطة الدماغ البيني البطني والخلايا الدبقية في المنطقة التي يتشكل فيها التصالب ، ويمكن أيضًا إفرازه للتحكم في تكوين التصالب[19]
النمو في التصالبة البصرية
عندما تقترب الخلايا العقدية الشبكية من التصالب البصري ، النقطة التي يلتقي عندها العصبان البصريان ، عند الدماغ البيني البطني حول الأيام الجنينية 10-11 في الفأر ، يتعين عليهم اتخاذ قرار بالعبور إلى السبيل البصري المقابل أو البقاء في مسار العصب البصري المماثل . في الفأر ، سيبقى حوالي 5٪ من الخلايا العقدية الشبكية ، ومعظمها يأتي من منطقة الهلال البطني الصدغي (VTc) من شبكية العين ، في نفس الجانب ، في حين أن 95٪ المتبقية من الخلايا العقدية الشبكية ستعبر[9] يتم التحكم في هذا إلى حد كبير من خلال درجة التداخل بين مجالي الرؤية في كلا العينين. لا يوجد تداخل كبير في الفئران ، في حين أن البشر الذين لديهم تداخل ، سيحصلون على حوالي 50٪ من الخلايا العقدية الشبكية المتقاطعة و 50٪ سيظلون في نفس الجانب..
بناء المخطط الخارجي للتصالبة
بمجرد وصول الخلايا العقدية الشبكية إلى التصالب ، ستتغير الخلايا الدبقية التي تدعمها من التشكل داخل الأوعية إلى الشكل الشعاعي. ستشكل مجموعة من الخلايا الدماغ البيني التي تعبر عن المستضد الجنيني الخاص بمرحلة مستضد سطح الخلية (SSEA) -1 و CD44 شكل V مقلوب.[20] سيقومون بتأسيس الجانب الخلفي للحد من التصالب البصري. بالإضافة إلى ذلك ، تعد إشارات الشق مهمة هنا: بروتيوجليكان كبريتات الهيبارين ، والبروتينات الموجودة في النسيج خارج الخلايا ، ستثبت مورفوجين الشق في نقاط محددة في حد التصالب الخلفي.[21] ستبدأ الخلايا العقدية الشبكية في التعبير عن Robo ، مستقبل الشق ، في هذه المرحلة ، مما يسهل التنافر.
إسقاط الجانب المقابل للخلايا العقدية الشبكية
تحتاج محاور الخلية العقدية الشبكية التي تنتقل إلى الجهاز البصري المقابل إلى العبور. يوفر Shh ، المعبر عنه على طول خط الوسط في الدماغ البيني البطني ، تلميحًا تنافرياً لمنع الخلايا العقدية الشبكية من عبور خط الوسط خارج المنشأ. ومع ذلك ، يتم إنشاء ثقب في هذا التدرج ، مما يسمح بعبور الخلايا العقدية الشبكية.
تشمل الجزيئات الوسيطة جذب NrCAM ، والذي يتم التعبير عنه من خلال نمو الخلايا العقدية الشبكية والخط الدبقي الناصف ويعمل جنبًا إلى جنب مع Sema6D ، عبر مستقبل plexin-A1.[9] يتم تحرير VEGF-A من خط الوسط يوجه الخلايا العقدية الشبكية لاتخاذ مسار مقابل ، بوساطة مستقبل neuropilin-1 (NRP1).[22] يبدو أن ادينوزين احادي الفوسفات الحلقي مهم جدًا في تنظيم إنتاج بروتين NRP1 ، وبالتالي تنظيم استجابة مخاريط النمو لتدرج VEGF-A في التصالب.[23]
الإسقاط في نفس الجانب للخلايا العقدية الشبكية
المكون الوحيد في الفئران التي تُسقط بشكل جانبي هو الخلايا العقدية الشبكية من الهلال البطني الصدغي في شبكية العين ، وفقط لأنها تعبر عن عامل النسخ Zic2. سوف Zic2 تشجيع التعبير عن EphB1 مستقبلات التيروزين كيناز، والتي، من خلال الإشارة إلى الأمام (انظر استعراض شو وآخرون.[24]) سوف يرتبط بـ ligand ephrin B2 المعبر عنه بواسطة الخلايا الدبقية الوسطى ويتم صده للابتعاد عن التصالب. ستظهر بعض VTc RGCs بشكل معاكس لأنها تعبر عن عامل النسخ Islet-2 ، وهو منظم سلبي لإنتاج Zic2.[25]
يلعب Shh دورًا رئيسيًا في الحفاظ على محاور الخلايا العقدية الشبكية مماثلة أيضًا. يتم التعبير عن Shh بواسطة الخلايا العقدية الشبكية الإسقاط من الناحية المقابلة والخلايا الدبقية في منتصف الخط. Boc ، أو Brother of CDO (مرتبط بـ CAM / خاضع للتنظيم بواسطة الجينات المسرطنة) ، وهو مستقبل مشترك لـ Shh يؤثر على إشارات Shh من خلال Ptch1,[26] يبدو أنه يتوسط في هذا التنافر ، كما هو الحال فقط على مخاريط النمو القادمة من إسقاط الخلايا العقدية الشبكية المماثل.[17]
تشمل العوامل الأخرى التي تؤثر على نمو الخلية العقدية الشبكية المماثل عائلة Teneurin ، وهي بروتينات التصاق عبر الغشاء تستخدم تفاعلات المثليين للتحكم في التوجيه ، و Nogo ، والتي يتم التعبير عنها بواسطة الخلايا الدبقية الشعاعية في خط الوسط..[27][28] يتم التعبير عن مستقبل Nogo بواسطة VTc RGCs فقط.[9]
أخيرًا ، يبدو أن عوامل النسخ الأخرى تلعب دورًا مهمًا في التغيير. على سبيل المثال ، Foxg1 ، المعروف أيضًا باسم Brain-Factor 1 ، و Foxd1 ، ويسمى أيضًا Brain Factor 2 ، هما عوامل نسخ حلزونية مجنحة يتم التعبير عنها في الكؤوس البصرية الأنفية والزمنية وتبدأ الحويصلات البصرية في التحرر من الأنبوب العصبي. يتم التعبير عن هذه العوامل أيضًا في الدماغ البيني البطني ، حيث يتم التعبير عن Foxd1 بالقرب من التصالب ، بينما يتم التعبير عن Foxg1 بشكل أكبر. يبدو أنها تلعب دورًا في تحديد الإسقاط المماثل من خلال تغيير التعبير عن إنتاج مستقبلات Zic2 و EphB1..[9][29]
نمو في الجهاز البصري
بمجرد الخروج من التصالب البصري ، ستمتد الخلايا العقدية الشبكية ظهريًا على طول السطح البطني البطيني مما يجعل السبيل البصري ، والذي سيرشدهم إلى الأكيمة العلوية والنواة الركبية الوحشية في الثدييات ، أو السقف في الفقاريات السفلية..[9] يبدو أن Sema3d يعزز النمو ، على الأقل في السبيل البصري القريب ، ويبدو أن إعادة ترتيب الهيكل الخلوي على مستوى مخروط النمو مهم.[30]
الميالين
في معظم الثدييات ، لا تكون محاور الخلايا العقدية للشبكية ميالينية حيث تمر عبر الشبكية. ومع ذلك ، فإن أجزاء المحاور التي تقع خارج شبكية العين تكون ميالينة. يُفسَّر نمط تكوّن الميالين وظيفيًا من خلال التعتيم المرتفع نسبيًا للميالين - المحاور النخاعية التي تمر عبر الشبكية تمتص بعض الضوء قبل أن يصل إلى طبقة المستقبلات الضوئية ، مما يقلل من جودة الرؤية. هناك أمراض العيون البشرية حيث يحدث هذا ، في الواقع. في بعض الفقاريات ، مثل الدجاج ، يتم تخليق محاور الخلية العقدية داخل الشبكية.[31]
انظر أيضاً
المصادر
- ^ Masland RH (January 2012). "The tasks of amacrine cells". Visual Neuroscience. 29 (1): 3–9. doi:10.1017/s0952523811000344. PMC 3652807. PMID 22416289.
- ^ Watson AB (June 2014). "A formula for human retinal ganglion cell receptive field density as a function of visual field location" (PDF). Journal of Vision. 14 (7): 15. doi:10.1167/14.7.15. PMID 24982468.
- ^ Curcio CA, Sloan KR, Kalina RE, Hendrickson AE (February 1990). "Human photoreceptor topography" (PDF). The Journal of Comparative Neurology. 292 (4): 497–523. doi:10.1002/cne.902920402. PMID 2324310. S2CID 24649779.
- ^ Principles of Neural Science 4th Ed. Kandel et al.
- ^ "Ionic conductances underlying excitability in tonically firing retinal ganglion cells of adult rat".
- ^ Henne J, Pöttering S, Jeserich G (December 2000). "Voltage-gated potassium channels in retinal ganglion cells of trout: a combined biophysical, pharmacological, and single-cell RT-PCR approach". Journal of Neuroscience Research. 62 (5): 629–37. doi:10.1002/1097-4547(20001201)62:5<629::AID-JNR2>3.0.CO;2-X. PMID 11104501.
- ^ Henne J, Jeserich G (January 2004). "Maturation of spiking activity in trout retinal ganglion cells coincides with upregulation of Kv3.1- and BK-related potassium channels". Journal of Neuroscience Research. 75 (1): 44–54. doi:10.1002/jnr.10830. PMID 14689447.
- ^ Jadeja RN, Thounaojam MC, Martin PM (2020). "Implications of NAD + Metabolism in the Aging Retina and Retinal Degeneration". Oxidative Medicine and Cellular Longevity. 2020: 2692794. doi:10.1155/2020/2692794. PMC 7238357. PMID 32454935.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب ت ث ج ح خ د ذ ر ز Erskine L, Herrera E (2014-01-01). "Connecting the retina to the brain". ASN Neuro. 6 (6): 175909141456210. doi:10.1177/1759091414562107. PMC 4720220. PMID 25504540.
- ^ Petros TJ, Rebsam A, Mason CA (2008-01-01). "Retinal axon growth at the optic chiasm: to cross or not to cross". Annual Review of Neuroscience. 31: 295–315. doi:10.1146/annurev.neuro.31.060407.125609. PMID 18558857.
- ^ Pacal M, Bremner R (May 2014). "Induction of the ganglion cell differentiation program in human retinal progenitors before cell cycle exit". Developmental Dynamics. 243 (5): 712–29. doi:10.1002/dvdy.24103. PMID 24339342.
- ^ أ ب Hufnagel RB, Le TT, Riesenberg AL, Brown NL (April 2010). "Neurog2 controls the leading edge of neurogenesis in the mammalian retina". Developmental Biology. 340 (2): 490–503. doi:10.1016/j.ydbio.2010.02.002. PMC 2854206. PMID 20144606.
- ^ Lo Giudice Q, Leleu M, La Manno G, Fabre PJ (September 2019). "Single-cell transcriptional logic of cell-fate specification and axon guidance in early-born retinal neurons". Development. 146 (17): dev178103. doi:10.1242/dev.178103. PMID 31399471.
- ^ Icha J, Kunath C, Rocha-Martins M, Norden C (October 2016). "Independent modes of ganglion cell translocation ensure correct lamination of the zebrafish retina". The Journal of Cell Biology. 215 (2): 259–275. doi:10.1083/jcb.201604095. PMC 5084647. PMID 27810916.
- ^ Randlett O, Poggi L, Zolessi FR, Harris WA (April 2011). "The oriented emergence of axons from retinal ganglion cells is directed by laminin contact in vivo". Neuron (in English). 70 (2): 266–80. doi:10.1016/j.neuron.2011.03.013. PMC 3087191. PMID 21521613.
{{cite journal}}: CS1 maint: unrecognized language (link) - ^ أ ب Thompson H, Andrews W, Parnavelas JG, Erskine L (November 2009). "Robo2 is required for Slit-mediated intraretinal axon guidance". Developmental Biology. 335 (2): 418–26. doi:10.1016/j.ydbio.2009.09.034. PMC 2814049. PMID 19782674.
- ^ أ ب Sánchez-Camacho C, Bovolenta P (November 2008). "Autonomous and non-autonomous Shh signalling mediate the in vivo growth and guidance of mouse retinal ganglion cell axons". Development. 135 (21): 3531–41. doi:10.1242/dev.023663. PMID 18832395.
- ^ Höpker VH, Shewan D, Tessier-Lavigne M, Poo M, Holt C (September 1999). "Growth-cone attraction to netrin-1 is converted to repulsion by laminin-1". Nature. 401 (6748): 69–73. Bibcode:1999Natur.401...69H. doi:10.1038/43441. PMID 10485706. S2CID 205033254.
- ^ Kim N, Min KW, Kang KH, Lee EJ, Kim HT, Moon K, et al. (September 2014). "Regulation of retinal axon growth by secreted Vax1 homeodomain protein". eLife. 3: e02671. doi:10.7554/eLife.02671. PMC 4178304. PMID 25201875.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Sretavan DW, Feng L, Puré E, Reichardt LF (May 1994). "Embryonic neurons of the developing optic chiasm express L1 and CD44, cell surface molecules with opposing effects on retinal axon growth". Neuron. 12 (5): 957–75. doi:10.1016/0896-6273(94)90307-7. PMC 2711898. PMID 7514428.
- ^ Wright KM, Lyon KA, Leung H, Leahy DJ, Ma L, Ginty DD (December 2012). "Dystroglycan organizes axon guidance cue localization and axonal pathfinding". Neuron. 76 (5): 931–44. doi:10.1016/j.neuron.2012.10.009. PMC 3526105. PMID 23217742.
- ^ Erskine L, Reijntjes S, Pratt T, Denti L, Schwarz Q, Vieira JM, et al. (June 2011). "VEGF signaling through neuropilin 1 guides commissural axon crossing at the optic chiasm". Neuron. 70 (5): 951–65. doi:10.1016/j.neuron.2011.02.052. PMC 3114076. PMID 21658587.
- ^ Dell AL, Fried-Cassorla E, Xu H, Raper JA (July 2013). "cAMP-induced expression of neuropilin1 promotes retinal axon crossing in the zebrafish optic chiasm". The Journal of Neuroscience. 33 (27): 11076–88. doi:10.1523/JNEUROSCI.0197-13.2013. PMC 3719991. PMID 23825413.
- ^ Xu NJ, Henkemeyer M (February 2012). "Ephrin reverse signaling in axon guidance and synaptogenesis". Seminars in Cell & Developmental Biology. 23 (1): 58–64. doi:10.1016/j.semcdb.2011.10.024. PMC 3288821. PMID 22044884.
- ^ Pak W, Hindges R, Lim YS, Pfaff SL, O'Leary DD (November 2004). "Magnitude of binocular vision controlled by islet-2 repression of a genetic program that specifies laterality of retinal axon pathfinding". Cell. 119 (4): 567–78. doi:10.1016/j.cell.2004.10.026. PMID 15537545. S2CID 16663526.
- ^ Allen BL, Song JY, Izzi L, Althaus IW, Kang JS, Charron F, et al. (June 2011). "Overlapping roles and collective requirement for the coreceptors GAS1, CDO, and BOC in SHH pathway function". Developmental Cell (in English). 20 (6): 775–87. doi:10.1016/j.devcel.2011.04.018. PMC 3121104. PMID 21664576.
{{cite journal}}: CS1 maint: unrecognized language (link) - ^ Wang J, Chan CK, Taylor JS, Chan SO (June 2008). "Localization of Nogo and its receptor in the optic pathway of mouse embryos". Journal of Neuroscience Research. 86 (8): 1721–33. doi:10.1002/jnr.21626. PMID 18214994.
- ^ Kenzelmann D, Chiquet-Ehrismann R, Leachman NT, Tucker RP (March 2008). "Teneurin-1 is expressed in interconnected regions of the developing brain and is processed in vivo". BMC Developmental Biology. 8: 30. doi:10.1186/1471-213X-8-30. PMC 2289808. PMID 18366734.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Herrera E, Marcus R, Li S, Williams SE, Erskine L, Lai E, Mason C (November 2004). "Foxd1 is required for proper formation of the optic chiasm". Development. 131 (22): 5727–39. doi:10.1242/dev.01431. PMID 15509772.
- ^ Sakai JA, Halloran MC (March 2006). "Semaphorin 3d guides laterality of retinal ganglion cell projections in zebrafish". Development. 133 (6): 1035–44. doi:10.1242/dev.02272. PMID 16467361.
- ^ Villegas GM (July 1960). "Electron microscopic study of the vertebrate retina". The Journal of General Physiology. 43(6)Suppl (6): 15–43. doi:10.1085/jgp.43.6.15. PMC 2195075. PMID 13842313.