الأجسام الصلبة
الأجسام الصلبة Solids
خواصها Properties
تتميز الأجسام الصلبة بأنها:
- تملك شكلاً و حجماً ثابتين , لأن البعد بين صغير جداً و قوى الارتباط بين جزيئاتها كبيرة ومتينة . وهكذا فإن الأجسام الصلبة تأخذ سطوح فصل محددة .
- غير قابلة للانضغاط , وذلك لمنع تداخل الغمامات الإلكترونية العائدة للجزيئات و الذرات .
- ذات معاملات تمدد حرارية صغيرة بالمقارنة مع معاملات تمدد كل من السوائل و الغازات .
- بطيئة جداً في انتشارها , ويعود ذلك لأن معظمها يحوي عيوباً تمثلها الفراغات الموجودة في بنيتها الصلبة , والتي تملأ بطريقة أو أخرى لاحقاً .
- يتملك معظمها بنى بلورية , تحدد الكثير من الخصائص المميزة للمادة الصلبة .
البنية البلورية Crystalline Structure
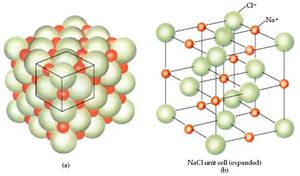
إن أهم ما يميز الأجسام الصلبة هو مقدرتها على تشكيل البلورات . وتعرّف البلورات على أنها أشكال هندسية محددة . وتحدّ البلورة سطوح فصل مستوية تمثل وجوه البلورة , والتي تتقاطع مع بعضها بزوايا (?,?,?) وأحرف (a,b,c) محددة . وتعتبر معالم سطح البلورة عالية الانتظام , وهي تعكس النمط المنتظم والمتكرر للذرات أو جزيئات أو الشواردالموجود ضمن البلورة . فعلى سبيل المثال : يتبلور ملح كلور الصوديوم NaClعلى شكل مكعبات مركزية الوجوه , تتقاطع وجوهها بزاوية 90 درجة ، وتشغل روؤس المكعب الواحد شوارد الكلور Cl- التي تتناوب مع شوارد Na+ الصوديوم , والتي تتوضع بدورها في المنتصف ما بين شوارد الكلور , بالإضافة إلى توضع شاردة كلور في مركز كل وجه .
- ملاحظة : يمكن لنفس المادة أحياناً أن تشكّل نماذج بلورية مختلفة في شروط متفاوتة ؛ حيث يتبلور كلور الصوديوم في بعض الظروف على شكل ثماني وجوه منتظم إضافة إلى الشكل المكعب مركزي الوجوه , وكذلك يتبلور الكربون في شكلين هما الغرافيت و الألماس ؛ وهذا ما يدعى بخاصة تعدد الأشكال البلورية أو التآصل [[]]Allotropism للأجسام الصلبة البلورية .
تعيين البنية البلورية Determining of Crystalline Structure
تمكن طريقة انعراج [[أشعة اكس]] X- Ray Diffraction من الحصول على قدرٍ وافٍ من المعلومات المتعلقة ببنية البلورات وتوزّع الدقائق (ذرات , جزيئات , شوارد) المكوّنة لها . ويوضّح الشكل-5.9 رسماً توضيحياً لتعيين البنية البلورية بطريقة انعراج أشعة اكس . وقد استخدمت طريقة انعراج أشعة- X لأول مرة عام 1912 من قبل الفيزيائي الألماني M.von Laue وذلك بعد أن كانت قد اكتشفت وبالصدفة من قبل Roentgen عام 1895 . و أشعة اكس عبارة عن إشعاع كهرومغناطيسي مثل الضوء العادي , ولكنها تتميز عن الضوء العادي بطاقتها الأعلى وبالتالي بمقدرتها على النفوذ والاختراق . ويستخدم من أجل دراسة البلورات حزم من أشعة-X بأطوال موجية قصيرة نسبياً تتراوح ما بين (0.015–15)nm وهذا المجال هو خارج نطاق الرؤية عند الإنسان والذي يبلغ (400-700)nm. ويمكن الحصول على أشعة اكس بقذف ذرات معدن ثقيل , مثل النحاس Cu أو المولبدينيوم Mo , بإلكترونات مسرّعة ذات طاقة عالية , مما يؤدي إلى انتقال هذه الطاقة إلى ذرات المعدن المقذوف وتهيّج إلكترونات ذراته , التي تقفز إلى سويات طاقية أعلى , ولكنها لا تلبث إن تعود أدراجها إلى سويّاتها الطاقية الأساسية مصدرة بذلك طاقة على شكل أشعة اكس . بعد ذلك تجمع أشعة اكس المتولدة على هيئة حزمة اسطوانية مركّزة , وذلك باستخدام حاجز سميك من الرصاص يحوي في منتصفه ثقباً تستطيع حزمة أشعة اكس الأسطوانية فقط المرور عبره إلى العينة هدف الدراسة , والتي توضع على مسار الحزمة الصادرة عن ثقب التجميع . وهكذا فإنه يمكن لأشعة اكس الواردة أن تصدم البلورة و تخترقها وتصدر عنها مشتتة . وأخيراً فإن أشعة اكس الصادرة عن البلورة والمشتتة تستقبل على طبقة فيلم (حساس) حيث تترك أشعة اكس أثراً على الفيلم في كلّ نقطة صدمتها أشعة اكس . والآن بمعالجة الفيلم نشاهد عليه بقعاً تعكس المواضع التي صدمت فيها أشعة اكس البلورة , حيث يعطي توزع هذه النقط النموذج الخاص للبلورة المدروسة , بالإضافة إلى معلومات أخرى عن أبعاد الجسيمات المكوّنة لها . لقد استطاع العالم فون-لاويه بهذه الطريقة تعيين بنية البيريل Be3Al2Si6O18 .
معادلة Bragg في انعراج أشعة اكس Bragg`s Equation in X-Ray Diffraction
إن انعراج أشعة اكس نتيجة اختراقها للبلورة ظاهرة معقدة , فهي تتضمن تأثيراً متبادلا بين كل من أشعة اكس الواردة والإلكترونات الموجودة في الدقائق المكونة للبلورة . لقد درس هذه الظاهرة العالم الإنكليزي وليام براغ - W. Bragg مع ابنه Lowrance ووجدا أنه في حال سقوط شعاعين من حزمة أشعة اكس المجمّعة على دقيقتين متجاورتين (من ذات المستوي) فإن الإشارة الصادرة عن إحدى الدقيقتين تقوّي الإشارة الصادرة عن الدقيقة الأخرى إذا فرق المسار المقطوع (?) يساوي تماماً إلى عدد صحيح (n) من طول موجة أشعة اكس (?) , وهذا ما يدعى بشرط براغ : n.λ → 2d.sinθ =n.λ= ∆ حيث : d هو البعد بين مستويين متتالين في البلورة , و θ زاوية ورود أو انعراج الأشعة , و n عدد صحيح يأخذ القيم : ...,n=1,2,3 لقد تمّ بطريقة انعراج أشعة اكس تحديد البنى الجزيئية للعديد من المواد , وبخاصة منها ذات البنى الجزيئية المعقدة لمركبات بيولوجية هامة . ففي عام 1962 تسلّم العالمان . Perutz , J. Kendrew جائزة نوبل في الكيمياء من أجل تعيين بنية الهيموغلوبينHemoglobin . وفي نفس العام أيضاً تم تعيين بنية جزيء الـ DNA المسؤول عن نقل المورّثات من قبل العلماء الثلاث F. Crick , J. Watson , M. Wilkins للذين نالوا جائزة نوبل في الطب . كما نالت D. Hodgkin جائزة نوبل في الكيمياء عام 1945 لتعين B12 , كما أنها كانت قد عيّنت من قبل بنية الأنسولين .
الشبكات البلورية Crystalline Lattices
أدت الدراسات الحديثة باستخدام الأشعة السينية إلى الحصول على دليل واضح وأكيد من أن الذرّات والشوارد والجزيئات المكوّنة للبلورات تكوّن نمطاً ثلاثي الأبعاد , ويتكرر بشكل دوري . يدعى النموذج الذي يصف ترتيب هذه الدقائق في البلورة بالشبكةالفراغية أو الشبكة البلورية ويكفي من أجل دراسة الشبكة البلورية أن ينظر إلى جزء منها يمثل نظام الترتيب في البلورة ويسمى هذا الجزء من الشبكة ب الوحدةالخلوية ,التي تعتبر حجر الأساس المكوّن للشبكة . وتعرّف الوحدة الخلوية – Unit Cell على أنها أصغر جزء من الشبكة البلورية , الذي بانزياحه بمقدار أبعاده الخاصة (a,b,c) وفي جميع الاتجاهات (?,?,?) يرسم الشبكة البلورية بأكملها . أدت أدت الدراسات الحديثة باستخدام الأشعة السينية إلى الحصول على دليل أكيد وواضح من أن الذرّات والشوارد والجزيئات المكوّنة للبلورات تكوّن نمطاً ثلاثي الأبعاد , ويتكرر بشكل دوري . لقد برهن عالم البلورات A. Bravais عام 1948 على وجود 14 نوعاً من الشبكات البلورية . وقد صنّفت فيما بعد في 7 مجموعات بلورية أساسية.
أنواع الأجسام الصلبة Types of Solids
ويستعاض أحياناً عن تصنيف الأجسام الصلبة البلورية وفق تناظر ترتيبها الهندسي بتصنيفها وفق الوحدات التي تشغل نقاط شبكتها . ويوجد وفق هذا التصنيف أربعة أنواع من البلورات هي :
- البلورات الجزيئية :وفيها تشغل الجزيئات نقاط الشبكة , وتكون قوى التجاذب فيها ضعيفة . وهي تميل لامتلاك طاقات شبكية صغيرة و درجات انصهار منخفضة , وتكون لينة وسهلة التشوه .
- البلورات الشاردية : وفيها تشغل الشوارد الموجبة والسالبة نقاط الشبكة , ويكون الترابط بينها كهراكدي(بين الشوارد الموجبة و الغمامة الإلكترونية) . وهي تميل لامتلاك طاقات شبكية كبيرة ودرجات انصهار عالية وتكون هشة .
- البلورات المشتركة : وفيها تشغل الذرات نقاط الشبكة , وتكون الروابط فيها مشتركة . وهي صلبة و قاسية وذات درجات انصهار مرتفعة و ناقلية ضعيفة للحرارة والكهرباء .
- البلورات المعدنية : وفيها تشغل الشوارد الموجبة فقط نقاط الشبكة , ويكون الترابط فيها كهراكدي .وهي ناقلة جيدة للحرارة والكهرباء .
الشبكات المكعبة Cubic Lattices
تعتبر الشبكات البلورية مكعبيّة الشكل من أهم الشبكات , ويوجد لها ثلاثة أنواع هي كما يلي .
شبكات مكعبة بسيطة Simple Cubic Lattice
وهي أبسطها , وفيها تشغل الذرات أو الجزيئات نقاط رؤوس المكعب ؛ ومثالها O2 الذي يمتلك عند تجمده شبكة بلورية مكعبة بسيطة . ومن أجل هذا النمط تـكون العلاقة بين طول حرف الوحدة ℓ ونصف قطر الدقيقة التي تشغل رأس الكعب r هي :
2r = ℓ → r = ℓ / 2 ويكون نصيب الوحدة الخلوية من الدقائق التي تشغلها هو دقيقة واحدة على الرؤوس (8x1/8=1) .
شبكات مكعبة مركزية الجسم Body-Centered Cubic Lattices
وفيها تشغل الدقائق رؤوس المكعب إضافةً إلى مركزه . ومثالها Li, Na , K, Fe , Cr
وتعطى علاقة نصف قطر الدقيقة r بدلالة طول حرف المكعب ℓ (الوحدة الخلوية) على النحوالتالي : 2r = d/2 = ½ (√3 ℓ) = (√3/2)ℓ → r = (√3/4)ℓ
ويكون نصيب الوحدة الخلوية من الدقائق التي تشغلها هو : (2 واحدة على الرؤوس 8x1/8=1, وواحدة في المركز 1x1=1)
شبكات مكعبة مركزية الوجوه Face-Centered Cubic Lattices
وفيها تحتل الدقائق رؤوس المكعب إضافة مراكز وجوهها . ومثالها : Ag , Au , Al , Cu , Ni بالإضافة إلى الغازات الخاملة . وتكون العلاقة بين نصف قطر الدقيقة r وطول حرف الوحدة (المكعب) ℓ : 4r = √2 ℓ → r = (√2 / 4)ℓ
ويكون نصيب الوحدة الخلوية من الدقائق التي تشغلها هو: 4 (واحدة على الرؤوس 8x1/8=1 , وثلاثة في الوجوه 6x1/2=3)
الطاقة الشبكية Lattice Energy
بالرغم من أن تشكل الأزواج الإلكترونية يكون مفيداً لشرح التوجهات الدورية, فإنه يكون أكثر واقعية التفكير بالمركبات الأيونية كما توجد كأجسام صلبة تحت الشروط العادية . في جميع المركبات الأيونية تجتمع الكاتيونات والأنيونات في الشبكة البلورية . ويوضح الشكل-5.16 مثالاً على ذلك الشبكة البلورية لكلور الصوديوم , المؤلفة من شوارد الصوديوم موجبة الشحنة Na+ وشوارد الكلور سالبة الشحنة Cl- . يتجاذب الكاتيون Mn+ إلى بضعة أنيونات Xn- التي تجذب بدورها العديد من الكاتيونات وهكذا ... . بالإضافة لذلك فإنه يوجد قوى تجاذب هامة بين الكاتيونات أو بين الأنيونات المتجاورة في الشبكة . ونتيجة لذلك فإن القياس الأكثر واقعية لسلوك المركبات الأيونية تأخذ بعين الاعتبار الطاقة المنتشرة عندما تلتقي الأيونات في الطور الغازي مع بعضها لتشكل الشبكة البلورية الصلبة :
Na(g)+ + Cl(g)- → NaCl(g) ; ∆HLattice = -786 kJ/mol
يدعى تغير الأنتالبية من أجل هذا التفاعل بالطاقة الشبكية (أو الأنتالبية الشبكية ) . تضبط الطاقة الشبكية بشكل كبير من خلال قوة التجاذب بين الكاتيونات والأنيونات , والتي قسناها بأنتالبية التشكل ∆Hf . لا يمكن للطاقة الشبكية لمركب أيوني أن تقاس بشكل مباشر ؛ وإنما تستنبط من خواص ترموديناميكية أخرى , أو تحسب من معادلة مشتقة من المعادلة السابقة . ويتركز اهتمامنا هنا في اختبار التوجهات الدورية للطاقة الشبكية , واستخدامها في إيجاد مسّوغات لبعض المركبات غير المعروفة . تماماً كما ∆Hf تعتمد على شحنة الأيون فإن ∆HL هي كّذلك أيضاً . حيث تصبح الطاقة الشبكية أقل سلبية عندما يصبح حجم أيون الهاليد أكبر , فعلى سبيل المثال تكون الطاقة الشبكية لـ LiI أقل سلبية من الطاقة الشبكية لـ LiF . ويلاحظ نفس التوجه عندما يصبح كاتيون المعدن القلوي أكبر , فمثلاً تكون الطاقة الشبكية لـ KF أقل سلبية من الطاقة الشبكية لـ LiF . يملك كلوريد الصوديوم NaCl أنتالبية تشكّل مولية قياسية تساوي – 411.2 kJ
Na(s) + 1/2Cl2(g) → NaCl(s) ; ∆Hf0 = - 411.2 kJ/mol
طاقة البلورات Energy of Crystals
تمثل طاقة البلورة قوى التجاذب الفعالة في البلورة . وتعرّف طاقة البلورة (أو طاقة الشبكة) على أنها الطاقة اللازمة لتحويل جزيئة غرامية من المادة من حالتها الصلبة إلى حالتها الغازية , فهي تمثل طاقة التصعّد Sublimation Energy . تملك بلورات الأجسام الصلبة,عموماً , طاقات بلورية منخفضة جداً ؛ مما يدل على تجاذب جزيئي ضعيف نسبياً , كما في جزيء CO2 الصلب (غاز CO2 الجاف) حيث تبلغ طاقته البلورية 23.4 kJ/mol . في حين تملك بلورات الأجسام الصلبة الشاردية طاقات بلورية مرتفعة نسبياً , كما في جزيء NaCl حيث تبلغ طاقته البلورية (770 kJ/mol) .
البلورات السائلة Liquid Crystals
يوجد بعض المواد الني تظهر خصائص السوائل والأجسام الصلبة معاً , وذلك ضمن مجال محدد من درجات الحرارة أعلى بقليل من درجات انصهارها ؛ والتي تدعى بالبلورات السائلة . فالبلورات السائلة هي مواد مائعة , إلاّ أن جزيئاتها تكون مرتبة بأسلوب منتظم للغاية . وعند درجات حرارة أعلى من المذكورة أعلاه يتم فقدان هذا الانتظام , وتصبح مثل أيّ سائل . ويوجد ثلاثة أنواع من البلورات السائلة , تدعى : النيماتيكية – السيماكتيكية – الكوليستيريكية وتكمن أهمية هذه البلورات السائلة بطريقة تأثيرها في الضوء . فالبلورة الكوليستيريكية تمتاز بأن الضوء المنعكس عنها يتغير بتغير درجة الحرارة . وهذا ما يسمح باستخدامها بعملية التخطيط الضوئي للجسم ؛ كالذي يجري في الطب من أجل تحديد موقع أحد الأوردة عن طريق درجة حرارة الجلد الأدفء التي يسببها هذا الوريد . وتستعمل البلورات النيماتيكية في صناعة الشاشات البلورية السائلة للساعات الإلكترونية والتي تمتاز باستهلاكها الضئيل للطاقة .
المصادر
الكيمياء العامة للدكتور عدنان حبش في كلية الصيدلة جامعة دمشق