تجربة سريرية
التجارب السريرية Clinical trials، هي تجربة أو ملاحظة تتم في بحث سريري. تم تصميم دراسات بحثية طبية مستقبلية أو سلوكية حول مشارك بشري للإجابة على أسئلة محددة حول التدخلات الطبية الحيوية أو السلوكية ، بما في ذلك علاجات | جديدة (مثل لقاحات جديدة و أدوية و خيارات غذائية و مكملات غذائية و أجهزة طبية) وتدخلات معروفة تبرر مزيد من الدراسة والمقارنة. تولد التجارب السريرية بيانات عن الأمان و الفعالية.[1] يتم إجراؤها فقط بعد حصولها على موافقة هيئة الصحة / لجنة الأخلاقيات في البلد الذي تُطلب فيه الموافقة على العلاج. هذه السلطات مسؤولة عن فحص نسبة المخاطرة / الفائدة للتجربة - لا يعني موافقتها أن العلاج "آمن" أو فعال ، ولكن فقط يمكن إجراء التجربة.
اعتمادًا على نوع المنتج ومرحلة التطوير ، يسجل الباحثون في البداية متطوعين أو مرضى في دراسات تجريبية صغيرة ، ثم يجرون بعد ذلك دراسات مقارنة على نطاق أوسع. يمكن أن تختلف التجارب السريرية في الحجم والتكلفة ، ويمكن أن تشمل مركز بحث واحد أو مراكز متعددة ، في بلد واحد أو في بلدان متعددة. يهدف تصميم الدراسة السريرية إلى ضمان الصلاحية العلمية و استنساخ النتائج.
يمكن أن تتراوح تكاليف التجارب السريرية بين مليارات الدولارات لكل دواء معتمد.[2] قد يكون الكفيل منظمة حكومية أو شركة مستحضرات صيدلانية ، تكنولوجيا حيوية أو الأجهزة الطبية. بعض الوظائف الضرورية للتجربة ، مثل المراقبة والعمل المخبري ، يمكن إدارتها من قبل شريك الاستعانة بمصادر خارجية ، مثل منظمة أبحاث تعاقدية أو مختبر مركزي. 10٪ فقط من جميع الأدوية التي بدأت في التجارب الإكلينيكية على البشر أصبحت أدوية معتمدة.[3]
نظرة عامة
تجارب العقاقير
تتضمن بعض التجارب السريرية أشخاصًا أصحاء بدون حالات طبية موجودة مسبقًا. تتعلق التجارب السريرية الأخرى بالمرضى الذين يعانون من حالات صحية محددة يرغبون في تجربة علاج تجريبي.
عندما يكون المشاركون متطوعين أصحاء ويحصلون على حوافز مالية ، فإن الأهداف تختلف عما كانت عليه عند المرضى. خلال فترات الجرعات ، تظل المواد الدراسية عادةً تحت الإشراف لمدة ليلة إلى 40 ليلة.
عادة ، يتم إجراء الاختبار التجريبي للحصول على أفكار لتصميم التجربة السريرية التي يجب اتباعها.
هناك هدفين لاختبار العلاجات الطبية: لمعرفة ما إذا كانت تعمل بشكل جيد بما فيه الكفاية ، تسمى "الفعالية" أو "التأثير" ؛ ومعرفة ما إذا كانت آمنة بما فيه الكفاية ، تسمى "السلامة". ولا يوجد معيار مطلق ؛ يتم تقييم كل من السلامة والفعالية بالنسبة لكيفية استخدام العلاج ، وما هي العلاجات الأخرى المتاحة ، وشدة المرض أو الحالة. يجب أن تفوق الفوائد المخاطر.[4][5] على سبيل المثال ، العديد من الأدوية لعلاج السرطان لها آثار جانبية شديدة لن تكون مقبولة لأدوية الألم التي لا تستلزم وصفة طبية ، ومع ذلك فقد تمت الموافقة على أدوية السرطان منذ استخدامها تحت رعاية الطبيب ، وتستخدم مدى الحياة - كحالة.[6]
في الولايات المتحدة ، يشكل المسنون 14٪ من السكان ، بينما يستهلكون أكثر من ثلث الأدوية.[7] و غالبًا ما يُستبعد الأشخاص الذين تزيد أعمارهم عن 55 عامًا (أو سن حدي مماثل) من التجارب لأن مشكلاتهم الصحية الأكبر وتناولهم للأدوية يعقد تفسير البيانات ، ولأنهم يتمتعون بقدرة فزيولوجية مختلفة عن الأشخاص الأصغر سنًا. وكثيراً ما يتم استبعاد الأطفال والأشخاص الذين يعانون من حالات طبية غير مرتبطة.[8] و غالبًا ما يتم استبعاد النساء الحوامل بسبب المخاطر المحتملة على الجنين.
يقوم الراعي بتصميم التجربة بالتنسيق مع لجنة من الباحثين السريريين الخبراء ، بما في ذلك العلاجات البديلة أو القائمة للمقارنة بالدواء الجديد ونوع (أنواع) المرضى الذين قد يستفيدون. إذا لم يتمكن الراعي من الحصول على ما يكفي من موضوعات الاختبار في أحد المواقع ، يتم تعيين محققين في مواقع أخرى للانضمام إلى الدراسة.
أثناء التجربة ، يقوم الباحثون بتطويع الأشخاص ذوي الخصائص المحددة سلفًا ، وإدارة العلاج (العلاجات) وجمع البيانات عن صحة الأشخاص لفترة زمنية محددة. تشمل البيانات قياسات مثل العلامات الحيوية ، وتركيز دواء الدراسة في الدم أو الأنسجة ، والتغيرات في الأعراض ، وما إذا كان هناك تحسن أو تفاقم للحالة التي يستهدفها عقار الدراسة. يرسل الباحثون البيانات إلى راعي التجربة ، الذي يقوم بعد ذلك بتحليل البيانات المجمعة باستخدام الاختبارات الإحصائية.
تتضمن أمثلة أهداف التجارب السريرية تقييم السلامة والفعالية النسبية للدواء أو الجهاز:
- على نوع معين من المرضى ، على سبيل المثال ، مريض تم تشخيصه بـ مرض الزهايمر
- بجرعات مختلفة ، على سبيل المثال ، جرعة 10 ملليگرام بدلاً من جرعة 5 ملليگرام
- لمؤشر جديد
- تقييم الفعالية المحسنة في علاج حالة المريض مقارنة بالعلاج القياسي لهذه الحالة
- تقييم دواء أو جهاز الدراسة بالنسبة إلى اثنين أو أكثر من التدخلات الشائعة / المعتمدة بالفعل لهذه الحالة ، على سبيل المثال ، الجهاز أ مقابل الجهاز ب ، أو العلاج أ مقابل العلاج ب)
بينما تختبر معظم التجارب السريرية أحد البدائل للتدخل الجديد ، فإن بعضها يمتد إلى ثلاثة أو أربعة وقد يشمل العلاج البديل.
باستثناء التجارب الصغيرة ذات الموقع الواحد ، يتم تحديد التصميم والأهداف في وثيقة تسمى پروتوكول التجارب السريرية. البروتوكول هو "دليل التشغيل" للتجربة ويضمن أن جميع الباحثين يقومون بالتجربة بنفس الطريقة على موضوعات مشابهة وأن البيانات قابلة للمقارنة عبر جميع الموضوعات.
نظرًا لأن التجربة مصممة لاختبار الفرضيات ومراقبة النتائج وتقييمها بدقة ، يمكن اعتبارها تطبيقًا لـ الطريقة العلمية ، وتحديدًا الخطوة التجريبية.
تُقيِّم التجارب السريرية الأكثر شيوعًا منتجات صيدلانية جديدة ، أو أجهزة طبية (مثل قثطرة جديدة) ، منتج طبي بيولوجي ، العلاجات النفسية ، أو تدخلات أخرى . قد تكون التجارب السريرية مطلوبة قبل السلطة التنظيمية الوطنية[9] على تسويق الابتكار.
تجارب الأجهزة
تجارب العمليات
مثل الأدوية ، الإجراء الطبي أو الإجراءات الجراحية قد يخضعون للتجارب السريرية ،[10] مثل دراسات حالة-مُخططة للتدخلات الجراحية.[11]
التاريخ
التطور

التجارب الحديثة

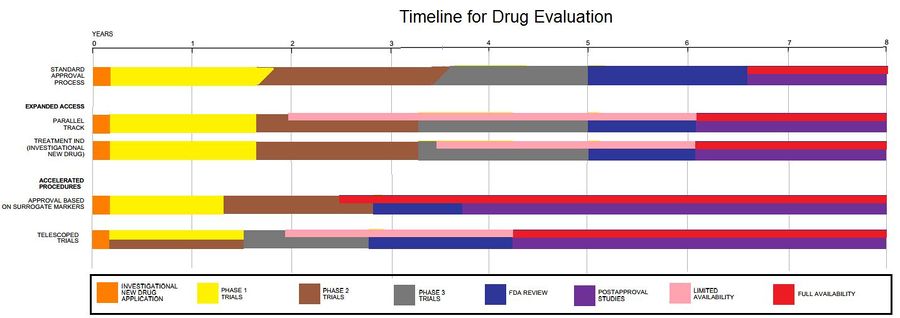
أنواع التجارب السريرية
مراحل التجارب السريرية
المرحلة الهدف ملاحظات المرحلة 0 الديناميكا الدوائية و حركية الدواء في البشر تجارب المرحلة 0 هي تجارب اختيارية لأول مرة في الإنسان. يتم إعطاء جرعات مفردة تحت العلاج من دواء الدراسة أو العلاج لعدد صغير من الأشخاص (عادة من 10 إلى 15) لجمع بيانات أولية عن الديناميكا الدوائية للعامل (ما يفعله الدواء بالجسم) والحركية الدوائية (ماذا يفعل الجسم بالأدوية ).[12] بالنسبة لعقار اختبار ، توثق التجربة امتصاص الدواء وتوزيعه واستقلابه وإزالته (إفرازه) وتفاعلات الدواء داخل الجسم ، للتأكد من أنها تبدو كما هو متوقع. المرحلة الأولى الفحص من أجل السلامة غالبًا ما تكون المحاكمات من منظور الشخص الأول. الاختبار ضمن مجموعة صغيرة من الأشخاص (عادةً 20-80) لتقييم السلامة وتحديد نطاقات الجرعات الآمنة وتحديد الآثار الجانبية.[13] المرحلة الثانية تحديد الفعالية الأولية للدواء ، عادة مقابل علاج بديل اختبار مع مجموعة أكبر من الناس (عادةً 100-300) لتحديد فعاليتها وتقييم سلامتها.[13] المرحلة الثالثة التأكيد النهائي للسلامة والفعالية اختبار مع مجموعات كبيرة من الناس (عادة 1000-3000) لتأكيد الفعالية ، وتقييم فاعليتها ، ومراقبة الآثار الجانبية ، ومقارنتها بالعلاجات شائعة الاستخدام ، وجمع المعلومات التي تسمح باستخدامها بأمان.[13] المرحلة الرابعة دراسات السلامة أثناء المبيعات تحدد دراسات ما بعد التسويق المخاطر والفوائد والاستخدام الأمثل. على هذا النحو ، فهي مستمرة خلال عمر الدواء للاستخدام الطبي النشط.[13]
تصميم التجربة
- عشوائي: يتم تعيين كل موضوع دراسة بشكل عشوائي لتلقي إما علاج الدراسة أو علاج بديل.
- أعمى: لا يعرف المشاركون في الدراسة العلاج الدراسي الذي يتلقونه. إذا كانت الدراسة مزدوجة التعمية ، فلا يعرف الباحثون أيضًا العلاج الذي يتلقاه الشخص. هذا الهدف هو منع الباحثين من معاملة المجموعتين بشكل مختلف. شكل من أشكال الدراسة مزدوجة التعمية يسمى تصميم "النموذج المزدوج" يسمح بتأمين إضافي ضد التحيز. في هذا النوع من الدراسة ، يتم إعطاء جميع المرضى جرعات علاج بديل ونشط في فترات متناوبة.
- العلاج البديل به: يسمح استخدام الدواء البديل (العلاج المزيف) للباحثين بعزل تأثير علاج الدراسة عن تأثير الدواء البديل.
قد يتم "رعاية" الدراسات السريرية التي تحتوي على أعداد صغيرة من الموضوعات من قبل باحثين فرديين أو مجموعة صغيرة من الباحثين ، وهي مصممة لاختبار أسئلة بسيطة أو جدوى لتوسيع البحث من أجل تجربة عشوائية أكثر شمولاً ذات شواهد.[14]
الدراسات المراقبة النشطة
الپروتوكول الرئيسي
پروتوكول التجارب السريرية
پروتوكول التجارب السريرية هو مستند يستخدم لتحديد وإدارة التجربة. يتم إعداده من قبل لجنة من الخبراء. يُتوقع من جميع الباحثين في الدراسة مراقبة الپروتوكول بدقة.
يصف الپروتوكول الأساس المنطقي والهدف (الأهداف) والتصميم والمنهجية والاعتبارات الإحصائية وتنظيم التجربة المخطط لها. يتم تقديم تفاصيل الاختبار في الوثائق المشار إليها في الپروتوكول ، مثل كتيب المحقق.
يحتوي الپروتوكول على خطة دراسة دقيقة لضمان سلامة وصحة الأشخاص الخاضعين للتجربة وتوفير نموذج دقيق لإجراء التجارب من قبل المحققين. وهذا يسمح بجمع البيانات عبر جميع الباحثين / المواقع. يقوم البروتوكول أيضًا بإبلاغ مديري الدراسة (غالبًا منظمة بحثية تعاقدية).
سمات التصميم
الموافقة المسبقة

القوة الإحصائية
تجارب الأدوية الوهمية
الزمن
الادارة
الجودة
التسويق
تكنولوجيا المعلومات
الجوانب الأخلاقية
تضارب المصالح والدراسات الغير مواتية
السلامة
الرعاة
محققو المواقع المحلية
مجالس المراجعة المؤسسية
الوكالات التنظيمية
تجميع بيانات السلامة أثناء التطور السريري
الاقتصاد
المشاركة في التجارب السريرية
تحديد مكان التجارب
الأبحاث
انظر أيضاً
المصادر
- ^ "Clinical Trials" (PDF). Bill and Melinda Gates Foundation. Retrieved 1 January 2014.
- ^ Dimasi, Joseph A; Grabowski, Henry G; Hansen, Ronald W (2016). "Innovation in the pharmaceutical industry: New estimates of R&D costs". Journal of Health Economics. 47: 20–33. doi:10.1016/j.jhealeco.2016.01.012. hdl:10161/12742. PMID 26928437.
- ^ Emanuel, Ezekiel J. "The Solution to Drug Prices". The New York Times.
Of the drugs started in clinical trials on humans, only 10 percent secure F.D.A. approval. ...
{{cite news}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ FDA Page last updated 25 April 2014 FDA's Drug Review Process: Continued
- ^ PhRMA. February 2007 Drug Discovery and Development
- ^ Merck Manual. Last full review/revision October 2013 by Daniel A. Hussar, PhD Overview of Over-the-Counter Drugs
- ^ Avorn J. (2004). Powerful Medicines, pp. 129–33. Alfred A. Knopf.
- ^ Van Spall HG, Toren A, Kiss A, Fowler RA (March 2007). "Eligibility criteria of randomized controlled trials published in high-impact general medical journals: a systematic sampling review". JAMA. 297 (11): 1233–40. doi:10.1001/jama.297.11.1233. PMID 17374817.
- ^ توافق السلطة التنظيمية في الولايات المتحدة و التي هي [[إدارة الغذاء والدواء (الولايات المتحدة] | إدارة الغذاء والدواء]] ؛ في كندا ، Health Canada ؛ في الاتحاد الأوروبي ، وكالة الأدوية الأوروبية ؛ وفي اليابان ، وزارة الصحة والعمل والرعاية الاجتماعية
- ^ Farrokhyar F, Karanicolas PJ, Thoma A, Simunovic M, Bhandari M, Devereaux PJ, Anvari M, Adili A, Guyatt G (March 2010). "Randomized controlled trials of surgical interventions". Annals of Surgery. 251 (3): 409–16. doi:10.1097/SLA.0b013e3181cf863d. PMID 20142732.
- ^ Cao AM, Cox MR, Eslick GD (March 2016). "Study design in evidence-based surgery: What is the role of case-control studies?". World Journal of Methodology. 6 (1): 101–4. doi:10.5662/wjm.v6.i1.101. PMC 4804244. PMID 27019801.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ The Lancet (July 2009). "Phase 0 trials: a platform for drug development?". Lancet. 374 (9685): 176. doi:10.1016/S0140-6736(09)61309-X. PMID 19616703.
- ^ أ ب ت ث خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةfda-types - ^ Eldridge SM, Lancaster GA, Campbell MJ, Thabane L, Hopewell S, Coleman CL, Bond CM (2016). "Defining Feasibility and Pilot Studies in Preparation for Randomised Controlled Trials: Development of a Conceptual Framework". PLOS ONE. 11 (3): e0150205. doi:10.1371/journal.pone.0150205. PMC 4792418. PMID 26978655.
{{cite journal}}: CS1 maint: unflagged free DOI (link)
قراءات إضافية
- Chow SC, Liu JP (2004). Design and Analysis of Clinical Trials: Concepts and Methodologies. ISBN 978-0-471-24985-6.
- Finn R (1999). Cancer Clinical Trials: Experimental Treatments and How They Can Help You. Sebastopol: O'Reilly & Associates. ISBN 978-1-56592-566-3.
- Henninger, Daniel (2002). "Drug Lag". In Henderson, David R. (ed.). Concise Encyclopedia of Economics (1st ed.). Library of Economics and Liberty.
{{cite encyclopedia}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) OCLC 317650570, 50016270 and 163149563 - Pocock, SJ (2004). Clinical Trials: A Practical Approach. John Wiley & Sons. ISBN 978-0-471-90155-6.
- Rang HP, Dale MM, Ritter JM, Moore PK (2003). Pharmacology (5 ed.). Edinburgh: Churchill Livingstone. ISBN 978-0-443-07145-4.