قانون الديناميكا الحرارية الثاني
| الديناميكا الحرارية |
|---|
 |
قانون الديناميكا الحرارية الثاني Second law of thermodynamics، هو ينص على أنه إنتروپيا أي نظام معزول لا يمكن أن تتناقص، لأن الأنظمة المعزولة تميل إلى التوازن الديناميكي الحراري - حالة تعتمد على الإنتروپيا القصوى.
مقدمة
حظى القانون الثاني للديناميكا الحرارية بإهتمام علماء كثيرين، بحيث توجد لهذا القانون عدة صيغ، ترجع كل صيغة منها إلى أحد العلماء البارزين. ولا نجد في مجال العلوم حالة مماثلة.
ونذكر هنا الثلاثة صيغ للقانون الثاني للحرارة، كل صيغة ترى الواقع من زاوية معينة، ولكنها تتحد جميعا في المعنى.
الصيغة الأولى وهي تتضمن انتقال الحرارة:
لا يمكن أن تنتقل كمية من الحرارة من جسم بارد إلى جسم ساخن، إلا ببذل شغل من الخارج.
الصيغة الثانية وهي تتضمن إنتروبيا النظام:
تتزايد إنتروپيا أي نظام معزول مع الوقت ، وتميل الانتروبيا لكي تصل إلى نهاية عظمى سواء في النظام المعزول أو في الكون.
الصيغة الثالثة وهي تتضمن تحول الطاقة الحرارية إلى شغل:
من المستحيل تحويل الطاقة الحرارية بأكملها إلى شغل بوساطة عملية دورية.
- (الإنتروپيا بصفة عامة هي مقياس "لهرجلة" النظام (عدم انتظامه) .)
الأنظمة الميكرونية
نظريات الحرارة وبالتالي القانون الثاني للحرارة تتعلق بالأنظمة الكبيرة المكونة من عدد كبير من الذرات أو الجزيئات والمتميزة بدرجة حرارة معينة. فعلى سبيل المثال في نظام يحتوي على جزيئين فقط توجد احتمال لكي يعطي الجزيء البطيء (البارد) طاقة إلى جزيئ سريع (ساخن). فمثل هذا النظام يخرج من إطار دراسة الديناميكا الحرارية ويمكن دراستها في إطار الديناميكا الحرارية الكمومية وباستخدام الديناميكا الإحصائية. في أي نظام معزول ويحتوي على عدة بيكوجرام من المادة يصبح احتمال مشاهدة انخفاض في الإنتروبية تكاد تكون معدومة. هذا ما صرح به الفيزيائي الروسي ليڤ لانداو.
انتشار الطاقة
يتعامل القانون الثاني للحرارة مع الحرارة والضغط والإنتروبيا والاتجاه الذي يسير فيه عملية من العمليات الحرارية. وعلى سبيل المثال : فالقانون الثاني ينص على عدم إمكانية انتقال الحرارة من جسم بارد إلى جسم ساخن ، بل العكس هو الصحيح أن الحرارة تنتقل من الجسم الساخن إلى الجسم البارد. كما يقول أيضا أن الطاقة المركزة الموجودة في نظام معزول تنتشر وتتوزع فيه بالتساوي مع مرور الزمن . أي أن انتشار الطاقة في نظام يعني ان الاختلافات في تركيز الطاقة تميل أن تختفي بمرور الوقت ، فتتساوى درجة الحرارة، ويتساوى الضغط ، وتتساوي الكثافة. كما يمكن القول بأن الانتروبيا - وهي إحدى تلك الخصائص - يمكن أخذها مقياس لانتشار الطاقة أو الحرارة. وعلى ذلك فالقانون الثاني للحرارة يتعلق بالإنتروبيا.
نصوص مختلفة للقانون
مبدأ كارنو
مبدأ كلوسيوس
مبدأ كلڤين
تكافؤ مبدأ كلوسيوس وكلڤين
اقتراح پلانك
العلاقة بين نص كلڤين واقتراح پلانك
نص پلانك
مبدأ كاراثيودوري
مبدأ پلانك
وصف نظام له تعبير معروف لطاقته الداخلية كدالة في المتغيرات الكثيرة لحالته
أنظمة الجاذبية
النتائج المباشرة
الحركة الدائمة من النوع الثاني
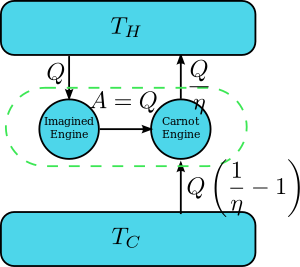
نظرية كارنو
تباين كلوسيوس
درجة الحرارة المطلقة
الإنتروپيا
الطاقة، العمل المفيد المتاح
التاريخ

الصيغة الغير رسمية
الصيغة الرياضية
صاغ العالم الألماني رودولف كلاوسيوس عام 1856 ما أسماه القانون الثاني للديناميكا الحرارية في الشكل التالي:
حيث :
Q كمية الحرارة ، وتقاس بالجول ،
T درجة الحرارة ، وتقاس ب كلفن.
N "كمية مكافئة " لجميع التحويلات المجهولة في عملية دورية. ثم قام عام 1865 بتعريف "الكمية المكافئة " إنتروبيا. وعلى أساس هذا التعريف قدم كلاوسيوس في نفس العام بتقديم الصيغة الشهيرة خلال محاضرة في الجمعية الفلسفية بزيوريخ المنعقدة في 42 أبريل حيث قال في ختام محاضرته :
" يميل الانتروبية في الكون إلى نهاية عظمى."
ويعتبر هذا النص أشهر نص للقانون الثاني. ونظرا للتعريف الواسع الذي يتضمنه هذا القانون، حيث يشمل الكون كله من دون أي تحديد لحالته، سواء كان كونا مفتوحا أو مغلقا أو معزولا لكي تنطبق عليه صيغة القانون، يتصور كثير من الناس أن الصيغة الجديدة تعني أن القانون الثاني للحرارة ينطبق على كل شيء يمكن تصوره.ولكن هذا ليس صحيحا فالصيغة الجديدة ماهي إلا تبسيط لحقيقة أعقد من ذلك.
وبمرور السنين اتخذت الصيغة الرياضية للقانون الثاني للديناميكا الحرارية في حالة نظام معزول تجري فيه تحولات معينة الشكل التالي :
حيث :
- S الانتروبي (entropy)،
- t الزمن.
الاشتقاق من الميكانيكا الإحصائية
حالات غير مكافئة
مصفوفة الزمن
جدل
عفريت ماكسويل
متناقضة لوشيمت
نظرية تكرار پوانكاريه
اقتباسات
انظر أيضاً
المصادر
المراجع
- Adkins, C.J. (1968/1983). Equilibrium Thermodynamics, (1st edition 1968), third edition 1983, Cambridge University Press, Cambridge UK, ISBN 0-521-25445-0.
- Bailyn, M. (1994). A Survey of Thermodynamics, American Institute of Physics, New York, ISBN 0-88318-797-3.
- Buchdahl, H.A. (1966). The Concepts of Classical Thermodynamics, Cambridge University Press, Cambridge UK.
- Callen, H.B. (1960/1985). Thermodynamics and an Introduction to Thermostatistics, (1st edition 1960) 2nd edition 1985, Wiley, New York, ISBN 0-471-86256-8.
- Čápek, V., Sheehan, D.P. (2005). Challenges to the Second Law of Thermodynamics: Theory and Experiment, Springer, Dordrecht, ISBN 1-4020-3015-0.
- C. Carathéodory (1909). "Untersuchungen über die Grundlagen der Thermodynamik". Mathematische Annalen. 67: 355–386.
Axiom II: In jeder beliebigen Umgebung eines willkürlich vorgeschriebenen Anfangszustandes gibt es Zustände, die durch adiabatische Zustandsänderungen nicht beliebig approximiert werden können. (p.363)
. A translation may be found here. Also a mostly reliable translation is to be found at Kestin, J. (1976). The Second Law of Thermodynamics, Dowden, Hutchinson & Ross, Stroudsburg PA. - Carnot, S. (1824/1986). Reflections on the motive power of fire, Manchester University Press, Manchester UK, ISBN 0719017416. Also here.
- Clausius, R. (1850). "Ueber Die Bewegende Kraft Der Wärme Und Die Gesetze, Welche Sich Daraus Für Die Wärmelehre Selbst Ableiten Lassen". Annalen der Physik. 79: 368–397, 500–524. Retrieved 26 June 2012.
{{cite journal}}: Invalid|ref=harv(help) Translated into English: Clausius, R. (July 1851). "On the Moving Force of Heat, and the Laws regarding the Nature of Heat itself which are deducible therefrom". London, Edinburgh and Dublin Philosophical Magazine and Journal of Science. 4th. 2 (VIII): 1–21, 102–119. Retrieved 26 June 2012. - Clausius, R. (1854). "Über eine veränderte Form des zweiten Hauptsatzes der mechanischen Wärmetheorie" (PDF). Annalen der Physik. Poggendoff. xciii: 481. Retrieved 24 March 2014.
{{cite journal}}: Invalid|ref=harv(help) Translated into English: Clausius, R. (July 1856). "On a Modified Form of the Second Fundamental Theorem in the Mechanical Theory of Heat". London, Edinburgh and Dublin Philosophical Magazine and Journal of Science. 4th. 2: 86. Retrieved 24 March 2014. Reprinted in: Clausius, R. (1867). The Mechanical Theory of Heat – with its Applications to the Steam Engine and to Physical Properties of Bodies. London: John van Voorst. Retrieved 19 June 2012. - Eu, B.C. (2002). Generalized Thermodynamics. The Thermodynamics of Irreversible Processes and Generalized Hydrodynamics, Kluwer Academic Publishers, Dordrecht, ISBN 1–4020–0788–4.
- Grandy, W.T., Jr (2008). Entropy and the Time Evolution of Macroscopic Systems. Oxford University Press. ISBN 978-0-19-954617-6.
- Greven, A., Keller, G., Warnecke (editors) (2003). Entropy, Princeton University Press, Princeton NJ, ISBN 0-691-11338-6.
- Kondepudi, D., Prigogine, I. (1998). Modern Thermodynamics: From Heat Engines to Dissipative Structures, John Wiley & Sons, Chichester, ISBN 0–471–97393–9.
- Lebon, G., Jou, D., Casas-Vázquez, J. (2008). Understanding Non-equilibrium Thermodynamics: Foundations, Applications, Frontiers, Springer-Verlag, Berlin, e-ISBN 978-3-540-74252-4.
- Lieb, E. H.; Yngvason, J. (1999). "The Physics and Mathematics of the Second Law of Thermodynamics" (PDF). Physics Reports. 310: 1–96. arXiv:cond-mat/9708200. Bibcode:1999PhR...310....1L. doi:10.1016/S0370-1573(98)00082-9. Retrieved 24 March 2014.
{{cite journal}}: Invalid|ref=harv(help) - Lieb, E.H., Yngvason, J. (2003). The Entropy of Classical Thermodynamics, Chapter 8 of Entropy, Greven, A., Keller, G., Warnecke (editors) (2003).
- Münster, A. (1970), Classical Thermodynamics, translated by E.S. Halberstadt, Wiley–Interscience, London, ISBN 0-471-62430-6.
- Pippard, A.B. (1957/1966). Elements of Classical Thermodynamics for Advanced Students of Physics, original publication 1957, reprint 1966, Cambridge University Press, Cambridge UK.
- Planck, M. (1897/1903). Treatise on Thermodynamics, translated by A. Ogg, Longmans Green, London, p. 100.
- Planck, M. (1926). Über die Begründing des zweiten Hauptsatzes der Thermodynamik, S.B. Preuß. Akad. Wiss. phys. math. Kl.: 453–463.
- Quinn, T.J. (1983). Temperature, Academic Press, London, ISBN 0-12-569680-9.
- Roberts, J.K., Miller, A.R. (1928/1960). Heat and Thermodynamics, (first edition 1928), fifth edition, Blackie & Son Limited, Glasgow.
- ter Haar, D., Wergeland, H. (1966). Elements of Thermodynamics, Addison-Wesley Publishing, Reading MA.
- Thomson, W. (1851). "On the Dynamical Theory of Heat, with numerical results deduced from Mr Joule's equivalent of a Thermal Unit, and M. Regnault's Observations on Steam". Transactions of the Royal Society of Edinburgh. XX (part II): 261–268, 289–298.
{{cite journal}}: Invalid|ref=harv(help) Also published in Thomson, W. (December 1852). "On the Dynamical Theory of Heat, with numerical results deduced from Mr Joule's equivalent of a Thermal Unit, and M. Regnault's Observations on Steam". Philos. Mag. 4. IV (22): 13. Retrieved 25 June 2012. - Truesdell, C. (1980). The Tragicomical History of Thermodynamics 1822-1854, Springer, New York, ISBN 0–387–90403–4.
- Uffink, J. (2003). Irreversibility and the Second Law of Thermodynamics, Chapter 7 of Entropy, Greven, A., Keller, G., Warnecke (editors) (2003).
- Zemansky, M.W. (1968). Heat and Thermodynamics. An Intermediate Textbook, fifth edition, McGraw-Hill Book Company, New York.
قراءات إضافية
- Goldstein, Martin, and Inge F., 1993. The Refrigerator and the Universe. Harvard Univ. Press. Chpts. 4–9 contain an introduction to the Second Law, one a bit less technical than this entry. ISBN 978-0-674-75324-2
- Leff, Harvey S., and Rex, Andrew F. (eds.) 2003. Maxwell's Demon 2 : Entropy, classical and quantum information, computing. Bristol UK; Philadelphia PA: Institute of Physics. ISBN 978-0-585-49237-7
- Halliwell, J.J. (1994). Physical Origins of Time Asymmetry. Cambridge. ISBN 0-521-56837-4.(technical).
- Carnot, Sadi (1890). Reflections on the Motive Power of Heat and on Machines Fitted to Develop That Power. New York: J. Wiley & Sons.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) (full text of 1897 ed.)) (html) - Stephen Jay Kline (1999). The Low-Down on Entropy and Interpretive Thermodynamics, La Cañada, CA: DCW Industries. ISBN 1928729010.
- Kostic, M., Revisiting The Second Law of Energy Degradation and Entropy Generation: From Sadi Carnot's Ingenious Reasoning to Holistic Generalization AIP Conf. Proc. 1411, pp. 327–350; doi: http://dx.doi.org/10.1063/1.3665247. American Institute of Physics, 2011. ISBN 978-0-7354-0985-9. Abstract at: [1]. Full article (24 pages [2]), also at [3].
وصلات خارجية
- Stanford Encyclopedia of Philosophy: "Philosophy of Statistical Mechanics" – by Lawrence Sklar.
- Second law of thermodynamics in the MIT Course Unified Thermodynamics and Propulsion from Prof. Z. S. Spakovszky
- E.T. Jaynes, 1988, "The evolution of Carnot's principle," in G. J. Erickson and C. R. Smith (eds.)Maximum-Entropy and Bayesian Methods in Science and Engineering, Vol 1, p. 267.
- Caratheodory, C., "Examination of the foundations of thermodynamics," trans. by D. H. Delphenich