لديپاسڤير/سوفوسبوڤير
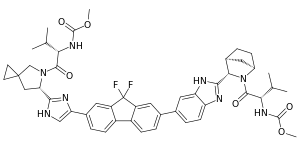 اللديپاسڤير. | |
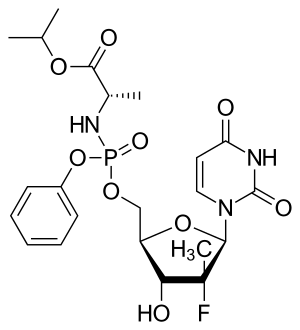 تركيب السوفوسبوڤير. | |
| Combination of | |
|---|---|
| لديپاسڤير | مثبط NS5A |
| سوفوسبوڤير | مثبط NS5B (RNA polymerase) |
| البيانات السريرية | |
| الأسماء التجارية | هارڤوني، هپسينتات-إل پي، وغيرها |
| AHFS/Drugs.com | Monograph |
| License data | |
| مسارات الدواء | عن طريق الفم |
| رمز ATC | |
| الحالة القانونية | |
| الحالة القانونية |
|
| المعرفات | |
| PubChem CID | |
| KEGG | |
| Chemical and physical data | |
| التركيب | C71H83F3N11O15P |
| الكتلة المولية | 1418.476 گ/مول |
| Melting point | 170–225 °C (338–437 °F) |
لديپاسڤير/سوفوسبوڤير Ledipasvir/sofosbuvir، يُباع تحت الاسم التجاري هارڤوني Harvoni، هو دواء يستخدم لعلاج التهاب الكبد الڤيروسي سي.[1] وهو مزيج من لديپاسڤير و سوفوسبوڤير.[1] تتراوح معدلات الشفاء من 94 ٪ إلى 99 ٪ في الأشخاص المصابين بالنمط الجيني 1 لفيروس التهاب الكبد الڤيروسي سي (HCV).[2] تدعم بعض الأدلة أيضًا الاستخدام في النمط الجيني HCV) 3) و 4.[2] . يؤخذ يوميًا عن طريق الفم لمدة 8-24 أسبوعًا.[1]
انه جيد التحمل بشكل عام.[3] تشمل الآثار الجانبية الشائعة آلام العضلات والصداع والغثيان والطفح الجلدي والسعال .[1] ليس من الواضح ما إذا كان الاستخدام أثناء الحمل آمنًا للطفل.[1] يعمل لديپاسڤير عن طريق تقليل نشاط NS5A ويعمل سوفوسبوڤير عن طريق تقليل نشاط NS5B polymerase.[1]
تمت الموافقة على لديپاسڤير/سوفوسبوڤير للاستخدام الطبي في الولايات المتحدة في عام 2014.[1] وهي مدرجة في قائمة منظمة الصحة العالمية للأدوية الأساسية ، وهي الأدوية الأكثر فعالية وأمانًا اللازمة في النظام الصحي.[4] تبلغ تكلفة الجملة في الولايات المتحدة حوالي 91،589.40 دولارًا أمريكيًا لمدة 12 أسبوعًا اعتبارًا من عام2016.[5] في بنگلادش ، يبلغ هذا المبلغ 1،092.00 دولارًا أمريكيًا.[6] يسافر بعض الأشخاص إلى الهند للحصول على أدوية منخفضة التكلفة.[7]
الاستخدامات الطبية
تتراوح معدلات الشفاء من 94 ٪ إلى 99 ٪ في الأشخاص المصابين بالنمط الجيني 1 (46 ٪ من حالات التهاب الكبد الڤيروسي سي).[8] كما تم تقييمها لعلاج العدوى بالأنماط الجينية الأخرى من التهاب الكبد الڤيروسي سي ، وأظهرت نتائج واعدة في الأنماط الجينية 3 و 4 (تشكل 30 ٪ وأقل من 22 ٪ من حالات التهاب الكبد الڤيروسي سي على التوالي).[2][9][10][8]
المقاومة
طفرات NS5A
الطفرات المتعددة من الريبيليكون لالتهاب الكبد الڤيروسي سي ضرورية لإحداث تأثير كبير في المقاومة بسبب آليات متعددة للعمل.[11] . بشكل عام ، يكون النمط الجيني التهاب الكبد الڤيروسي سي 1أ أقل مقاومة للطفرة من النمط الجيني 1 ب.[12]
بالنسبة إلى النمط الجيمي 1 ب ، كان استبدال الأحماض الأمينية الفردية (على سبيل المثال L31V) في الريبليكون أقل من 100 مرة زيادة في المقاومة ل لديپاسڤير في هارڤوني ، في حين أن استبدال الأحماض الأمينية يزيد على 1000 ضعف في المقاومة.[12][13]كان للنمط الجيني 1 أ زيادة مماثلة ولكن أكثر جوهرية في المقاومة مع كل زيادة في استبدال الأحماض الأمينية مع بدائل المقاومة المرتبطة في K24R, M28T/V, Q30R/H/K/L, L31M, and or Y93H/N.[14]
يكون لتعدد الأشكال NS5A أيضًا تأثير على المقاومة الفيروسية مع بدائل الأحماض الأمينية المرتبطة بالمقاومة الأكثر شيوعًا والمكتشفة في Q30R و Y93H أو N و L31M في المرضى الذين يعانون من استجابة فيروسية سريعة(RVR).[14] كانت الأشكال الأساسية المرتبطة بمقاومة NS5A المحددة في التجارب السريرية هي M28T / V و Q30H و Q30R و L31M و H58P و Y93H و Y93N في النمط الجيني 1 أ و L28M و A92T و Y93H في النمط الجيني 1ب.[14] يميل المرضى الذين يعانون من تعدد الأشكال NS5A الأساسي إلى ارتفاع معدلات الانتكاس عند استخدام لديپاسڤير/سوفوسبوڤير.[14] Tيتراوح الفرق بين معدلات الانتكاس بين مجموعات العلاج الساذجة والعلاجية ذات الأشكال الأساسية NS5A من 1٪ بعد نظام 12 أسبوعًا و 0٪ بعد نظام 24 أسبوعًا على التوالي .[12][14]
طفرات NS5B
يساهم استبدال الأحماض الأمينية المفردة S282T في المقاومة الفيروسية ويقلل من نشاط سوفوسبوڤير في لديپاسڤير/سوفوسبوڤير بحوالي 2 إلى 18مرة.[12][15]
المقاومة المتصالبة
لم تُلاحظ أي مقاومة متقاطعة في اتحاد لديپاسڤير و سوفوسبوڤير في المرحلة ION 1،2 ، و 3 تجارب سريرية مثل لديپاسڤير كانت نشطة بالكامل ضد البدائل المرتبطة بمقاومة سوفوسبوڤير والعكس بالعكس.[14][16]
الآثار الجانبية
أكثر من 10 ٪ من الأشخاص الذين يتناولون لديپاسڤير/سوفوسبوڤير يعانون من الصداع أو التعب ؛ تحدث الطفح الجلدي والغثيان والإسهال والأرق في ما بين 1 ٪ و 10 ٪ من الأشخاص الذين يتناولونه.[9][17]
ترتبط ردود الفعل الأكثر حدة بالتفاعلات التحسسية للأدوية ومشاكل القلب والأوعية الدموية.[بحاجة للاستشهاد الطبي] تعتبر الآثار الجانبية لهارفوني خفيفة نسبيًا مقارنة بالمعالجة القديمة القائمة على الانترفيرون .
التفاعلات الدوائية
لديپاسڤير/سوفوسبوڤير هو الركيزة لنواقل الأدوية بروتين سكري-p وبروتين مقاومة سرطان الثدي.[12] قد ينخفض الامتصاص المعوي لهذه الركائز الناقلة للادوية عن طريق محرضين مثل ريفامپيسين ونبتة سانت جون .[18]
يُنصح المرضى أيضًا بالابتعاد عن ضادات مستقبلات الهيدروجين (H2RA) ومثبطات مضخة البروتون (PPI) لأنهم يقللون من تركيز اللديپاسڤير (قابلية ذوبانه تعتمد على الأس الهيدروجيني ووهي تزداد في الحالة الحمضية). لذلك ، يُنصح بتناول مثبطات مضخة البروتون (PPI) بعد ساعتين على الأقل من لديپاسڤير/سوفوسبوڤير بجرعة تقل عن أو تساوي 20 ملغ يوميًا و H2RAs بجرعة تقل عن أو تساوي 40 ملغ مرتين يوميًا.[12][19]
بالإضافة إلى ذلك يجب تجنب لديپاسڤير/سوفوسبوڤير عند تناول الأميودارون أو الأدوية الأخرى التي تخفض معدل ضربات القلب ؛ هناك خطر كبير من تباطؤ القلب أو توقفه عند استخدام لديپاسڤير/سوفوسبوڤير مع هذه الأدوية.[9][17]
آليات العمل
الآلية الأكثر شيوعًا المرتبطة بـ لديپاسڤير/سوفوسبوڤير هي فرط الفسفرة في NS5A ، وهو بوليميريز فيروسي مهم في التجمع الفيروسي المناسب ويتداخل مع استقلاب الكبد المناسب.[20] يثبط لديپاسڤير/سوفوسبوڤيرالتجمع الفيروسي المناسب من خلال إعادة تحديد موقع NS5A في توطين الخلية الخلوية.[12]
NS5B ، وهو بوليميريز فيروسي يمكن أن يبدأ في تخليق الحمض النووي الريبي (DNA) ، كما تم تثبيطه بشكل متغير بواسطة لديپاسڤير/سوفوسبوڤير..[21]
مثبطات NS5A و NS5B مجتمعة يكون لها تأثير تآزري..[22]
الحركة الدوائية
Sيتم امتصاص سوفوسبوڤير بسرعة في البلازما مع تركيز الذروة (Cmax) عند 0.8 إلى 1 ساعة بعد الجرعة المعطاة ويخضع لعملية الاستقلاب الكبدي اضافية مع 61 إلى 65 ٪ مرتبط ببروتينات البلازما البشرية.[23][12] ثم يتم تحويله في الغالب إلى المستقلب الخالي من الفوسفات الغير نشط GS-331007 (الذي تم إزالته بنسبة 76٪ من خلال الترشيح السلبي الكلوي) والذي يبلغ متوسط تركيز البلازما الذروة عند 3.5 إلى 4 ساعات بعد تناول الدواء.[24][14] لا يبدو أن سوفوسبوڤير يتأثر بمستويات مختلفة من المغذيات الكبيرة بالمقارنة مع حالات الصيام.[25]
يكون ليديباسفير أقصى تركيز عند 4 إلى 4.5 ساعات بعد الابتلاع ولا يتأثر بالمغذيات الكبيرة.[12][14] هو أكثر من 98 ٪ مرتبط بالبروتين ويتم التخلص منه في الغالب عن طريق البراز ، مع الحد الأدنى من الاستقلاب في الكبد.[14]
عملية الإزالة
متوسط عمر النصف النهائي بعد جرعة من لديپاسڤير/سوفوسبوڤير لمدة 90 ملغ من (C14)-لديپاسڤير هو 47 ساعة ؛ لمدة 400 ملغ من [14C] - سوفوسبوفير هو 0.5 ساعة (بعد التوزيع الأولي للأدوية في أنسجة الجسم) و 27 ساعة (إفراز الدواء في النهاية).[14][26]
| المادة | نانو جرام/مليلتر |
|---|---|
| لديپاسڤير | 323 |
| سوفوسبوڤير | 618 |
| GS-331007 | 707 |
ملاحظة: الحد الأقصى للتركيز أعلى بنسبة 32 ٪ في الأفراد الأصحاء من المصابين بالتهاب الكبد الفيروسي سي.[14]
| المادة | نانو جرام*ساعة/مليلتر |
|---|---|
| لديپاسڤير | 7290 |
| سوفوسبوڤير | 1320 |
| GS-33107 | 12,000 |
ملاحظة: الحد الأقصى للتركيز أعلى بنسبة 24 ٪ في الأفراد الأصحاء من المصابين بالتهاب الكبد الفيروسي سي.[14]
الكشف عنه في الدم
تم تطوير طريقة تحليلية تعتمد على الاستشراب السائل المتزامنين ل لديپاسڤير/سوفوسبوڤير في البلازما البشرية باستخدام داكلاتاسفير المضاد للفيروسات كمعيار داخلي. وكان متوسط الاسترداد لاستخراج سوفوسبوڤير و لديپاسڤير 91.61 ٪ و 88.93 ٪ على التوالي .[27]
المجتمع والثقافة
المنتج الوحيد للدواء هي شركة گلعاد للعلوم.[1]
المصادر
- ^ أ ب ت ث ج ح خ د "Ledipasvir and Sofosbuvir". The American Society of Health-System Pharmacists. Archived from the original on 25 December 2016. Retrieved 8 December 2016.
- ^ أ ب ت Keating GM (2015). "Ledipasvir/Sofosbuvir: a review of its use in chronic hepatitis C". Drugs. 75 (6): 675–85. doi:10.1007/s40265-015-0381-2. PMID 25837989.
- ^ The selection and use of essential medicines: Twentieth report of the WHO Expert Committee 2015 (including 19th WHO Model List of Essential Medicines and 5th WHO Model List of Essential Medicines for Children) (PDF). WHO. 2015. p. 70. ISBN 9789240694941. Archived (PDF) from the original on 20 December 2016. Retrieved 8 December 2016.
- ^ "WHO Model List of Essential Medicines (19th List)" (PDF). World Health Organization. April 2015. Archived (PDF) from the original on 13 December 2016. Retrieved 8 December 2016.
- ^ "NADAC as of 2016-12-21 | Data.Medicaid.gov". Centers for Medicare and Medicaid Services. Archived from the original on 24 December 2016. Retrieved 25 December 2016.
- ^ Azam, Monirul (2016-05-30). "1". Intellectual Property and Public Health in the Developing World (in الإنجليزية). Open Book Publishers. ISBN 9781783742318. Archived from the original on 2016-12-26.
- ^ "Hep C drug tourism has begun as patients seek Harvoni, Sovaldi overseas". FiercePharma. 2015-06-02. Archived from the original on 2015-11-04. Retrieved 2015-10-25.
- ^ أ ب Messina, Jane P.; Humphreys, Isla; Flaxman, Abraham; Brown, Anthony; Cooke, Graham S.; Pybus, Oliver G.; Barnes, Eleanor (January 2015). "Global distribution and prevalence of hepatitis C virus genotypes". Hepatology. 61 (1): 77–87. doi:10.1002/hep.27259. ISSN 1527-3350. PMC 4303918. PMID 25069599.
- ^ أ ب ت "US Label" (PDF). FDA. June 2016. Archived (PDF) from the original on 2017-02-05.. See FDA index page for NDA 205834 Archived 2017-02-05 at the Wayback Machine.
- ^ Canadian Agency for Drugs and Technologies in Health (16 January 2015). "Holkira (Ombitasvir/Paritaprevir/ Ritonavir with Dasabuvir) and Harvoni (Ledipasvir/Sofosbuvir) for Chronic Hepatitis C: A Review of the Clinical Evidence". Rapid Response Service. Canadian Agency for Drugs and Technologies in Health. PMID 25674658. Archived from the original on 5 November 2017.
- ^ Issur, Moheshwarnath; Götte, Matthias (2014-11-06). "Resistance patterns associated with HCV NS5A inhibitors provide limited insight into drug binding". Viruses. 6 (11): 4227–4241. doi:10.3390/v6114227. ISSN 1999-4915. PMC 4246218. PMID 25384189.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب ت ث ج ح خ د ذ Gritsenko, Diana; Hughes, Gregory (April 2015). "Ledipasvir/Sofosbuvir (Harvoni): Improving Options for Hepatitis C Virus Infection". Pharmacy and Therapeutics. 40 (4): 256–276. ISSN 1052-1372. PMC 4378517. PMID 25859119.
- ^ Gao, Min (October 2013). "Antiviral activity and resistance of HCV NS5A replication complex inhibitors". Current Opinion in Virology. 3 (5): 514–520. doi:10.1016/j.coviro.2013.06.014. ISSN 1879-6265. PMID 23896281.
- ^ أ ب ت ث ج ح خ د ذ ر ز س "HARVONI (ledipasvir and sofosbuvir)" (PDF). Retrieved 2018-02-22.
- ^ Vermehren, Johannes; Sarrazin, Christoph (August 2012). "The role of resistance in HCV treatment". Best Practice & Research. Clinical Gastroenterology. 26 (4): 487–503. doi:10.1016/j.bpg.2012.09.011. ISSN 1532-1916. PMID 23199507.
- ^ "harvoni_pi.pdf" (PDF). Retrieved 2018-02-21.
- ^ أ ب "Harvoni 90 mg/400 mg film-coated tablets - Summary of Product Characteristics" (in الإنجليزية). UK Electronic Medicines Compendium. December 2016. Archived from the original on 27 October 2016. Retrieved 4 February 2017.
- ^ "Drug Interactions Between Direct-Acting anti-HCV Antivirals Sofosbuvir and Ledipasvir and HIV Antiretrovirals". www.natap.org. Retrieved 2018-02-22.
- ^ "Impact of Food and Antacids on Levels of Ledipasvir and Sofosbuvir". www.natap.org. Retrieved 2018-02-22.
- ^ Gong, Guozhong; Waris, Gulam; Tanveer, Rasheeda; Siddiqui, Aleem (2001-08-14). "Human hepatitis C virus NS5A protein alters intracellular calcium levels, induces oxidative stress, and activates STAT-3 and NF-κB". Proceedings of the National Academy of Sciences of the United States of America. 98 (17): 9599–9604. doi:10.1073/pnas.171311298. ISSN 0027-8424. PMC 55498. PMID 11481452.
- ^ Lin, M. Valerie; Chung, Raymond (2014). "Recent FDA approval of sofosbuvir and simeprevir. Implications for current HCV treatment". Clinical Liver Disease. 3 (3): 65–68. doi:10.1002/cld.332. PMC 6448702. PMID 30992888.
- ^ Pawlotsky, Jean-Michel (August 2013). "NS5A inhibitors in the treatment of hepatitis C". Journal of Hepatology. 59 (2): 375–382. doi:10.1016/j.jhep.2013.03.030. ISSN 1600-0641. PMID 23567084.
- ^ "Sofosbuvir". www.drugbank.ca. Retrieved 2018-03-23.
- ^ McQuaid, Thomas; Savini, Carolyn; Seyedkazemi, Star (March 2015). "Sofosbuvir, a Significant Paradigm Change in HCV Treatment". Journal of Clinical and Translational Hepatology. 3 (1): 27–35. doi:10.14218/JCTH.2014.00041. ISSN 2225-0719. PMC 4542085. PMID 26357632.
- ^ Cada, Dennis J.; Baker, Danial E.; Bindler, Ross Jason (March 2015). "Ledipasvir/Sofosbuvir". Hospital Pharmacy. 50 (3): 224–234. doi:10.1310/hpj5003-224. ISSN 0018-5787. PMC 4567193. PMID 26405313.
- ^ "Pharmacology: Basic Pharmacology, ANS, Endocrine". www.kumc.edu. Retrieved 2018-03-23.
- ^ Elkady, Ehab F.; Aboelwafa, Ahmed A. (2016-09-01). "A Rapid and Optimized LC-MS/MS Method for the Simultaneous Extraction and Determination of Sofosbuvir and Ledipasvir in Human Plasma". Journal of AOAC International. 99 (5): 1252–1259. doi:10.5740/jaoacint.16-0021. PMID 27480956.
- CS1 maint: unflagged free DOI
- Template:drugs.com link with non-standard subpage
- Infobox-drug molecular-weight unexpected-character
- Pages using infobox drug with unknown parameters
- Infobox drug articles with contradicting parameter input
- Chemical articles without CAS registry number
- Articles without EBI source
- Chemical pages without ChemSpiderID
- Chemical pages without DrugBank identifier
- Articles without UNII source
- Drug has EMA link
- Articles containing unverified chemical infoboxes
- Drugs that are a combination of chemicals
- أدوية مركبة
- NS5B (polymerase) inhibitors
- NS5A inhibitors
- گلعاد للعلوم
- RTT