تآكل جلفاني
التآكل الجلفاني إنگليزية: Galvanic corrosion (المعروف أيضاً باسم التآكل الثنائي المعدني أو التآكل التبايني للمعادن) هو عملية كهروكيميائية يتآكل فيها معدن واحد بشكل أفضل عندما يكون في اتصال كهربائي مع معدن آخر في وجود محلول كهرلي. تُستغل ردة الفعل الجلفانية المماثلة في الخلايا الأولية لتوليد جهد كهربائي مفيد لتشغيل الأجهزة المحمولة. يتم تسمية هذه الظاهرة باسم الطبيب والفيزيائي الإيطالي لويجي جلفاني (1737-1798).
نظرة عامة
تختلف المعادن والسبائك غير المتشابهة فيما يتعلق بالكمون القطبي الكهربائي، وعندما يتم اتصال اثنين أو أكثر منها في محلول كهرلي، يتصرف المعدن الأكثر نشاطاً كأنود والآخر كاثود (أي المعدن الأقل نشاطاً). الفرق في الجهد الكهربائي بين ردود الفعل عند القطبين هو القوة الدافعة لزيادة الاتجاه إلى المعدن الأنودي، الذي يذوب في المحلول الكهرلي. يؤدي ذلك إلى تآكل المعدن عند الأنود بشكل أسرع مما كان سيحدث بالإضافة إلى تثبيط التآكل عند الكاثود. يعد وجود محلول كهرلي ومسار توصيل كهربائي بين المعادن أمراً أساسياً لحدوث التآكل الجلفاني. يوفر المحلول الكهرلي وسيلة للهجرة الأيونية حيث تتحرك الأيونات لمنع تراكم الشحنة الكهربائية التي ستوقف الردة الكيميائية. إذا احتوى المحلول الكهرلي على أيونات المعدن فقط التي لا تخفض بسهولة (مثل Na+، Ca2+، K+، Mg2+، أو Zn2+) فإن ردة الفعل الكاثودية تكون اختزال H + المذاب إلى H+ إلى H2 أو O2 إلى OH−.[1][2][3][4]
في بعض الحالات، يتم تشجيع هذا النوع من التفاعل بشكل مقصود. على سبيل المثال، تحتوي البطاريات المنزلية ذات التكلفة المنخفضة عادةً على خلايا الكربون-الزنك. كجزء من دائرة مغلقة (مسار الإلكترونات)، يتعرض الزنك داخل الخلية للتآكل بشكل أفضل (مسار الأيونات) كجزء أساسي من إنتاج الكهرباء في البطارية. ومن الأمثلة الأخرى الحماية المهبطية الخاصة بالبنى المدفونة أو المغمورة بالإضافة إلى خزانات المياه الساخنة. في هذه الحالة، تعمل الأنودات التعويضية كجزء من زوج جلفاني، وتشجع على تآكل الأنود في حين تحمي معدن الكاثود.
في حالات أخرى، مثل وجود معادن مختلطة في الأنابيب (على سبيل المثال، النحاس والحديد الزهر وغيرها من المعادن الزهرية)، فإن التآكل الجلفاني سيساهم في التآكل المتسارع لأجزاء من المجموعة. يمكن حقن مثبطات التآكل مثل نتريت الصوديوم أو موليبدات الصوديوم في هذه المجموعات لتقليل الجهد الجلفاني. ومع ذلك، يجب مراقبة تطبيق هذه المثبطات بعناية. إذا زاد تطبيق مثبطات التآكل من توصيلية الكهرل داخل المجموعة، فيمكن زيادة إمكانية التآكل الجلفاني بشكل كبير.
تعتبر الحموضة أو القلوية (pH) أيضاً عاملاً رئيسياً فيما يتعلق بأنظمة التداول الثنائية المعدنية المغلقة. إذا كانت قيمة الحموضة وجرعات مثبطات التآكل غير صحيحة، فسيتم تسريع التآكل الجلفاني. في معظم أنظمة التدفئة والتهوية وتكييف الهواء (HVAC)، لا يمكن استخدام الأنودات والكاثودات التعويضية كخيار، حيث يتطلب تطبيقها داخل أنابيب النظام ومع مرور الزمن، يمكن أن تتآكل وتطلق جسيمات يمكن أن تسبب أضراراً ميكانيكية محتملة للمضخات الدائرة، ومبادلات الحرارة، وما إلى ذلك.[5]
أمثلة على التآكل
مثال شائع للتآكل الجلفاني في الحديد المجلفن، وهو ورقة من الحديد أو الفولاذ مغطاة بطبقة من الزنك. حتى عندما يتم كسر الطلاء الواقي من الزنك، لا يتم شحن الصلب الأساسي الذي يقع أسفله. بدلاً من ذلك، يتم تآكل الزنك لأنه أقل "نبلاً". ويمكن أن يحدث تأكل الفلز الأساسي فقط بعد استهلاك الزنك. بالمقارنة مع علبة الصفيح التقليدية، يحدث العكس من التأثير الواقي، حيث أن القصدير هو أكثر نبلاً من الصلب الأساسي، وعندما يتم كسر طلاء القصدير، يتم شحن الصلب الموجود تحته على الفور بصورة تفضيلية.
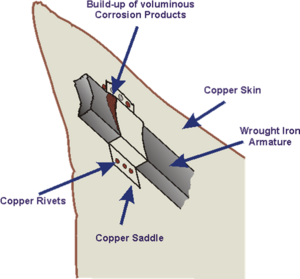
تمثال الحرية
حدث مثال مذهل للتآكل الكهروكيميائي في تمثال الحرية عندما كشفت فحوصات الصيانة العادية في الثمانينيات من القرن الماضي أن التآكل قد حدث بين الغطاء النحاسي الخارجي وهيكل الدعم المصنوع من الحديد المطاوع. وعلى الرغم من أن المشكلة كانت متوقعة عند بناء الهيكل من قبل غوستاف إيفل وتصميم فريدريك بارثولدي في الثمانينيات من القرن التاسع عشر، فإن طبقة العزل من الشيلاك بين المعادن الاثنين فشلت مع الزمن وأدت إلى تآكل دعامات الحديد. تم إجراء تجديد شامل مع استبدال العزل الأصلي بـمتعدد رباعي فلورو الإيثيلين PTFE. كانت البنية بعيدة عن عدم الأمان بسبب العدد الكبير من الروابط غير المتأثرة، ولكن اعتبر ذلك إجراءً احترازياً للحفاظ على رمز وطني للولايات المتحدة.[6]
البحرية الملكية وسفينة إتش إم إس ألارم
في القرن السابع عشر[vague]، وافق صموئيل بيبيس (الذي كان يعمل كأمين عام للبحرية) على إزالة الغلاف الرصاصي من سفن البحرية الملكية الإنجليزية لمنع تفكك الحديد في مفاصل الموجهات ورؤوس البراغي، على الرغم من إعترافه بعدم فهمه السبب الذي يتسبب في تآكل المعدن بوجود الرصاص.[7]
حدث تكرار المشكلة عندما تم تغطية السفن بالنحاس لتقليل تراكم الأعشاب البحرية وحمايتها من دودة السفن. في تجربة قامت بها البحرية الملكية في عام 1761، تم تغطية هيكل الفرقاطة HMS Alarm بطبقات من النحاس بوزن 12 أونصة. وعند عودتها من رحلتها إلى الهند الغربية، تبين أن النحاس لا يزال في حالة جيدة وقد حول دون ظهور دودة السفن، ولكنه أيضاً انفصل عن الهيكل الخشبي في العديد من الأماكن بسبب أن المسامير المستخدمة لتثبيتها كانت "قد تحللت لتصبح عجينة صدئية".[8]لكن مما أثار دهشة فرق التفتيش، أن بعض المسامير الحديدية تقريباً لم تتضرر. وكشفت التفتيشات الدقيقة أن الورق البني المقاوم للماء الموضوع تحت رأس المسمار قد حمى بعض المسامير بشكل غير مقصود: "حيث كان هذا الغطاء مثالياً، تم حفظ الحديد من الإصابة". وكان النحاس المستخدم لتغطية السفينة قد وصل إلى الحوض الجاف مغلفاً بالورق البني، الذي لم يتم إزالته دائماً قبل تثبيت الأوراق على الهيكل. وبالتالي، كانت الاستنتاجات التي تم إرسالها إلى الأميرالية في عام 1763 هي أنه لا يجب السماح بملامسة الحديد للنحاس مباشرةً في مياه البحر. .[9][10]
سفينة القتال الساحلية للبحرية الأمريكية اندبندنس
اُبلغ عن تآكل جلفاني خطير على أحدث سفينة هجومية للبحرية الأمريكية، سفينة القتال الساحلية USS Independence، الذي تسبب فيه أنظمة الدفع بالماء المصنوعة من الفولاذ المرتبطة بهيكل من الألمنيوم. بدون عزل كهربائي بين الفولاذ والألمنيوم، يعمل هيكل الألمنيوم كأنود للفولاذ المقاوم للصدأ، مما يؤدي إلى تآكل جلفاني شديد.[11]
أجهزة الإضاءة المتآكلة
كشف سقوط غير متوقع في عام 2011 لمصباح ثقيل من السقف في نفق السيارات الضخم Big Dig في بوسطن أن التآكل قد ضعف دعمه. وقد تسبب الاستخدام الغير صحيح للألمنيوم عندما يتم وضعه في اتصال مع الفولاذ المقاوم للصدأ في التآكل السريع في وجود مياه مالحة. [12] فرق الكمون الكهروكيميائي بين الفولاذ المقاوم للصدأ والألمنيوم يتراوح بين 0.5 إلى 1.0 فولت، حسب السبائك المحددة المستخدمة، ويمكن أن يسبب تآكلاً كبيراً في غضون شهور قليلة في ظروف غير مواتية. وتتطلب استبدال الآلاف من المصابيح المتعطلة، تكلفة تُقدر بـ 54 مليون دولار.[13]
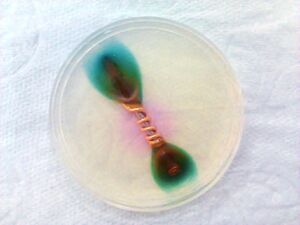
خلية اللازانيا
يتم إنتاج "خلية اللازانيا" عن طريق الصدفة عندما يتم تخزين الطعام الرطب المالح مثل اللازانيا في صينية فولاذية ويتم تغطيته بورق الألمنيوم. بعد ساعات قليلة، يتطور الورق الألمنيوم فتحات صغيرة حيث يلامس اللازانيا، وتتغطى سطح الطعام ببقع صغيرة مؤلفة من الألمنيوم المتآكل.[14]في هذا المثال، يعتبر الطعام المالح (اللازانيا) المحلول الكهربائي، وورق الألمنيوم هو الأنود، والصينية الفولاذية هي الكاثود. إذا لامس ورق الألمنيوم المحلول الكهربائي فقط في مناطق صغيرة، فإن التآكل الجلفاني سيكون مركزاً ويمكن أن يحدث التآكل بشكل سريع نسبياً. إذا لم يتم استخدام ورق الألمنيوم مع حاوية معدنية مختلفة، فإن التفاعل كان على الأرجح كيميائياً. يمكن لتراكيز عالية من الملح أو الخل أو بعض المركبات الحمضية الأخرى أن تتسبب في تفتت ورق الألمنيوم. ومنتج أي من هذه التفاعلات هو ملح الألمنيوم. لا يؤثر ذلك على الطعام، ولكن يمكن أن يضفي أي رواسب نكهة ولون غير مرغوب فيهما.[15]
التنظيف الالكتروليتي
تقنية شائعة لتنظيف أدوات الفضة هي غمر الفضة أو الفضة الإسترليني (أو حتى الأشياء المطلية بالفضة) وقطعة من الألومنيوم (يفضل استخدام ورق الألمنيوم بسبب مساحته السطحية الأكبر بكثير من حبات الألمنيوم، على الرغم من أنه إذا كان لورق الألمنيوم وجه "لاصق"، يجب إزالته باستخدام صوف الصلب أولاً) في حمام كهربائي ساخن (عادة ما يتألف من الماء وبيكربونات الصوديوم، أي صودا الخبز المنزلية) وهذا هو مثال على التآكل الجلفاني. يغمق الفضة ويتآكل في وجود جزيئات الكبريت الجوية، ويتآكل نحاس الفضة الإسترليني في مجموعة من الظروف. يمكن إزالة هذه الطبقات من التآكل إلى حد كبير من خلال الاختزال الكهروكيميائي لجزيئات كبريتيد الفضة: يزيل وجود الألومنيوم (الذي يقل نبله من الفضة والنحاس) في حمام بيكربونات الصوديوم ذرات الكبريت عن كبريتيد الفضة وينقلها إلى ورق الألمنيوم ويتآكلها (الذي هو معدن أكثر نشاطاً بكثير)، مما يترك عنصر الفضة وراءها. لا يتم فقدان أي عنصر فضة في العملية.[16]
الحد من التآكل الجلفاني
هناك عدة طرق للحد من والوقاية من هذا النوع من التآكل.
- عزل المعدنين كهربائياً عن بعضهما البعض. إذا لم يكن هناك اتصال كهربائي بينهما، فلن يحدث أي ارتباط جلفاني. يمكن تحقيق ذلك باستخدام مواد غير موصلة بين المعادن ذات الكمون الكهربائي المختلف. يمكن عزل الأنابيب باستخدام فوهة أنبوبية مصنوعة من مواد بلاستيكية، أو مصنوعة من مواد معدنية مبطنة داخلياً بمواد عازلة. من المهم أن تكون الفوهة بطول كافٍ لتكون فعالة. لأسباب تتعلق بالسلامة، يجب تجنب هذه العملية في أنظمة التأريض الكهربائية التي تستخدم الأنابيب للتأريض الكهربائي أو تحتوي على ربط متساوي الجهد.
- القوارب المعدنية المتصلة بتغذية كهربائية من الشاطئ عادة ما يجب أن يتم توصيل الهيكل الخارجي بالأرض لأسباب السلامة. ومع ذلك، يُرجح أن يكون نهاية تلك الاتصال الأرضي عبارة عن عصا نحاسية مدفونة داخل المرسى، مما يؤدي إلى "بطارية" من الفولاذ والنحاس بحوالي 0.5 فولت. بالإضافة إلى ذلك، يتم توصيل بطانة كل قارب ببطانة جميع القوارب الأخرى، مما يؤدي إلى وجود "بطاريات" إضافية بين المروحيات (التي يمكن أن تكون مصنوعة من البرونز) وجدران الهيكل الفولاذي، والتي قد تتسبب في تآكل المروحيات الثمينة. لمثل هذه الحالات، يعتبر استخدام معزل جلفاني ضرورياً، وهو عبارة عن ديودات نصف موصلة موصولة في سلسلة متوازية مع ديودات توصيل في الاتجاه المعاكس (مضادة للتوازن). يتم إدخال هذا الجهاز في اتصال الأرض الواقي بين الهيكل الخارجي وموصل الحماية الساحلي. يمنع هذا أي تيار في الموصل الواقي في حالة تطبيق الجهد الكهربائي أقل من 1.4 فولت (أي 0.7 فولت لكل ديود)، ولكنه يسمح بتدفق التيار الكامل في حالة وجود خلل كهربائي. سيكون لا يزال هناك تسرب طفيف جداً للتيار عبر الديودات، مما قد يؤدي إلى تآكل أسرع بقليل من المعتاد.
- يمكن التأكد من عدم وجود اتصال مع مادة كهليكترولية بين المعادن. يمكن ذلك عن طريق استخدام مركبات مقاومة للماء مثل الشحوم، أو عن طريق طلاء المعادن بطبقة واقية لا تخترقها السوائل، مثل الطلاء، الورنيش، أو البلاستيك المناسب. إذا لم يكن من الممكن طلاء المعدنين، فينبغي طلاء المعدن الأكثر نبلاً، أي المعدن ذو الجهد الأعلى. ويفضل ذلك، لأنه إذا تم تطبيق الطلاء فقط على المعدن الأكثر نشاطاً، في حالة تلف الطلاء، سيكون هناك منطقة كاثودية كبيرة جداً ومنطقة أنودية صغيرة جداً، وسيكون معدل التآكل عالياً بالنسبة للمنطقة الأنودية المكشوفة.
- استخدام معجون مضاد للأكسدة مفيد لمنع التآكل بين اتصالات النحاس والألومنيوم الكهربائية. يتكون المعجون من معدن أقل نبلاً من الألومنيوم أو النحاس.
- اختيار المعادن التي لديها كمون كهربائي مماثل هو الطريقة الأمثل للحد من تآكل جلفاني. كلما كان الكمون الكهربائي الفردي متطابق بشكل أكبر، كلما كان الفرق الكهربائي أصغر، وبالتالي كان التيار الجلفاني أقل. استخدام نفس المعدن لجميع البناء هو أسهل طريقة لمطابقة الكمون الكهربائي.
- يمكن أيضاً استخدام تطبيق الطلاء الكهربائي أو غيره من التطبيقات الكهربائية الأخرى للمساعدة في الوقاية من التآكل الكهروجلفاني. ويميل ذلك إلى استخدام المعادن أكثر نبلية التي تقاوم التآكل بشكل أفضل. يمكن استخدام الكروم والنيكل والفضة والذهب. تحمي الجلفنة بالزنك المعدن الأساسي للصلب بفعل الأنود البديل.
- تستخدم الحماية الكاثودية واحد أو أكثر من الأنودات البديلة المصنوعة من معدن أكثر نشاطاً من المعدن المحمي. تشمل سبائك المعادن المستخدمة عادة في الأنودات التضحية الزنك والمغنيسيوم والألومنيوم. يتم استخدام هذا النهج بشكل شائع في سخانات المياه والعديد من الهياكل المعدنية المدفونة أو المغمورة.
- يمكن أيضاً تطبيق الحماية الكاثودية عن طريق توصيل مصدر طاقة كهربائي مباشر كالتيار المستمر (DC) لمقاومة التيار الجلفاني التآكلي. (انظر حماية مهبطية § Impressed current cathodic protection (ICCP).)
السلاسل الجلفانية
يمكن تصنيف جميع المعادن في سلسلة جلفانية تمثل الكمون الكهربائي الذي تولده في محلول كهرليتي معين مقابل مرجع كهربائي قياسي. توضح الموضع النسبي لاثنين من المعادن على مثل هذه السلسلة مؤشراً جيداً على المعدن الأكثر عرضة للتآكل بسرعة أكبر. ومع ذلك، يمكن أن تؤثر عوامل أخرى مثل تهوية الماء وسرعة التدفق بشكل كبير على معدل العملية.
المؤشر المصعدي

يمكن توقع التوافق بين معدنين مختلفين عن طريق النظر في مؤشر الأنودي. هذا المعامل هو مقياس للجهد الكهروكيميائي الذي سيتم توليده بين المعدن والذهب. للعثور على الجهد النسبي لزوج من المعادن، يتطلب الأمر فقط طرح مؤشراتهم الأنودية.[17]
لتقليل التآكل الجلفاني للمعادن المخزنة في بيئات عادية مثل تخزينها في مستودعات أو بيئات غير متحكمة في درجة الحرارة والرطوبة، يجب ألا يزيد الفرق في مؤشر التأكسد الخافض بين المعدنين المتصلين عن 0.25 فولت. يمكن تحمل 0.50 فولت في البيئات المتحكمة فيها درجة الحرارة والرطوبة. في البيئات القاسية مثل الخارجية والرطوبة العالية والبيئات المالحة، يجب ألا يزيد الفرق في مؤشر التأكسد الخافض بين المعدنين المتصلين عن 0.15 فولت. على سبيل المثال: يوجد فرق بين الذهب والفضة يبلغ 0.15 فولت، لذلك لن تتعرض المعدنين للتآكل الكبير حتى في البيئة القاسية.[18][صفحة مطلوبة]
عندما تتطلب مراعاة التصميم أن تتلامس المعادن غير المتشابهة، يتم غالباً إدارة الفرق في مؤشر الأنودي بواسطة التشطيبات والطلاءات. يتيح التشطيب والطلاء المختار للمواد غير المتشابهة أن تكون في اتصال، مع حماية المواد الأكثر قاعدية من التآكل بواسطة المواد الأكثر نبلاً.[18][صفحة مطلوبة] سيكون دائماً المعدن الذي لديه أكبر مؤشر مصعدي سلبي هو المعدن الذي سيتعرض في النهاية للتآكل عندما يكون هناك عدم توافق كهروكيميائي جلفاني. ولهذا السبب، يجب عدم وضع أدوات المائدة المصنوعة من الفضة الإسترليني والفولاذ المقاوم للصدأ معاً في غسالة الصحون في نفس الوقت، حيث من المرجح أن تتعرض الأدوات المصنوعة من الفولاذ للتآكل بحلول نهاية الدورة (حيث يعمل الصابون والماء كالمادة الكيميائية الكهربائية، والحرارة تسرع عملية التآكل).
| الفلز | المؤشر (V) |
|---|---|
| الأكثر مهبطية | |
| الذهب، ذهب، صلب ومطلي؛ سبيكة ذهب-بلاتين. | −0.00 |
| الروديوم-مطلي بالذهب على نحاس مطلي بالفضة | −0.05 |
| الفضة، صلب أو مطلية؛ معدن مونيل؛ سبائك عالية من النيكل-النحاس | −0.15 |
| النيكل، صلب أو مطلية؛ تيتانيوم وسبائكه؛ مونيل | −0.30 |
| النحاس، صلب أو مطلي؛ نحاس منخفض النسبة أو البرونز؛ لحام فضة؛ سبائك عالية النحاس والنيكل الألماني؛ سبائك النيكل والكروم | −0.35 |
| النحاس الأصفر والبرونز | −0.40 |
| النحاس العالي والبرونز. | −0.45 |
| الفولاذ المقاوم للتآكل من نوع 18٪ كروم | −0.50 |
| الكروم مطلي؛ مطلي بالقصدير؛ الفولاذ المقاوم للتآكل من نوع 12٪ كروم. | −0.60 |
| القصدير-صفيح القصدير؛ لحام الرصاص والقصدير. | −0.65 |
| الرصاص، صلب أو مطلي؛ سبائك عالية الرصاص. | −0.70 |
| الألمنيوم المطروق من سلسلة 2000. | −0.75 |
| الحديد، مطروق أو رمادي أو مطاوع؛ شبائك منخفضة الفولاذ والكربون العادي. | −0.85 |
| الألمنيوم، سبائك مطروقة غير سلسلة الألمنيوم 2000، سبائك صب من نوع السليكون. | −0.90 |
| الألمنيوم، سبائك صب (بخلاف نوع السليكون)؛ الكادميوم، مطلي بالكرومات. | −0.95 |
| صفيحة الزنك الساخنة؛ الصلب المجلفن | −1.20 |
| الزنك، مطروق؛ سبائك صب في قوالب الزنك؛ مطلي بالزنك. | −1.25 |
| مغنسيوم وسبائك قواعد المغنيسيوم، صب أو مطروق. | −1.75 |
| بريليوم | −1.85 |
| الأكثر مصعدية |
انظر أيضاً
- تآكل
- مصعد جلفاني
- Galvanic series
- جلفنة
- Pourbaix diagram
- عزل جلفاني في الدوائر الكهربائية / الإلكترونية.
المراجع
- ^ Decker, Franco lan (January 2005). "Volta and the 'Pile'". Electrochemistry Encyclopedia. Case Western Reserve University. Archived from the original on 2012-07-16.
- ^ Turner, Edward (1841). Liebig, Justus; Gregory, William (eds.). Elements of chemistry: including the actual state and prevalent doctrines of the science (7 ed.). London: Taylor and Walton. p. 102.
During the action of a simple circle, as of zinc and copper, excited by dilute sulfuric acid, all of the hydrogen developed in the voltaic action is evolved at the surface of the copper.
- ^ Goodisman, Jerry (2001). "Observations on Lemon Cells". Journal of Chemical Education. 78 (4): 516–518. Bibcode:2001JChEd..78..516G. doi:10.1021/ed078p516. Goodisman notes that many chemistry textbooks use an incorrect model for a cell with zinc and copper electrodes in an acidic electrolyte.
- ^ Graham-Cumming, John (2009). "Tempio Voltiano". The Geek Atlas: 128 Places Where Science and Technology Come Alive. O'Reilly Media. p. 97. ISBN 9780596523206.
- ^ M. Houser, Corrosion Control Services, Inc., introduction handbook
- ^ "Reclothing the First Lady of Metals - Repair Details". Copper Development Association. Retrieved 16 August 2019.
- ^ Bryant, Arthur (1935). Samuel Pepys: The Years of Peril. Cambridge: Macmillan. p. 370.
- ^ "Galvanic corrosion... What it is and how to fight it". Motorboating. Hearst Magazines Inc. 82 (1): 50. July 1948.
- ^ "CLI Houston". Retrieved January 15, 2011.
- ^ Trethewey, K.R.; Chamberlain, J. (1988). "Historic Corrosion Lessons". Corrosion Doctors. Retrieved 2014-02-27.
- ^ David Axe. "Builder Blames Navy as Brand-New Warship Disintegrates". Wired.
- ^ Mullan, Jeff (April 6, 2011). "Tunnel Safety Ceiling Light Fixture Update" (PDF). Report to the MassDOT Board of Directors. MassDOT. Retrieved 2012-04-09.
- ^ Murphy, Sean P. (April 5, 2012). "Big Dig needs $54m light fix". boston.com. The Boston Globe. Archived from the original on April 6, 2012. Retrieved 2012-04-09.
- ^ Water. Hemat, R.A.S. Editor: Urotext. ISBN 1-903737-12-5. p. 826
- ^ "Food Safety Education | for Consumers | FAQ".
- ^ "Galvanic Cleaning of Silver Coins - Tutorial". www.metaldetectingworld.com.
- ^ Wheeler, Gerson J., The design of electronic equipment: a manual for production and manufacturing, Prentice-Hall, 1972
- ^ أ ب ت "Handbook of Corrosion Engineering". www.corrosion-doctors.org.
وصلات خارجية
- Short description is different from Wikidata
- Articles containing إنگليزية-language text
- Pages using Lang-xx templates
- All Wikipedia articles needing clarification
- Wikipedia articles needing clarification from August 2019
- Articles with hatnote templates targeting a nonexistent page
- مقالات بالمعرفة بحاجة لذكر رقم الصفحة بالمصدر from January 2011
- تآكل