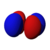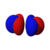مدار ذري

في ميكانيكا الكم، المدار الذري atomic orbital، هي دالة رياضية تصف تصف الطبيعة الموجية لحركة الإلكترونات في الذرة.[1]، بواسطة هذه الدالة يمكن حساب المنطقة أو الحيز من الفراغ الذي يمكن أن يتواجد فيه الإلكترون حول ذرة مفردة (حرة) في مستوى طاقة معينة.
بشكل محدد، فإن المدارات الذرية عبارة عن حالات طاقة كمومية منفصلة، لكل إلكترون على حدة في السحابة الإلكترونية حول ذرة مفردة (حرة)، يعبر عنها على شكل دالة رياضية في ميكانيكا الكم. ويعبر عن المدار الذري في ميكانيكا الكم بعدد الكم المداري.
يتكون الجدول الدوري الحديث من 18 مجموعة رأسيه،وسبع دورات افقية.وتنقسم المجموعالات الرأسيه إلى مجموعات أساسية ((A)) ومجموعات فرعية ((B)) فالمجموعات الأساسية (A) تحتوي على (8)مجموعات عموديه أعطيت السبع المجموعات الأولى منهاا الأرقام 1A,2A,3A,4A,5A,6A,7Aاما المجموعة الثامنة منها والمشتمله على الغازات الخامله فتسمى على المجموعات الصفريه وأعطيت الرقم صفر (0) ووضعت في أقصى يمين الجدول بعد المجموعة (7A).وأبتداءً من الدورة الرابعة وضعت المجموعات الفرعيه (B) بين المجموعتين الأساسيتين (2Aو 3A)، وسميت عناصر المجموعات الفرعيه (B) بالعناصر الانتقاليه وتتكون من عشر أعمدة ((مجموعات)) رأسية وتتدرج خواص العناصر في الجدول رأسياً من أعلى إلى سفل المجموعات، كما تتدرج افقياً في عناصر الدورات المختلفة من يسار إلى يمينه.
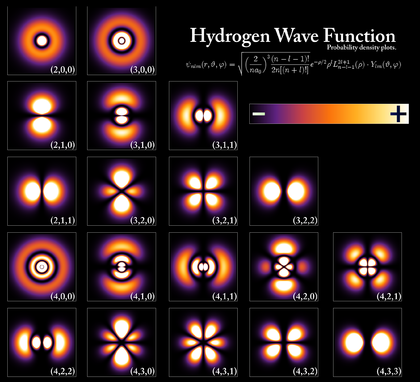
خصائص الإلكترون
- الطبيعة الجزيئية
- الطبيعة الجسيمية
تعريف ميكانيكا الكم الرسمي
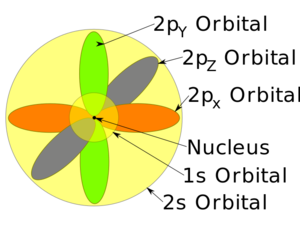
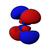
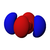
أنواع المدارات

التاريخ
النماذج المبكرة
ذرة بور

المفاهيم والروابط الحديثة لمبدأ الريبية لهايزنبرگ
الأسماء المدارية
المدارات شبيهة الهيدروجين
الأعداد الكمية
المدارات المعقدة
| ℓ = 0 | ℓ = 1 | ℓ = 2 | ℓ = 3 | ℓ = 4 | … | |
|---|---|---|---|---|---|---|
| n = 1 | ||||||
| n = 2 | 0 | −1, 0, 1 | ||||
| n = 3 | 0 | −1, 0, 1 | −2, −1, 0, 1, 2 | |||
| n = 4 | 0 | −1, 0, 1 | −2, −1, 0, 1, 2 | −3, −2, −1, 0, 1, 2, 3 | ||
| n = 5 | 0 | −1, 0, 1 | −2, −1, 0, 1, 2 | −3, −2, −1, 0, 1, 2, 3 | −4, −3, −2, −1, 0, 1, 2, 3, 4 | |
| … | … | … | … | … | … | … |
المدارات الحقيقية
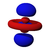
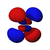
أشكال المدارات
جدول المدارات
الفهم النوعي للأشكال
- s-type drum modes and wave functions
- p-type drum modes and wave functions
- d-type drum modes
الطاقة المدارية
| s | p | d | f | g | h | |
|---|---|---|---|---|---|---|
| 1 | 1 | |||||
| 2 | 2 | 3 | ||||
| 3 | 4 | 5 | 7 | |||
| 4 | 6 | 8 | 10 | 13 | ||
| 5 | 9 | 11 | 14 | 17 | 21 | |
| 6 | 12 | 15 | 18 | 22 | 26 | 31 |
| 7 | 16 | 19 | 23 | 27 | 32 | 37 |
| 8 | 20 | 24 | 28 | 33 | 38 | 44 |
| 9 | 25 | 29 | 34 | 39 | 45 | 51 |
| 10 | 30 | 35 | 40 | 46 | 52 | 59 |
وضع الإلكترون والجدول الدوري

1s 2s 2p 2p 2p 3s 3p 3p 3p 4s 3d 3d 3d 3d 3d 4p 4p 4p 5s 4d 4d 4d 4d 4d 5p 5p 5p 6s 4f 4f 4f 4f 4f 4f 4f 5d 5d 5d 5d 5d 6p 6p 6p 7s 5f 5f 5f 5f 5f 5f 5f 6d 6d 6d 6d 6d 7p 7p 7p |
التأثيرات النسبية
الانتقال بين المدارات
State 1) n = 1, ℓ = 0, mℓ = 0 and s = +1/2
State 2) n = 2, ℓ = 0, mℓ = 0 and s = +1/2
انظر أيضاً
المصادر
- ^ Orchin, Milton; Macomber, Roger S.; Pinhas, Allan; Wilson, R. Marshall (2005). Atomic Orbital Theory (PDF).
- ^ Jeong, Jong Seok; Odlyzko, Michael L.; Xu, Peng; Jalan, Bharat; Mkhoyan, K. Andre (2016-04-26). "Probing core-electron orbitals by scanning transmission electron microscopy and measuring the delocalization of core-level excitations". Physical Review B. 93 (16): 165140. Bibcode:2016PhRvB..93p5140J. doi:10.1103/PhysRevB.93.165140.
قراءات إضافية
- Tipler, Paul; Llewellyn, Ralph (2003). Modern Physics (4 ed.). New York: W. H. Freeman and Company. ISBN 0-7167-4345-0.
- Scerri, Eric (2007). The Periodic Table, Its Story and Its Significance. New York: Oxford University Press. ISBN 978-0-19-530573-9.
- Levine, Ira (2014). Quantum Chemistry (7th ed.). Pearson Education. ISBN 0-321-80345-0.
- Griffiths, David (2000). Introduction to Quantum Mechanics (2 ed.). Benjamin Cummings. ISBN 978-0-13-111892-8.
- Cohen, Irwin; Bustard, Thomas (1966). "Atomic Orbitals: Limitations and Variations". J. Chem. Educ. 43 (4): 187. Bibcode:1966JChEd..43..187C. doi:10.1021/ed043p187.
وصلات خارجية
- Guide to atomic orbitals
- Covalent Bonds and Molecular Structure
- Animation of the time evolution of an hydrogenic orbital
- The Orbitron, a visualization of all common and uncommon atomic orbitals, from 1s to 7g
- Grand table Still images of many orbitals
- David Manthey's Orbital Viewer renders orbitals with n ≤ 30
- Java orbital viewer applet
- What does an atom look like? Orbitals in 3D
- Atom Orbitals v.1.5 visualization software
- Crystal-Style Orbital Viewer