هيدروكربون عطري
الهيدروكربونات الأروماتية أو الأرينات هى هيدروكربونات, وتركيبها الجزيئي يتضمن على الأقل مجموعة تتكون من 6 ذرات كربون في مستوى, مرتبطة معا بإلكترونات غير متمركزة, في نفس المستوى كما لو كانت تتكون من من روابط تساهمية أحادية وثنائية بالتبادل. وهذا التجمع بعد أبسط هيدروكربون أروماتي (البنزين) يسمي بحلقة بنزين.
تعريف
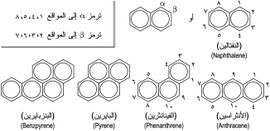
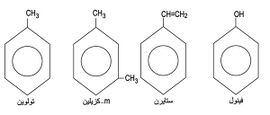
الفحوم الهدروجينية العطرية aromatic hydrocarbons طائفة من المركبات وصفت بالعطرية (أروماتية) لما تتصف به من روائح مميزة. إلا أن هذا الوصف لم يعد يقصد به ذلك المعنى، وإنما أصبح دليلاً على مجموعة من الخواص المميزة الأخرى. والبنزن benzene ذلك السائل الذي اكتشفه فارادي Faraday عام 1825 هو مثلٌ على هذه المركبات. وتدعى باقي مركبات الطائفة أشباه البنزن لأن فيها نظاماً إلكترونياً غير متوضع، يميِّز كل حلقة من الحلقات المندغمة. ولهذا فإن هذه المركبات ذات شبه كبير بالبنزن في تفاعلاتها، ويبيِّن الشكل (1) بعضاً منها.
هناك بعض المركبات الحلقية التي لا تصنف في المركبات العطرية، ومثال ذلك الفحوم الهدروجينية الحلقية alicyclic hydrocarbons، وهي تشمل مركبات حلقية مشبعة (أي لا تحوي روابط مضاعفة في الحلقة الكربونية) وتلك التي فيها روابط مضاعفة وتظهر فيها جميع خواص الألكِنات alkenes، وأما الفحوم الهدروجينية العطرية (الأرينات) ففي حلقاتها روابط مضاعفة إلا أن تفاعلاتها تختلف عن تفاعلات الألكِنات.
أشكال التوزيعات الإلكترونية لحلقة البنزين
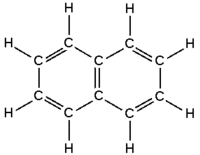
كل ذرة كربون في الحلقة السداسية بها أربعة إلكترونات لتشاركها. أحدها يذهب لذرة الهيدروجين, إثنين لذرتين الكربون المجاورتين. ويتبقى بذلك إلكترون وحيد يتم مشاركته مع أحد ذرات الكربون المجاورة, ولذلك يتم رسم حلقة البنزين بالشكل الذى تكون فيه الروابط الأحادية والثنائية متناوبة خلال الشكل السداسي.
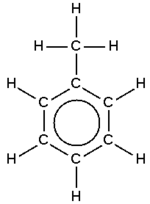
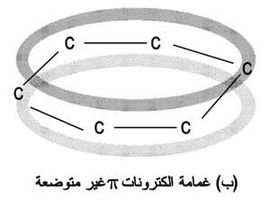
ويفضل كثير من الكيميائين رسم حلقة البنزين بوضع دائرة في الحلقة لإظهار أنه يوجد 6 إلكترونات يدوروا بعدم تمركز في المدارات الجزيئية والتى تمثل شكل الحلقة نفسه. وهذا يمثل بدقة طبيعة الست روابط والتى لها قوة رابطة تقريبا 105. وهذا التساوي موضح بشكل أكثر عن طريق الرنين. وتدور الإلكترونات أعلى وأسفل الحلقة, والمجال الكهرمغناطيسي الناشيء يجعل الحلقة مستقيمة.
وحديثا, فإنه يمكن وصف حلقة البنزين كمركبات فيها أنظمة مغلقة ومستمرة من الحلقات, التى تتكون من مجموعات من ألكترونات سيجما وباي. وتكون المدارات الذرية المكونة للنظام سيجما مهجنة sp2, بينما المدارات الذرية المكونة للنظام باي تكون مدارات p نقية.
ويمكن استخدام قاعدة إيريك هوكل "4n+2" لتوقع الأروماتية, بواسطة عدد الإلكترونات (باي) غير المتمركزة, ولو أنها تساوي (4n+2), حيث أن n عدد صحيح غير سالب, فإن الجزيء يكون أروماتي.
البنزن
أبسط الفحوم الهدروجينية العطرية هو البنزن C6H6، وكان يسمى قديماً البنزول benzol، وقد درس هذا المركب دراسة مستفيضة من جميع النواحي. وهو سائل لا لون له في درجة حرارة الغرفة، كتلته الحجمية 0.87غ/سم3 ونقطة انصهاره 5.75 ْ س ونقطة غليانه 80.3 ْس. وقد أوحت صيغة هذا المركب لكيميائيي القرن التاسع عشر أنه مركب غير مشبع، فبدت كيمياؤه على هذا الأساس شاذة. فالألكن alkene غير المشبع يتحد مع البروم مباشرة، ويتأكسد بالمحلول الحمضي لفوق المنغنات في حين لا يتأثر البنزن في شروط التفاعل هذه. وبرفع درجة الحرارة أو باستعمال وسيط (حفّاز) يتفاعل البنزن، ولكن التفاعلات هي تفاعلات استبدال وليست تفاعلات ضم أو أكسدة (الشكل -2).
بحلول عام 1834 عيّنت صيغة البنزن الأولية CH ومن ثم صيغته الجزيئية وتبيّن أنها C6H6. وقد بدت هذه الصيغة شاذة في ضوء ما كان يُعرف من مركبات فحوم هدروجينية أخرى. ففي معظمها لم تكن نسبة عدد ذرات الهدروجين إلى عدد ذرات الكربون تقل عن 1/2. ولذلك فإن صيغة البنزن المذكورة التي تحتوي على عدد قليل نسبياً من الهدروجين أوحت إلى المهتمين بكيميائه أنه مركب غير مشبع لدرجة عالية. إلا أن السلوك المميز للبنزن أنه يشترك في تفاعلات الاستبدال وليس الضم. وفي الوقت ذاته اكتشفت مركبات أخرى ذات صلة بالبنزن منها البنز ألدهيد (من اللوز المر) وكحول البنزيل (من صمغ البنزوين) والتولوين (من بلسم تولو). وقد لاحظ كيكوليه August Kekulé بين عامي (1829-1896) أن خسف هذه المركبات وما يجري عليها من تحولات ينتهي إلى الاحتفاظ بوحدة من ست ذرات كربون. وهي في هذا تتفق مع البنزن، فاقترح له بنية حلقية مستوية ومتناظرة وجميع ذرات الهدروجين فيها متماثلة (الشكل -3).
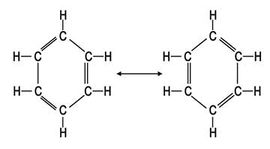
اقترح كيكوليه عام 1865 أن بنية جزيء البنزن طنين (تجاوب) بين بنيتين (الشكل -4).
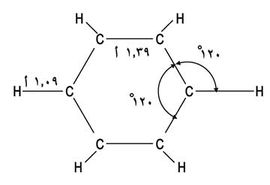
بإمعان النظر في هاتين البنيتين يلاحظ أن رابطة ما بين ذرتي كربون هي في إحداهما مزدوجة بينما هي في الثانية أحادية. وبتصور هجين بين هاتين الصيغتين يُتوقع عندئذ أن تكون الروابط كربون - كربون في البنزن بين المفردة والثنائية. وهذا مـا يؤكده القيـاس، فجزيء البنـزن مستوٍ، طـول الرابطة كربون - كربون فيه 1.39 أنغستروم (الأنغستروم = 10-8سم) وهي قيمة تقـع بين طـول الـرابطة كربون - كربون الأحاديـة (1.54أ) وطـول الـرابطة كربون - كربون الثنائية (1.34أ) كما يتبين من (الشكل -5).
ومن افتراضات نظرية الطنين أن هجين الطنين أكثر ثباتاً مما يقدّر لأي من البنى المساهمة، وذلك لما يتميز به عدم توضع delocalization الإلكترونات الستة من نوع π، فهي غير محصورة بين ذرتين كما في الروابط المزدوجة التي تظهر في أي من بنيتي كيكوليه.
تفسير بنية البنزن عن طريق المدارات
يتبيّن من الشكل (5) أن زاوية الروابط في البنزن هي 120 ْ، وهي قيمة تذكّر بالتهجين sp2 في الاتلين. وانطلاقاً من ذلك يُفترض أن ذرات الكربون الست في الحلقة مهجّنة بطريقة sp2، وأن كل ذرة منها تستخدم مداراً orbit من نوع sp2 للترابط مع ذرتي الكربون المجاورتين وتستخدم الثالث للترابط مع الهدروجين؛ وهذا يعني أن جميع الذرات تقع في المستوي نفسه مما يجعل مدارات p التي تحملها ذرات الكربون متوازية ومتقاربة بما يحقق التراكب الفعّال على مدار الحلقة (المسافة بين أي ذرتي كربون هي 1.39أ) (الشكل -6).
يؤدي هذا التراكب إلى سحابة إلكترونية حلقية فوق مستوى الذرات وإلى أخرى تحت ذلك المستوي. وهذا هو المقصود بانتشار الإلكترونات أو عدم توضعها فهي ملك لجميع ذرات الحلقة في نظام ربط مغلق، وليست متمركزة بين ذرات معينة. وهذا التصور لبنية البنزن مصدر لصيغة تلخص ملامحه يرسم فيها دائرة ضمن الحلقة السداسية (الشكل -6جـ).
تسمية المركبات العطرية
تسمى معظم المركبات العطرية كمشتقات من البنزن (الشكل -7):
ولبعضها الآخر أسماء خاصة بها (الشكل -8).
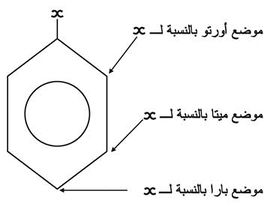
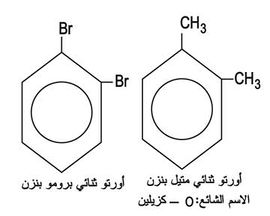
وعندما تُستبدل زمرتان بذرتي هدروجين (كما في الكزيلين)، فحسب الوضع النسبي لهاتين الزمرتين يتكون أورتو ortho أو ميتا meta أو بارا para، ويُكتب عادة الحرف الأول فقط (الشكل-9).
وعندما ترتبط زمرتان مع ذرتي كربون متجاورتين يقال عنهما أورتو (الشكل -10):
أما إذا توسطت ذرة كربون في الحلقة البنزنية بين الزمرتين المستبدلتين فيسمى المركب ميتا (الشكل -11):
أما إذا توسط بين الزمرتين ذرتا كربون فيدعى المركب بارا (الشكل -12):
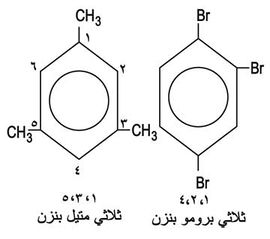
أما إذا استُبدِل في الحلقة البنزنية ثلاث زمر أو أكثر فعندها يُلجأ في التسمية إلى الترقيم (الشكل -13):
وإذا كان الجزيء العطري من المركبات ذات الاسم الشائع، فعندها توضع الزمرة البديلة في الموضع 1 (الشكل -14).
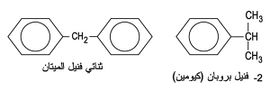
وعندما يستبدل في الحلقة البنزنية بهدروجين واحد زمرة مؤلفة من أكثر من ذرة واحدة أو زمرة بسيطة، فعندها تعد الزمرة C6H5 هي المستبدَلة في ألكان، أو ألكِن أو مركب آخر. والزمرة C6H5 تسمى عندئذ زمرة فنيل phenyl كما في المركبين (الشكل -15).
خصائص الهيدروكربونات الأروماتية
- لها ترافق.
- ذرات الكربون يكون لها تهجين sp2, وبالتالي يكون لها بناء ثلاثي مستوي.
- نسبة كربون-هيدروجين كبيرة.
- يحترقوا بلهب أصفر سخامي نظرا لارتفاع نسبة كربون-هيدروجين.
- يمكن يحدث لها تفاعلات الاستبدال المحبة للإلكترونات, بعكس المركبات الأليفاتية التى تفضل تفاعلات الاستبدال المحب للنواة.
أعضاء هذه المجموعة من المواد
يمكن للهيدروكربونات الأروماتية أن تكون وحيدة الحلقة أو متعددة الحلقات . البنزين, C6H6, هو أبسط المواد الوحيدة الحلقة ويعرف بأنه أول هيدروكربون أروماتي, ولقد تم التعرف عليه لأول مرة عن طريق فريدريك أجوست كيكولي فون شترادونتيز في القرن التاسع عشر. وقد اخترع عدم تمركز الإلكترونات التى تنتقل بطريقة سريعة بين الشكل الثنائي والأحادي, أو اختصارا هو عملية الرنين, والتى تتحرك الروابط الثنائية فيها حول الحلقة السداسية. وعموما فإن العزم الكلي للروابط الأروماتية المتضمنة في ظاهرة الأروماتية تكون أقوى من العزم الكلي للروابط عند النظر إليها كاتحاد بين الروابط الأحادية والثنائية. وعلى هذا فيجب التعرف على الترابط الأروماتي كنوع من الترابط بعيد عن كل الأنواع الأخرى من الروابط المتعددة, مثل الروابط الثنائية والثلاثية. ويمكن وصف هذا بدقة أكبر عن طريق نظرية المدار الجزيئي.
الهيدروكربونات الأروماتية المتعددة الحلقات
المقالة الرئيسية: الهيدروكربونات الأروماتية المتعددة الحلقات
من الأرينات المهمة الهيدروكربونات الحلقية المتعددة الحلقات, كما تسمى أيضا الهيدروكربونات الحلقية المتعددة الذرات. وتكون من أكثر من حلقة أروماتية. وأبسط هذه الهيدروكربونات البينتالين.
الهيدروكربونات الأروماتية متعددة الحلقات التى تتكون من ثلاث حلقات أو أكثر شحيحة الذوبان في الماء, ولها ضغط بخار منخفض. وبزيادة الوزن الجزيئي, يقل كل من الذائبية وضغط البخار. الهيدروكربونات الأروماتية المتعددة الحلقات التى لها حلقتين تذوب أكثر في الماء كما أنها تكون أكثر تطايرا. ونظرا لهذا الخواص, فإن الهيدروكربونات الأروماتية متعددة الحلقات تتواجد طبيعيا في التربة والرسوبيات, بعيدا عن الماء والهواء. وعموما فإن الهيدروكربونات الأروماتية المتعددة الحلقات تتواجد في شكل جسيمات معلقة في الماء والهواء.
وبزيادة الوزن الجزيئي. فإن قدرة الهيدروكربونات الأروماتية المتعددة الحلقات على أن تكون مادة مسرطنة تزيد, بينما تقل سميتها. البينزو[إيه] بيرين, هو أول مادة مادة كيميائية مسرطنة تم اكتشافها.
النفثالين (C10H8), يتكون من حلقتان متحدتين المستوى ويتشاركان في أحد الحواف. ولمزيد من الدقة فإن النفثالين ليس أحد الهيدروكربونات الأروماتية المتعددة الحلقات, ولكن يعتبر من الهيدروكربونات الأروماتية ذات الحلقتين. وللنفثالين رائحة مميزة, وهى معروفة لمن استخدم النفثالين في مقاومة العثة (نفثالين كور).
الهيدروكربونات الأروماتية المتعددة الحلقات التى تعرف بخواصها المسرطن, والمشوهة:
- بنزو(إيه) أنثراسين و كرايزين (C18H12).
- بنزو(بي) فلورانثين.
- بنزو(جيه) فلورانثين.
- بنزو(كيه) فلورانثين.
- بنزو (إيه) بيرين (C20H12).
- بنزو (غي) بيريلين.
- كورونين.
- داي بينزو (إيه,إتش) أنثراسين (C20H14).
- إندينو(3,2,1-سيد) بايرين (C22H12).
- أوفالين.
- فينانثرين
ويحتوى القطران أيضا على الهيدروكربونات الأروماتية المتعددة الحلقات.
الهيدروكربونات الأروماتية متعددة الحلقات ونشأة الحياة
في يناير من عام 2004 (في المقابلة 203 للمجتمع الفلكي الأمريكي), تم الإبلاغ عن فريق برئاسة إيه. ويت, قام بدراسة انبعاث الأشعة فوق البنفسجية من السديم المستطيل الأحمر ووجد أن هناك طيف خاص بالأنثراسين, والبيرين. (لم يتم ملاحظة وجود أيا من المركبات المعقدة مثل هذه في الفضاء من قبل.) وقد عزز هذا الاكتشاف الافتراضات التى تقول أن السديم الذى يشابه المستطيل الأحمر يقترب من نهاية حياته. وأن دورات الحرارة الحالية تسبب وصول الهيدروجين والكربون الموجودين في قلب السديم إلى الرياح النجمية, ويكون إشعاعهم للخارج. وبعد برودتهم, ترتبط الذرات ببعضها ظاهريا بطرق مختلفة وبالتالي تكون جسيمات من ملايين الذرات أو أكثر.
واستنتج ويت وفريقه أنه نظرا لأن الهيدروكربونات الأروماتية المتعددة الحلقات يمكن أن تكون أساسية في نشأة الحياة على الأرض فإن أى سديم سيكون بالضرورة محتو على نوع من أنواع الحياة.
استحضار المركبات العطرية
| الاسم | الصيغة | نقطة الغليان(س ْ) | نقطة الانصهار(س ْ) | الانحلال بلماء |
|---|---|---|---|---|
| بنزن | C6H6 | 80 | +6 | لا |
| تولوين | C6H5CH3 | 111 | -95 | لا |
| O- كزيلين | C6H4(CH3)2 | 144 | -27 | لا |
| m- كزيلين | C6H4(CH3)2 | 139 | -54 | لا |
| p- كزيلين | C6H4(CH3)2 | 138 | +13 | لا |
| نفتالين | C10H8 | 218 | +80 | لا |
| أنتراسين | C4H10 | 342 | +218 | لا |
| فينانترين | C14H10 | 340 | +101 | لا |
يستحصل البنزن وأشباهه مثل النفتالين والأنتراسين بتقطير الفحم. وهي عملية معقدة عندما تجري في المختبر وتستلزم جهداً كبيراً لفصل المنتجات بعضها عن بعض، لكنها عملية اقتصادية لفصل البنزن. كما أن الحاجة متزايدة إلى فحم الكوك الذي ينتج بتسخين الفحم بمعزل عن الهواء، ويتكون عند تحويل كل طن من الفحم إلى فحم الكوك نحو 70 لتراً من قطران الفحم، وهو سائل زيتي مكوَّن من منتجات عدة، ويعطي عندما يخضع للتقطير التجزيئي fractional نحو 30 لتراً من البنزن. كما يعطي تقطير القطران التجزيئي مقادير أقل من متيل البنزن والنفتالين والأنتراسين. ويبين الجدول (1) بعض المركبات الناتجة من قطران الفحم.
وتشير الدراسات إلى أن البنزبايرين وغيره من أشباه البنزن ذات الجزيئات الأكبر تسبب مرض سرطان الرئة لعمال تعدين الفحم وما يتصل به من صناعات.
ومن الطرائق السريعة للحصول على البنزن في المختبر، تسخين ملح الكلسيوم لحمض البنزويك Ca(C6H5COO)2 مع الكلس الصودي (الكلس الصودي هو مزيج ماءات الكلسيوم وماءات الصوديوم):
Ca(C6H5COO)2 + Ca (OH)2 → 2C6H6 +2CaCO3
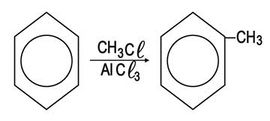
وهناك طريقة واحدة تتصف بفائدتها الكبيرة في تحضير أصناف متعددة من الأرينات هي تفاعل ألكلة فريدل - كرافت. وأساس الطريقة هي تسخين كلور الألكان مع البنزن بوجود ثلاثي كلوريد الألمنيوم. فمتيل بنزن، على سبيل المثال، يستحصل بتفاعل البنزن مع كلورو ميتان CH3Cl بوجود كلور الألمنيوم (الشكل -16):
الخواص الكيمياوية للبنزن
يتضح من الشكل (1) أن تفاعلات البنزن تختلف عن تفاعلات الألكِنات. فتفاعل الضم في المركبات العطرية سيؤدي إلى الإخلال في عدم توضع الإلكترونات فوق الحلقة كلها، هذه الخاصة التي تزيد ثبات المركبات العطرية. ولهذا، فإن تفاعلات الضم التي تتم في الألكِنات لا تحدث في المركبات العطرية. فالبنزن والبروم، على سبيل المثال، لا يتفاعلان دون وجود حفّازات، ويجري في الحلقة هدرجة وساطية ببطء شديد جداً، وبشروط خاصة يتم التفاعل المبين في الشكل (17).
وبدلاً من تفاعلات الضم، يقوم البنزن والمركبات العطرية بتفاعلات استبدال فيمكن هلجنة الحلقة أو نترتتها أو ألكلتها بوجود الوسيط المناسب الشكل (2).
شاهد أيضا
وصلات خارجية
- Carcinogenic FAC list in Portable Document Format.
- مختصر الهيدروكربونات الأروماتية المتعددة الحلقات .
- قائمة الهيدروكربونات الأروماتية المتعددة الحلقات .
- مناقشة حول الغازات المميتة 11:2002 EXPLORER
المصادر
المراجع
- اجتماع مجتمع الفلك الأمريكي. 11 يناير 2004. منhttp://www.aas.org/meetings/aas203/
- الجزيئات الفضائية تشير لوجود حياة عضوية. 11 يناير 2004. باتر سباي إس. من http://www.newscientist.com/news/news.jsp?id=ns99994552