حمض أميني
الحمض الأميني أو الحمض النشادري إنگليزية: Amino Acid. الاحماض الامينيه هي "لبنات البناء" الرئيسية لبناء البروتين و الببتبد في الجسم. يمكن ملاحظتها بسهولة بعد هضم البروتين. ثمانيه أساسية مهمة جدا (لا يمكن للجسم البشري أن يصنعها بنفسه) و الباقي غير اساسية (يمكن صنعها داخل الجسم البشري، بشرط التغذية السليمة). بالرغم من قدرة الجسم على تصنيع الأحماض غير الأساسية ، إلا أنه و في بعض الأحيان يتوجب أخذ مكملات للأحماض غير الأساسية لضمان توفر الكميه المثلى في الجسم. البعض يضيف قسما ثالثا هو شبه-أساسية ، حيث يقوم الجسم بتصنيع عذه الأحماض و لكن بكميات محدودة.
اضافة إلى بناء الخلايا واصلاح الانسجه ، الاحماض الامينيه تشكل مادة البناء الرئيسية للاجسام المضاده لمكافحة غزو البكتريا والفيروسات، و هي تشكل جزءا أساسيا من نظام الانزيمات و الهرمونات؛ وهي تبني البروتينات النووية ، رنا (الحَمْضُ النَّوَوِيِّ الرِّيبِي) و دنا (الحَمْضُ الرِّيْبِيُّ النَّوَوِي المَنْزُوع الأوكسِجين) . كما تقوم الأحماض الأمينية بدور رئيسي بحمل الاوكسجين إلى انحاء الجسم المختلفة ، وهي مكون أساسي للنشاط العضلي .
نظريا يوجد 64 نوع منها، فالدنا تبنى من 4 روامز هي A ، C ، G ، T و تبنى الأحماض عادة بتركيب عدة روامز ، مثل GCA, GCC, GCG . لكن المتوفر في إجسام الكائنات الحية هي أقل من ذلك، ما بين 20 إلى 26 نوع من الأحماض الأمينية. مع ملاحظة أن الكثير منها يتشكل باكثر من ثلاث روامز و قد تصل إلى 6 و البعض منها مكون فقط من رامز واحد.
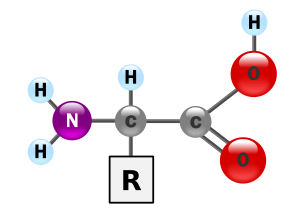
الحمض الأميني هو أحد مركبات عضوية تحمل نوعين من الجذور الكيميائية، وهي جذر أميني (نشادري) [1] و جذر هيدروكسيل متحدتين مع ذرة كربون مرتبطة بدورها بسلسلة عضوية جانبية Side chain تكون مختلفة من حمض أميني إلى آخر. تعتبر الحموض الأمينية وحدة التركيب الأساسية للبروتينات في الكائنات الحية.
ترقم ذرات الكربون عادة بالأحرف الإغريقية، و تنتمي الحموض الأمينية المكونة للبروتينات إلى فئة ألفا α-Amino Acids وذلك لأن جذري الأمين و الهيدروكسيل يرتبطان بذرة الكربون الأولى في السلسلة. وتوجد كذلك حموض أمينية أحيائية من فئة بيتا مثل البيتا-ألانين β-Alanine و أخرى من فئة جاما مثل حمض الجاما-بيتيريك γ-Aminobutyric acid أو GABA. و رغم وجود عدد كبير من الحموض الألفا-الأمينية في الطبيعة إلا أن السلاسل البروتينية لا تحتوي سوى 20 نوعا منها فقط. وتضطلع الحموض الأمينية بمهام أخرى كلعبها دور نواقل عصبية و مواد أولية لبعض الهرمونات أو كمصدر للطاقة. و تتوفر أيضا مجموعة من الحموض الأمينية المخلقة(المصطنعة) كيميائيا و لها عديد الاستعملات في مجال الصناعة الكيميائية و الصيدلية و الغذائية.
البنية الكيميائية العامة
يعتبر هيدروكسي كرباميد Hydroxycarbamide الحمض الأميني الأبسط من حيث التركيب فهو متكون من جذر أميني متصل مباشرة بكربون جذر الهيدروكسيل. وهذا المركب غير أحيائي. أما في بقية الأحماض الأمينية فتدخل ذرة أو أكثر من الكربون بين هذين الجذرين. و يحدد موقع الأمين في السلسلة الكربونية الفئة التي ينتمي اليها الحمض الأميني كما يلي:
- أحماض ألفا-أمينية، حيث يتصل جذر الأمين بالكربون رقم 2 بعد كربون جذر الهيدروكسيل و يرقم بألفا . يسمى المركب بالحمض 2-أمينوايتانويك Aminoethanoic acid، أو ما يعرف بالغليسين Glycine، أبسط الحموض الأمينية لدى الكائنات الحية. أما بقية الأحماض الألفا-أمينية فلها نفس البنية مع اختلاف في السلسلة الجانبية ، فعوضا عن ذرة الهيدروجين المرتبطة بالكربون ألفا في الغليسين، تتخذ أنواع مختلفة، على سبيل المثال، جذر المثيل Methyl في حالة الألانين Alanine أو جذر مختلف الحلقة Heterocyclic بالنسبة للتريبتوفان Tryptophan. والدور الأساسي للأحماض الألفا-أمينية هو بناء مختلف البروتينات.
- أحمض بيتا-أمينية، يرتبط جذر الأمين بالكربون الثالث بداية من كربون جذر الهيدروكسيل ، وأبسط ممثل أحيائي لهذه الفئة هو البيتا-ألانين، يتأتي من تحلل الكارنوسين Carnosine، و يلعب دور ناقل عصبي مثبط للغليسين.
- أحماض جاما-أمينية، يتحد جذر الأمين بالكربون الرابع بعد كربون جذر الهيدروكسيل ، المثال المعروف في هذه الفئة هو حامض الجاما-بيتيريك GABA، وهو كذلك ناقل عصبي مثبط.
Occurrence and functions in biochemistry

Standard amino acids
التماثلية البصرية (التناظر)
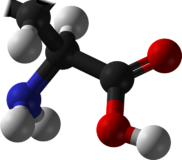
لدى جميع الأحماض الألفا-أمينية، باستثناء الجليسين، يكون الكربون-ألفا مرتبطا بجذور مختلفة و مجموعة جانبية مميزة لذى نقول أنه كايرالي Chiral أو مركز ناشط بصريا. ونتيجة لهذه الخاصية، فان كل حمض ألفا-أميني متواجد في الطبيعة على شكل نظيرتين بصريتين Stereoisomers، يمينية Dextrogyre ويرمز لها، في الكيمياء الحيوية، بـ ، أو يسارية Levogyre ويرمز لها بـ . و معنى ذلك فيزيائيا أنها تقوم بازاحة الضوء المستقطب بزاوية معينة اما باتجاه عقارب الساعة بنسبة للنضيرة ، و هو الاتجاه الموجب (+)، أو ضد اتجاه عقارب الساعة بنسبة للنضيرة ، و هو الاتجاه السالب (-). و بالنسبة لنظام التسمية R / S، الأكثر استعملا في الكيمياء العضوية، فان نفس المبدأ يتبع حسب قاعدة "كان إنجولد بريلوج" فــ = R و = S.
ولا تنطبـق هـذه القـاعدة الا على السيستيـن Cysteine لأن الجذر الكبريتي ليسـت له الأولوية في هذه الحالــة. اذن فالـ -سيستين هو الـ S -سيستين، و الـ -سيستين هو الـ R -سيستين [2].
و في المثال الموجود على النموذج المقابل، نجد الـ -ألانين و كأنه صورة عبر المرآة لالـ -ألانين، وهما مركبان لا يمكن مطابقتهما non-superimposable، تماما كما لا يمكن مطابقة قفى اليد اليمنى مع ظهر اليد اليسرى صورة. ولسبب لا يزال محيرا، فان غالبية الأحماض الألفا-أمينية المكونة للبروتينات هي من النضيرة و ليست . ولكن يمكن أن نجد بعض الـ -أحماض أمينية في أنواع مـن الصدفيات [3] مثل عائلة الكونيدات Conidae، و في الغشاء البيبتدوسكري Peptidoglycan لبعض البكتيريا [4].
تصنيف الأحماض الأمينية
تقسم الأحماض الألفا-أمينية العشرون الموجودة في البروتينات، و المشفرة في المعلومة الوراثية، إلى مجاميع حسب عدد من الخصائص الفيزيائية، الكيميائية و الأحيائية :
- الطبيعة الكيميائيـة للسلسلة الجانبيـة : بما أن المجموعة الجانبية هي التي تحدد هوية الحمض الأميني، يمكن اذن تقسيم الأحماض الأمينية إلى ذات سلسلة هيدروكاربونية، اما أليفاتية Aliphatic أو أروماتية Aromatic أو مختلفة الحلقة Heterocyclic.
- القطبيـة الكهربائيـة : تقسم الأحماض الأمينية حسب قطبيتها الكهربائية، وذلك حسب حالة التأين، إلى قطبية Polar (سالبة أو موجبة الشحنة) أو غير قطبية Nonpolar (عديمة الشحنة). تحدد هذه الخاصية المهمة قابلية الأحماض الأمينية للانحلال في الماء (و الماء هو محلول قطبي)، فتكون الأحماض الأمينية ذات المجاميع الجانبية القطبية متجاذبة مع الماء Hydrophilic، و هي عادة ما تكون على الجزء الخارجي للبروتينات. بينما الأحماض الأمينية ذات السلاسل الجانبية غير القطبية، وغير المتجاذبة مع الماء Hydrophobic، تميل إلى التجمع للداخل.

- القاعديـة \ الحمضيـة : السلسلة الجانبية من الممكن أن تكون قاعدية، مثل حمض الليسين Lysine أو الأرجنين Arginine و هو شديد القاعدية، أو حمضية، مثل الجلوتميت Glutamic acid و الأسبارتيت Aspartic acid، أو متعادلة مثل الجليسين و الليوسين Leucine. وعادة ما تكون الأحماض الأمينية ذات المجاميع الجانبية القاعدية و الحمضية قطبية جدا وهي توجد بصورة كبيرة على سطح البروتينات المماس للماء.
- يمكن ايضا أن نقسم الأحماض الأمينية حسب أهميتها الغذائية و توفرها الأحيائي إلى :
- أحماض أمينية أساسية Essential لا يصنعها الجسم، و يجب تناولها في الغذاء. مثال، الليوسين و الليسين.
- أحماض أمينية شبه-أساسية Semi-essential يستطيع الجسم تخليقها ولكن ليس بكميات كافية، خاصة في مرحلة النمو، و يحبذ أن تتوفر في الغذاء. مثال، الأرجنين و الهستيدين Histidine.
- أحماض أمينية غير أساسية Nonessential متوفرة في الجسم السليم بكميات دائمة، و لا تستلزم حضورها في الغذاء. مثال، الجليسين و البرولين Proline.
قــائمة تصنيف الأحمــاض الألفا-الأمينيـة المكونة للبروتينات[5]
أنظر إلى المقال المفصل التالي قائمة الأحماض الأمينية
| الحمض الأميني | الرمـز (ثلاثة حروف) | الرمـز (حرف واحد) | الكتلة الذرية (غ \ مول) | قطبية السلسلة الجانبية | حمضية أو قاعدية السلسلة الجانبية | الأهمية الغذائية |
|---|---|---|---|---|---|---|
| ألانين Alanine |
Ala |
A |
89,1 |
غير قطبي |
متعـادل |
غير أساسي |
| أرجنين Arginine |
Arg |
R |
174,20 |
قطبي |
قاعـدي (قوي) |
شبه-أساسي |
| أسباراجين Asparagin |
Asn |
N |
132,12 |
قطبي |
متعـادل |
غير أساسي |
| أسبارتيت Aspartic acid |
Asp |
D |
133,10 |
قطبي |
حمضـي |
غير أساسي |
| سيستين Cysteine |
Cys |
C (م) |
121,16 |
قطبي |
متعـادل |
غير أساسي (م م) |
| جلوتامين Glutamin |
Gln |
Q |
146,15 |
قطبي |
متعـادل |
غير أساسي |
| جلوتاميت Glutamic acid |
Glu |
E |
147,13 |
قطبي |
حمضـي |
غير أساسي |
| جليسين Glycine |
Gly |
G |
75,07 |
غير قطبي |
متعـادل |
غير أساسي |
| هيستدين Histidine |
His |
H |
155,16 |
قطبي |
قاعـدي (ضعيف) |
شبه-أساسي |
| ايزوليوسين Isoleucine |
Ile |
I |
131,17 |
غير قطبي |
متعـادل |
أساسـي |
| ليوسين Leucine |
Leu |
L |
131,17 |
غير قطبي |
متعـادل |
أساسـي |
| ليسين Lysine |
Lys |
K |
146,19 |
قطبي |
قاعـدي |
أساسـي |
| ميثايونين Methionine |
Met |
M |
149,21 |
غير قطبي |
متعـادل |
أساسـي |
| فينيلألانين Phenylalanine |
Phe |
F |
165,19 |
غير قطبي |
متعـادل |
أساسـي |
| برولين Proline |
Pro |
P |
115,13 |
غير قطبي |
متعـادل |
غير أساسي |
| سيرين Serine |
Ser |
S |
105,09 |
قطبي |
متعـادل |
غير أساسي |
| ثريونين Threonine |
Thr |
T |
119,12 |
قطبي |
متعـادل |
أساسـي |
| تريبتوفان Tryptophan |
Trp |
W |
204,23 |
قطبي |
متعـادل |
أساسـي |
| تيروسين Tyrosin |
Tyr |
Y |
181,19 |
قطبي |
متعـادل |
غير أساسي (م م) |
| فالين Valine |
Val |
V |
117,15 |
غير قطبي |
متعـادل |
أساسـي |
(م) رمز السيستين C يمكن أن يكتب أيضا S-HC، اذا كان الجذر الكبريتي (-HS) حرا أو S-SC، اذا كان هذا الجذر مرتبطا بجذر كبريتي لسيستين أخرى في السلسلة البيبتيدية. و تختلف الخاصيات أيضا في هذه الحالة، فالسيستين المرتبطة تصير غير قطبية.
(م م) هذه الأحماض الأمينية تصير أساسية في مراحل النمو الأولى و عند الأطفال.
أنواعها
تقسم الحموض الأمينية إلى زمرتين هما الحموض الأمينية اللادورية acycliques والحموض الأمينية الدورية cyclique.
ـ الحموض الأمينية اللادورية: تقسم هذه الحموض بدورها إلى قسمين هما: الحموض الأمينية الصرفة purs والحموض الأمينية المختلطة mixtes.
أ - الحموض الأمينية الصرفة: تشمل هذه الحموض الزمر الآتية:
1) حموض وحيدة الحمض وحيدة الأمين، وأهمها الغليكوكول - اللوسين - النولوسين - الفالين - ألألانين.
2) حموض وحيدة الحمض ثنائية الأمين، وأهما الأورنيتين والليزين.
3) حموض ثنائية الحمض وحيدة الأمين، وأهمها حمض الأسبارتيك، وحمض الغلوتاميك.
ب - الحموض الأمينية المختلطة: تشمل هذه الحموض الزمر الآتية:
1) حموض أمينية ذات نواة بولة (urée) وأهمها السيتْرولين.
2) حموض أمينية ذات نواة غوانيدين وأهمها الأرْجنيني.
3) حموض أمينية غولية وأهمها السِّيرين (Serine).
4) حموض أمينية كبريتية وأهمها السيستين والسيستئين والمتْيونين.
ـ الحموض الأمينية الدورية: تشمل هذه الفئة من الحموض الأمينة الزمر الثلاث الآتية:
1) الحموض الأمينية العطرية وأهمها الفينيل ألانين والتيروزين.
2) الحموض الأمينية الدورية اليودية وأهمها التيروكسين.
3) الحموض الأمينية اللامتجانسة وهي إما ذات نواة بيرول وأهمها البرولين والأوكسي برولين أو ذات نواة إيمينازول وأهمها الهيْستيدين، أو ذات نواة أندول وأهمها التِربْتوفان.
الصفات الفيزيائية
هي مواد مبلورة بيضاء ذوابة في الماء (باستثناء السيستين والتيروزين) وغير ذوابة في الغول (باستثناء السيستين والبرولين والأوكسي برولين)، كما أنها قليلة الانحلال في معظم المذيبات العضوية، وتنحل في محاليل الحموض والقلويات، وتؤثر الحموض الأمينية في الضوء المستقطب، فيحرفه بعضها إلى اليمين وبعضها الآخر إلى اليسار باستثناء الغليكوكول فإنه لا يؤثر في الضوء المستقطب لعدم احتوائه على كربون غير متناظر.
الحموض الأمينية من الأجسام المتحللة بالكهرباء المذبذبة Amphotére إذا أنها تحوي مجموعات حمضية وأخرى قلوية وبالتالي فهي تتمتع بصفات حمضية وبصفات قلوية في آن واحد، وتتأين في بيئة قلوية كتشرد الحمض.
وتتشرد في بيئة حمضية كتشرد القلوي:
وعلى هذا فإن الحموض الأمينية يمكن أن تتحد مع الحموض بوظيفتها الأمينية ومع القلويات بوظيفتها الحمضية وذلك بحسب (pH) البيئة. وفي درجة معينة من (pH) وهي المسماة نقطة تساوي التكهرب point isoéléctrique ويرمز إليها بـ (pHi) يكون تشرد الوظيفة الحمضية معادلاً لتشرد الوظيفة الأمينية، وبالتالي تكون الشحنة الكهربائية للحمض الأميني معدومة، فلا يبدي الحمض الأميني حينئذ صفات حمضية ولا صفات قلوية، ويعدّ عندها شاردة مختلطة من الشكل +H3N ― CHR ― COO وعلى هذا إذا وضعت الحموض الأمينية في وسط أشد قلوية من نقطة تساوي تكهربها فإنها تبدو كحموض، وإذا وضعت في وسط أشد حموضة من نقطة تكهربها فإنها تبدو كقلويات.
وتتجه محاليل الحموض الأمينية بتأثير التيار الكهربائي إما إلى المصعد أو إلى المهبط، ففي وسط ذي (pH) أدنى من نقطة تساوي التكهرب تعطي شاردة موجبة
تتجه نحو المهبط، وفي وسـط ذي (pH) أعلى من نقطة تسـاوي التكهرب تعطي شـاردة سالبة
تتجه نحو المصعد. وفيما يلي نقطة تساوي التكهرب لبعض الحموض الأمينية:
غليسين
6.10هيستيدين
7.59
تيروزين
5.66 حمض الأسبارتيك
2.77
أرجنيين
10.7 الغلوتاميك
3.22
الخواص الكيميائية
تكون الرابط البيبتيدي
الرابط البيبتيدي : وهي الاصرة التي تتشكل بين جزيئتين عندما تتفاعل مجموعة الكربوكسيل للجزيئة الاولى مع مجموعة الامينو للجزيئة الثانية محررة جزيئة الماء (H2O) ويدعى هذا التفاعل بالتآلف الجاف وكذلك يسمى (تفاعل التكثيف) ويحدث بين الاحماض الامينية. أن الآصرة الناتجة من هذا التفاعل وهي CO-NH تسمى الاصرة البيبتيدية وتدعى الجزيئة الناتجة بالأميد ، وألاميدات مركبات عضوية تحتوي مجموعة وظيفية تدعى الاميد وهي عبارة عن زمرة كربونيل متصلة بزمرة أمين.
الخاصيات الأيونية و القطبية الكهربائية
يُعزى قسم من الخواص الكيماوية للحموض الأمينية إلى احتوائها على الوظيفة الحمضية في حين يعزى قسم آخر منها إلى احتوائها على الوظيفة الأمينية.
1- الخواص الكيمياوية الناتجة من وجود الوظيفة الحمضية: إن أهم هذه الخواص هي الآتية: أ - تتحد الحموض الأمينية مع القلويات فتكوّن أملاحاً:
ب - تتحد مع الأغوال فتكون أثيرات ملحية (أي إسترات):
جـ - تتحول الوظيفة الحمضية في الحموض الأمينية بالإرجاع إلى وظيفة غولية:
د - إذا سُخّنت مع الباريت المركز فإنها تتحول إلى أمينات وينفصل الكربوكسيل:
ويحدث هذا التفاعل في العضوية بتأثير الخمائر فيؤدي إلى تكوّن مركبات ذات فعالية فيزيولوجية كبيرة (تحول الهيستيْدين على هيستامين) كما أن جراثيم المعى تفصل الكربوكسيل من الحموض الأمينية.
2- الخواص الكيمياوية الناتجة عن وجود الوظيفة الأمينية: إن أهم هذه الخواص هي الآتية:
أ - تتحد الحموض الأمينية مع الحموض فتكوِّن أملاحاً:
ب - تتحد الحموض الأمينية بوظيفتها الأمينية مع جذر كربوكسيل فتكوِّن مركبات أميدية، وحينما يكون كلّ من الجسمين المتفاعلين من الحموض الأمينية فإن المركب الناتج يدعى ببتيد peptide:
جـ - تتفاعل الحموض الأمينية مع الألدئيدات فتكوّن إيمينات يطلق عليها اسم أساس شيف Base de Schiff
وإذا كان الألدئيد المستعمل هو الفورمول فإن التفاعل يصبح على الشكل الآتي:
ويلاحظ أن الوظيفة الأمينية في المركب الناتج قد طُوِّقت بتأثير الفورمول وأن الجسم الناتج يمكن معايرته بمحلول قلوي معايَرٍ بوجود فنولفتالئين، وهذا هو أساس معايرة الحموض على خطة سورنْزِن Sorenen.
د - إذا أُكسدت الحموض الأمينية بحمض الآزوتي (NO2H) فإنها تتحول إلى حموض غولية وينطلق الآزوت:
ويمكن معايرة الآزوت الناتج بقياس حجمه، وبالتالي يمكن استنتاج معادلة من الحمض الأميني؛ وهذا هو أساس خطة فان سلايك Van Slyke لمعايرة الحموض الأمينية.
وللحموض الأمينية كاشف ملون هام هو النينهيدرين Ninhydrine يُعتمد عليه في كشفها ومعيرتها وذلك استناداً إلى اللون الأزرق الذي تبديه هذه الحموض مع الكاشف المذكور.[6]
التفاعلات الكيميائية
1- الخواص الامينية للحوامض الامينية: بالنظر لاحتواء الحوامض الامينية على مجموعتين الأمين والكاربوكسيل لذا فأنها تعتبر ثنائية القطب اى تعمل كحامض أو كقاعدة وتسمى امفوتيرية أي تفقد وتكتسب بروتون لهذا فانها اذا وضعت في محاليل حامضية قوية PH = 1 تتقبل بروتون وتشحن (+) واذا وضعت في محاليل قاعدية قوية تفقد بروتون وتنشحن (-) اما في نقطة التعادل الكهربائي (Pl-) هي النقطة التي تتساوى فيها عدد (+) مع (-) وتكون PH معينة لكل حامض أميني كالاتي: أ- الحوامض الأمينية المتعادلة:- محصلة الشحنة = صفر P1=PH= (5-6.3) ب- القاعدية: محصلة الشحنة = صفر P1 = PH = (7.6-10.8) ج- الحامضية محلصة الشحنة = صفر P1 = PH = (2.97-3.2)
2- نزع الكربوكسيل تجرد الحامض الاميني من مجموعة الكاربوكسيل Decarboxylation عند تجريد المجموعة الكاربوكسيلية من الحوامض الأمينية فأنها تتحول إلى الأمينات الأولية وذلك بمساعدة الأنزيمات من نوع Decarboxylation
3- نزع الأمين تجريد الموجوعة الأمينية Deamination عند تجريد الحوامض الأمينية من مجموعة الأمين تتحول إلى حوامض كاربوكسيلية وأمونيا والحوامض الكاربوكسيلية تتمثل في الجسم إلى مركبات تستفاد منها الخلية أما الامونيا فأنها تطرح في البول على شكل يوريا بواسطة دورة تسمى بدورة اليوريا والتي تحدث في الكبد وذلك بتخليص الجسم من النتروجين او من الامونيا السادة
4 - نقل الأمين تفاعل نقل مجموعة الامين Transmination ويتم في هذا التفاعل انتزاع مجموعة الامين بواسطة الاكسدة ونقلها من مركب إلى أخر من المركبات المتفاعلة، يتم هذا التفاعل بمساعدة انزيمات (Transminase) حيث تتحول الحوامض الأمينية إلى حوامض كيتونية والتي بدروها تتحول إلى مشتقات كاربوهيداتية تستفاد منها الخلية
5- نترزة التفاعل مع حامض النتروز يستعمل هذا التفاعل لغرض قياس كمية الحامض الاميني في محلول معين حيث يتفاعل حامض النتروز مع الحامض الاميني محرراً النتروجين الذي يكمل جمعه وحساب حجمه يمكن تصنيف كمية الحامض الاميني
6- التفاعل: Nihydrin Nihydrin: مادة مؤكسدة قوية تتفاعل مع الحوامض الأمينية لتعطي مركب أزرق اللون يعتمد هذا التفاعل على وجود مجموعتي الأمين والكاربوكسيل بشكر حر وهذا التفاعل يكون حساس لكشف عن المركبات قليلة من الحوامض الامينية
7- تفاعل سانكر Sanger يستعمل هذا التفاعل لتشخيص الحامض الأميني الموجود في بداية السلسلة الببتيدية (النهاية النتروجينية) يستعل كاشف (D.VFB) 2,4- Dinitre fluro Benzen حيث يتفاعل هذا المركب مع الحامض الأميني الأول في نهاية النتروجينية من السلسلة الببتيدية مكونا مركب أصفر اللون حيث يشخص الحامض الأميني المرتبط به بواسطة Chromatogralply في هذا التفاعل تتحرر الاحماض الامينية من السلسلة الببتيدية بشكل حر ويعتبر هذا التفاعل مدمراً للسلسلة الببتيدية وذلك بتحرير الحوامض الأمينية بشكل حر.
8- تفاعل إيدمان Edman reaction
يستعمل هذا التفاعل لمعرفة تتابع (Sequence ) في السلسلة الببتيدية ويعتبر هذا التفاعل مهم لأنه يحطم السلسلة الببتيدية ويمكن تكراره مع السلسلة الناتجة لحد عشرين حامض أميني أو أكثر يستعمل في هذا التفاعل الكاشف Phenyl iso thioCyngtac.
الخواص العامة للأحماض الأمينية
كاربونات تنائية القطب الحوامض الأمينية مركبات مشابهة للأملاح مثل الاملاح كلها مركبات صلبة ذات درجة انصهار عالية لدرجة انها تحترق بصورة عامة قبل تحولها إلى الحالة المنصهرة انها مركبات غير ذائبة في المذيبات الغير المستقطبة وتذوب في الماء.
امتصاص واستخدامات الأحماض الامينية
تتنتقل الحوامض الأمينية، وهي نواتج النهائية لهضم البروتين تنتقل بسرعة من خلال جدران الامعاء الدقيقة كما تمتص ايضا الببتيدات البسيطة وصغيرة جداً. تستعمل الحوامض الأمينية المنفردة في واحدة من الطرق الاتية: 1- لتصنيع نسيج بروتيني جديد، او لترنيم نسيج قديم أو للاحلال محل بروتينات سوائل الجسم المتحطمة. 2- لتصنيع مركبات غير بروتينية تحتوي على نتروجين مثل الحوامض النووية الهيم (heme) او الكريانين (Creatine) 3- لتوفير الطاقة الكيميائية والتعرض للهدم. اذ قد تدخل المركبات الوسيطة الناتجة من هدم الحوامض الامينية في دورة حامض النتريك او يمكن استعمالها لتصنيع الكلوكوز الحوامض الشحمية التي يمكن خزنها في النسيج الدهني. اما المركبات الرئيسية الناتجة عن هدم الكامل للحوامض الامينية فما هي الا ثنائي اوكسيد الكاربون والماء واليوريا.
مصادر الأحماض الامينية
طبيعية
أن وجود الاحماض الامينية في الجسم يأتي من مصدرين هما: 1- الجزء الأكبر من الاحماض الأمينية ناجم عن البروتين الغذائي.
2- من تعويض بروتينات الجسم بغدة endogrnous من خلال الجوع وسوء التغذية.
صناعية
تعد الأحماض الأمينية هي المركبات الرئيسية لجميع الكائنات الحية. اذ يتم انتاجها بكميات كبيرة بواسطة التقنية الحيوية باستخدام عمليات التخمير والتحول الحيوي. وقد سيطرت عدة شركات يابانية على أسواق العالم من خلال انتاجها الوفير من الأحماض الأمينية. وقد استخدمت هذه الشركات نظم التخمير التي يجرى من خلالها استنبات البكتريا أو الفطريات، والتي يتم الاختيار منها لانتاج أحماض أمينية معينة بكميات كبيرة والتي تفرز داخل وسط التخمير. وعند جمع الوسط والتخلص من المركبات الأخرى، يتم الحصول على الأحماض الأمينية بكميات قد تصل إلى المئات أو آلاف الأطنان في العام.[7]
وتشتمل الأحماض الأمينية التي تنتج تجاريا على :
1 – حمض گلوتاميني: وهو الحمض الأميني الذي يتم انتاجه بكميات كبيرة فضلا عن أي حمض آخر ، لأنه يستعمل بكثرة كجلوتاميت صوديوم أحادي MSG في صناعة الغذاء، ويكسب الطعام نكهته المميزة. ويستخدم في بلدان الشرق الأقصى كتابل للمائدة.
2 – لايسين: وهو الحمض الأميني الثاني الذي تنتج منه كميات وفيرة، ويستخدم كعليقة اضافية لغذاء الحيوان (الذي يكون في الغالب به نقص جوهري في الأحماض الأمينية الأساسية. وعلى وجه الخصوص اللايسين).
3 – سيستين: الميثيونين، ويحتوي هذان الحمضان الأمينيان على عنصر الكبريت، ويستخدمان أيضا كعلائق اضافية لغذاء الحيوان.
4 – فنيلالانين: بالاضافة إلى استخدامه بكميات قليلة كعليقة اضافية لغذاء الحيوان، فان الفنيلالانين يعتبر أهم المكونات الكيميائية الغالية في صناعة Aspartame.
5 – تريبتوفان: أثار ذلك الحمض ضجة اعلامية كبيرة عندما أنتج في عام 1990 عن طريق الهندسة الوراثية الجديدة لميكروب المسيلة Bacillus amyloluquefaciens والذي قام بتصنيعه Denko K. وكانت هذه المادة مرتبطة بمرض اعتلال جسدي نادر يسمى بمجموعة أعراض الوهن الذلي المحب الأيوسينيٍٍ EMS، وقد تعالت الأصوات وكثرت الادعاءات التي تثبت أن الهندسة الوراثية غير محمودة العواقب.وفي حقيقة الأمر فان المشكلة كانت ترجع إلى أن هناك مركبا كيميائيا تولد أثناء عمليات التنقية، وليست له علاقة تذكر بدنا المعالج.
وهناك العديد من الأحماض الأمينية التي لا تستطيع أجسامنا صنعها بنفسها (وهي الأحماض الأمينية التي من أصل حيواني)، وبالتالي يجب أن نتناولها في وجباتنا الغذائية. ويجري صنعها أيضا بكميات كبيرة من أجل الاستهلاك الآدمي، أو الاستهلاك الحيواني. ويوجد هناك 15 حمضا أمينيا طبيعيا آخر – وتوجد هذه الأحماض في البروتينات – ويتم انتاجها بواسطة عملية التخمير بكميات بقدر بآلاف الأطنان.والأحماض الأمينية الأخرى التي لا توجد في البروتينات، وخصوصا من نوع D-isomers يتم صنعها عن طريق عمليات التحول الحيوي كمواد كيميائية وسيطة. وتستخدم عمليات التحول الحيوي لهذه المواد، لأنها لا توجد في الطبيعة أو توجد بكميات ضئيلة، وعلى سبيل المثال فإن D-isomers acids يتم استخدامه في تصنيع المضادات الحيوية. وتعتبر D-amino acids هي تلك الأحماض التي لها أيدية Handedness مخالفة للأحماض الأمينية الطبيعية.
تحضيرها
تحضر الحموض الأمينية بمعالجة المشتقات الهالوجينية للحموض العضوية بالنشادر:
ويمكن تحضيرها أيضاً بإرجاع الحموض الخلّونية في بيئة نشادر:
المصادر
- ^ باستثناء وحيد و هو البرولين لأن جذره الأميني يرتبط بالسلسلة الجانبية في شكل حلقة.
- ^ ينبغي عدم الخلط بين و هي المجموعة الجانبية و R وهو تسمية للنضيرة البصرية اليمينية.
- ^ Pisarewicz K, Mora D, Pflueger F, Fields G, Marí F (2005). "Polypeptide chains containing D-gamma-hydroxyvaline". J Am Chem Soc. 127 (17): 6207–15. PMID 15853325.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ van Heijenoort J (2001). "Formation of the glycan chains in the synthesis of bacterial peptidoglycan". Glycobiology. 11 (3): 25R–36R. PMID 11320055.
- ^ Nelson, David L. (2000). Lehninger Principles of Biochemistry (3rd ed ed.). Worth Publishers. ISBN 1-57259-153-6.
{{cite book}}:|edition=has extra text (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - ^ راتب محملجي. "الحموض الأمينية". الموسوعة العربية.
- ^ قالب:معجم التكنولوجيا الحيوية
- الظفر، سامي عبد المهدي، الكيمياء الحياتية
- النحفي، طلال سعيد، الكيمياء الحياتية "جامعة الموصل – كلية العلوم 1987
- المظفر، سامي عبد المهدي، رياض رشيد سلمان "الكيمياء الحياتية (دار الكتب الطباعة – النشر" جامعة بغداد، كلية التربية 1984
- باسل كمال "البروتينات" جامعة الموصل كلية الزراعة.
- Roger, L; DeKock, Harry, B. gray "chemical structure and bonding" 1980
ترجمة: زكوم، مهدي ناجي، جماعة البصرة (1983).
- مقدمات في كيمياء الحياة، ترجمة الدكتور احمد سلمان الجنابي.
- أسس الكيمياء العامة والعضوية والحياتية/ تأليف. جون ر.هرار ترجمة الدكتور عبد ناجي.
- هربت ما يسليش/ تاليف هوارد بنجامكين/ جاكوب شارفكين
- رسالة ماجستير/ للطالب مؤيد عبد الحسن، تحضير وتشخيص معقدات بعض الايونات الانثانات مع حامض الانثرانيك والحامض الأميني الفنيل الأمين (2003)
- هابر "الكيمياء الحيوية" ترجمة وأشراف أ.د. رويدة أبو سمرة د. نزار حمود / د. عماد أبو علي.
وصلات خارجية
- List of Standard Amino Acids The Detailed PDF List of Standard Amino Acids (including 3D depictions)
- Nomenclature and Symbolism for Amino Acids and Peptides IUPAC-IUB Joint Commission on Biochemical Nomenclature (JCBN)
- Molecular Expressions: The Amino Acid Collection - Has detailed information and microscopy photographs of each amino acid.
- Amino acid properties - Properties of the amino acids (a tool aimed mostly at molecular geneticists trying to understand the meaning of mutations)
- Synthesis of Amino Acids and Derivatives
- Learn the 20 proteinogenic amino acids online