أكسيد الرصاص الثنائي

| |
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Lead(II) oxide
| |
| أسماء أخرى | |
| المُعرِّفات | |
| رقم CAS | |
| ECHA InfoCard | 100.013.880 |
| رقم RTECS |
|
| UN number | 3288 |
CompTox Dashboard (EPA)
|
|
| الخصائص | |
| الصيغة الجزيئية | PbO |
| كتلة مولية | 223.20 g/mol |
| المظهر | red or yellow solid |
| الكثافة | 9.64 g/cm3 [1] |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | insoluble |
| قابلية الذوبان | insoluble in alkalis soluble in HCl |
| البنية | |
| البنية البلورية | tetragonal, tP4 |
| الزمرة الفراغية | P4/nmm, No. 129 |
| المخاطر | |
تبويب الاتحاد الاوروپي (DSD)
|
Repr. Cat. 1/3 Harmful (Xn) Dangerous for the environment (N) |
| توصيف المخاطر | R61, R20/22, R33, R62, R50/53 |
| تحذيرات وقائية | S53, S45, S60, S61 |
| نقطة الوميض | Non-flammable |
| مركبات ذا علاقة | |
أنيونات أخرى
|
كبريتيد الرصاص سيلينيد الرصاص تيلوريد الرصاص |
كاتيونات أخرى
|
أول أكسيد الكربون أول أكسيد السيليكون أكسيد ثاني الجرمانيوم ثاني أكسيد القصدير |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
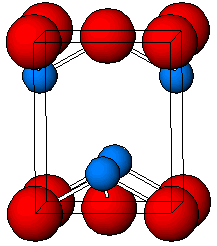
أكسيد الرصاص الثنائي مركب كيميائي له الصيغة PbO ، ويكون على شكل بلورات حمراء أو صفراء وذلك حسب البنية البلورية .
الخواص
بنية أكسيد الرصاص الثنائي الأحمر لها بنية رباعية tetragonal وتعرف تحت اسم مرتك [2] Litharge أو المُرداسَنج [3]، والأخير ذكره الخوارزمي في كتابه مفاتيح العلوم (الأسرب هو الرصاص).
بتسخين المركب إلى درجة حرارة تبلغ 488° س [4] تتغير البنية ويحدث تحول في الشكل البنيوي إلى النظام البلوري المعيني المستقيم orthorhombic ويكون الناتج ذو لون أصفر يعرف باسم ماسيكوت Massicot .
يحدث هذا التحول بشكل بطيء عند درجات حرارة منخفضة لذلك فإن الشكل شبه شبه المستقر من أكسيد الرصاص الثنائي هو الشكل الأصفر.
يتفاعل أكسيد الرصاص الثنائي مع الأكسجين عند درجة حرارة تتراوح عند 500°س حيث يحصل تفاعل ضم مشكلاً رابع أكسيد الرصاص (أحمر الرصاص).
- 3PbO + 1/2 O2 → Pb3O4
تجدر الإشارة إلى ضرورة إبقاء درجة الحرارة تحت 550°س، وإلا تفكك المركب الناتج إلى مكوناته.
التحضير
يحضر أكسيد الرصاص الثنائي من أكسدة فلز الرصاص المصهور عند حوالي 600°س .
- 2Pb + O2 → 2PbO
يحضر المركب بأسلوب آخر، وذلك بالتفكك الحراري لمركب نترات الرصاص الثنائي أو كربونات الرصاص
- 2Pb(NO3)2 → 2PbO + 4NO2 + O2
- PbCO3 → PbO + CO2
كما ينتج من تفاعل هيدروكسيد الرصاص مع هيدروكسيد الصوديوم.
الاستخدامات
- سابقاً كان يستعمل كخضاب وحالياً يستعمل لتحضير مركبات الرصاص الأخرى.
- يدخل مركب أكسيد الرصاص الثنائي ضمن المركبات المستعملة في فلكنة المطاط.
- يدخل أكسيد الرصاص الثنائي في بعض تفاعلات التكاثف في الاصطناع العضوي [5].
السلامة
مركبات الرصاص سامة يجب الحذر عند التعامل معها.
القضايا الصحية
المصادر
- Taschenbuch chemische Substanzen, Willmes, Verlag Harri
Deutsch, ISBN 3-8171-1662-4
وصلات خارجية
- Case Studies in Environmental Medicine - Lead Toxicity
- ToxFAQs: Lead
- National Pollutant Inventory - Lead and Lead Compounds Fact Sheet
- Webelements PbO
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
- ^ مجمع اللغة العربية في القاهرة
- ^ http://alhibr1.com/arabic_lissan.php?qamous=%D9%85%D8%B1%D8%AA%D9%83
- ^ Holleman, Wiberg: Lehrbuch der anorganischen Chemie, 1985
- ^ “1,4-Diphenylbutadiene” Corson, B. B. Organic Syntheses, Coll. Vol. 2, p.229 (1943). http://www.orgsyn.org/orgsyn/pdfs/CV2P0229.pdf.

