تبخر

التبخر (إنگليزية: evaporation) هو عملية فيزيائية يحدث فيها تحول جزيئات المادة من الحالة السائلة إل الحالة الغازية بفعل الحرارة. وهو عكس عملية التكثف.
ويحدث في كل درجة حرارة ممكنة. ويمكن أن يتم التبخر في الخلاء أو بوجود غاز يعلو السائل؛ ويكون التبخر في الخلاء سريعاً وصاخباً ويصيب داخل السائل؛ أما إذا كان يعلو السائل غاز يؤثر فيه بضغطٍ كافٍ فإن التبخر يكون بطيئاً ولا يصيب إلا سطح السائل. وفي كلتا الحالتين، إذا كان الحجم المتاح للبخار محدوداً، يتوقف التبخر عندما يبلغ ضغط البخار فوق السائل قيمة عظمى، ويوصف هذا الضغط الأعظمي بأنه ضغط بخار السائل الإشباعي ضش، وهو يختلف باختلاف طبيعة السائل ولا يتوقف في حالة السائل الواحد النقي إلا على درجة حرارته ويزداد بازديادها.
أما إذا كان الجو الغازي غير محدود أو متجدداً، فتتوقف سرعة التبخر على عوامل عديدة منها طبيعة السائل ودرجة حرارته والضغط الواقع عليه من جميع الغازات (ض) والضغط الجزئي ضف الناتج عن بخاره فقط. وقد وجد دلتون Dalton أن هذه السرعة سر تتناسب طرداً مع الفرق بين الضغط ضش وضف لبخار السائل في جو الغاز الخليط، كما تتناسب هذه السرعة عكساً مع ضغط الغاز الكلي، أي: image: 1631-2.jpg حيث يدل ب على معامل يتعلق بسرعة تجدد الغاز فوق السائل وهو يزداد بازديادها.
النظرية
توازن تبخري
where P1, P2 are the vapor pressures at temperatures T1, T2 respectively, ΔHvap is the enthalpy of vaporization, and R is the universal gas constant. The rate of evaporation in an open system is related to the vapor pressure found in a closed system. If a liquid is heated, when the vapor pressure reaches the ambient pressure the liquid will boil.
تقضي النظرية الجزيئية بأن السائل يتألف من جزيئات molecules دائمة الحركة بسرعات تزداد بازدياد درجة حرارته، وينجم تبخر السائل عن أن جزيئاته الأكثر سرعة تفلح في التخلص من جذب جزيئات السائل الأخرى عند سطحه فتنفلت من هذا السطح متحولة إلى بخار، ولكن بعضها ما يلبث أن يصطدم بسطح السائل فيعود إلى حالة السيولة، وفي الوقت نفسه تترك بعض الجزيئات السائل وتتحول إلى بخار. وما دام البخار فوق السائل غير مشبع فإن عدد جزيئات السائل التي تفلت من السطح في واحدة الزمن وتصير بخاراً يكون أكبر من عدد جزيئات البخار التي تتحول إلى سائل في الزمن نفسه، فتزداد بذلك كثافة البخار ويزداد ضغطه ويستمر هذا الازدياد إلى أن يساوي عددُ جزيئات البخار المتحولة إلى سائل في واحدة الزمن عددَ جزيئات السائل المتحولة إلى بخار في الزمن نفسه فتبلغ كثافة البخار حينئذ أقصى حد ممكن لها في درجة حرارته، ويقال عندئذ إن البخار صار مشبعاً وأنه في حالة توازن تحريكي مع سائله. ويختلف هذا البخار المشبع مع سائله عن الغاز في أن تكبير حجم أو تصغيره لا يؤثر، مادام مشبعاً، في كثافته أو ضغطه إذا بقيت درجة حرارته ثابتة، أي أنه لا يخضع لقانون بويل ـ ماريوط. أما إذا حدث التبخر في الهواء الطلق كأن يوضع صحن ملئ بالماء مثلاً في غرفة مفتوحة، فإن من الراجح ألا تعود الجزيئات البخارية إلى السائل وتتكاثف إذا لم يكن جو الغرفة مشبعاً، ويكون عدد الجزيئات المتحولة إلى بخار أكبر بكثير من تلك التي تعود لتتكاثف، ويستمر التبخر في هذه الحالة إلى أن يتبخر الماء كلّه.
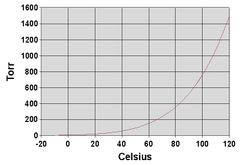
تغير الضغط الإشباعي للبخار بتغير درجة الحرارة حين تزداد درجة الحرارة يزداد الضغط الأعظمي للبخار ببطء في البداية ثم يتسارع ازدياده، وكلما كان السائل أكثر تطايراً كان تسارع ازدياد ضغطه أكبر. ويبين الشكل المظهر العام لتغير ضغط البخار الإشباعي ض بتغير درجة الحرارة دْ؛ ويمثل المنحني أب تغير ضغط بخار الجسم الصلب، في حين يمثل المنحني ب جـ تغير ضغط بخار الجسم السائل، وهو ينتهي عند النقطة جـ التي تسمى درجة الحرارة الموافقة لها الدرجة الحرجة للجسم السائل، وتعرَّف بأنه من المستحيل تمييع البخار أو الغاز في درجة حرارة أعلى منها مهما كان الضغط المطبق عليه. وتصبح الخواص الفيزيائية للسائل وبخاره واحدة فيما بعد الدرجة الحرجة.
ويكون الضغطان الأعظميان لبخار الجسم الصلب وبخار الجسم السائل متساويين عند النقطة ب المسماة النقطة الثلاثية إذ يحدث عندها توازن بين حالات أو أطوار الجسم الثلاث: الصلبة والسائلة والغازية. ويَقْسِمْ منحني توازن السائل مع بخاره مستوى الشكل إلى منطقتين توافق المنطقة العليا حالات مستقرة للسائل وحده، في حين توافق السفلى حالات مستقرة لبخارٍ ليس على تماس مع سائله وذي ضغوط أقل من ضغط البخار المشبع، ويوصف بخار كهذا بأنه جاف وتكون خواصه كخواص الغاز يخضع بتقريب أولي إلى قانون بويل ـ ماريوط، وحين يكون ضغط البخار بعيداً جداً عن ضغط الإشباع لا يعود هناك فرق بينه وبين الغاز. وللانتقال من حالة البخار إلى الحالة السائلة يجب إما إنقاص درجة الحرارة تحت ضغط ثابت أو زيادة الضغط في درجة حرارة ثابتة. ويمكن كذلك ملاحظة توازنات شبه مستقرة بين السائل وبخاره فيما بين النقطة الثلاثية والنقطة الحرجة تكون ناجمة عن تأخر في تكاثف البخار، وفيها يكون السائل موجوداً مع بخاره الذي يسمى فوق المشبع supersaturated، ويكون ضغطه أكبر من ضغط البخار المتوازن توازناً مستقراً في درجة الحرارة المعتبرة. هذا ويمكن العبور من إحدى المنطقتين إلى الأخرى دون المرور بوضع يتوازن فيه السائل مع بخاره وذلك بالالتفاف من علٍ حول النقطة الحرجة جـ. صيغ رياضية للدالة ض = تا(د) إن للعلاقة بين الضغط الأعظمي لبخار السائل ودرجة حرارته أهمية كبيرة في حالة الماء، والصيغة التجريبية هي: image:1631-3.jpg
حيث ض هو الضغط الأعظمي لبخار الماء مقدراً بالكيلو غرام/سم2 (أي بالضغط الجوي تقريباً) وحيث د: درجة الحرارة المئوية (سلزيوس). وتصح هذه العلاقة بارتياب نسبي صغير (آحاد في المئة) من أجل درجات الحرارة ما بين 100ْس و200ْس. وتعود الأهمية الأساسية لهذه الصيغة إلى سهولة تطبيقها. وهناك صيغ أخرى عامة تستند إلى اعتبارات نظرية منها: image:1631-4
حيث د: درجة الحرارة المطلقة، أ، ب ثابتان يتوقفان على طبيعة السائل ومنها: image:1631-5
حيث α وß وγ ثوابت تتوقف كذلك على طبيعة السائل. وكلا الصيغتين تُستنتجان من معادلة كلابيرون Clapeyron: image:1631-6
حيث حس: الحجم النوعي للسائل؛ حب: الحجم النوعي لبخاره و خ: حرارة استبخار السائل في الدرجة المطلقة د . (الحجم النوعي لمادة هو حجم واحدة الكتل منها) وتزداد الدقة في الصيغتين (2) و(1) كلما ابتعدت درجة الحرارة د عن النقطة الحرجة.
حرارة الاستبخار
إن تحول الجسم السائل إلى بخار يصحبه دائماً امتصاص كمية من الحرارة تنطلق من هذا البخار حين يتحول إلى سائل مرة أخرى؛ وتسمى هذه الحرارة بحرارة استبخار السائل، وهي تتوقف على نوع السائل وعلى درجة الحرارة التي استبخر فيها؛ فإذا لم يأخذ السائل المتبخر الكمية من الحرارة اللازمة لاستبخاره من منبع حراري أخذها من السائل المستبخر نفسه ومن الأجسام الملامسة له. ففي هذه الحالة تكون عملية التبخر إذن عملية تبريد في الوقت نفسه، وتزداد شدتها بازدياد سرعة التبخر. والأمثلة على التبريد الناجم عن التبخر كثيرة لا تُحصى كالبرودة الناجمة عن تبخر بعض المواد الشديدة التطاير كالإيتر والكحول وتبخر الماء على سطوح الجرار وعن جسم الإنسان ولاسيما عندما تكون الأجسام المبلولة عرضة لتيار من الهواء الجاف. ويستفاد من التبريد المصحوب بالتبخر في عمليات كثيرة من أشهرها صنع الجليد وحفظ الأطعمة والمشروبات باردة في خزائن التبريد.
وإذا أُعطي السائل المتبخر حرارة من منبع حراري فإن قسماً من هذه الحرارة يُصرف في رفع درجة حرارته، ويُصرف القسم الآخر في الاستبخار، ويبقى الأمر كذلك إلى أن تصل درجة حرارة السائل المتبخر درجة غليانه تحت الضغط السائد فتبقى حينئذ درجة حرارته ثابتة وتُصرف كل الحرارة المأخوذة من المنبع الحراري في عملية الاستبخار. وتعرف حرارة استبخار سائلٍ بأنها عدد الحريرات اللازمة لتحويل غرام من هذا السائل وهو في درجة حرارة معينة (درجة غليانه) إلى بخار مشبع في درجة الحرارة نفسها. ويبين الجدول 1 حرارة استبخار بعض السوائل في درجات غليانها العيارية. أي ضغط بخارها المشبع يساوي الضغط الجوي النظامي.
السائل
الماء
الإيتر
الكحول الإيتيلي
الأمونياك
الزئبق
حرارة الاستبخار حريرة/غرام
539
88
208
321
77
الجدول (1)
حرارة الاستبخار حريرة/غرام
وتقاس حرارة الاستبخار بإحدى الطرائق المألوفة لقياس كمية الحرارة، فإذا كانت كتلة السائل الذي تحوّل إلى بخار ك (غرام) وكانت ن حرارته النوعية و خ حرارة استبخاره عند الغليان تحت الضغط ض وفي درجة الحرارة د، وكانت كَ السعة الحرارية للمسعر ولما يحويه من ماء وكانت د1 درجة الحرارة في بدء التجربة ود2 في نهايتها فإن: image:1631-7.jpg
(كمية الحرارة التي خسرها البخار) = (كمية الحرارة التي اكتسبها المسعر) وقد أجمل رينولت Regnault نتائج قياساته لحرارة استبخار الماء بالعلاقة: خ = 606.5 - 0.695 دْ
حيث قدِّرت خ بالحريرة لكل غرام؛ وهي علاقة دقيقة تقريباً فيما بين الدرجتين 50ْس و200ْس. ومن الأفضل حساب حرارة الاستبخار بوجه عام استناداً إلى معادلة كلابيرون (العلاقة 3). كذلك يمكن حساب حرارة استبخار السائل اعتماداً على أن التغير في حجم السائل المستبخر يرافقه القيام بعمل هو: image:1631-8.jpg
إذا تم ذلك في درجة حرارة ثابتة وكان ضغط البخار ض ثابتاً؛ وينتج من المبدأ الأول في التحريك الحراري [ر]، أي: Δ طا= كح ـ عم، أن تغير الطاقة الداخلية طدبـ طدس يساوي:
image:1631-11.jpg
أي إن حرارة الاستبخار تساوي الفرق بين انطلبية السائل وانطلبية البخار.[1]
الاستخدامات
بخر الاشتعال
Fuel droplets vaporize as they receive heat by mixing with the hot gases in the combustion chamber. Heat (energy) can also be received by radiation from any hot refractory wall of the combustion chamber.
ترسيب الرقاقي
Thin films may be deposited by evaporating a substance and condensing it onto a substrate.
انظر أيضاً
| من | إلى | |||
| صلب | سائل | غاز | پلازما | |
|---|---|---|---|---|
| صلب | Solid-Solid Transformation | ذوبان | Sublimation | - |
| سائل | تجمد | N/A | غليان/تبخر | - |
| غاز | ترسيب | تكثف | N/A | تأيين |
| پلازما | - | - | Recombination/إزالة التأين | N/A |
- Atmometer (evaporimeter)
- بلورة
- تحلية المياه
- تقطير
- تجفيف
- مجفـِف
- Evapotranspiration
- Flash evaporation
- حرارة تبخر
- الحرارة الكامنة
- Pan evaporation
- نتح
المصادر
- Sze, Simon Min. Semiconductor Devices: Physics and Technology. ISBN 0-471-33372-7. Has an especially detailed discussion of film deposition by evaporation.
- [1]