لناليدوميد
 | |
| البيانات السريرية | |
|---|---|
| النُطق | /ˌlɛnəˈlɪdoʊmaɪd/ |
| الأسماء التجارية | رڤليميد Revlimid |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a608001 |
| License data | |
| فئة السلامة أثناء الحمل |
|
| مسارات الدواء | فموي (كپسولات) |
| رمز ATC | |
| الحالة القانونية | |
| الحالة القانونية | |
| بيانات الحركية الدوائية | |
| التوافر الحيوي | غير محددة |
| ارتباط الپروتين | 30% |
| الأيض | غير محدد |
| Elimination half-life | 3 ساعات |
| الإخراج | البول (67% غير متغير) |
| المعرفات | |
| |
| رقم CAS | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.218.924 |
| Chemical and physical data | |
| التركيب | C13H13N3O3 |
| الكتلة المولية | 259.261 g/mol |
| 3D model (JSmol) | |
| Chirality | Racemic mixture |
| |
| |
| (verify) | |
اللناليدوميد Lenalidomide (الاسم التجاري رڤليميد Revlimid)، هو دواء مشتق من الثاليدوميد thalidomide أُعتمد في الولايات المتحدة عام 2005.[1]
في البداية، كان من المفترض أن يستخدم كعلاج الورم النقوي المتعدد multiple myeloma، الذي يُستخدم الثاليدوميد كعلاج مقبول له. وقد أظهر اللناليدوميد أيضاً فعالية لعلاج فئة من اضطرابات الدم المعروفة بمتلازمة خلل التنسج النقوي myelodysplastic syndrome. في السنوات الأخيرة جرى تطويره مع أدوية أخرى، وقد أظهر اللناليدوميد في البقاء العام على قيد الحياة للمرضى المصابين بالورم النخاعي (الذي كان تشخيصه في السابق ضعيفاً)، على الرغم من أن السمية تظل مشكلة بالنسبة للمستخدمين.[2] تبلغ تكلفة الدواء 163.381 دولار للحالات المتوسطة.[3]
الاستخدامات الطبية
الورم النقوي المتعدد
الورم النقوي المتعدد Multiple myeloma هو أحد أنواع سرطان الدم، ويتميز بتراكم خلية الپلازما في النخاع العظمي.[4] يعتبر اللناليدوميد واحداً من الأدوية الجديدة التي تستخدم لعلاج الورم النقوي المتعدد. وهو نظير جزيئي أكثر قوة من الثاليدومايد، الذي يمنع تولد الأوعية الدموية في الورم، ويمنع تكون السيتوكينات التي تفرز الورم ويحول دون تكاثر الورم من خلال تحريض الاستموات.[5][6][7]
مقارنة بالپلاسـِبو placebo، فاللناليدوميد فعالاً في إحداث استجابة كاملة أو "جزئية جيدة جداً" وكذلك في تحسين البقاء على قيد الحياة بدون تطور المرض. الآثار الجانبية الشائعة بين المرضى المعالجين باللناليدوميد لعلاج الورم النقوي هي قلة الخلايا المتعادلة neutropenia (انخفاض في عدد خلايا الدم البيضاء)، الخثار الوريدي العميق deep vein thrombosis، العدوى infection، وزيادة خطر الإصابة بالأورام الأنسجة الدموية hematological malignancies الأخرى.[8] لا تفوق مخاطر الإصابة بأورام اأنسجة الدموية الأساسية في المرحلة الثانية فوائد استخدام اللنالدوميد لعلاج الورم النخاعي المتعدد المنتكس أو الحر.[9] قد يكون من الصعوبة استنفار الخلايا الجذعية لاستغراسها ذاتياً لدى الأشخاص الذين يستخدمون اللناليدوميد.[10]
في 29 يونيو 2006، حصل اللناليدوميد على ترخيص ادارة الغذاء والدواء الأمريكية لاستخدامه مع الدكسامثازون dexamethasone للمرضى المصابين بالورم النقوي المتعدد ممن خضعوا في السابق للعلاج بدواء واحد على الأقل.[11] في 22 فبراير 2017، اعتمدت ادارة الغذاء والدواء اللناليدوميد كعلاج maintenance مستقل (بدون الدكسامثازون) للمرضى المصابين بالورم النقوي المتعدد بعد زراعة الخلايا الجذعية الذاتية.[12]
في 23 أبريل 2009، أصدر المعهد الوطني للصحة وتفوق الرعاية (NICE) تقدير التقييم النهائي (FAD) لاعمتاد اللناليدوميد، مع الدكستامثازون، كخيار لعلاج المرضى المصابين بالورم النقوي المتعدد ممن خضعوا للعلاج بواحد أو أكثر من العلاجات في إنگلترة وويلز.[13]
في 5 يونيو 2013، عينت ادارة الغذاء والدواء اللناليدوميد كعلاج تخصصي يحتاج توزيع صيدلي متخصص لاستخدامه في "علاج لمفومة خلية الوشاح mantle cell lymphoma (MCL) للحالات التي تعرضت للانتكاس أو تقدم المرض بعد خضوعهم لعلاجين، يتضمن أحدهمها البورتزوميب. الرڤليميد هو الخيار الوحيد المتوفر عن طريق الصيدلة المتخصصة، "برنامج التوزيع المحدود بالتامن مع استراتيجية تقييم المخاطر والتعديل (REMS) لاحتمال كونه يمثل خطورة على الجنين."[14]
متلازمة خلل التنسج النقوي
مع متلازمة خلل التنسج النقوي myelodysplastic syndrome، ظهرت أفضل النتائج للناليدوميد في الحالات المصابة Chromosome 5q deletion syndrome (متلازمة-5q).[15] تنتج المتلازمة عن حزف الكروموسوم البشري 5 الذي تحذف ثلاث جينات متجاورة، granulocyte-macrophage colony-stimulating factor، Platelet-derived growth factor receptor B، و Colony stimulating factor 1 receptor.[16][17]
اعتمدته ادارة الغذاء والدواء في 27 ديسمبر 2005، لعلاج الحالات التي لديها خطر MDS و5q منخفض أو متوسط مع أو بدون اضطرابات جينية إضافية. المرحلة الثالثة المكتملة، هي دراسة متعددة المركز، فردية الذراع تقيم تأثير وسلامة استخدام بالرڤليميد كعلاج منفرد achieving haematopoietic improvement in red blood cell (RBC) transfusion dependent subjects with low- or intermediate-1-risk MDS associated with a deletion 5q cytogenetic abnormality.
أُعتمد اللناليدوميد في 17 يونيو 2013 من قبل وكالة الأدوية الأوروپية لاستخدامه لعلاج متلازمة خلل التنسج النقوي ذات الخطر-1 المنخفض أو المتوسط للمرضى الذين يعانون من التشوه الوراثي 5q ولا يعنون من تشوهات وراثية أخرى، ويعتمدون على نقل خلايا الدم الحمراء، وللحالات التي تجد الخيارات العلاجية الأخرى غير كافية أو مؤثرة.[18]
لمفومة خلية الوشاح
أُعتمد اللناليدوميد من قبل ادارة الغذاء والدواء لعلاج [[لمفومة خلية الوشاح|لمفومة خلية الوشاح mantle cell lymphoma للمرضى الذين تعرضوا لانتكاسة أو تطور المرض بعد تلقيهم لعلاجين آخرين على الأقل.[1] ومن تلك الأدوية السابقة البورتزوميب bortezomib.
أنواع أخرى من السرطان
يخضع اللناليدوميد لتجارب سريرية جارية لاستخدام كعلاج [[لمفومة هودجكن|للمفومة هودجكن قالب:إنج11]]،[19] وأيضاً لعلاج [[لمفوما لاهودجكينية|اللمفوما لاهودجكينية non-Hodgkin's lymphoma، [[اللوكيميا الليمفاوية المزمنة|اللوكيميا الليمفاوية المزمنة chronic lymphocytic leukemia، وسرطانات الورم الصلب، مثل سرطانة الپنكرياس.[20] إحدى مراحل التجربة السريرية الثلاثة قامت بها سلجين Celgene على مرضى مسنين مصابين باللوكيميا الليمفاوية المزمنة للخلايا البائية في يوليو 2013، عندما لوحظ وجود عدد غير متناسب من الوفيات بالسرطان أثناء العلاج باللناليدوميد مقابل المرضى الذين عولجوا [[كلورامبوسيل|بالكلورامبوسيل {{إنج1|قالب:Chlorambucil]].[21]
الآثار الجانبية
يرتبط اللناليدويمد بالثاليدوميد thalidomide المعروف بتأثيره المشوه teratogen. أظهرت التجاربة التي أجريت على القردة أن اللناليدوميد ذو أثر تشويهي أيضاً..[22] بالتالي يصنف الناليدوميد ضمن فئة السلامة أثناء الحمل pregnancy category X ولا يمكن وصفه للنساء الحوامل أو التي يتوقعن حدوث حمل أثناءا لعلاج. لهذا السبب، فهذا الدواء متاح في الولايات المتحدة (تحت العلامة التجارية رڤاليميد) ضمن نظام التوزيع المقيد المسمى رڤأسيست RevAssist. وعلى النساء اللاتي من الممكن حدوث حمل لديهن استخدام وسيلتين على الأقل لمنع الحمل الموثوقة أثناء العلاج ولمدة أربعة أسابيع على الأقل بعد التوقف عن العلاج بالليناليوميد.[1]
بالإضافة لتسمم الأجنة القاتل، يحمل اللناليدوميد أيضاً تحذيرات الصندوق الأسود لتسمم الدم (تشمل [[قلة الخلايا المتعادلة|قلة الخلايا المتعادلة neutropenia وقلة الصفيحات thrombocytopenia والخثار thromboembolisms الوريدي والشرياني.[1]
الآثار الجانبية المحتملة الخطرة للناليدوميد هي [[خثار|الخثار thrombosis و قلة الصفيحات thrombocytopenia. كبد نقى العظم Myelosuppression هي سمية مرتبطة بالجرعات العالية، التي تتناقض مع تجربة الثالوميد.[23] قد يرتبط اللناليدوميد أيضاً ببعض الآثار الجانبية التي تشمل الأورام الخبيثة الرئيسية الثانية، التفاعلات الجلدية الحادة، تفاعلات الحساسية المفرطة، متلازمة انحلال الورم tumor lysis syndrome، تفاعل تفشي الورم، قصور الغدة الدرقية hypothyroidism، و[[فرط الدرقية|فرط الدرقية hyperthyroidism. [1]
الجلطات الدموية الوريدية
اللناليدوميد، مثل الثاليدوميد، المركب المشتق منه اللناليدوميد، قد يسبب [[جلطة دموية وريدية|الجلطات الدموية الوريدية venous thromboembolism، إحدى المضاعفات الخطرة المحتملة لاستخدامه. بحث بـِنـِت وزملاءه في حالات الجلطات الدموية الوريدية المرتبطة باللناليدوميد بين المرضى المصابين بالورم النقوي المتعدد.[24] توصلوا إلى أن هناك معدلات مرتفعة من الإصابة بالجلطات الدموية الوريدية عندم تلقي المرضى المصابين بالورم النقوي المتعدد بالثاليدوميد أو اللناليدوميد مع أدوية أخرى مثل الدكسامثازون dexamethasone، الملفالان melphalan، أو الدوكسوروبيسين doxorubicin. عند استخدام اللناليدوميد والدكسامثازون لعلاج الورم النقوي المتعدد، أصيب 14% من المرضى بالجلطات الدموية الوريدية (من 3-75%). أما المرضى الذين عولجوا بالپروفيلاكسيس لعلاج الجلطات الدوية الوريدية المرتبطة باللناليدوميد، مثل الأسپرين، كانت معدلات الإصابة بالخثار الوريدي منخفضة عن أولئك الذين لم يعالجوا بالپروفيلاكسيس، أقل من 10%. يبدو من الواضح أن الخثار الوريدي هو أثر جانبي خطر مرتبط باللناليدوميد، والثاليدوميد أيضاً. في الواقع، فإن تحذير الصندوق الأسود الموجودة على عبوة اللناليدوميد، يشير إلى أن استخدام اللناليدوميد-الدكسامثازون لعلاج الورم النقوي المتعدد يرتبط بمعدلات مرتفعة للإصابة بالخثار الوريدي.
في الوقت الحالي، هناك تجارب سريرية تعقد المزيد من الاختبارات على فعالية اللناليدوميد لعلاج الورم النقوي المتعدد، ولتحديد كيفية منع الخثار الوريدي المرتبط باللناليدوميد.
متلازمة ستيڤن-جونسون
في مارس 2008، أدرجت ادارة الغذاء والدواء الأمريكية اللناليدوميد على قائمة من 20 وصفة طبية تحت التحقيق لمشكلات السلامة المحتملة. يخضع الدواء للبحث عن زيادة محتملة لخطر تطور متلازمة ستيڤن-جونسون، حالة جلدية تمثل خطر على حياة المريض.[25]
مراجعة السلامة المستمرة من ادارة الغذاء والدواء
في 2011، بدأت ادارة الغذاء والدواء مراجعة مستمرة والتي تركز على التجارب السريرية التي توصلت لوجود خطر متزايد لتطور السرطانات مثل اللوكيميا النقوية الحادة ولمفومة الخلايا البائية،[3] ومع ذلك توصي ادارة الغذاء والدواء حالياً جميع الأشخاص بالاستمرار في علاجهم.[26]
آلية العمل
أستخدم اللناليدوميد كعلاج ناجح للاضطرابات الالتهابية والسرطانات في السنوات العشر الماضية. هناك آليات عمل متعددة]]، ويمكن تبسيطها بتنظيمها كآليات عمل في المعمل وعلى الكائنات الحية.[27] في المعمل، هناك ثلاث أنشطة رئيسية للناليدوميد: الأثر المضاد للأورام anti-tumor المباشر، تثبيط تولد الأوعية angiogenesis، والتعديل المناعي immunomodulation. على الكائنات الحية، يحث اللناليدوميد استموات apoptosis الخلايا الورمية بشكل مباشر وغير مباشر عن طريق تثبيطه لدعم الخلايا الجذعية للنخاع العظمي، من خلال تأثيراته المضادة لنقض العظم anti-osteoclastogenic والمضادة لتولد الأوعية anti-angiogenic، وعن طريق النشاط المعدل للمناعة. للناليدوميد نطاق أنشطة واسع يمكن استخدامه لعلاج العديد من أنواع السرطانات الدموية والصلبة.
على المستوى الجزيئي، أظهر اللناليدوميد تفاعلاً مع السرلبون cereblon ليگاز E3 اليوبيكويتين[28] ويستهدف هذا الانزيم لإضعاف عاملي نسخ الإيكاروس Ikaros ،IKZF1 وIKZF3.[29] كانت هذه الآلية غير متوقعة حيث أنها تقترح أن العمل الرئيسي للناليدوميد هي اعادة استهداف نشاط أحد الانزيمات وليس حصر نشاط الانزيم أو عملية التأشير، ومثن فهو فهو يمثل نمطاً جديداً لعمل الدواء. ومن الآثار الأكثر تخصيصية لهذه الآلية هي خصائص اللناليدوميد المضادة لتولد الأوعية والمضادة للأورام، والتي قد تكون غير موجودة في مشتقات الثاليدوميد الأخرى.
أبحاث
أبحاث الثاليدوميد على المستوى المنخفض المتواصلة، على الرغم من تاريخه المرتبط بالتشوهات، قد أظهرت بشكل غير متوقع أن المركب يؤثر على وظيفة الجهاز المناعي. كان الدواء، على سبيل المثال، قد أُعتمد مؤخراً من قبل ادارة الغذاء والدواء لعلاج مضاعفات الجذام؛ كما بحثه كعامل مساعد لعلاج بعض الأورام الخبيثة. كشفت الدراسات الأخيرة على المركبات المتعلقة عن سلسلة من الجزيئات التي تثبط عامل نخر الورم tumor necrosis factor (TNF-α).[citation needed]
التركيب
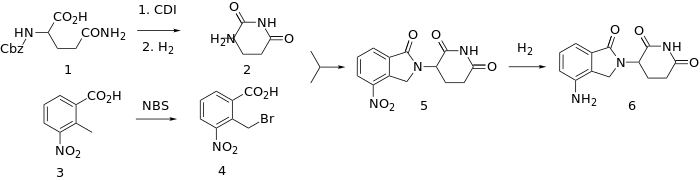
السعر
في الولايات المتحدة تبلغ تكلفة اللناليدوميد 163.381 دولار سنوياً للشخص المتوسط.[3] Lenalidomide made almost $3.8bn for Celgene in 2012.[31]
في 2013، رفض المعهد الوطني للصحة وتفوق الرعاية (NICE) في المملكة المتحدة اللناليدوميد "ليستخدم كعلاج للأشخاص المصابون متلازمة خلل التنسج النقوي myelodysplastic syndrome أحد أنواع اضطراب النخاع العظمي" في إنگلترة وإسكتلندة، زاعماً أن سلجن "لم تقدم أدلة كافية لتبرير الـ3.780 جنيه إسترليني شهرياً (5746.73 دولار) ثمن اللناليدوميد عند استخدامه لعلاج الأشخاصا المصابون بمتلازمة خلل التنسج النقوي".[31]
انظر أيضاً
المصادر
- ^ أ ب ت ث ج REVLIMID [package insert]. Summit, NJ: Celgene Corporation; 2017. Accessed at https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/021880s055lbl.pdf on 14 September 2018.
- ^ McCarthy PL, Owzar K, Hofmeister CC, Hurd DD, Hassoun H, Richardson PG, Giralt S, Stadtmauer EA, Weisdorf DJ, Vij R, Moreb JS, Callander NS, Van Besien K, Gentile T, Isola L, Maziarz RT, Gabriel DA, Bashey A, Landau H, Martin T, Qazilbash MH, Levitan D, McClune B, Schlossman R, Hars V, Postiglione J, Jiang C, Bennett E, Barry S, Bressler L, Kelly M, Seiler M, Rosenbaum C, Hari P, Pasquini MC, Horowitz MM, Shea TC, Devine SM, Anderson KC, Linker C (2012). "Lenalidomide after stem-cell transplantation for multiple myeloma". N. Engl. J. Med. 366 (19): 1770–81. doi:10.1056/NEJMoa1114083. PMC 3744390. PMID 22571201.
- ^ أ ب ت Badros, Ashraf Z. Badros (May 10, 2012). "Lenalidomide in Myeloma — A High-Maintenance Friend". N Engl J Med. 366 (19): 1836–1838. doi:10.1056/NEJMe1202819. PMID 22571206.
- ^ Armoiry X, Aulagner G, Facon T (June 2008). "Lenalidomide in the treatment of multiple myeloma: a review". Journal of Clinical Pharmacy and Therapeutics. 33 (3): 219–26. doi:10.1111/j.1365-2710.2008.00920.x. PMID 18452408.
- ^ Li, S; Gill, N; Lentzsch, S (Nov 2010). "Recent advances of IMiDs in cancer therapy". Curr Opin Oncol. 22 (6): 579–85. doi:10.1097/CCO.0b013e32833d752c. PMID 20689431.
- ^ Tageja, N (Mar 2011). "Lenalidomide - current understanding of mechanistic properties". Anticancer Agents Med Chem. 11 (3): 315–26. PMID 21426296.
- ^ Kotla, V; Goel, S; Nischal, S; Heuck, C; Vivek, K; Das, B; Verma, A (Aug 2009). "Mechanism of action of lenalidomide in hematological malignancies". J Hematol Oncol. 2: 36. doi:10.1186/1756-8722-2-36. PMC 2736171. PMID 19674465.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Yang, B; Yu, RL; Chi, XH; Lu, XC (2013). "Lenalidomide treatment for multiple myeloma: systematic review and meta-analysis of randomized controlled trials". PLoS ONE. 8 (5): e64354. doi:10.1371/journal.pone.0064354. PMC 3653900. PMID 23691202.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Dimopoulos, MA; Richardson, PG; Brandenburg, N; Yu, Z; Weber, DM; Niesvizky, R; Morgan, GJ (Mar 22, 2012). "A review of second primary malignancy in patients with relapsed or refractory multiple myeloma treated with lenalidomide". Blood. 119 (12): 2764–7. doi:10.1182/blood-2011-08-373514. PMID 22323483.
- ^ Li, Shirong; Gill, Navkiranjit; Lentzsch, Suzanne (November 2010). "Recent advances of IMiDs in cancer therapy". Current Opinion in Oncology. 22 (6): 579–585. doi:10.1097/CCO.0b013e32833d752c. PMID 20689431.
- ^ "FDA approves lenalidomide oral capsules (Revlimid) for use in combination with dexamethasone in patients with multiple myeloma". FDA. 2006-06-29. Retrieved 2015-10-15.
{{cite web}}: Cite has empty unknown parameters:|deadurl=and|subscription=(help) - ^ https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm542791.htm
- ^ "REVLIMID Receives Positive Final Appraisal Determination from National Institute for Health and Clinical Excellence (NICE) for Use in the National Health Service (NHS) in England and Wales". Reuters. April 23, 2009.
{{cite journal}}: Cite journal requires|journal=(help) - ^ Ness, Stacey (13 March 2014). "New Specialty Drugs". Pharmacy Times. Retrieved 5 November 2015.
- ^ List A, Kurtin S, Roe DJ, et al. (February 2005). "Efficacy of lenalidomide in myelodysplastic syndromes". The New England Journal of Medicine. 352 (6): 549–57. doi:10.1056/NEJMoa041668. PMID 15703420.
- ^ https://www.ncbi.nlm.nih.gov/gene/5159
- ^ Nimer SD (2006). "Clinical management of myelodysplastic syndromes with interstitial deletion of chromosome 5q". Journal of Clinical Oncology. 24 (16): 2576–82. doi:10.1200/JCO.2005.03.6715. PMID 16735711.
- ^ "Revlimid Approved In Europe For Use In Myelodysplastic Syndromes". The MDS Beacon. Retrieved 2013-06-17.
- ^ "Phase II Study of Lenalidomide for the Treatment of Relapsed or Refractory Hodgkin's Lymphoma". ClinicalTrials.gov. US National Institutes of Health. February 2009.
- ^ "276 current clinical trials world-wide, both recruiting and fully enrolled, as of 27 February 2009". ClinicalTrials.gov. US National Institutes of Health. February 2009.
- ^ "Celgene Discontinues Phase 3 Revlimid Study after 'Imbalance' of Deaths". Nasdaq. July 18, 2013.
- ^ "Revlimid Summary of Product Characteristics. Annex I" (PDF). European Medicines Agency. 2012. p. 6.
- ^ Rao KV (September 2007). "Lenalidomide in the treatment of multiple myeloma". American Journal of Health-System Pharmacy. 64 (17): 1799–807. doi:10.2146/ajhp070029. PMID 17724360.
- ^ Bennett CL, Angelotta C, Yarnold PR, et al. (December 2006). "Thalidomide- and lenalidomide-associated thromboembolism among patients with cancer". JAMA: the Journal of the American Medical Association. 296 (21): 2558–60. doi:10.1001/jama.296.21.2558-c. PMID 17148721.
- ^ "Potential Signals of Serious Risks/New Safety Information Identified from the Adverse Event Reporting System (AERS) between January - March 2008". US Department of Health & Human Services. FDA. March 2008.
- ^ "FDA Drug Safety Communication: Ongoing safety review of Revlimid (lenalidomide) and possible increased risk of developing new malignancies". US Food and Drug Administration. FDA. April 2011.
- ^ Vallet S, Palumbo A, Raje N, Boccadoro M, Anderson KC (July 2008). "Thalidomide and lenalidomide: Mechanism-based potential drug combinations". Leukemia & Lymphoma. 49 (7): 1238–45. doi:10.1080/10428190802005191. PMID 18452080.
- ^ Zhu, Y. X.; Braggio, E; Shi, C. X.; Bruins, L. A.; Schmidt, J. E.; Van Wier, S; Chang, X. B.; Bjorklund, C. C.; Fonseca, R; Bergsagel, P. L.; Orlowski, R. Z.; Stewart, A. K. (2011). "Cereblon expression is required for the antimyeloma activity of lenalidomide and pomalidomide". Blood. 118 (18): 4771–9. doi:10.1182/blood-2011-05-356063. PMC 3208291. PMID 21860026.
- ^ Stewart, A. K. (2014). "Medicine. How thalidomide works against cancer". Science. 343 (6168): 256–7. doi:10.1126/science.1249543. PMC 4084783. PMID 24436409.
- ^ Muller, G. W.; Chen, R.; Huang, S. Y.; Corral, L. G.; Wong, L. M.; Patterson, R. T.; Chen, Y.; Kaplan, G.; Stirling, D. I. (1999). "Amino-substituted thalidomide analogs: Potent inhibitors of TNF-α production". Bioorganic & Medicinal Chemistry Letters. 9 (11): 1625–30. doi:10.1016/S0960-894X(99)00250-4. PMID 10386948.
- ^ أ ب "Revlimid faces NICE rejection for use in rare blood cancer Watchdog's draft guidance does not recommend Celgene's drug for NHS use in England and Wales". Pharma News. 11 July 2013. Retrieved 5 November 2015.
قراءات إضافية
- Chang DH, Liu N, Klimek V, et al. (July 2006). "Enhancement of ligand-dependent activation of human natural killer T cells by lenalidomide: therapeutic implications". Blood. 108 (2): 618–21. doi:10.1182/blood-2005-10-4184. PMC 1895497. PMID 16569772.
- Anderson KC (October 2005). "Lenalidomide and thalidomide: mechanisms of action--similarities and differences". Seminars in Hematology. 42 (4 Suppl 4): S3–8. doi:10.1053/j.seminhematol.2005.10.001. PMID 16344099.
وصلات خارجية
- Official website Includes list of adverse reactions
- Prescribing Information
- International Myeloma Foundation article on Revlimid
- multiplemyeloma.org Revlimid April 2007 Summary
- CS1 maint: unflagged free DOI
- Template:drugs.com link with non-standard subpage
- ECHA InfoCard ID from Wikidata
- Infobox-drug molecular-weight unexpected-character
- Pages using infobox drug with unknown parameters
- Drug has EMA link
- Drugboxes which contain changes to watched fields
- Articles with unsourced statements from March 2018
- أدوية مضادة للأورام
- مثبطات المناعة
- أيزويندولينات
- گلوتاریمیدات
- أمينات عطرية
- أدوية آليات عملها غير معروفة