كراتين
الكـِراتين أو القرتين Keratin، هي عائلة من الپروتينات الليفية، وهي صلبة وعديمة الذوبان موجودة لدى الزواحف والطيور والبرمائيات والثدييات، وتدخل بشكل أساسي في تكوين الشعر والصوف والأظافر والمخالب والجلد ومينا الأسنان والحوافر والقرون، لا يضاهيها في الصلابة من بين المواد الحيوية سوى الكيتين.
تعريف
الكراتين هو پروتين متين عديم الذوبان يوجد في الطبقة الخارجية للجلد عند بني البشر وحيوانات أخرى عديدة. وتدعى هذه الطبقة الخارجية البشرة. تحتوي الطبقة السطحية من خلايا البشرة على القرَتين. ويجعل القرتين الموجود في هذه الخلايا الجلد متينًا ويكاد يكون مانعًا للماء بشكل تام. ويزداد عدد الخلايا المحتوية على القرتين في الأماكن التي يتعرض فيها الجلد لكثير من الاحتكاك والارتخاء ـ مثل الكفين والقدمين ـ مما يؤدي إلى تكون ما يسمى الجسأة. ويتم طرح الخلايا المحتوية على القرتين واستبدال أخرى جديدة بها باستمرار. وتحدث الحالة المعروفة باسم الهبرية، عندما تطرح فروة الرأس مثل هذه الخلايا.
الوظيفة
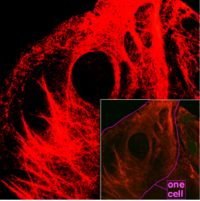
Keratin filaments are abundant in keratinocytes in the cornified layer of the epidermis; these are cells which have undergone keratinization. In addition, keratin filaments are present in epithelial cells in general. For example, mouse thymic epithelial cells (TECs) are known to react with antibodies for keratin 5, keratin 8, and keratin 14. These antibodies are used as fluorescent markers to distinguish subsets of TECs in genetic studies of the thymus.
- the α-keratins in the hair (including wool), horns, nails, claws and hooves of mammals[التحقق مطلوب]
- the harder β-keratins found in nails and in the scales and claws of reptiles, their shells (chelonians, such as tortoise, turtle, terrapin), and in the feathers, beaks, claws of birds and quills of porcupines.[1] (These keratins are formed primarily in beta sheets. However, beta sheets are also found in α-keratins.)[2]
The baleen plates of filter-feeding whales are made of keratin.
Although it is now difficult to be certain, the scales, claws, some protective armour and the beaks of dinosaurs were probably composed of keratin.[3]
Keratins (also described as cytokeratins) are polymers of type I and type II intermediate filaments, which have only been found in the genomes of chordates (vertebrates, Amphioxus, urochordates). Nematodes and many other non-chordate animals seem to only have type V intermediate filaments, lamins, which have a long rod domain (vs. a short rod domain for the keratins).
العناية بالشعر
عند فقدان الشعر لمادة الكراتين يبدأ في الجفاف والتقصف وتقل نسبة الكيراتين تدريجيا حتى تصل نسبته في الشعر إلى 35% وهذا لعدة أسباب فأما لأسباب وراثية أو نتيجة فرد الشعر وكثرة الصبغات واستخدام الكريمات والشامبوهات الغلط والاكثار من السيشوار والمكواة ولهذا كان أستخدام الكيراتين المصنع من مواد طبيعية ليقوي نسبة الكيراتين الطبيعية الموجودة في الشعر وبالتالى يرجع الشعر إلى طبيعته وصحته فمادة الكيراتين هي المسئولة عن صلابة الشعر ومقاومته للحرارة اللي ممكن يتعرض لها من العوامل الخارجية نتيجة كثرة استعمال المكواة والسشوار أو الصبغة الكيماوية ولذلك يعتبر الكيراتين فرد وعلاج للشعر وهو أحدث علاج للشعر التالف المقصف أو المجعد أو الناشف أو المتساقط أو الشعر المجهد ويتغلغل في الأماكن التالفة ويعالجها وميزاته إنه غير قابل للذوبان ويصلح لجميع أنواع الشعر وكل الأعمار.[4]
الأنواع المستخدمة
الكيراتين المستخدم للعناية بالشعر، له أنواع من حيث مدة مفعوله ومن حيث الغرض منه فيل أنه 7 أنواع كل نوع بيناسب طبيعة كل شعر فيوجد كيراتين فرد وعلاج وهو أغلى الأنواع ويوجد كيراتين لفرد فقط أو مايسمى الليس وهناك نوع لعلاج فقط أو مايسمى ترتمنت ويوجد نوع يستخدم مرة واحدة وتستمر نتائجة للأبد لأنه يرفع نسبة الكيراتين الطبيعية في الجسم ويوجد نوع مؤقت اى يدوم فترة ثم يحتاج التكرار كل فترة ونتيجته بتستمر من 3 شهور إلى 3 سنين وعموما درجة الفرد والتموج حسب الرغبة فأما لفرد الخالص أو الفرد بدرجه بها تموجات واسعة ويوجد الآن بدائل لكيراتين وكلها من منتجات الكيراتين المعالج أو الترتمنت وهى أرخص نسبيا عن الكيراتين ككريم كيراتينو وكريم Rb Hot Couffier.
مادة الفورمالين
الكيراتين المقلد يحتوى على مادة الفورمالين وهى مادة مسرطنة ويتم إضافتها بنسبة كبيرة جدا ويضاف الكثير من المواد الكيماوية والبطاس وهى مواد خطيرة جدا على الشعر ورائحته مثيرة للدموع وتسبب الشعور بحرقان بسبب المواد الكيماوية الشديدة به ويستمر على الشعر 3 شهور فقط والنوع المقلد بيطلب تتجنب نزول حمام السباحة وثمنه 1500 جنيه مصري أو أقل. أما الآصلى ليس له أي آثار جانبية فملمسه واحد ومتجانس ومن غير حبيبات وخالى من الفورمالين وحاصل على علامة موافقة منظمة الدواء والغذاء الأمريكية.
طريقة الاستخدام
يتم دخول الكيراتين إلى الشعر عن طريق جهاز معين بواسطة أمبولات ويخرج الكيراتين على شكل بخار ويتم تصفيف الشعر به.
البيولوجيا الجزيئية والكيمياء الحيوية
The usefulness of keratins depends on their supermolecular aggregation. These depend on the properties of the individual polypeptide strands, which depend in turn on their amino acid composition and sequence. The α-helix and β-sheet motifs, and disulfide bridges, are crucial to the conformations of globular, functional proteins like enzymes, many of which operate semi-independently, but they take on a completely dominant role in the architecture and aggregation of keratins.
The alpha keratin helix is not a true alpha helix, as it only has 3.5 residues/turn, where the normal alpha helix has 3.6 residues/turn. This is important for the different helices to form tight disulfide bonds. Also, roughly every seventh residue is a leucine, so they can line up and help the strands stick together through hydrophobic interactions.
التقرن
Cornification is the process of forming an epidermal barrier in stratified squamous epithelial tissue. At the cellular level, cornification is characterised by:
- production of keratin
- production of small proline-rich (SPRR) proteins and transglutaminase which eventually form a cornified cell envelope beneath the plasma membrane
- terminal differentiation
- loss of nuclei and organelles, in the final stages of cornification metabolism ceases and the cells are almost completely filled by keratin
During the process of epithelial التمايز, cells become cornified as keratin protein is incorporated into longer keratin intermediate filaments. Eventually the nucleus and cytoplasmic organelles disappear, metabolism ceases and cells undergo a programmed death as they become fully keratinized. In many other cell types, such as cells of the dermis, keratin filaments and other intermediate filaments function as part of the cytoskeleton to mechanically stabilize the cell against physical stress. It does this through connections to desmosomes, cell-cell junctional plaques, and hemidesmosomes, cell-basement membrane adhesive structures.
Cells in the epidermis contain a structural matrix of keratin, which makes this outermost layer of the skin almost waterproof, and along with collagen and elastin, gives skin its strength. Rubbing and pressure cause thickening of the outer, cornified layer of the epidermis and form protective calluses — useful for athletes and on the fingertips of musicians who play stringed instruments. Keratinized epidermal cells are constantly shed and replaced (see dandruff).
These hard, integumentary structures are formed by intercellular cementing of fibers formed from the dead, cornified cells generated by specialized beds deep within the skin. Hair grows continuously and feathers moult and regenerate. The constituent proteins may be phylogenetically homologous but differ somewhat in chemical structure and supermolecular organization. The evolutionary relationships are complex and only partially known. Multiple genes have been identified for the β-keratins in feathers, and this is probably characteristic of all keratins.
التفاصيل البنائية
Fibrous keratin molecules supercoil to form a very stable, left-handed superhelical motif to multimerise, forming filaments consisting of multiple copies of the keratin monomer.[5]
Limited interior space is the reason why the triple helix of the (unrelated) structural protein collagen, found in skin, cartilage and bone, likewise has a high percentage of glycine. The connective tissue protein elastin also has a high percentage of both glycine and alanine. Silk fibroin, considered a β-keratin, can have these two as 75–80% of the total, with 10–15% serine, with the rest having bulky side groups. The chains are antiparallel, with an alternating C → N orientation.[6] A preponderance of amino acids with small, nonreactive side groups is characteristic for structural proteins, for which H-bonded close packing is more important than chemical specificity.
Disulfide bridges
In addition to intra- and intermolecular hydrogen bonds, keratins have large amounts of the sulfur-containing amino acid cysteine, required for the disulfide bridges that confer additional strength and rigidity by permanent, thermally-stable crosslinking—a role sulfur bridges also play in vulcanized rubber. Human hair is approximately 14% cysteine. The pungent smells of burning hair and rubber are due to the sulfur compounds formed. Extensive disulfide bonding contributes to the in solubility of keratins, except in dissociating or reducing agents.
The more flexible and elastic keratins of hair have fewer interchain disulfide bridges than the keratins in mammalian fingernails, hooves and claws (homologous structures), which are harder and more like their analogs in other vertebrate classes. Hair and other α-keratins consist of α-helically-coiled single protein strands (with regular intra-chain H-bonding), which are then further twisted into superhelical ropes that may be further coiled. The β-keratins of reptiles and birds have β-pleated sheets twisted together, then stabilized and hardened by disulfide bridges.
تشكل الخيوط
It was theorized that keratins are combined into 'hard' and 'soft,' or 'cytokeratins' and 'other keratins'[مطلوب توضيح]. That model is now understood to be correct. A new nuclear addition in 2006 to describe keratins takes this into account.[7]
Keratin filaments are intermediate filaments. Like all intermediate filaments, keratin proteins form filamentous polymers in a series of assembly steps beginning with dimerization; dimers assemble into tetramers and octamers and eventually, the current hypothesis holds, into unit-length-filaments (ULF) capable of annealing end-to-end into long filaments.
الاقتران
| أ (طبيعي-قاعدي) | ب (حامضي) | التواجد |
|---|---|---|
| كراتين 1، كراتين 2 | كراتين 9، كراتين 10 | الطبقة القرنية، الخلايا الكراتينية |
| كراتين 3 | كراتين 12 | القرنية |
| كراتين 4 | كراتين 13 | ظهارة مطبقة الخلايا |
| كراتين 5 | كراتين 14، كراتين 15 | ظهارة مطبقة الخلايا |
| كراتين 6 | كراتين 16، كراتين 17 | ظهارة حرشفية الخلايا |
| كراتين 7 | كراتين 19 | ductal epithelia |
| كراتين 8 | كراتين 18، كراتين 20 | ظهارة بسيطة |
الحرير
fibroins الحرير التي تنتجها الحشرات والعناكب كثراً ما تـُصنف ككراتينات، بالرغم من أنه غير واضح إذا ما كانت phylogenetically related لكراتينات الفقاريات.
Silk found in insect pupae, and in spider webs and egg casings, also has twisted β-pleated sheets incorporated into fibers wound into larger supermolecular aggregates. The structure of the spinnerets on spiders’ tails, and the contributions of their interior glands, provide remarkable control of fast extrusion. حرير العنكبوت عادة ما يكون سمكه 1 - 2 ميكرومتر (µm)، بالمقارنة بـ 60 µm للشعر البشري، وأكثر لبعض الثدييات. السمات المفيدة حيوياً وتجارياً لألياف الحرير تعتمد على تنظيم يلاسل بروتين متجاورة متعددة في مناطق بلورية صلبة بأحجام متغيرة متبادلة مع مناطق غير متبلورة مرنة حيث تكون السلاسل randomly coiled.[8] A somewhat analogous situation occurs with synthetic بوليمرات مثل النايلون، developed as a silk substitute. الحرير من hornet cocoon contains doublets about 10 µm across, with cores and coating, and may be arranged in up to 10 layers; also in plaques of variable shape. Adult hornets also use silk as a glue, as do spiders.
الأهمية السريرية
بعض الفطريات المعدية، مثل أولئك المتسببين في قدم الرياضي، الدودة الحلقية، or the Batrachochytrium dendrobatidis (Chytrid fungus) which is killing amphibians all over the world, feed on keratin.
الأمراض التي تسببها التحورات في جينات الكراتين تضم
- Epidermolysis bullosa simplex
- Ichthyosis bullosa of Siemens
- Epidermolytic hyperkeratosis
- Steatocystoma multiplex
- Keratosis pharyngis
أنظر أيضاً
صور اضافية
المصادر
- ^ Hickman, Cleveland Pendleton; Roberts, Larry S.; Larson, Allan L. (2003). Integrated principles of zoology. Dubuque, IA: McGraw-Hill. p. 538. ISBN 0-07-243940-8.
{{cite book}}: Cite has empty unknown parameter:|coauthors=(help)CS1 maint: multiple names: authors list (link) - ^ Kreplak L, Doucet J, Dumas P, Briki F (2004). "New aspects of the alpha-helix to beta-sheet transition in stretched hard alpha-keratin fibers". Biophys J. 87 (1): 640–7. doi:10.1529/biophysj.103.036749. PMC 1304386. PMID 15240497.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1617199/
- ^ الكيراتين وأنواعه وأشهر الأسئلة عنه، موسوعة الجمال
- ^ {{{author}}}, Fundamentals of Biochemistry, [[{{{publisher}}}]], [[{{{date}}}]].
- ^ "Secondary Protein". Elmhurst.edu. Retrieved 2010-09-23.
- ^ Schweizer J, Bowden PE, Coulombe PA, Langbein L, Lane EB, Magin TM, Maltais L, Omary MB, Parry DA, Rogers MA, Wright MW. New consensus nomenclature for mammalian keratins. J Cell Biol. 2006 Jul 17;174(2):169-74.
- ^ Australia. "Spiders - Silk structure". Amonline.net.au. Retrieved 2010-09-23.
للاستزادة
Ramot Y, Paus R, Tiede S, Zlotogorski A. Endocrine controls of keratin expression. Bioessays. 2009 Apr;31(4):389-99. PMID: 19274655