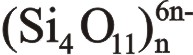سيليكات
سيليكات silicates ضروب السيليكات هي أملاح لا عضوية، تشتق من ثنائي أكسيد السيلسيوم (السيليكون) SiO2 ذي التفاعل الحمضي. السيلسيوم. وهي واسعة الانتشار في القشرة الأرضية، فهي، مع الرمل، تكوِّن نحو 75% من كتلة القشرة الأرضية الأرض. ولهذه المركبات أهميتها من الناحية الجيوفيزيائية، والبنية الكيمياوية، وفي الصناعة.
وقبل البحث في السيليكات لابد من التفريق بين كل من الصخور rocks علم الصخور والفلزات minerals والخامات ores. فالصخور مزيج معقد من الفلزات. والفلزات مواد صلبة معينة كائنة في القشرة الأرضية لها بنية محدَّدة نوعاً ما، مثل أي مركبات مستقلة. أما الخام فهو فلز يمكن استخراجه وتصنيعه وتكون العملية مجدية اقتصادياً.
فلزات ضروب السيليكات والصخور
أدى تصلّب حمم الأرض (اللابا) المنصهرة إلى تشكل الصخور البركانية (النارية)، إلا أن هذه الصخور، بفعل الرياح والماء، قد تفتت أو انحلت جزئياً، وترسَّبت النواتج مشكّلة الصخور الرسوبية sedimentary rocks. وغالباً ما اندفنت هذه الصخور وتعرَّضت لدرجات عالية من الحرارة والضغط فتحول شكلها ونتج منها الصخور التحولية metamorphic rocks. والصخور البركانية، عموماً، تبلورت وانفصلت مواد لها بنية محدَّدة على الأغلب، هي الفلزات السيليكاتية. وفي أي صنف من الصخور ذات التركيب العام نفسه يلاحظ اختلاف كبير في المظهر، لاختلاف حجوم البلورات فيها. ويمكن تصنيف ضروب السيليكات الفلزية في مجموعات هي:
1ـ الفلزات الرئيسة المهمة.
2ـ فلزات القلة.
3ـ الفلزات الثانوية.
تشمل كلُّ مجموعة عدة زمر، وتدرج فيما يأتي صيغُ ضروب السيليكات المكوِّنة لكل من هذه الزمر، وأسماؤها.
1ـ الفلزات الرئيسية المهمة، وتشمل:
أ ـ ضروب الفلسبار (الصفاح) feldspars:
الأورتوكلاز orthoclase، KAlSi3O8؛ الميكروكلين microcline، KAlSi3O8؛ البلاجيوكلاز الحمضي acid plagioclase، ألبايْت albite، NaAlSi3O8؛ البلاجيوكلاز القلوي (القاعدي) basic plagioclase، أنورثيت anorthite، CaAl2Si2O8.
ب ـ زمرة شبه الفلسبار feldspathoid group:
لوسيت lucite، KAl (SiO3)2؛ نيفيلين nepheline، [Na,K]AlSiO4؛ السوداليت sodalite، Na8al6cl2(Si6O24)؛ لازوريت lazurite، Na5Al3S (SiO4)3.
جـ ـ البيروكسين pyroxene:
انْستاتيت enstatite، MgSiO4؛ هايبرسثين hypersthene، [Mg,Fe]SiO3؛ ديوبسيد diopside، Ca[Mg,Fe] (SiO3)2؛ أوغيت augite،Ca,Mg(SiO3)2 + [Mg,Fe][Al2O3,Fe2O3]SiO3؛ جاديت jadeite، NaAl (SiO3)2.
د ـ الأمفيبول amphibole:
الأنثوفيليت anthophyllite، (OH)2 (Mg,Fe)7Si8O22؛ تريموليت tremolite، (OH)2Ca2Mg5 (Si4O11)2؛ هـورن بلـند hornblende، NaAlSi2O6 + Ca (MgFe)3Si4O12.
هـ ـ الميكا mica:
مسكوفيت muscovite، (OH)2KAl2Si3AlO10؛ بيوتيت (الميكا السوداء)، (OH)2K(Mg,Fe)3AlSi3O10؛ فلوغوبيت phlogopite، (OH)2KMg3Si3AlO10؛ ليبيدوليت lepidolite، KLi2Al(Si4O10) (OH,F)2.
و ـ زمرة الأوليفين olivine group:
أوليفين olivine، (Mg,Fe)2SiO4؛ فورستيريت forsterite، Mg2SiO4.
2ـ فلزات القلة minor rock-making minerals، وهي تشمل:
تيتانيت titanite، CaTiSiO5؛ بيريل Beryl، Be3Al2 (SiO3)6؛ سبودومين spodumene، LiAl (SiO3)2؛ كـالامـيـن calamine، Zn2(OH)2SiO3؛ ويليميت willemite، Zn2(SiO4)؛ زركون zircon، ZrSiO4؛ تورمالين tourmaline، (Na2Ca)(Mg,Al)27B9Si18HxO93؛ توباز topaz، (AlF)2SiO4.
3ـ الفلزات الثانوية secondary minerals وتشمل:
أ ـ زمرة ضروب الزيوليت zeolites، المشتقة من ضروب الفلسبار وضروب شبه الفلسبار:
تشابازيت chabazite، [Ca,Na2]Al2(SiO3)4.6H2O؛ أنالسيت analcite، NaAl(SiO3)2.H2O؛ ناتروليت natrolite، Na2Al2Si3O10.2H2O؛ هيولنديت heulandite، CaAl2Si7O18.6H2O؛ ستيلبيت stilbite، (Na2Ca)Al2Si6O16.6H2O.
ب ـ الكلوريت chlorite:
بينّينيت penninite، Mg5(Al,Fe) (Al,Si)4O10(OH)8؛ كلينُكلور clinochlore، Al,Mg5Si3Al10(OH)8؛ ايبيدوت epidote، Ca2(Al,Fe)3OH(SiO4)3؛ تلْك talc، Mg3(Si4O10) (OH)2.
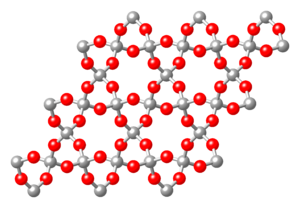
جـ ـ ضروب السيليكات المميهة الناتجة عن التفتت:
سرْبِنْتين serpentine، 2H2O.3MgO.2SiO2؛ كاولينيت kaolinite، Al2(Si2O3) (OH)4؛ بنتونيت bentonite، Al2O3.5SiO3.5H2O.
د ـ العقيق الأحمر (بَنَفْش) garnet:
أندراديت andradite، Ca3Fe2(SiO4)3؛ غروسُّلاريت grossularite، Ca3Al2(SiO4)3؛ ألْمانْديت almandite، Fe3Al2(SiO4)3؛ بيروب pyrope، Mg3Al2(SiO4)3.
هـ ـ السيليكات الناتجة، بصورة رئيسية، عن التحول metamorphism:
أنْدَلوسيت andalusite، Al2SiO5؛ بريهنيت prehnite، H2Ca2Al2(SiO4)3؛ فيزوفيانيت vesuvianite، Ca10Al4(Mg,Fe)2Si9O34(OH)4؛ ســكـابوليت scapolite، Ca4Al6Si6O24(SO4,CO3) إلى Na4Al3Si9O24Cl؛ وُلاّستونيت wollastonite، CaSiO3؛ سيانيت cyanite، Al2SiO5؛ سيلّيمانيت sillimanite، Al2SiO5.
الصخور البركانية

الجرانيت granite أكثر الصخور البركانية وفرة في القشرة الأرضية. ويعدّ صخراً حمضياً لوجود أكاسيد حمضية بنسبة كبيرة فيه. وتبلغ نسبة أكسيد السيلسيوم فيه وسطياً 70%، ونسبة أكسيد الألمنيوم نحو 15%. ويبدو أن اليابسة تتألف من ألواح حجرية غرانيتية سمكها نحو 30 كيلو متراً «تطفو» على مادة بازلتية أثقل. والوشاح وهو الطبقة المغلّفة لنواة الأرض الحديدية يشبه البريدوتيت، وهو صخر بركاني قاتم اللون يتكون بصورة رئيسية من أملاح أورثو سيليكات المغنسيوم والحديد. وهناك برهان مقنع يدعم النظرية التي مفادها أن الأرض تكثَّفت من غمامة كونية باردة. وفي البداية كانت الطبقة الخارجية للأرض ذات طبيعة بازلتية. وبعد نحو بليون (10 9) سنة أدت الحرارة الناتجة من النشاط الإشعاعي لنظير البوتاسيوم 40 بصورة رئيسية إلى تفكك البازلت وتحوله إلى جرانيت الذي تشكلت منه اليابسة، وإلى دونيت (وهو سيليكات متعامدة ثقيلة) ترسب في الأسفل. ويبدو، من المحتمل، أن هذه العملية مستمرة ولذلك فاليابسة مستمرة بالنمو.
التجوية
تتفتت الفلزات الرئيسية بفعل التأثير الميكانيكي والكيمياوي للرياح والأمطار أي بفعل التجوية weathering. تتحول بلورات الكوارتز (وهو أحد الشكلين البلوريين لأكسيد السيلسيوم) المؤلفة من بلورات كبيرة إلى حبيبات صغيرة من الرمل . الرمل الكوارتزي، وتتحول ضروب الفلسبار، وهي ألمينوسيليكات ذات بنية هيكلية، بفعل CO2 والماء، إلى رمل وطين.
وبشروط مغايرة، يتشكل البوكسيت (أكسيد الألمنيوم المائي Al2O3 nH2O)، كما ينتج أيضاً ناتج ليفي هو المسكوفيت muscovite:
والبلاجيوكلاس من الفلسبارات يتحول إلى ضروب الزيوليت وفلزات أخرى، ويكوّن البيوتيت مكوِّنات الكلوريت ويتأثر الأوليفين مباشرة بحمض الكربون والأكسجين، فيتأكسد الحديد ويترسب على شكل مجنيتيت ويشكل المغنسيوم المغنزيت ويطرأ تغيرات مماثلة على ضروب الأمفيبول والبيروكسين.
الصخور الرسوبية والتحولية
أكثر المنتجات المترسبة انتشاراً هي الصلصال (الطين) clay، والطَفْل (طُفال) sale، والحجر الرملي، والحجر الكلسي، والدولوميت، والمغنيتيت، والجص. ويصير الحجر الرملي، بالشروط التحولية، صواناً flint أو كوارتزيت وهو صخر حبيْبي. ويتحوَّل الطَفْل إلى إردواز slate، ويتحول الحجر الكلسـي إلى رخـام marble.
السيليكات القلوية
يستحصل ملح سيليكات الصوديوم التجاري، المعروف باسم الزجاج المائي بصهر السيليس SiO2 بدرجة حرارة 1300 ْس مع كربونات الصوديوم والفحم الخشبي ثم استخلاص الكتلة الزجاجية في الصاد الموصد، أو بحل السيليس في هدروكسيد الصوديوم. وتراوح نسبة أكسيد السيلسيوم إلى أكسيد الصوديوم فيه بين 2 و4. يتكون بنهاية التفاعل مزيج معقد من السيليكات القلوية وفق المخطط:
وهي تباع، عادة، محلولاً مركزاً لزجاً. وعندما يكون المزيج غنياً بالقلوي تكون النواتج منحلة بالماء، وعندما يكون محتواها من القلوي قليلاً تصير هذه النواتج عديمة الانحلال. وتحوي النواتج المنحلة سيليكات ذات وزن جزيئي منخفض مثل Na4SiO4، Na2x(SiO3)x، Na2Si2O5.
وتشبه ضروب السيليكات القلوية الأخرى مركب الصوديوم. ومنحنيات تغير التركيب بدلالة درجات الحرارة للجملة K2O.SiO2-H2O تبيِّن تشكيل عدة أملاح مميهة للأملاح K2SiO5، K2SiO3، ويشكل الليثيوم ملح أورتو سيليكات الليثيوم. وعلى الرغم من انحلال السيليس في هدروكسيد الأمونيوم المركز، لا يمكن تحضير أملاح سيليكات الأمونيوم الصلبة لأن محاليلها تتحلل بالماء في أثناء تبخيرها.
بنية ضروب السيليكات
لأملاح السيليكات بنى متنوعة ومعقدة جداً. وقد ساعدت طريقة الانعراج بأشعة رونتجن (الأشعة السينية) في تعرّف هذه البنى، إذ كانت بنية السيليكات، قبل ذلك، لغزاً حيَّر الكيميائيين مدة طويلة. وطرق تحليلها، كيمياوياً، صعبة وطويلة.
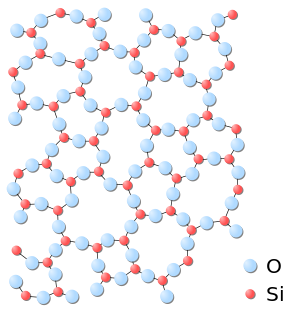
لابد لتعرّف بنية السيليكيات وسبب تعقيدها من مقارنة بنية ثنائي أكسيد الكربون CO2، وهو الأكسيد الذي يشكله عنصر الكربون الذي يقع فوق السيليكون في الجدول الدوري (الفصيلة الرئيسية الرابعة IVA)، وبنية أكسيد السيليكون SiO2. وتبيِّن هذه المقارنة أن أنماط الروابط التي تربط الذرات بعضها ببعضها الآخر تتوقف على السوية الطاقية التي تتواجد فيها إلكترونات التكافؤ. فأكسيد الكربون غاز في الدرجة العادية من الحرارة والضغط الجوي. وثنائي أكسيد السيليكون جسم صلب، وأنقى أنواعه الكوارتز والرمل الكوارتزي. ففي ثنائي أكسيد الكربون رابطتان ثنائيتان (مضاعفتان). وتكون في الرابطة الثنائية إحدى الرابطتين من نوع σ والثانية من نوع π، وصيغة غاز الكربون هي صيغة حقيقية. ويتكوَّن غاز الكربون من جزيئات مستقلة. أما أكسيد السيليكون فيعطى، عادة، الصيغة SiO2 إلا أن هذه الصيغة تجريبية فقط ولا وجود لجزيئات SiO2 مستقلة، ولا وجود لرابطة π فيه. فالروابط أحادية وتشكل شبكة ضخمة من الذرات. ويعود السبب في الفرق بين الأكسيدين إلى أن المدارات p في ذرة السيليكون لا تتلاحم مع مدارات p في الأكسجين لتشكيل روابط .
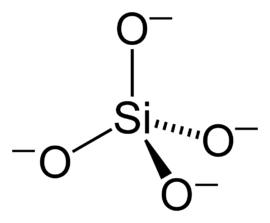
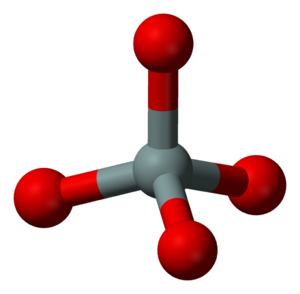
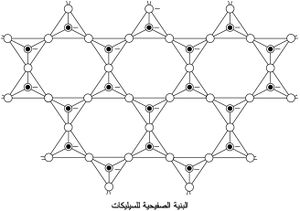
الوحدة الرئيسة في بناء السيليكات هي رباعي الوجوه SiO4 (أي شاردة الأورتو سيليكات ) تحتل ذرة سيليكون Si مركزه وتحتل رؤوسه الأربعة أربع ذرات أكسجين تمس ذرة السيليكون. وقد يكون هذا الرباعي مفرداً، أو يشترك رباعايا وجوه برأسيهما، أو تشترك الرباعيات بذراتها الأكسجينية مكونة مجموعات حلقية صغيرة أو تشكل سلاسل طويلة جداً أو صفائح لا متناهية في حدودها أو سيليكات هيكلية ذات ثلاثة أبعاد.
أبسط ضروب السيليكيات بنيةً هي الأورتوسيليكات (الشكل ـ 1) التي تحوي الشاردة السالبة ذات الشكل رباعي الوجوه. وتتعدل الشحنة الرباعية بالشحنة الموجبة للشوارد المعدنية metallic: أربع شوارد M+، أو شاردتينM2+ أو تتعدل بمجموعة من الشوارد الموجبة. وهي قليلة الانتشار في الطبيعة منها أورتوسيليكات الكلسيوم Ca2SiO4 وهي المكوّن الرئيس في أحد أصناف الإسمنت، والأوليفين المكوِّن الرئيس في البازلت بالقشرة الأرضية وتدخل في تركيبه الشوارد Fe2+ ، Mg2+ و Mn2+ والشاردة Fe2+ هي التي تمنحه اللون الزيتوني، والزركون، وضروب العقيق الأحمر.
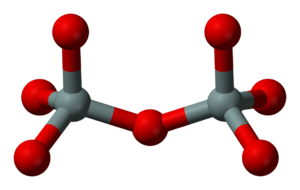
والفلزات التي تحوي شاردة بيرو سيليكات (ثنائي السيليكات) (Si2O7)6- (الشكل ـ 1) يرتبط فيها رباعيا وجوه معاً (رأس فيه أكسجين من الأول مع رأس فيه أكسجين من الثاني وتنحذف ذرة أكسجين) وهي قليلة الانتشار في الطبيعة مثل Sc2Si2O7 وZn4(OH)2Si2O7.
السيليكات الحلقية ويعرف لها نوعان يحويان الشوارد (Si3O9)6- و(Si6O18)12 (الشكل ـ 1) والصيغة العامة لمثل هذه الشوارد هي (SinO3n)2n-. وتصادف الشاردة (Si3O9)6- في الوُلاستونيت وتصادف الشاردة (Si6O18)12- في البيريل.
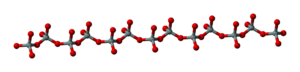
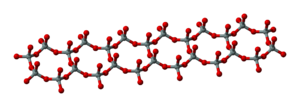
إن ارتباط رباعيات الوجوه بعضها ببعضها الاخر وفق سلاسل يؤدي إلى تشكل ميتاسيليكات
وقد تكون السلاسل مزدوجة ويؤدي هذا إلى تشكل ميتا تتراسيليكات فعندما تكون السلاسل أحادية يكون في كل رباعي وجوه أكسجينان غير مشتركين، كما هي الحال في السبوديمن وضروب البيروكسين، أما في حالة السلاسل المزدوجة فترتبط كل سلسلتين أحاديتين متوازيتين بذرات مشتركة من الأكسجين كما في الأمفيبول وفلزات الاسبستوس.
وتربط الشواردُ المعدنية السلاسلَ المتوازية فيما بينها أيضاً، وقوى الارتباط الكهراكدية هذه أضعف من الروابط في السلاسل نفسها، لذا تتميز المواد التي تتألف من سلاسل بهذا الشكل مثل الأسبستوس بأن لها بنية ليفية.
أما إذا اتحدت السلاسل معاً بصورة تامة فتتشكل بنية صفيحية صيغتها
كما هو مبيَّن في الشكل (3). تتميز الصفيحة الواحدة أنها تتشكل من تكرار الحلقة (Si6O18) في مستوٍ واحد. وتصبح ثلاث ذرات أكسجين في كل رباعي وجوه مشتركة، ويسلك الأكسجين الرابع سلوكاً كما لو كان يحوي تكافؤاً حراً. وترتبط هذه الطبقات بعضها ببعضها الآخر بقوى كهراكدية بالشوارد المعدنية. ويمكن فصل المواد التي لها هذه البنية إلى صفائح أو وريقات. ولكثير من الفلزات المهمة هذه البنية الصفيحية مثل الكاولين Al2(OH)4Si2O5، والتلْك، وضروب الميكا: بيوتيت ومسكوفيت.
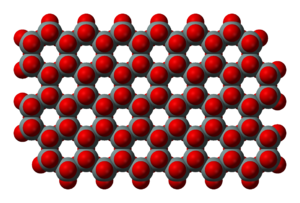
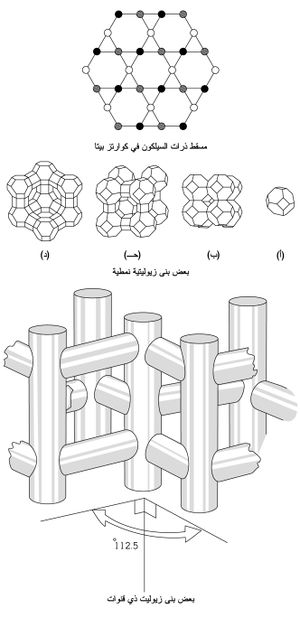
إذا تشاركت رباعيات الوجوه SiO4 برؤوسها الأربعة تنتج بنية فراغية أعقد من الصفائح اللامتناهية إذ تصبح البنية التحتية ذات ثلاثة أبعاد، وتكون كل ذرة أكسجين في رؤوس الشاردة البسيطة (SiO4)4- مشتركة بين رباعيَيْ وجوه. والصيغة التجريبية لهذه السيليكات الهيكلية هي (SiO2)n أي هي سيليس[ر]. وإذا حلّت ذرة ألمنيوم محل ذرة سيليكون في هذه السيليكات تصبح ذات شحنة سالبة، وتتعدَّل هذه الشحنة بشوارد موجبة أخرى موزعة بانتظام خلال بنيانها، مثال ذلك النوزيان Na8(Al6Si6O24)SO4 وإذا حلت الشاردة S2- في هذا المركب مكان تنتج صيغة الحجر الأزرق (النيلة). ومن السيليكات ذات البنية الهيكلية: ضروب الفلسبار، وضروب الزيوليت وهـي واسعة الانتشار فـي الطبيعة ومتنوعـة. ففي الكوارتـز (SiO2)n, β، تأخذ ذرات السيليكون مواقعها في ثلاثة مستويات ارتفاعاتها مختلفة ومسقط مراكز ذرات السيليكون على مستو واحد ذو شكل سداسي (الشكل ـ 4). وتعتبر ضروب الزيوليت الهيكلية أهم ضروب السيليكات الهيكلية فهي ألمينوسيليكات ذات بنية هيكلية تحوي شوارد موجبة وجزيئات ماء في فجواتها وهذه قابلة للحركة بسهولة مما يسمح بالتبادل الشاردي ion exchange. ويبيّن الشكل (4) بعض بنى الزيوليت النمطية: (أ) وحدة سوداليت sodalite؛ (ب) سوداليت (260 بيكومتر)؛ (ج) زيوليت A ن(420بيكومتر)؛ (د) فوجاسيت faujasite ن(1140بيكومتر). وتمثل الخطوطُ الجسورَ الأكسجينية؛ ونقاط تقاطع الخطوط هي مواقع ذرات السيليكون أو الألمنيوم. وتدل الأعداد بين قوسين على أقطار الفجوات الكائنة فيها. كما يبين الشكل (4) بنية زيوليت ZSM-5 ذي القنوات وهو يستعمل حفّازاً. القنوات الشاقولية فيه مستقيمة ولها مقطع عرضي ذو شكل بيضوي (قطع ناقص) تراوح أقطارها بين 510 و580 بيكومتر. والقنوات الأفقية شكلها خط منكسر (متعرج) ومقطعها دائري، أقطارها تراوح بين 540 و560 بيكومتر. وقد تم اصطناع زيوليتات مخبرياً. أما الحجر شبه الكريم اللازورد lapis lazuli ذو اللون الأزرق، وهو نصف شفاف إلى عاتم، فمعروف منذ العصور الغابرة. وقد تم اصطناعه ودعي ألترا مارين. وهو ألمينوسيليكات.
استعمالات ضروب السيليكات
يستعمل الزجاج المائي في صناعة الصابون ومساحيق الغسيل لتأمين وسط قلوي. كما يستعمل في صنع المواد المضادة للحريق وفي صنع الورق، ويستعمل موادَّ حافظة للبيض وصمغاً لا عضوياً للصق الخشب والزجاج والبورسلان وغيرها. أما ميتا سيليكات الصوديوم Na2SiO3. 5H2O الصلب والأورتوسيليكات الصلب Na4SiO4 وNa3HSiO4. 5H2O الصلب فجميعها مستحضرات تجارية تستعمل لإزالة عسر الماء ومستحضراتٍ للتنظيف.
أما ضروب الميكا والمسكوفيت (الميكا البيضاء) فتستعمل كثيراً في الصناعات الكهربائية موادَّ عازلة. وتتميز هذه المركبات بقابليتها للانشطار وتحولها إلى صفائح لدنة شفافة ورقيقة جداً. وتستعمل الميكا لصنع نوافذ الأفران وفي صنع «الثلج» الصنعي لتزيين شجرة الميلاد كما تستعمل مادة للتزيين في أوراق الجدران، وفي كثير من الدهانات الخاصة. أما الأسبست (الأسبستوس) فيشمل الفلزات ذات البنية الليفية، ومن أهمها الأمينت amiantus، وهو ضرب من الأسبستوس ناعم حريري مثل الكريزوتيل chrysotile وهو سيليكات مغنزيوم وأليافه مرنة يمكن جدل الطويلة منها، وقد تكون أليافه قاسية لايمكن جدلها كما في الأسبستوس الأمفيبولي amphibole asbestos الذي يتكون من ضروب سيليكات المغنزيوم والكلسيوم والصوديوم، ولهذه الفلزات بنية نسيجية، وانصهارها صعب. والأسبستوس مهم تجارياً لاستعماله عازلاً حرارياً. وتستعمل الألياف الطويلة في صنع خيط الأسبستوس ونسيجه وورقه ومنها أمكن الحصول على أدوات مقاومة للحرارة لا حصر لها. وقد ثار جدل واسع فيما يتعلق بأضرار الأسبستوس على صحة الجهاز التنفسي.
الكاولين (الصلصال الصيني) صخر رخو أبيض غير لدن يسمى أيضاً الصلصال الأبيض، وتركيبه التقريبي Al2O3.2SiO2 ويستعمل في صناعة الخزف، والتَلْك أو حجر الصابون، وهو سيليكات المغنزيوم المميهة. يستعمل التَلْك في صناعة الصابون، والحكك الافرنسي، ومسحوق (بودرة التلك)، وفي صنع الدهان والمطاط وعوازل للأسطحة. ويستعمل الشكل الليفي كثيراً في الورق. ويستعمل حجر الصابون مادة مقاومة للحرارة. وضروب البنتونيت والبيروفلّيت هي أشكال من ضروب سيليكات الألمنيوم أو الفلزات الطينية وكلاهما مهمان مالئاتٍ تجارية للمطاط والورق وأنواع الصابون. أما الفلسبار فيستعمل كثيراً في صناعة الزجاج والخزف، كما يستعمل في تغطية الإسمنت والسطوح الملوّثة لإعطائها مظهر الغرانيت.

وتستعمل ضروب الزيوليت مبادِلات شاردية ومناخل جزيئية (كأن تفصل مركبات الفحوم الهيدروجينية الخطية عن الحلقية بالاعتماد على الاختلاف في حجمها)، كما تستعمل أيضاً حفّازات (وسطاء) catalysts.
وتستعمل السيليكات في صناعة البورسلين والخزف : الخزف والخزافة، فعند شي مزيج من الصلصال (الكاولينيت) والكوارتز والفلسبار بنسب مختلفة بدرجات حرارة مختلفة تنتج تشكيلة من المنتجات الخزفية.
والزجاج هو مصهور خليط غير بلوري من أكاسيد أساسية (قاعدية) وثنائي أكسيد السيليكون. وتستعمل عادة أكاسيد المعادن القلوية أو القلوية الترابية إلا أنه يمكن أن يستبدل بها كلياً أو جزئياً أكاسيد الرصاص أو الزنك، أو الزرنيخ أو الأنتموان أو الألمنيوم وغيرها. كما يمكن استعمال أكسيد البور أو الفسفور بدلاً من أكسيد السيليكون.
يعود تاريخ صنع الإسمنت[ر] والاسمنت الأمينتي إلى ما قبل بداية القرن العشرين. ويصنع الإسمنت بتسخين مزيج من الحجر الكلسي والصلصال، أو أي مواد ذات تركيب مشابه، إلى درجة مرتفعة من الحرارة (نحو 1450 ْس). ثم يُسحَق الناتج «الآجر المقسّى» مع الجص (نحو 2 ـ3%).