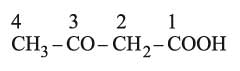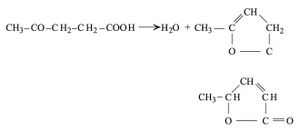حمض كيتوني
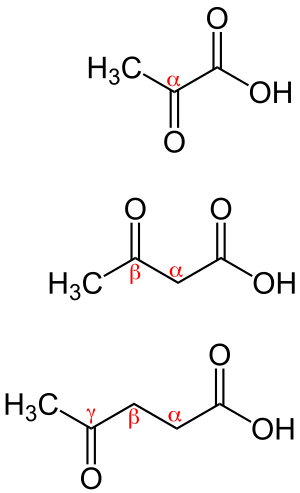
حمض كيتوني Keto acids أو oxoacids مركبات تحوي جزيئاتها وظيفتين كيمياويتين: وظيفة كربوكسيلية COOH ووظيفة كيتونية (سيتونية) C=O، وتكون هاتان الوظيفتان إما متجاورتين كما في الحموض ألفا (α) مثل R–CO–COOH، أو منفصلتين إحداها عن الأخرى بعددٍ (N) من ذرات الكربون كما في الحموض بيتا (β) مثل R–CO–CH2–COOH أو گاما (γ) أو دلتا(δ) .
وتـسمى الحموض الكيتونية عادة باسـتخدام البادئة [[أوكسو OXO متبوعة بـاسـم الحمض الكربوكسيلي الموافق، ويعرف الكثير منها بأسـماء خاصة شاعت لـسهولتـها وقصرها مثل CH3COCOOH و(2- أوكـسو البروبانوئيك) واسمه الشائع حمض البيروفيك pyruvic، ومثل: CH3COCH2COOH (أوكسو - 3 البوتانوئيك) واسمه الشائع حمض أستيل الخل acetoacetic acid.
الحموض الكيتونية - α
من بين طرائق تحضير هذه الحموض فعل كلوريد الحمض (كلوريد الأستيل مثلاً) في [[سيانيد النحاسي (نحاس أحادي التكافؤ) ثم حلمهة hydrolysis الناتج:
وتنتج هذه الحموض أيضاً عند تطبيق طريقة تحضير أخرى انطلاقاً من الإستر الثنائي أوكسالو أسيتات الإتيل، وذلك بنزع [[الكربوكسيل من الحموض الثنائية الكيتونية بالتسخين:
الحموض الكيتونية ألفا مركبات قليلة الثبات وتتفكك بالتسخين في وسط حمضي معطية ألدهيدات.
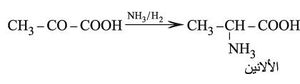
إن حمض البيروفيك (حمض الحصرم الناري) CH3.CO–COOH أبسط هذه الحموض وهو عبارة عن سائل لزج شره للماء، ويحضر من تفكك حمض الطرطير HOOC–CHOH–CHOH–COOH بتسخينه مع كبريتات البوتاسيوم الحامضة فيتبلمه (يخسر الماء) ويُنْزَعُ كربوكسيله. وهوحمض قوي يعطي أملاحاً تسمى البيروفات ويملك خواص مرجعة بسبب تفككه إلى ألدهيد الخل، ويمكن إرجاعه إلى حمض اللبن CH3–CHOH–COOH إرجاعاً كيميائياً أو حيوياً بوساطة الخمائر المناسبة. ويتكون أيضاً كمركب متوسط intermediate أثناء التخمر الغولي للجلوكوز، وكذلك في أثناء استقلاب السكريات، كما أنه يؤدي دوراً حيوياً في اصطناع الألانين، الحمض الأميني الذي يدخل في تركيب بروتينات عدة:
الحموض الكيتونية - β
هي أكثر أهمية من الحموض ألفا، ويعد حمض أستيل الخل
ومشتقاته الألكيلية على الكربونين 2 و4 أهم هذه الحموض. وتحضر عموماً بحلمهة الإسترات الموافقة بلطف لضعف ثباتها حرارياً.
ويتم تحضير هذه الإسترات بتفاعل كلايْزِن Claisen وذلك بتكاثف جزيئين من الإستر بتأثير قلوي قوي مثل إيتيلات الصوديوم أو أميد الصوديوم.
أستيل أسيتات الإتيل
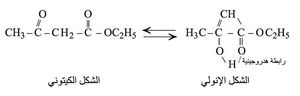
وكما هي عليه الحال في الكيتونات البسيطة R–CO–CH3 نصادف في هذه الإسترات التصاوغ (التماكب) الكيتوني الإنولي إلاّ أن نسبة الإنول في المزيج المتوازن لهذه الإسترات أكبر بكثير وتصل إلى نحو 10% في المحلول المائي (حالة أستيل أسيتات الإتيل) بينما نجدها بحدود 1.5×10-5% في حالة الأستون CH3–CO–CH3. ويمكن أن نعزو هذا الارتفاع إلى حركية الهدروجين الكبيرة وإلى وجود الرابطة الهدروجينية داخل جزيء الإنول.
ويمكن نزع البروتون الحركي للمجموعة CH2 بفعل القلويات الشديدة وتكوين مشتقات معدنية يمكن أَلْكَلَتها بفعل المشتقات الهالوجينية بسهولة:
كذلك تعطي الإسترات الناتجة بالحلمهة اللطيفة في وسط قلوي أو حمضي ممدد، حموضاً كيتونية متبادلة تؤدي بعد خسارة CO2 إلى مركبات كيتونية CH3–CO–CH2–R (اصطناع الكيتونات من أسيتيل أسيتات الإتيل). ولكن الفعل الشديد للوسط القلوي المركز يؤدي إلى شطرها وتكوُّن جزيئين من الحمض.
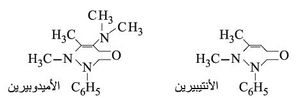
ويتكاثف إستر أستيل الخل مع الفينيل هيدرازين NH–NH2 – مكوناً حلقة غير متجانسة تسمى البيرازولون pyrazolone التي تدخل في بنية بعض الملونات وبعض الأدوية مثل الأنتيبيرين antipyrine والأميدوبيرين amidopyrine.
الحموض الكيتونية - γ
هي أقل الحموض الكيتونية أهمية ويعد حمض الليفوليك Levulic من أبسطها CH3–CO–CH2–CH2COOH، وهو ينشأ عن فعل الحموض المعدنية المركزة في السكريات سداسية الكربون C6، كما يتكون عند أكسدة المطاط.[1]
إن الحموض الكيتونية غاما أكثر ثباتاً من الحموض ألفا أو بيتا، إلا أنها مع ذلك تفقد ماءها بالحرارة معطية لكتونات إتيلينية:
المصادر
- ^ محمد عمار الخياط. "الحموض الكيتونية". الموسوعة العربية.
انظر أيضاً
وصلات خارجية
| هذا organic chemistry article هو بذرة. بإمكانك مساعدة المعرفة بأن تنمـِّـيـه. |