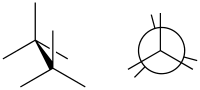
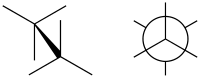
تشاكل مكسوف
في الكيمياء التشاكل المكسوف Eclipsed conformation هو نوع من أنواع التشكل الكيميائي يتواجد بين ذرتين في أى سلسلة مفتوحة مفردة الرابطة بين مدارين مهجنين sp3 وتصل الطاقة فيها لأعلى مستوياتها نظرا لوجود الإعاقة الفراغية.
وفى مثال الإيثان يظهر مسقط نيومان أن الدوران حول رابطة C-C ليس كامل الحرية ولكن توجد حواجز طاقة. وجزيء الإيثان في التشكل المكسوف يعاني من إجهاد الفتل وبحدوث دوران حول رابطة C-C فإنه عند حدوث الدوران بعد التشكل المكسوف تنطلق طاقة فتل مقدارها 12.5 كيلو جول/مول.

تطبيقات بنيوية
As established by X-ray crystallography, octachlorodimolybdate(II) anion ([Mo2Cl8]4-) has an eclipsed conformation. This sterically unfavorable geometry is given as evidence for a quadruple bond between the Mo centers.[1]
Experiments such as X-ray and electron diffraction analyses, nuclear magnetic resonance, microwave spectroscopies, and more have allowed researchers to determine which cycloalkane structures are the most stable based on the different possible conformations. Another method that was shown successful is molecular mechanics, a computational method that allows the total strain energies of different conformations to be found and analyzed (see also chemical bonding: Computational approaches to molecular structure). It was found that the most stable conformations had lower energies based on values of energy due to bond distances and bond angles.[2]
In many cases, isomers of alkanes with branched chains have lower boiling points than those that are unbranched, which has been shown through experimentation with isomers of C8H18. This is because of a combination of intermolecular forces and size that results from the branched chains. The more branches that an alkane has, the more extended its shape is; meanwhile, if it is less branched then it will have more intermolecular attractive forces that will need to be broken which is the cause of the increased boiling point for unbranched alkanes. In another case, 2,2,3,3-tetramethylbutane is shaped more like an ellipsoid causing it to be able to form a crystal lattice which raises the melting point of the molecule because it will take more energy to transition from a solid to a liquid state.[2]
انظر أيضاً
المراجع
- ^ Brignole, A. B.; Cotton, F. A.; Dori, Z. (1972). Rhenium and Molybdenum Compounds Containing Quadruple Bonds. Inorganic Syntheses. Vol. 13. pp. 81–89. doi:10.1002/9780470132449.ch15. ISBN 978-0-470-13244-9.
{{cite book}}:|journal=ignored (help) - ^ أ ب "hydrocarbon - Three-Dimensional Structures". Britannica. Retrieved November 15, 2022.