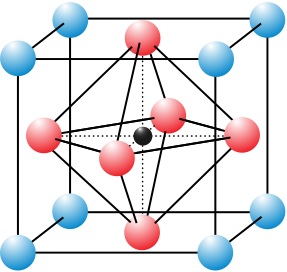
بنية الپيروڤسكيت



تكون بنية الپيروڤسكيت إنگليزية: Perovskite structure بلورية ذات الصيغة ABX3، وقد اكتشفت لأول مرة كمعدن يُسمى بالپيروڤسكيت، والذي يتكون من أكسيد الكالسيوم تيتانيوم (CaTiO3).[2] اكتُشف المعدن لأول مرة في جبال الأورال في روسيا بواسطة گوستاڤ روز في عام 1839 وأُطلق عليه اسمه تيمناً بعالم المعادن الروسي ليڤ پيروڤسكي (1792-1856). تمثل 'A' و'B' أيونات مشحونة إيجابياً (أي كاتيونات) وغالباً ما يكون حجمها مختلفاً، و'X' هو أيون مشحون سلبياً (أنيون، غالباً أكسيد) يتشكل رابطة بين الكاتيونات الاثنين. تكون ذرات 'A' عموماً أكبر من ذرات 'B'. تتميز البنية المكعبة المثالية بوجود الكاتيون 'B' في تنسيق سداسي الأضلاع، محاطاً بأنيونات ثمانية الأوجه، والكاتيون 'A' في تنسيق مكعبي. قد تكون هناك أشكال إضافية للبيروفسكيت حيث يكون لكل من المواقع 'A' و'B' تكوين يتألف من A1x-1A2x and/or B1y-1B2y، وقد تختلف الإعدادات الكيميائية للأنيونات X عن التكوين المثالي بينما يحدث التغير في حالات التأكسد للأيونات داخل المواقع A و B.[3]
كونها واحدة من أكثر المجموعات البنيوية وفرةً، يوجد البيروفسكيت في عدد هائل من المركبات التي تتمتع بخصائص وتطبيقات وأهمية متنوعة.[4] المركبات الطبيعية التي تحتوي على هذا الهيكل تشمل البيروفسكيت واللوباريت وسيليكات البيروفسكيت بريدجمانيت.[2][5] منذ اكتشاف خلايا البيروفسكيت الشمسية في عام 2009، والتي تحتوي على بيروفسكيت هاليد الرصاص ميثيل أمونيوم، يوجد اهتمام كبير بالبحث في مواد البيروفسكيت.[6]
البنية
تعتمد بنية البيروفسكيت على العديد من [أكسيد|الأكاسيد]] التي تحمل الصيغة الكيميائية ABO3. الشكل المثالي المثالي للبنية هو الشكل المكعب (الزمرة الفراغية Pm3m، رقم 221) الذي نادراً ما يواجه. البنية المعينية القائمة (على سبيل المثال، الزمرة الفراغية Pnma، رقم 62، أو Amm2، رقم 68) والرباعية الزوايا (على سبيل المثال، الزمرة الفراغية I4/mcm، رقم 140، أو P4mm، رقم 99) هي الأشكال غير المكعبة الأكثر شيوعاً. على الرغم من أن بنية البيروفسكيت تأخذ اسمها من مركب CaTiO3، إلا أن هذا المعدن ذو شكل غير مثالي. SrTiO3 and CaRbF3 هي أمثلة على البيروفسكيت المكعب. تيتانات الباريوم هو مثال على بيروفسكيت يمكن أن يأخذ الأشكال المتراجحة (الزمرة الفراغية R3m، رقم 160) والبنية المعينية القائمة والرباعية الزوايا اعتماداً على درجة الحرارة.[7]
في خلية الوحدة المكعبة المثالية لمركب من هذا النوع، يقع الذرة من النوع 'A' في موضع زاوية المكعب (0, 0, 0)، والذرة من النوع 'B' تقع في موضع الوسط البنائي (1/2, 1/2, 1/2)، وذرات الأكسجين تقع في مواضع الوجوه المركزة (1/2, 1/2, 0)، (1/2, 0, 1/2)، و(0, 1/2, 1/2). يوضح الرسم إلى اليمين الحواف للخلية القائمة المعادلة مع وجود ذرة 'A' في موضع زاوية المكعب، وذرة 'B' في المركز البنائي، وذرات الأكسجين في مواضع الوجوه المركزة.
توجد أربع فئات عامة لاقتران الكاتيونات الممكنة: A+B2+X−3، أو 1:2 بيروفسكيت، [8] A2+B4+X2−3، أو 2:4 بيروفسكيت، A3+B3+X2−3، أو 3:3 بيروفسكيت; وA+B5+X2−3، أو 1:5 بيروفسكيت.
متطلبات حجم الأيونات النسبية لاستقرار البنية المكعبة صارمة للغاية، لذلك يمكن أن يؤدي الالتواء والتشويه إلى ظهور العديد من الإصدارات المشوهة ذات التماثل الأدنى، حيث يتم تقليل أعداد تنسيق ذرات A أو ذرات B أو كلاهما. يقلل الانحناء المائل للأوكتاهيدرات BO6 من تنسيق ذرة A الأصغر حجماً من 12 إلى أقل من ذلك بقليل، في حين يتيح لذرة B الأصغر حجماً أن تحقق نمط تكوين رابطة مستقرة من خلال تحويلها عن مركز الأوكتاهيدرة. التيار الكهربائي الناتج هو المسؤول عن خاصية الكهرباء الحديدية ويتم تظهيره في الپيروڤسكيت مثل BaTiO3 التي تشوه بهذه الطريقة.
تحتوي البنى المعقدة للبيروفسكيت على اثنين من الكاتيونات المختلفة في موقع B. وهذا يؤدي إلى إمكانية وجود أشكال مرتبة وغير مرتبة.
الپيروڤسكيت ذو الطبقات
قد يكون الپيروڤسكيت مُهيكل في طبقات، حيث تكون البنية ABO 3 منفصلة بواسطة أوراق رقيقة من المادة المُدخلة. يتم تعريف أشكال مختلفة من المداخل، استناداً إلى التركيب الكيميائي للمدخل، على أنها:[9]
- طور Aurivillius phase: تتكون الطبقة المُدخلة فيها من أيونات [Bi 2O 2]2+، وتحدث كل طبقة n ABO 3، مما يؤدي إلى الصيغة الكيميائية العامة [Bi 2O 2]-A (n−1)B 2O 7. تم اكتشاف خواصها في نقل أيون الأكسيد لأول مرة في السبعينيات من قبل تاكاهاشي وزملائه، وتم استخدامها لهذا الغرض منذ ذلك الحين.[10]
- طور Dion−Jacobson phase: تتكون الطبقة المُدخلة فيها من فلز قلوي (M) في كل n طبقة n ABO 3، مما يعطي الصيغة العامة M+ A (n−1)B nO (3n+1).
ChatGPT
- طور Ruddlesden-Popper phase: تحدث الطبقة المُدخلة في أبسط الطورات بين كل طبقة واحدة (n = 1) أو طبقات متعددة (n > 1) من شبكة ABO 3. تتمتع أطوار رودليسن−بوبر بعلاقة مماثلة للپيروڤسكيت من حيث شعاع الذرة للعناصر، حيث يكون A عادةً كبيراً (مثل La[11] أو Sr[12])والأيون B يكون أصغر بكثير وعادةً يكون عنصر انتقالي (مثل Mn أو Co[11] Co[13] أو Ni[14]). أو Ni). في الآونة الأخيرة، تم تطوير بيروفسكيت[15] عضوية-لاعضوية متعددة الطبقات، حيث يتكون الهيكل من طبقة واحدة أو أكثر من أكتاهيدرات MX64--، حيث M هو فلز بتهاجيني مثل Pb2+ أو Sn2+، وX هو أيون هاليد (مثل F−
, Cl−
, Br−
, I−
)، مفصولة بطبقات من الكاتيونات العضوية (مثل كاتيون البوتيلامونيوم أو كاتيون الفينيل إثيلامونيوم).[16][17]
الأغشية الرقيقة

يمكن ترسيب الپيروڤسكايت على شكل أغشية رقيقة منتجة تباعاً على سطح پيروڤسكايتات أخرى[18] باستخدام تقنيات مثل ترسيب الليزر المنبعث بالنبضات وترسيب الجزيئات بالحزمة. يمكن أن تكون هذه الأغشية سميكة بضعة نانومترات أو حجم وحدة خلية واحدة فقط[19]يمكن استخدام التراكيب المحددة والفريدة عند الحدود بين الغشاء والمادة الأساسية لهندسة الحدود، حيث يمكن أن تنشأ خصائص جديدة.[20]يمكن أن يحدث ذلك من خلال آليات عدة، من توتر عدم التطابق بين المادة الأساسية والغشاء، تغير في تدوير أوكتاهيدر الأكسجين، تغيرات تركيبية، والحجز الكمي.[21]مثال على ذلك هو LaAlO3 المزروع بـ SrTiO3، حيث يمكن أن تظهر الحدود التوصيلية، على الرغم من أن كلاً من LaAlO3 وSrTiO3 غير موصلة.[22]مثال آخر هو نمو SrTiO3 زرع بـ LSAT ((LaAlO3)0.3 (Sr2AlTaO6)0.7) أو DyScO3، حيث يمكن أن يحوّل الإجهاد الثنائي المتماثل المطبق بطريقة كهرحديدية إلى حركة متذبذبة عند درجة حرارة الغرفة من خلال وسائل ثنائية المحور المطبقة فوق المحور الإجهاد.[23] يطبق توازن الشبكة غير المتطابق لـ GdScO3 مع SrTiO3 (+1.0%) إجهاد شد الضغط، مما يؤدي إلى انخفاض ثابت الشبكة الخارج عن المستوى في SrTiO3 مقارنةً بـ LSAT (–0.9%)، مما يؤدي إلى تطبيق إجهاد الضغط طولياً في SrTiO3 وبالتالي زيادة ثابت الشبكة الخارج عن المستوى (وبالتالي زيادة ثابت الشبكة في المستوى).[23]
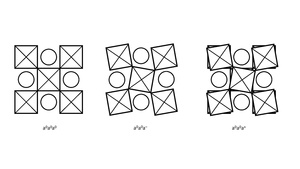
الإمالة ثمانية الأوجه
Beyond the most common perovskite symmetries (cubic, tetragonal, orthorhombic), a more precise determination leads to a total of 23 different structure types that can be found.[24] These 23 structure can be categorized into 4 different so-called tilt systems that are denoted by their respective Glazer notation.[25]
| Tilt System
number |
Tilt system symbol | Space group |
|---|---|---|
| Three-tilt systems | ||
| 1 | a+b+c+ | Immm (#71) |
| 2 | a+b+b+ | Immm (#71) |
| 3 | a+a+a+ | Im3 (#204) |
| 4 | a+b+c- | Pmmn (#59) |
| 5 | a+a+c- | Pmmn (#59) |
| 6 | a+b+b- | Pmmn (#59) |
| 7 | a+a+a- | Pmmn (#59) |
| 8 | a+b-c- | A21/m11 (#11) |
| 9 | a+a-c- | A21/m11 (#11) |
| 10 | a+b-b- | Pmnb (#62) |
| 11 | a+a-a- | Pmnb (#62) |
| 12 | a-b-c- | F1 (#2) |
| 13 | a-b-b- | I2/a (#15) |
| 14 | a-a-a- | R3c (#167) |
| Two-tilt systems | ||
| 15 | a0b+c+ | Immm (#71) |
| 16 | a0b+b+ | I4/mmm (#139) |
| 17 | a0b+c- | Bmmb (#63) |
| 18 | a0b+b- | Bmmb (#63) |
| 19 | a0b-c- | F2/m11 (#12) |
| 29 | a0b-b- | Imcm (#74) |
| One-tilt systems | ||
| 21 | a0a0c+ | C4/mmb (#127) |
| 22 | a0a0c- | F4/mmc (#140) |
| Zero-tilt systems | ||
| 23 | a0a0a0 | Pm3m (#221) |
The notation consists of a letter a/b/c, which describes the rotation around a Cartesian axis and a superscript +/—/0 to denote the rotation with respect to the adjacent layer. A “+” denotes that the rotation of two adjacent layers points in the same direction, whereas a “—” denotes that adjacent layers are rotated in opposite directions. Common examples are a0a0a0, a0a0a– and a0a0a+ which are visualized here.
أمثلة
معادن
The perovskite structure is adopted at high pressure by bridgmanite, a silicate with the chemical formula (Mg,Fe)SiO
3, which is the most common mineral in the Earth's mantle. As pressure increases, the SiO44− tetrahedral units in the dominant silica-bearing minerals become unstable compared with SiO68− octahedral units. At the pressure and temperature conditions of the lower mantle, the second most abundant material is likely the rocksalt-structured (Mg,Fe)O oxide, periclase.[2]
At the high pressure conditions of the Earth's lower mantle, the pyroxene enstatite, MgSiO3, transforms into a denser perovskite-structured polymorph; this phase may be the most common mineral in the Earth.[26] This phase has the orthorhombically distorted perovskite structure (GdFeO3-type structure) that is stable at pressures from ~24 GPa to ~110 GPa. However, it cannot be transported from depths of several hundred km to the Earth's surface without transforming back into less dense materials. At higher pressures, MgSiO3 perovskite, commonly known as silicate perovskite, transforms to post-perovskite.
پيروڤسكيتات مركبة
Although there is a large number of simple known ABX3 perovskites, this number can be greatly expanded if the A and B sites are increasingly doubled / complex AA’BB’X6.[27] Ordered double perovskites are usually denoted as A2BB’O6 where disordered are denoted as A(BB’)O3. In ordered perovskites, three different types of ordering are possible: rock-salt, layered, and columnar. The most common ordering is rock-salt followed by the much more uncommon disordered and very distant columnar and layered.[27] The formation of rock-salt superstructures is dependent on the B-site cation ordering.[28][29] Octahedral tilting can occur in double perovskites, however Jahn–Teller distortions and alternative modes alter the B–O bond length.
غيرها
Although the most common perovskite compounds contain oxygen, there are a few perovskite compounds that form without oxygen. Fluoride perovskites such as NaMgF3 are well known. A large family of metallic perovskite compounds can be represented by RT3M (R: rare-earth or other relatively large ion, T: transition metal ion and M: light metalloids). The metalloids occupy the octahedrally coordinated "B" sites in these compounds. RPd3B, RRh3B and CeRu3C are examples. MgCNi3 is a metallic perovskite compound and has received lot of attention because of its superconducting properties. An even more exotic type of perovskite is represented by the mixed oxide-aurides of Cs and Rb, such as Cs3AuO, which contain large alkali cations in the traditional "anion" sites, bonded to O2− and Au− anions.[بحاجة لمصدر]
خصائص المواد
Perovskite materials exhibit many interesting and intriguing properties from both the theoretical and the application point of view. Colossal magnetoresistance, ferroelectricity, superconductivity, charge ordering, spin dependent transport, high thermopower and the interplay of structural, magnetic and transport properties are commonly observed features in this family. These compounds are used as sensors and catalyst electrodes in certain types of fuel cells[30] and are candidates for memory devices and spintronics applications.[31]
Many superconducting ceramic materials (the high temperature superconductors) have perovskite-like structures, often with 3 or more metals including copper, and some oxygen positions left vacant. One prime example is yttrium barium copper oxide which can be insulating or superconducting depending on the oxygen content.
Chemical engineers are considering a cobalt-based perovskite material as a replacement for platinum in catalytic converters for diesel vehicles.[32]
التطبيقات
Physical properties of interest to materials science among perovskites include superconductivity, magnetoresistance, ionic conductivity, and a multitude of dielectric properties, which are of great importance in microelectronics and telecommunication. They are also some interests for scintillator as they have large light yield for radiation conversion. Because of the flexibility of bond angles inherent in the perovskite structure there are many different types of distortions which can occur from the ideal structure. These include tilting of the octahedra, displacements of the cations out of the centers of their coordination polyhedra, and distortions of the octahedra driven by electronic factors (Jahn-Teller distortions).[33] The financially biggest application of perovskites is in ceramic capacitors, in which BaTiO3 is used because of its high dielectric constant.[34][35]
الطاقة الضوئية
Synthetic perovskites have been identified as possible inexpensive base materials for high-efficiency commercial photovoltaics[37][38] – they showed a conversion efficiency of up to 26.3% reported in 2022 by Northwestern University[38][39][40] and can be manufactured using the same thin-film manufacturing techniques as that used for thin film silicon solar cells.[41] Methylammonium tin halides and methylammonium lead halides are of interest for use in dye-sensitized solar cells.[42][43] In July 2016, a team of researchers led by Dr. Alexander Weber-Bargioni demonstrated that perovskite PV cells could reach a theoretical peak efficiency of 31%.[44]
Among the methylammonium halides studied so far the most common is the methylammonium lead triiodide (CH 3NH 3PbI 3). It has a high charge carrier mobility and charge carrier lifetime that allow light-generated electrons and holes to move far enough to be extracted as current, instead of losing their energy as heat within the cell. CH 3NH 3PbI 3 effective diffusion lengths are some 100 nm for both electrons and holes.[45]
Methylammonium halides are deposited by low-temperature solution methods (typically spin-coating). Other low-temperature (below 100 °C) solution-processed films tend to have considerably smaller diffusion lengths. Stranks et al. described nanostructured cells using a mixed methylammonium lead halide (CH3NH3PbI3−xClx) and demonstrated one amorphous thin-film solar cell with an 11.4% conversion efficiency, and another that reached 15.4% using vacuum evaporation. The film thickness of about 500 to 600 nm implies that the electron and hole diffusion lengths were at least of this order. They measured values of the diffusion length exceeding 1 μm for the mixed perovskite, an order of magnitude greater than the 100 nm for the pure iodide. They also showed that carrier lifetimes in the mixed perovskite are longer than in the pure iodide.[45] Liu et al. applied Scanning Photo-current Microscopy to show that the electron diffusion length in mixed halide perovskite along (110) plane is in the order of 10 μm.[46]
For CH 3NH 3PbI 3, open-circuit voltage (VOC) typically approaches 1 V, while for CH 3NH 3PbI(I,Cl) 3 with low Cl content, VOC > 1.1 V has been reported. Because the band gaps (Eg) of both are 1.55 eV, VOC-to-Eg ratios are higher than usually observed for similar third-generation cells. With wider bandgap perovskites, VOC up to 1.3 V has been demonstrated.[45]
The technique offers the potential of low cost because of the low temperature solution methods and the absence of rare elements. Cell durability is currently insufficient for commercial use.[45]
Planar heterojunction perovskite solar cells can be manufactured in simplified device architectures (without complex nanostructures) using only vapor deposition. This technique produces 15% solar-to-electrical power conversion as measured under simulated full sunlight.[47]
الليزرات
In 2008, researchers demonstrated that perovskite can generate laser light. LaAlO3 doped with neodymium gave laser emission at 1080 nm.[48] In 2014 it was shown that mixed methylammonium lead halide (CH3NH3PbI3−xClx) cells fashioned into optically pumped vertical-cavity surface-emitting lasers (VCSELs) convert visible pump light to near-IR laser light with a 70% efficiency.[49][50]
Light-emitting diodes
Due to their high photoluminescence quantum efficiencies, perovskites may be good candidates for use in light-emitting diodes (LEDs).[51] Although the stability of perovskite LEDs is not yet as good as III-V or organic LEDs, there are plenty of ongoing research to solve this problem, such as incorporating organic molecules[52] or potassium dopants[53] in perovskite LEDs.
التحليل الكهروضوئي
In September 2014, researchers at EPFL in Lausanne, Switzerland, reported achieving water electrolysis at 12.3% efficiency in a highly efficient and low-cost water-splitting cell using perovskite photovoltaics.[54][55]
Scintillators
In 1997, scintillation properties of cerium doped lutetium aluminum perovskite (LuAP:Ce) single crystals were reported.[56] The main property of those crystals is a large mass density of 8.4 g/cm3, which gives short X- and gamma-ray absorption length. The scintillation light yield and the decay time with Cs137 radiation source are 11,400 photons/MeV and 17 ns, respectively.[57] Those properties made LUAP:Ce scintillators attractive for commercials and they were used quite often in high energy physics experiments. Until eleven years later, one group in Japan proposed Ruddlesden-Popper solution-based hybrid organic-inorganic perovskite crystals as low-cost scintillators.[58] However, the properties were not so impressive in comparison with LuAP:Ce. Until the next nine years, the solution-based hybrid organic-inorganic perovskite crystals became popular again through a report about their high light yields of more than 100,000 photons/MeV at cryogenic temperatures.[59] Recent demonstration of perovskite nanocrystal scintillators for X-ray imaging screen was reported and it is triggering more research efforts for perovskite scintillators.[60] Layered Ruddlesden-Popper perovskites have shown potential as fast novel scintillators with room temperature light yields up to 40,000 photons/MeV, fast decay times below 5 ns and negligible afterglow.[16][17] In addition this class of materials have shown capability for wide-range particle detection, including alpha particles and thermal neutrons.[61]
أمثلة للپيروڤسكيتات
البسيطة:
- تيتانات الاسترونشم
- تيتانات الكالسيوم
- تيتانات الرصاص
- Bismuth ferrite
- Lanthanum ytterbium oxide
- Silicate perovskite
- منجنيت اللانثانم
- Yttrium aluminum perovskite (YAP)
- Lutetium aluminum perovskite (LuAP)
- Lanthanum strontium manganite
- LSAT (lanthanum aluminate – strontium aluminum tantalate)
- Lead scandium tantalate
- Lead zirconate titanate
- Methylammonium lead halide
- Methylammonium tin halide
- Formamidinium tin halide
انظر أيضاً
- Antiperovskite
- Aurivillius phases
- Diamond anvil
- Goldschmidt tolerance factor
- Ruddlesden-Popper phase
- Spinel
المراجع
- ^ A. Navrotsky (1998). "Energetics and Crystal Chemical Systematics among Ilmenite, Lithium Niobate, and Perovskite Structures". Chem. Mater. 10 (10): 2787. doi:10.1021/cm9801901.
- ^ أ ب ت Wenk, Hans-Rudolf; Bulakh, Andrei (2004). Minerals: Their Constitution and Origin. New York, NY: Cambridge University Press. ISBN 978-0-521-52958-7.
- ^ N. Orlovskaya, N. Browning, ed. (2003). Mixed Ionic Electronic Conducting Perovskites for Advanced Energy Systems.
- ^ Artini, Cristina (2017-02-01). "Crystal chemistry, stability and properties of interlanthanide perovskites: A review". Journal of the European Ceramic Society (in الإنجليزية). 37 (2): 427–440. doi:10.1016/j.jeurceramsoc.2016.08.041. ISSN 0955-2219.
- ^ Bridgemanite on Mindat.org
- ^ Fan, Zhen; Sun, Kuan; Wang, John (2015-09-15). "Perovskites for photovoltaics: a combined review of organic–inorganic halide perovskites and ferroelectric oxide perovskites". Journal of Materials Chemistry A (in الإنجليزية). 3 (37): 18809–18828. doi:10.1039/C5TA04235F. ISSN 2050-7496.
- ^ Johnsson, Mats; Lemmens, Peter (2007). "Crystallography and Chemistry of Perovskites". Handbook of Magnetism and Advanced Magnetic Materials. arXiv:cond-mat/0506606. doi:10.1002/9780470022184.hmm411. ISBN 978-0470022177. S2CID 96807089.
- ^ Becker, Markus; Klüner, Thorsten; Wark, Michael (2017-03-14). "Formation of hybrid ABX3 perovskite compounds for solar cell application: first-principles calculations of effective ionic radii and determination of tolerance factors". Dalton Transactions (in الإنجليزية). 46 (11): 3500–3509. doi:10.1039/C6DT04796C. ISSN 1477-9234. PMID 28239731.
- ^ Cava, Robert J. "Cava Lab: Perovskites". Princeton University. Retrieved 13 November 2013.
- ^ Kendall, K. R.; Navas, C.; Thomas, J. K.; Zur Loye, H. C. (1996). "Recent Developments in Oxide Ion Conductors: Aurivillius Phases". Chemistry of Materials. 8 (3): 642–649. doi:10.1021/cm9503083.
- ^ أ ب Munnings, C; Skinner, S; Amow, G; Whitfield, P; Davidson, I (15 October 2006). "Structure, stability and electrical properties of the La(2−x)SrxMnO4±δ solid solution series". Solid State Ionics. 177 (19–25): 1849–1853. doi:10.1016/j.ssi.2006.01.009.
- ^ Munnings, Christopher N.; Sayers, Ruth; Stuart, Paul A.; Skinner, Stephen J. (January 2012). "Structural transformation and oxidation of Sr2MnO3.5+x determined by in-situ neutron powder diffraction" (PDF). Solid State Sciences. 14 (1): 48–53. Bibcode:2012SSSci..14...48M. doi:10.1016/j.solidstatesciences.2011.10.015. hdl:10044/1/15437.
- ^ Amow, G.; Whitfield, P. S.; Davidson, I. J.; Hammond, R. P.; Munnings, C. N.; Skinner, S. J. (January 2004). "Structural and sintering characteristics of the La2Ni1−xCoxO4+δ series". Ceramics International. 30 (7): 1635–1639. doi:10.1016/j.ceramint.2003.12.164.
- ^ Amow, G.; Whitfield, P. S.; Davidson, J.; Hammond, R. P.; Munnings, C.; Skinner, S. (11 February 2011). "Structural and Physical Property Trends of the Hyperstoichiometric Series, La2Ni(1−x)CoxO4+δ". MRS Proceedings. 755. doi:10.1557/PROC-755-DD8.10.
- ^ Stoumpos, Constantinos C.; Cao, Duyen H.; Clark, Daniel J.; Young, Joshua; Rondinelli, James M.; Jang, Joon I.; Hupp, Joseph T.; Kanatzidis, Mercouri G. (2016-04-26). "Ruddlesden–Popper Hybrid Lead Iodide Perovskite 2D Homologous Semiconductors". Chemistry of Materials. 28 (8): 2852–2867. doi:10.1021/acs.chemmater.6b00847. ISSN 0897-4756.
- ^ أ ب Xie, Aozhen; Maddalena, Francesco; Witkowski, Marcin E.; Makowski, Michal; Mahler, Benoit; Drozdowski, Winicjusz; Springham, Stuart Victor; Coquet, Philippe; Dujardin, Christophe; Birowosuto, Muhammad Danang; Dang, Cuong (2020-10-13). "Library of Two-Dimensional Hybrid Lead Halide Perovskite Scintillator Crystals". Chemistry of Materials. 32 (19): 8530–8539. doi:10.1021/acs.chemmater.0c02789. ISSN 0897-4756. S2CID 224916409.
- ^ أ ب Maddalena, Francesco; Xie, Aozhen; Arramel; Witkowski, Marcin E.; Makowski, Michal; Mahler, Benoit; Drozdowski, Winicjusz; Mariyappan, Thambidurai; Springham, Stuart Victor; Coquet, Philippe; Dujardin, Christophe (2021-03-01). "Effect of commensurate lithium doping on the scintillation of two-dimensional perovskite crystals". Journal of Materials Chemistry C (in الإنجليزية). 9 (7): 2504–2512. doi:10.1039/D0TC05647B. ISSN 2050-7534. S2CID 233789445.
- ^ Martin, L.W.; Chu, Y.-H.; Ramesh, R. (May 2010). "Advances in the growth and characterization of magnetic, ferroelectric, and multiferroic oxide thin films". Materials Science and Engineering: R: Reports. 68 (4–6): 89–133. doi:10.1016/j.mser.2010.03.001. S2CID 53337720.
- ^ Yang, G.Z; Lu, H.B; Chen, F; Zhao, T; Chen, Z.H (July 2001). "Laser molecular beam epitaxy and characterization of perovskite oxide thin films". Journal of Crystal Growth. 227–228 (1–4): 929–935. Bibcode:2001JCrGr.227..929Y. doi:10.1016/S0022-0248(01)00930-7.
- ^ Mannhart, J.; Schlom, D. G. (25 March 2010). "Oxide Interfaces--An Opportunity for Electronics". Science. 327 (5973): 1607–1611. Bibcode:2010Sci...327.1607M. doi:10.1126/science.1181862. PMID 20339065. S2CID 206523419.
- ^ Chakhalian, J.; Millis, A. J.; Rondinelli, J. (24 January 2012). "Whither the oxide interface". Nature Materials. 11 (2): 92–94. Bibcode:2012NatMa..11...92C. doi:10.1038/nmat3225. PMID 22270815.
- ^ Ohtomo, A.; Hwang, H. Y. (January 2004). "A high-mobility electron gas at the LaAlO3/SrTiO3 heterointerface". Nature. 427 (6973): 423–426. Bibcode:2004Natur.427..423O. doi:10.1038/nature02308. PMID 14749825. S2CID 4419873.
- ^ أ ب Haeni, J. H.; Irvin, P.; Chang, W.; Uecker, R.; Reiche, P.; Li, Y. L.; Choudhury, S.; Tian, W.; Hawley, M. E.; Craigo, B.; Tagantsev, A. K.; Pan, X. Q.; Streiffer, S. K.; Chen, L. Q.; Kirchoefer, S. W. (2004). "Room-temperature ferroelectricity in strained SrTiO3". Nature (in الإنجليزية). 430 (7001): 758–761. Bibcode:2004Natur.430..758H. doi:10.1038/nature02773. hdl:2027.42/62658. ISSN 1476-4687. PMID 15306803. S2CID 4420317.
- ^ Woodward, P. M. (1997-02-01). "Octahedral Tilting in Perovskites. I. Geometrical Considerations". Acta Crystallographica Section B: Structural Science (in الإنجليزية). 53 (1): 32–43. doi:10.1107/S0108768196010713. ISSN 0108-7681.
- ^ Glazer, A. M. (1972-11-15). "The classification of tilted octahedra in perovskites". Acta Crystallographica Section B: Structural Crystallography and Crystal Chemistry (in الإنجليزية). 28 (11): 3384–3392. doi:10.1107/S0567740872007976. ISSN 0567-7408.
- ^ John Lloyd; John Mitchinson (2006). "What's the commonest material in the world". QI: The Book of General Ignorance. Faber & Faber. ISBN 978-0-571-23368-7.
- ^ أ ب Vasala, Sami; Karppinen, Maarit (2015-05-01). "A2B′B″O6 perovskites: A review". Progress in Solid State Chemistry (in الإنجليزية). 43 (1): 1–36. doi:10.1016/j.progsolidstchem.2014.08.001. ISSN 0079-6786.
- ^ Serrate, D; Teresa, J M De; Ibarra, M R (2007-01-17). "Double perovskites with ferromagnetism above room temperature". Journal of Physics: Condensed Matter. 19 (2): 023201. doi:10.1088/0953-8984/19/2/023201. ISSN 0953-8984. S2CID 94885699.
- ^ Meneghini, C.; Ray, Sugata; Liscio, F.; Bardelli, F.; Mobilio, S.; Sarma, D. D. (2009-07-22). "Nature of "Disorder" in the Ordered Double Perovskite Sr2FeMoO6". Physical Review Letters. 103 (4): 046403. Bibcode:2009PhRvL.103d6403M. doi:10.1103/PhysRevLett.103.046403. PMID 19659376.
- ^ Kulkarni, A; FT Ciacchi; S Giddey; C Munnings; et al. (2012). "Mixed ionic electronic conducting perovskite anode for direct carbon fuel cells". International Journal of Hydrogen Energy. 37 (24): 19092–19102. doi:10.1016/j.ijhydene.2012.09.141.
- ^ J. M. D. Coey; M. Viret; S. von Molnar (1999). "Mixed-valence manganites". Advances in Physics. 48 (2): 167–293. Bibcode:1999AdPhy..48..167C. doi:10.1080/000187399243455. S2CID 121555794.
- ^ Alexandra Witze (2010). "Building a cheaper catalyst". Science News Web Edition.
- ^ Lufaso, Michael W.; Woodward, Patrick M. (2004). "Jahn–Teller distortions, cation ordering and octahedral tilting in perovskites". Acta Crystallographica Section B. 60 (Pt 1): 10–20. doi:10.1107/S0108768103026661. PMID 14734840.
- ^ "Capacitor Market Size, Share, Scope, Trends, Opportunities & Forecast". Verified Market Research (in الإنجليزية الأمريكية). Retrieved 2022-12-15.
- ^ Merz, Walter J. (1949-10-15). "The Electric and Optical Behavior of BaTi${\mathrm{O}}_{3}$ Single-Domain Crystals". Physical Review. 76 (8): 1221–1225. doi:10.1103/PhysRev.76.1221.
- ^ Eames, Christopher; Frost, Jarvist M.; Barnes, Piers R. F.; o'Regan, Brian C.; Walsh, Aron; Islam, M. Saiful (2015). "Ionic transport in hybrid lead iodide perovskite solar cells". Nature Communications. 6: 7497. Bibcode:2015NatCo...6.7497E. doi:10.1038/ncomms8497. PMC 4491179. PMID 26105623.
- ^ Bullis, Kevin (8 August 2013). "A Material That Could Make Solar Power "Dirt Cheap"". MIT Technology Review. Retrieved 9 May 2023.
- ^ أ ب Li, Hangqian. (2016). "A modified sequential deposition method for fabrication of perovskite solar cells". Solar Energy. 126: 243–251. Bibcode:2016SoEn..126..243L. doi:10.1016/j.solener.2015.12.045.
- ^ "Research Cell Efficiency Records" (PDF). Office of Energy Efficiency & Renewable Energy. 2020.
- ^ Zhu, Rui (2020-02-10). "Inverted devices are catching up". Nature Energy (in الإنجليزية). 5 (2): 123–124. Bibcode:2020NatEn...5..123Z. doi:10.1038/s41560-020-0559-z. ISSN 2058-7546. S2CID 213535738.
- ^ Liu, Mingzhen; Johnston, Michael B.; Snaith, Henry J. (2013). "Efficient planar heterojunction perovskite solar cells by vapour deposition". Nature. 501 (7467): 395–398. Bibcode:2013Natur.501..395L. doi:10.1038/nature12509. PMID 24025775. S2CID 205235359.
- ^ Lotsch, B.V. (2014). "New Light on an Old Story: Perovskites Go Solar". Angew. Chem. Int. Ed. 53 (3): 635–637. doi:10.1002/anie.201309368. PMID 24353055.
- ^ Service, R. (2013). "Turning Up the Light". Science. 342 (6160): 794–797. Bibcode:2013Sci...342..794S. doi:10.1126/science.342.6160.794. PMID 24233703.
- ^ "Nanoscale discovery could push perovskite solar cells to 31% efficency (sic)". 2016-07-04.
- ^ أ ب ت ث Hodes, G. (2013). "Perovskite-Based Solar Cells". Science. 342 (6156): 317–318. Bibcode:2013Sci...342..317H. doi:10.1126/science.1245473. PMID 24136955. S2CID 41656229.
- ^ Liu, Shuhao; Wang, Lili; Lin, Wei-Chun; Sucharitakul, Sukrit; Burda, Clemens; Gao, Xuan P. A. (2016-12-14). "Imaging the Long Transport Lengths of Photo-generated Carriers in Oriented Perovskite Films". Nano Letters. 16 (12): 7925–7929. arXiv:1610.06165. Bibcode:2016NanoL..16.7925L. doi:10.1021/acs.nanolett.6b04235. ISSN 1530-6984. PMID 27960525. S2CID 1695198.
- ^ Liu, M.; Johnston, M. B.; Snaith, H. J. (2013). "Efficient planar heterojunction perovskite solar cells by vapour deposition". Nature. 501 (7467): 395–398. Bibcode:2013Natur.501..395L. doi:10.1038/nature12509. PMID 24025775. S2CID 205235359.
- ^ Dereń, P. J.; Bednarkiewicz, A.; Goldner, Ph.; Guillot-Noël, O. (2008). "Laser action in LaAlO3:Nd3+ single crystal". Journal of Applied Physics. 103 (4): 043102–043102–8. Bibcode:2008JAP...103d3102D. doi:10.1063/1.2842399.
- ^ Wallace, John (28 March 2014) High-efficiency perovskite photovoltaic material also lases. LaserFocusWorld
- ^ "Study: Perovskite solar cells can double as lasers". Rdmag.com. 2014-03-28. Retrieved 2014-08-24.
- ^ Stranks, Samuel D.; Snaith, Henry J. (2015-05-01). "Metal-halide perovskites for photovoltaic and light-emitting devices". Nature Nanotechnology (in الإنجليزية). 10 (5): 391–402. Bibcode:2015NatNa..10..391S. doi:10.1038/nnano.2015.90. ISSN 1748-3387. PMID 25947963.
- ^ Wang, Heyong; Kosasih, Felix Utama; Yu, Hongling; Zheng, Guanhaojie; Zhang, Jiangbin; Pozina, Galia; Liu, Yang; Bao, Chunxiong; Hu, Zhangjun; Liu, Xianjie; Kobera, Libor; Abbrent, Sabina; Brus, Jiri; Jin, Yizheng; Fahlman, Mats; Friend, Richard H.; Ducati, Caterina; Liu, Xiao-Ke; Gao, Feng (December 2020). "Perovskite-molecule composite thin films for efficient and stable light-emitting diodes". Nature Communications. 11 (1): 891. Bibcode:2020NatCo..11..891W. doi:10.1038/s41467-020-14747-6. PMC 7021679. PMID 32060279.
- ^ Andaji‐Garmaroudi, Zahra; Abdi‐Jalebi, Mojtaba; Kosasih, Felix U.; Doherty, Tiarnan; Macpherson, Stuart; Bowman, Alan R.; Man, Gabriel J.; Cappel, Ute B.; Rensmo, Håkan; Ducati, Caterina; Friend, Richard H.; Stranks, Samuel D. (December 2020). "Elucidating and Mitigating Degradation Processes in Perovskite Light‐Emitting Diodes". Advanced Energy Materials. 10 (48): 2002676. doi:10.1002/aenm.202002676. S2CID 228806435.
- ^ Jingshan Luo; et al. (26 September 2014). "Water photolysis at 12.3% efficiency via perovskite photovoltaics and Earth-abundant catalysts". Science. 345 (6204): 1593–1596. Bibcode:2014Sci...345.1593L. doi:10.1126/science.1258307. PMID 25258076. S2CID 24613846.
- ^ "Harvesting hydrogen fuel from the Sun using Earth-abundant materials". Phys.org. Sep 25, 2014. Retrieved 26 September 2014.
- ^ Moszynski, M (11 January 1997). "Properties of the new LuAP:Ce scintillator". Nuclear Instruments and Methods in Physics Research A. 385 (1): 123–131. Bibcode:1997NIMPA.385..123M. doi:10.1016/S0168-9002(96)00875-3.
- ^ Maddalena, Francesco; Tjahjana, Liliana; Xie, Aozhen; Arramel; Zeng, Shuwen; Wang, Hong; Coquet, Philippe; Drozdowski, Winicjusz; Dujardin, Christophe; Dang, Cuong; Birowosuto, Muhammad Danang (February 2019). "Inorganic, Organic, and Perovskite Halides with Nanotechnology for High–Light Yield X- and γ-ray Scintillators". Crystals (in الإنجليزية). 9 (2): 88. doi:10.3390/cryst9020088.
- ^ Kishimoto, S (29 December 2008). "Subnanosecond time-resolved x-ray measurements using an organic-inorganic perovskite scintillator". Appl. Phys. Lett. 93 (26): 261901. Bibcode:2008ApPhL..93z1901K. doi:10.1063/1.3059562.
- ^ Birowosuto, Muhammad Danang (16 November 2016). "X-ray Scintillation in Lead Halide Perovskite Crystals". Sci. Rep. 6: 37254. arXiv:1611.05862. Bibcode:2016NatSR...637254B. doi:10.1038/srep37254. PMC 5111063. PMID 27849019.
- ^ Chen, Quishui (27 August 2018). "All-inorganic perovskite nanocrystal scintillators". Nature. 561 (7721): 88–93. Bibcode:2018Natur.561...88C. doi:10.1038/s41586-018-0451-1. PMID 30150772. S2CID 52096794.
- ^ Xie, Aozhen; Hettiarachchi, Chathuranga; Maddalena, Francesco; Witkowski, Marcin E.; Makowski, Michał; Drozdowski, Winicjusz; Arramel, Arramel; Wee, Andrew T. S.; Springham, Stuart Victor; Vuong, Phan Quoc; Kim, Hong Joo (2020-06-24). "Lithium-doped two-dimensional perovskite scintillator for wide-range radiation detection". Communications Materials (in الإنجليزية). 1 (1): 37. Bibcode:2020CoMat...1...37X. doi:10.1038/s43246-020-0038-x. ISSN 2662-4443.
للاستزادة
- Tejuca, Luis G (1993). Properties and applications of perovskite-type oxides. New York: Dekker. p. 382. ISBN 978-0-8247-8786-8.
- Mitchell, Roger H (2002). Perovskites modern and ancient. Thunder Bay, Ontario: Almaz Press. p. 318. ISBN 978-0-9689411-0-2.
وصلات خارجية
- "Cubic Perovskite Structure". Center for Computational Materials Science. U.S. Naval Research Laboratory. Archived from the original on 2008-10-08. (includes a Java applet with which the structure can be interactively rotated)
- Перовскит в Каталоге Минералов
- CS1 الإنجليزية الأمريكية-language sources (en-us)
- Short description with empty Wikidata description
- Articles containing إنگليزية-language text
- Pages using Lang-xx templates
- Articles with unsourced statements from October 2020
- Portal-inline template with redlinked portals
- Pages with empty portal template
- علم المعادن
- القدرة الشمسية
- پيروڤسكيتات
- أنواع البنى البلورية
- علم البلورات