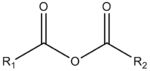
أنهيدريد
الأنهيدريد مادة كيميائية تكوِّن أحماضًا أو قواعد عندما تتحد مع الماء. مثلاً يكوِّن الماء مع ثالث أكسيد الكبريت (SO3)، وهو حمض أنهيدريد، حمض الكبريتيك H2 SO4. ويكوِّن الماء مع أكسيد الكالسيوم (CaO)، وهو أنهيدريد قاعدي، هيدروكسيد الكالسيوم القاعدي Ca(OH)2. يمكن تشكيل الأنهيدريدات بإزالة الأحماض والقواعد أو بالتركيب المباشر من مواد أخرى.
أنهيدرات حمضية هامة
أنهيدريد الخل هو كيماوي صناعي رئيس يستعمل على نطاق واسع لاعداد إسترات الخلات، مثل خلات السليولوز. أنهيدريد المالئيك هو سابق للعديد من الراتنجات بواسطة بلمرة تساهمية مع الستايرين. أنهيدريد المالئيك هو دايإنوفيل في تفاعل ديلز-ألدر.[1]
استخدامات
تشمل الاستخدامات الصناعية للأنهيدريدات صناعة الألياف الاصطناعية والبلاستيك والأفلام والتصوير الضوئي (الفوتوغرافيا) والأدوية.
المصادر
- ^ Heimo Held, Alfred Rengstl, Dieter Mayer "Acetic Anhydride and Mixed Fatty Acid Anhydrides" Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a01_065
All content in this article is created by Marefa contributors and is © Marefa. All rights reserved.