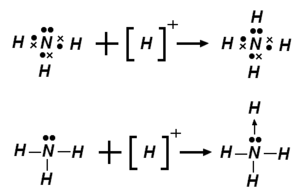أحماض وقواعد لويس
المصطلح حمض لويس Lewis acid يشير إلى تعريف للحمض نشره گلبرت لويس في 1923، ينص: مادة الحمض هي تلك التي بإمكانها توظيف زوج منفرد من جزيء آخر لإكمال المجموعة المستقرة لأحد ذراتها.[1] وبذلك، H+ هو حمض لويس، لأن بإمكانه قبول زوج منفرد، لإكمال شكلها المستقر، الذي يتطلب إلكترونين.
حمض لويس يعرف حسب الاتحاد الدولي للكيمياء البحتة والتطبيقية بأنه "الكيان الجزيئي (والفصائل الكيميائية المطابقة) التي تكون متقبلة لزوج إلكتروني وبالتالي قادرة على التفاعل مع قلوي لويس لتكوين ناتج إضافة لويس، عن طريق مشاركة المزدوج الالكتروني المقدم من قلوي لويس".[2] على سبيل المثال التفاعل بين ثلاثي مثيل البورون مع الأمونيا يعطي ناتج إضافة Me3BNH3. يعرف حمض لويس بأنه الفصيل القادر على اكتساب مزدوج الكتروني الحر. وقلوي لويس هو الفصيل الذي يمنح المزدوج الإلكتروني الحر، وبالتالي يكون H+ حمض لويس، لكونه قادراً على استقبال المزودج الحر، بينما يكون OH- و NH3 قلوي لويس، حيث باستطاعتهما تقبل المزدوج الحر.
تاريخ
نشأ هذا المفهوم باقتراح گلبرت لويس نظرية الترابط الكيميائي في 1923.[3] وقد نـُشِرت نظرية برونستد-لاوري للحمض-قاعدة في نفس السنة. وتتمايز النظريتان عن بعضهما البعض إلا أنهما متكاملتان. فقاعدي لويس هو أيضاً قاعدي برونستد-لاوري، ولكن حمض لويس لا يحتاج أن يكون حمض برونستد-لاوري.
The classification into hard and soft acids and bases (HSAB theory) followed in 1963. The strength of Lewis acid-base interactions, as measured by the standard enthalpy of formation of an adduct can be predicted by the Drago–Wayland two-parameter equation.
أحماض لويس
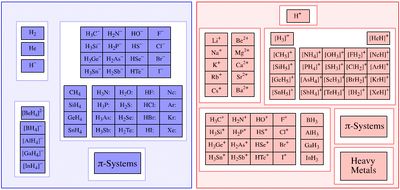
Lewis acids are diverse. Simplest are those that react directly with the Lewis base. But more common are those that undergo a reaction prior to forming the adduct.
- Examples of Lewis acids based on the general definition of electron pair acceptor include:
- the proton (H+) and acidic compounds onium ions, such as NH4+ and H3O+
- metal cations, such as Li+ and Mg2+, often as their aquo or ether complexes,
- trigonal planar species, such as BF3 and carbocations H3C+
- pentahalides of phosphorus, arsenic, and antimony
- electron poor π-systems, such as enones and tetracyanoethylene
Again, the description of a Lewis acid is often used loosely. For example, in solution, bare protons do not exist.
قواعد لويس
A Lewis base is an atomic or molecular species where the HOMO is highly localized. Typical Lewis bases are conventional amines such as ammonia and alkyl amines. Other common Lewis bases include pyridine and its derivatives. Some of the main classes of Lewis bases are
- amines of the formula NH3−xRx where R = alkyl or aryl. Related to these are pyridine and its derivatives.
- phosphines of the formula PR3−xAx, where R = alkyl, A = aryl.
- compounds of O, S, Se and Te in oxidation state 2, including water, ethers, ketones
The most common Lewis bases are anions. The strength of Lewis basicity correlates with the pKa of the parent acid: acids with high pKa's give good Lewis bases.
- Examples of Lewis bases based on the general definition of electron pair donor include:
Again, the description of a Lewis base is often used loosely. For example, in solution, hydride is unknown in solution.
The strength of Lewis bases have been evaluated for various Lewis acids, such as I2, SbCl5, and BF3.[4]
| Heats of binding of various bases to BF3 | ||
|---|---|---|
| قاعدي لويس | الذرة المعطاة | Enthalpy of Complexation (kJ/mol) |
| Et3N | N | 135 |
| quinuclidine | N | 150 |
| pyridine | N | 128 |
| Acetonitrile | N | 60 |
| Et2O | O | 78.8 |
| THF | O | 90.4 |
| acetone | O | 76.0 |
| EtOAc | O | 75.5 |
| DMA | O | 112 |
| DMSO | O | 105 |
| Tetrahydrothiophene | S | 51.6 |
| PMe3 | P | 97.3 |
تطبيقات قواعد لويس
انظر أيضاً
مراجع
- ^ Lewis, G.N., Valence and the Structure of Atoms and Molecules (1923) p. 142.
- ^ http://goldbook.iupac.org/L03508.html
- ^ Miessler, L. M., Tar, D. A., (1991) p166 - Table of discoveries attributes the date of publication/release for the Lewis theory as 1923.
- ^ Christian Laurence and Jean-François Gal "Lewis Basicity and Affinity Scales : Data and Measurement" Wiley, 2009. ISBN 9780470749579.