الواصمات الحيوية للشيخوخة
الواصمات الحيوية للشيخوخة (بالانگليزية Biomarkers of aging) بالاتينية (Biomarkers senescentis) هي واصمات حيوية يمكن أن تتنبأ بالقدرة الوظيفية في سن متأخر أفضل من العمر الزمني.[1]وبطريقة أخرى، فإن الواصمات الحيوية للشيخوخة تعطي "العمر البيولوجي" الحقيقي، والذي قد يختلف عن العمر الزمني.
ستسمح الواصمات الحيوية المصدق عليها للشيخوخة باختبار التدخلات لإطالة العمر، لأن التغييرات في الواصمات الحيوية يمكن ملاحظتها طوال عمر الكائن الحي.[1]على الرغم من أن الحد الأقصى للعمر سيكون وسيلة للتحقق من صحة الواصمات الحيوية للشيخوخة، إلا أنه لن يكون وسيلة عملية للأنواع طويلة العمر مثل البشر لأن الدراسات الطولية ستستغرق وقتًا طويلاً.[2]من الناحية المثالية، يجب أن تقايس الواصمات الحيوية للشيخوخة العملية البيولوجية للشيخوخة وليس التأهب للمرض، ويجب أن تتسبب في الحد الأدنى من الصدمات للمقايسة في الكائن الحي، ويجب أن تكون قابلة للقياس بشكل قابل للتكاثر خلال فترة قصيرة مقارنة بعمر الكائن الحي.[1]يمكن أن يطلق على مجموعة بيانات الواصم الحيوي للكائن الحي "النمط العمري" الخاص به.[3]
على الرغم من أن شيب الشعر يزداد مع تقدم العمر،[4]لا يمكن وصف شيب الشعر بأنه واصم حيوي للشيخوخة. وبالمثل، فإن تجاعيد الجلد والتغيرات الشائعة الأخرى التي تظهر مع تقدم العمر ليست مؤشرات أفضل للوظائف المستقبلية من العمر الزمني. واصل علماء الشيخوخة الحيوية جهودهم للعثور على الواصمات الحيوية للشيخوخة والتحقق من صحتها، لكن النجاح حتى الآن كان محدودًا. تم استخدام مستويات خلايا الذاكرة التائية CD4 و CD8 والخلايا التائية الغير بالغة لإعطاء تنبؤات جيدة بالعمر المتوقع للفئران في منتصف العمر.[5]
سمح التقدم في تحليل البيانات الضخمة بتطوير أنواع جديدة من "ساعات الشيخوخة". ساعة الشيخوخة هي واصم حيوي واعد للشيخوخة ويمكنها أن تتنبأ بدقة بالعمر الزمني للإنسان.[6]يمكن أيضًا استخدام الكيمياء الحيوية الأساسية للدم وعدد الخلايا للتنبؤ بدقة بالعمر الزمني.[7]أظهرت دراسات أخرى للساعة الدموية على مجموعات البيانات الكبيرة من سكان كوريا الجنوبية وكندا وأوروبا الشرقية أن الواصمات الحيوية للشيخوخة قد تكون خاصة بالسكان ويمكن أن تنبئ بالوفيات.[8] من الممكن أيضًا التنبؤ بالعمر الزمني للإنسان باستخدام الساعة النسخية.[9]
أدى الإدخال الأخير لأجهزة الاستشعار منخفضة الطاقة والمضغوطة، استنادًا إلى الأنظمة الكهروميكانيكية الصغري (MEMS)، إلى ظهور جيل جديد من الأجهزة القابلة للارتداء وذات اسعار معقولة التي توفر فرصًا لا مثيل لها لجمع وتخزين السحابي لسجلات الأنشطة الرقمية الشخصية . وبالتالي، يمكن استخدام تقنيات التعلم الآلي العميق الحديثة لإنتاج واصم حيوي رقمي لإثبات المفهوم للعمر في شكل توقع جميع الأسباب والوفيات من مجموعة كبيرة كافية من تدفقات النشاط البدني البشري لمدة أسبوع واحد معززة من قبل البيانات السريرية الغنية (بما في ذلك سجل الوفيات، على النحو المنصوص عليه، على سبيل المثال، دراسة استقصاء الصحة الوطنية وفحص التغذية).[10]
الواصمات التخلقية
فقدان الهيستونات
واصم تخلقي جديد وجد في دراسات خلايا الشيخوخة هي فقدان الهيستونات . تظهر معظم الأدلة أن فقدان الهيستونات مرتبط بانقسام الخلايا. في شيخوخة الخميرة وتقسيمها، أظهر MNase-seq (تسلسل النوكلياز للمكيرة) فقدًا في الجسيمات النووية بنسبة 50 ٪ تقريبًا. تعتبر كمية الهيستون المناسبة مهمة في الخميرة كما هو موضح من إطالة العمر الذي شوهد في السلالات التي تفرط في التعبير عن الهيستونات.[11]نتيجة فقدان الهيستون في الخميرة هو تضخيم النسخ . في الخلايا الأصغر سنًا، تمتلك الجينات التي يتم تحفيزها مع العمر هياكل كروماتينية محددة، مثل تحديد المواقع النووية الغامضة، وعدم وجود منطقة مستنفدة الجسيم النووي (NDR) عند المحفز، وضعف طور الكروماتين، وتكرار أعلى لعناصر TATA، وزيادة إشغال عوامل الكروماتين القمعية. ومع ذلك، في الخلايا الأكبر سنًا، يكون فقدان الجسيمات النووية نفسها في المحفز أكثر انتشارًا مما يؤدي إلى زيادة نسخ هذه الجينات.[11]
لا تظهر هذه الظاهرة في الخميرة فحسب، بل شوهدت أيضًا في الديدان المسنة، وأثناء شيخوخة الخلايا الليفية الأولية ثنائية الصبغيات البشرية، وفي الخلايا البشرية الهرمية. في الخلايا الليفية الأولية للإنسان، لوحظ أن التوليف المنخفض للهيستونات الجديدة كان نتيجة لتقصير القسيمات الطرفية التي تنشط استجابة تلف الحمض النووي. قد يكون فقدان الهستونات الأساسية واصمة تخلقية عامة للشيخوخة عبر العديد من الكائنات الحية.[12]
متغيرات الهيستون
بالإضافة إلى الهستونات الأساسية، H2A، H2B، H3، و H4، هناك إصدارات أخرى من بروتينات الهيستون التي يمكن أن تكون مختلفة بشكل كبير في تسلسلها وهي مهمة لتنظيم ديناميكا الكروماتين. هيستون H3.3 هو متغير من هيستون H3 مدمج في الجينوم بشكل مستقل عن الاستنساخ. إنه الشكل الرئيسي للهيستون H3 الذي يظهر في كروماتين الخلايا البشرية الشائخة، ويبدو أن زيادة H3.3 يمكن أن تؤدي إلى الهرم.[12]
هناك العديد من المتغيرات من هيستون 2، وأكثرها تورطًا في الشيخوخة هو ماكرو H2A. يُفترض عمومًا أن وظيفة الماكرو H2A هي إسكات النسخ ؛ في الآونة الأخيرة، تم اقتراح أن الماكرو H2A مهم في قمع النسخ في بؤر الهيتروكروماتين المرتبطة بـ الهرم (SAHF).[12]الكروماتين الذي يحتوي على الماكرو H2A منيع لبروتينات إعادة التشكيل المعتمدة على أدينوزين ثلاثي الفوسفات ولربط عوامل النسخ.[13]
تعديلات الهيستون
تساهم زيادة أستلة الهستونات في اتخاذ الكروماتين حالة أكثر ترابطاً مع تقدم الكائن الحي، على غرار زيادة النسخ الملحوظ بسبب فقدان الهيستونات.[14]هناك أيضًا انخفاض في مستويات H3K56ac أثناء الشيخوخة وزيادة في مستويات.[11] زيادة H4K16ac في خلايا الخميرة القديمة مرتبط مع انخفاض في مستويات HDAC Sir2، والتي يمكن أن تزيد من عمر عندما يتم التعبيرة عنها بشكل كبير.[11]
تم ربط مثيلة الهيستونات بتنظيم فترة الحياة في العديد من الكائنات الحية، على وجه التحديد H3K4me3، علامة تنشيط، و H4K27me3، علامة تثبيط في الديدان الخيطية، يؤدي فقدان أي من بروتينات Trithorax الثلاثة التي تحفز ثلاثي ميثيل H3K4 مثل WDR-5 و ناقلات الميثيل SET-2 و ASH-2 إلى خفض مستويات H3K4me3 وزيادة فترة الحياة. يؤدي فقدان الإنزيم الذي يزيل الميثيل H3K4me3، RB-2 إلى زيادة مستويات H3K4me3 في الديدان الخطية ويقلل من فترات حياتها.[14] في قشرة الفص الجبهي للمخ في المكاك ريسوسي، يزيد H3K4me2 في المحفزات والمعززات أثناء تطور ما بعد الولادة والشيخوخة.[15] تعكس هذه الزيادات تدريجيًا هياكل كروماتين أكثر نشاطًا ونسخاً يمكن الوصول إليها (أو مفتوحة) بشكل تدريجي والتي ترتبط غالبًا باستجابات الإجهاد مثل استجابة تلف الحمض النووي. قد تشكل هذه التغييرات ذاكرة تخلقية للضغوط والأضرار التي يعاني منها الكائن الحي أثناء نموه وتقدمه.[15]
يلعب UTX-1، وهو نازع المثيلة H3K27me3 نازع المثيلة، دورًا مهمًا في شيخوخة الديدان المدورة : زيادة تعبير utx-1 يرتبط بانخفاض في H3K27me3 وانخفاض في العمر. أظهر تكسير Utx-1 زيادة فيفترة الحياةالافتراضي[14]التغيرات في مستويات H3K27me3 تؤثر أيضًا على خلايا الشيخوخة في ذبابة الفاكهة والبشر.
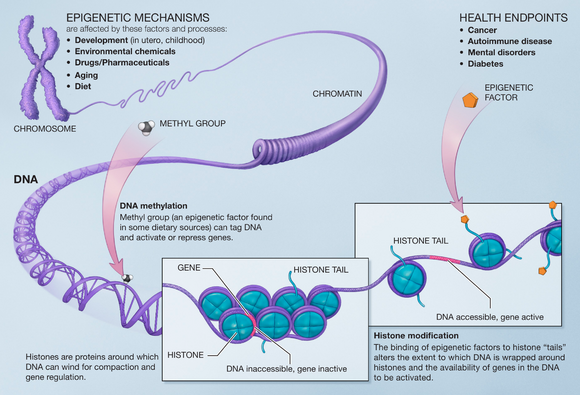
مثيلة الدنا
مثيلة الحمض النووي هو تعديل شائع في خلايا الثدييات. تتم ميثلة قاعدة السيتوزين وتصبح 5-ميثيل سيتوزين، غالبًا عندما تكون في سياق ثنائي النوكليوتيد CpG .ترتبط فرط المثيلة لجزر CpG بقمع النسخ ويرتبط فرط المثيلة لهذه المواقع بتنشيط النسخ. أظهرت العديد من الدراسات أن هناك فقدانًا لمثيلات الدنا أثناء الشيخوخة في العديد من الأنواع مثل الجرذان والفئران والأبقار والهامستر والبشر. لقد ثبت أيضًا أن DNMT1 و DNMT3a ينخفضان مع تقدم العمر ويزيد DNMT3b.[16]
يمكن أن يقلل نقص المثيلة للحمض النووي من الاستقرار الجيني، ويحث على إعادة تنشيط الجينات القافزة، ويسبب فقدان الدمغ، وكل ذلك يمكن أن يساهم في تطور السرطان والتسبب في المرض.[16]
الواصمات الحيوية المناعية
تشير البيانات الحديثة إلى أن زيادة تواتر خلايا CD8 + T الهرمة في الدم المحيطي يرتبط بتطورفرط السكر في الدم من حالة ما قبل السكري مما يشير إلى أن الشيخوخة تلعب دورًا في الشيخوخة الأستقلابية. يمكن استخدام خلايا Cd8 + T الهرمة كواصم حيوي للإشارة إلى الانتقال من مرحلة ما قبل السكري إلى فرط السكر في الدم الواضح.[17]
في الآونة الأخيرة، قام هاشيموتو وزملاؤه في العمل بتحديد وصف آلاف الخلايا المناعية المنتشرة من الخلايا المعمرين بدقة وحيدة الخلية. لقد حددوا زيادة فريدة جدًا في خلايا CD4 T السامة للخلايا في هؤلاء المعمرين. بشكل عام، تحتوي خلايا CD4 T على وظائف مساعدة، ولكن ليست سامة للخلايا، في ظل الظروف الفسيولوجية، ولكن هؤلاء المعمرين، الذين تعرضوا لتوصيف خلية واحدة لمستقبلات الخلايا التائية الخاصة بهم، كشفوا عن تراكمات من الخلايا التائية CD4 T السامة للخلايا من خلال التوسع النسيلي. قد يكون تحويل الخلايا التائية CD4 المساعدة إلى مجموعة متنوعة سامة للخلايا تكيفًا مع المرحلة المتأخرة من الشيخوخة مما يساعد في مكافحة العدوى ويحتمل أن يعزز مراقبة الورم.[18]
تطبيقات الواصمات الحيوية للشيخوخة
الآليات الرئيسية التي تم تحديدها كواصمات حيوية محتملة للشيخوخة هي مثيلة الحمض النووي، وفقدان الهستونات، وتعديل هيستون. إن استخدامات الواصامات الحيوية للشيخوخة منتشرة في كل مكان، كما أن تحديد المعلمة الفيزيائية للشيخوخة البيولوجية من شأنه أن يسمح للبشر بتحديد العمر الحقيقي، والوفيات، والمرض.[11] يجب أن يكون التغيير في الواصم الحيوي الفيزيائي متناسبًا مع التغيير في عمر النوع. وبالتالي، بعد إنشاء واصم حيوي للشيخوخة، سيكون البشر قادرين على الغوص في البحث حول إطالة فترات الحياة وإيجاد جداول زمنية لظهور الأمراض الوراثية المحتملة.
سيسمح أحد تطبيقات هذه النتيجة بتحديد العمر البيولوجي للشخص. تستخدم مثيلة الحمض النووي بنية الحمض النووي في مراحل مختلفة من الحياة لتحديد العمر. مثيلة الحمض النووي هي مثيلة السيستين في منطقة CG أو Cpg. يرتبط فرط المثيلة في هذه المنطقة بانخفاض نشاط النسخ والعكس في حالة نقص المثيلة. بعبارة أخرى، كلما احتفظت منطقة الحمض النووي "بإحكام" أكثر، كلما كانت الأنواع أكثر استقرارًا و "أصغر". بالنظر إلى خصائص مثيلة الحمض النووي في الأنسجة، وجد أنها تكاد تكون صفرًا للأنسجة الجنينية، ويمكن استخدامها لتحديد تسارع العمر ويمكن استنساخ النتائج في أنسجة الشمبانزي.[19]
انظر أيضاً
المصادر
- ^ أ ب ت Baker GT, Sprott RL (1988). "Biomarkers of aging". Experimental Gerontology. 23 (4–5): 223–39. doi:10.1016/0531-5565(88)90025-3. PMID 3058488. S2CID 31039588.
- ^ Harrison, Ph.D., David E. (November 11, 2011). "V. Life span as a biomarker". Jackson Laboratory. Archived from the original on April 26, 2012. Retrieved 2011-12-03.
- ^ Ahadi, Sara; Zhou, Wenyu; Schüssler-Fiorenza Rose, Sophia Miryam; Sailani, M. Reza; Contrepois, Kévin; Avina, Monika; Ashland, Melanie; Brunet, Anne; Snyder, Michael (2020). "Personal aging markers and ageotypes revealed by deep longitudinal profiling". Nature Medicine. 26 (1): 83–90. doi:10.1038/s41591-019-0719-5. PMC 7301912. PMID 31932806.
- ^ Van Neste D, Tobin DJ (2004). "Hair cycle and hair pigmentation: dynamic interactions and changes associated with aging". Micron. 35 (3): 193–200. doi:10.1016/j.micron.2003.11.006. PMID 15036274.
- ^ Miller RA (April 2001). "Biomarkers of aging: prediction of longevity by using age-sensitive T-cell subset determinations in a middle-aged, genetically heterogeneous mouse population". The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 56 (4): B180-6. doi:10.1093/gerona/56.4.b180. PMC 7537444. PMID 11283189.
- ^ Horvath S (2013). "DNA methylation age of human tissues and cell types". Genome Biology. 14 (10): R115. doi:10.1186/gb-2013-14-10-r115. PMC 4015143. PMID 24138928.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Putin E, Mamoshina P, Aliper A, Korzinkin M, Moskalev A, Kolosov A, Ostrovskiy A, Cantor C, Vijg J, Zhavoronkov A (May 2016). "Deep biomarkers of human aging: Application of deep neural networks to biomarker development". Aging. 8 (5): 1021–33. doi:10.18632/aging.100968. PMC 4931851. PMID 27191382.
- ^ Mamoshina P, Kochetov K, Putin E, Cortese F, Aliper A, Lee WS, Ahn SM, Uhn L, Skjodt N, Kovalchuk O, Scheibye-Knudsen M, Zhavoronkov A (October 2018). "Population Specific Biomarkers of Human Aging: A Big Data Study Using South Korean, Canadian, and Eastern European Patient Populations". The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 73 (11): 1482–1490. doi:10.1093/gerona/gly005. PMC 6175034. PMID 29340580.
- ^ Peters MJ, Joehanes R, Pilling LC, Schurmann C, Conneely KN, Powell J, et al. (October 2015). "The transcriptional landscape of age in human peripheral blood". Nature Communications. 6: 8570. Bibcode:2015NatCo...6.8570.. doi:10.1038/ncomms9570. PMC 4639797. PMID 26490707.
- ^ Pyrkov TV, Slipensky K, Barg M, Kondrashin A, Zhurov B, Zenin A, Pyatnitskiy M, Menshikov L, Markov S, Fedichev PO (March 2018). "Extracting biological age from biomedical data via deep learning: too much of a good thing?". Scientific Reports. 8 (1): 5210. Bibcode:2018NatSR...8.5210P. doi:10.1038/s41598-018-23534-9. PMC 5980076. PMID 29581467.
- ^ أ ب ت ث ج Sen P, Shah PP, Nativio R, Berger SL (August 2016). "Epigenetic Mechanisms of Longevity and Aging". Cell. 166 (4): 822–839. doi:10.1016/j.cell.2016.07.050. PMC 5821249. PMID 27518561.
- ^ أ ب ت Pal S, Tyler JK (July 2016). "Epigenetics and aging". Science Advances. 2 (7): e1600584. Bibcode:2016SciA....2E0584P. doi:10.1126/sciadv.1600584. PMC 4966880. PMID 27482540.
- ^ Zhang R, Poustovoitov MV, Ye X, Santos HA, Chen W, Daganzo SM, et al. (January 2005). "Formation of MacroH2A-containing senescence-associated heterochromatin foci and senescence driven by ASF1a and HIRA". Developmental Cell. 8 (1): 19–30. doi:10.1016/j.devcel.2004.10.019. PMID 15621527.
- ^ أ ب ت McCauley BS, Dang W (December 2014). "Histone methylation and aging: lessons learned from model systems". Biochimica et Biophysica Acta (BBA) - Gene Regulatory Mechanisms. 1839 (12): 1454–62. doi:10.1016/j.bbagrm.2014.05.008. PMC 4240748. PMID 24859460.
- ^ أ ب Han Y, Han D, Yan Z, Boyd-Kirkup JD, Green CD, Khaitovich P, Han JD (December 2012). "Stress-associated H3K4 methylation accumulates during postnatal development and aging of rhesus macaque brain". Aging Cell. 11 (6): 1055–64. doi:10.1111/acel.12007. PMID 22978322. S2CID 17523080.
- ^ أ ب Lillycrop KA, Hoile SP, Grenfell L, Burdge GC (August 2014). "DNA methylation, ageing and the influence of early life nutrition". The Proceedings of the Nutrition Society. 73 (3): 413–21. doi:10.1017/S0029665114000081. PMID 25027290.
- ^ Lee, Yong-ho; Kim, So Ra; Han, Dai Hoon; Yu, Hee Tae; Han, Yoon Dae; Kim, Jin Hee; Kim, Soo Hyun; Lee, Chan Joo; Min, Byoung-Hoon; Kim, Dong-Hyun; Kim, Kyung Hwan (2018-11-02). "Senescent T Cells Predict the Development of Hyperglycemia in Humans". Diabetes. 68 (1): 156–162. doi:10.2337/db17-1218. ISSN 0012-1797. PMID 30389747.
- ^ Hashimoto, Kosuke; Kouno, Tsukasa; Ikawa, Tomokatsu; Hayatsu, Norihito; Miyajima, Yurina; Yabukami, Haruka; Terooatea, Tommy; Sasaki, Takashi; Suzuki, Takahiro (2019-05-20). "Single-cell transcriptomics reveals expansion of cytotoxic CD4 T-cells in supercentenarians". Proceedings of the National Academy of Sciences of the United States of America. 116 (48): 24242–24251. bioRxiv 10.1101/643528. doi:10.1073/pnas.1907883116. PMC 6883788. PMID 31719197.
- ^ Horvath, Steve (2013). "DNA methylation age of human tissues and cell types". Genome Biology. 14 (10): R115. doi:10.1186/gb-2013-14-10-r115. ISSN 1465-6906. PMC 4015143. PMID 24138928.
{{cite journal}}: CS1 maint: unflagged free DOI (link)