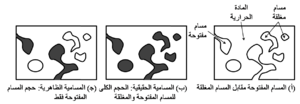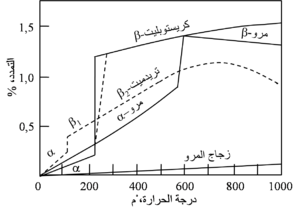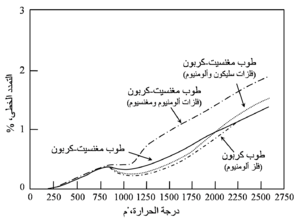الخصائص الكيميائية والفيزيائية للحراريات وعلاقتها بظروف الخدمة
ساهم بشكل رئيسي في تحرير هذا المقال
|
بينت مقالات بنية الحراريات وخصائص الحراريات أن هناك طائفة واسعة من الحراريات، من ناحية المواد الخام والتركيب العام وطريقة الصنع، والحاجة إلى الحراريات متنوعة كذلك. إن تحليل ظروف الخدمة في صناعة الحديد والصلب يدل في العموم على أن الحراريات مطلوبة لمقاومة ما يأتى:
- مدى واسع من درجات الحرارة، تصل إلى 2200 ْم.
- التغيرات المفاجئة في درجات الحرارة ؛ إجهادات الشد العالية المصاحبة لهذه التغيرات السريعة في درجات الحرارة السريع تسبب صدمة حرارية تؤدى إلى التَشَرُّخ أو الكسر.
- مستويات منخفضة من إجهادات الضغط في درجات الحرارة العالية والمنخفضة على حد سواء.
- قوى حك (كشط) في درجات الحرارة العالية والمنخفضة على حد سواء.
- فعل التآكل الذى يُحدثة الخبث، والذى يتراوح ما بين الطابع الحمضى إلى القاعدى.
- فعل الفلزات المنصهرة، وهو مؤثر دائماً في درجات الحرارة العالية وقادر على ممارسة ضغوط وقوى طفو كبيرة.
- فعل الغازات، بما في ذلك CO2وSO2 وCl وCH4 وH2O، والأكاسيد المتطايرة وأملاح الفلزات، فكلها قادرة على اختراق الحراريات والتفاعل معها.
وبتعرض الحراريات لواحد أو أكثر من الظروف المذكورة سابقا، فهى عادة ما تعمل بمثابة عوازل فعالة للغاية، أو قد تكون هناك حاجة أيضا إلى أن تكون موصلة أو ماصة للحرارة اعتمادا على تطبيقها. كما يجب أن تؤدى الحراريات وظيفتها دون تعريض العمال لبيئات أو لظروف غير آمنة أو غير صحية في جميع الأوقات.
وبما أن أى بيئة خدمة معينة عادة ما تنطوى على أكثر من واحدة من العوامل المذكورة أعلاه، فإن تحديد عمر المادة الحرارية مسبقاً هى عملية معقدة تشمل معلومات عن الخصائص الفيزيائية والحرارية على النحو الذى تحدده الاختبارات المعملية، وتحليل تأثير ظروف بيئة الخدمة أو العملية على المادة الحرارية، ومعرفة التفاعلات الأساسية بين الحراريات والملوثات المختلفة التى تواجهها في الخدمة. سيتم في هذا الباب وصف الخصائص الفيزيائية والكيميائية للحراريات كما تم قياسها في مجموعة متنوعة من الاختبارات المعملية، نسوقها هنا كدليل عام لفهم الطبيعة المعقدة لهذه المواد في ما يتعلق ببيئات خدمتها.
التركيب الكيميائى
كما هو موضح في القسم المتعلق بتصنيف الحراريات، تختلف المواد الخام المستخدمة في صناعة الحراريات بشكل ملحوظ، وينتج عن ذلك مواد ذات مدى واسع من التركيبات. ولا بد من التأكيد هنا على أن هذه حراريات لم تتغير قبل الاستخدام، ولم يطرأ عليها أى تغيير كيميائى أثناء الخدمة. الحراريات لديها قدرة فريدة على تحمل التغيير الحاصل من الاختراق والتلوث و/أو التفاعل أثناء الخدمة، وما زالت تعمل بكفاءة كمواد هندسية يُتَّكَل عليها. سنتناول فيما بعد التفاعلات التى تحدث بين الحراريات والبيئات المحيطة بها. وكقاعدة عامة، فالاتجاهات الحديثة في تطوير الحراريات تتطلب مواد تحتوى على الحد الأدنى من الشوائب، وهذه الشوائب تُخَفَّض عمداً أثناء تجهيز المواد الخام والمنتجات الحرارية.
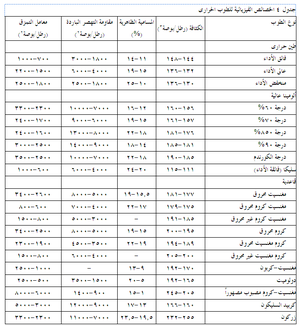
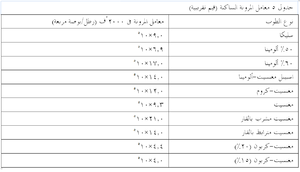
يوضح جدول 1 وصف المكونات غير المرغوبة (الموجودة أصلاً أو الحاصلة من التلوث) في عدة أنواع من الحراريات. وتجدر الإشارة إلى أن العديد من الشوائب الأخرى (مثل PbO وZnO وB2O3 وغيرها) الغير مرغوبة في جميع الحراريات بسبب نقاط انصهارها المنخفضة لم نتناولها هنا بالدراسة. أما أهمية التركيب (الكيميائى) فستوصف في موضع أخر، حيث سيتم استخدام منحنيات الأطوار للإشارة إلى التفاعلات الحاصلة في الحراريات وبيئتها في درجات الحرارة المرتفعة.
الكثافة والمسامية
كثافة الحراريات ومساميتها من بين أهم خصائص الحراريات التى يساء فهمها ولكنها مفيدة. لا بد أن نُقَدِّر أن معظم الحراريات ليست كثيفة تماماً، ولكنها تحتوى عمداً على مسام مفتوحة ومغلقة. فالمواد الحراية التامة الكثافة التى بطبيعتها منخفضة مقاومة الشد لا تستطيع أن تقاوم تدرجات درجة الحرارة في الخدمة العادية في درجات الحرارة الثابتة (على سبيل المثال عبر جدار من الفرن، أو أنبوب داخلة من الصلب وخارجه ظروف جوية عادية). تصنع المواد الحرارية عادة ببنيات غير متجانسة لتعزيز مقاومة التصدع الحرارى. ويقاس حجم المسام بغمر عينة من المادة الحرارية في سائل أو في فراغ. ويستند قياس الحجم الإجمالى إلى مبدأ أرشميدس، الذى ينص على أن الجسم المغمور في مائع سوف يزن أقل من وزنه الفعلى بمقدار مساوى لوزن المائع المزاح. وبمعرفة الفارق في الوزن وكثافة المائع، يُحسب حجم الجسم المغمور بسهولة، ويقاس حجم المسام المفتوحة بمقدار السائل الذى تمتصه العينة.
يوضح شكل 1 الفرق بين المسامية الظاهرية والحقيقية، ونوضح فيما يلى الخطوات المتبعة في تحديد هذه الخصائص باستخدام أسلوب التفريغ والضغط. فهذه القياسات البسيطة مفيدة إلى حد ما في المقارنة بين الحراريات، ول
كنها أكثر فائدة لقياسات مراقبة الجودة لتحديد مدى توافق عملية التصنيع مع مواصفات المواد الحرارية. يُعَيَّن حجم وكمية المسام في المادة الجامدة من خلال قياس كمية الزئبق الذى يمكن أن يُدفع إلى داخل مسام المادة قيد الدراسة عند ضغوط مختلفة. ولأن الزئبق عادة لا يُبَلِّل المواد، فلن يخترق الزئبق الفتحات بين حشود الجسيمات ما لم يتم التأثير بقوة خارجية. ومن ثم فإن مدى اختراق الزئبق إلى داخل المسام يتم وفق علاقة صارمة مع الضغوط المؤثرة.
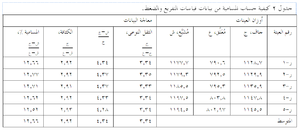
الخطوات العشر المتبعة لتعيين نسبة المسامية وفقاً لأسلوب التفريغ والضغط موضحة في شكل ءءء ، وهى:
- احصل على الأوزان الجافة
- اشحن العينات إلى داخل خزان التفريغ والضغط
- فرِّغ الهواء من الخزان وأبقه مفرغاً لمدة 30 دقيقة
- غطى العينات بسائل داخل الخزان
- استعد تفريغ الهواء من الخزان وأبقه مفرغاً لمدة 5 دقائق
- اضغط الخزان وأبقه مضغوطاً لمدة 15 دقيقة
- أخرج العينات من الخزان واغمرها في السائل
- احصل على الأوزان المُعَلَّقة (وهى داخل السائل)
- احصل على الأوزان المُشَبَّعة (بعد إخراجها من السائل)
- احسب النتائج كما في جدول 2.
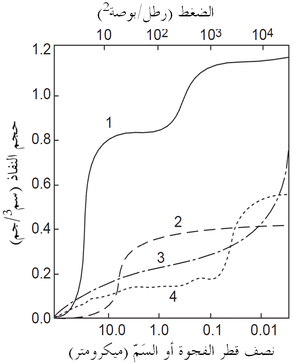
حجم المسام لا يحدد التوزيع الحجمى لمسام المادة الحرارية فقط ولكن يحدد أيضا حجم الروابط التى تشكلت في الكنان (الأرضية) المسامى وبين الكنان المسامى والجسيمات الكثيفة الخشنة. فحجم كل منطقة ترابط له تأثير هام على المفاضلة في خصائص الحراريات. فالعدد الكبير من المناطق الرابطة الأصغر يمكنه كَلّ امتداد الشروخ ويزيد من مقاومة امتدادها، ومن ثم تتحسن مقاومة الصدمات الحرارية. ومع ذلك، فالعدد الأصغر من الروابط ذات مساحة مقطع أكبر هو أبطأ في الذوبان ويمكنه تحسين مقاومة التآكل بالخبث. يبين شكل 3 نتائج نموذجية لتوزيع حجم المسام في حراريات عدة. لاحظ الأحجام الصغيرة للمسام والفروق بين هذه المنتجات.
مقاومة الحرارة
إن استخدام اختبار المخروط البيرمترى المكافئ التقليدى له فائدة ضئيلة بالنسبة للحراريات المنتجة هذه الأيام، حيث يقيس هذا الاختبار نقطة الليونة النسبية. إن المقاومة النسبية للحرارة في الحراريات الحديثة يقاس قياساً أكثر جدوى وفائدة باستخدام اختبارات للتشوه تحت الحمل و/أو الزحف. يبين جدول 3 مقارنة بعض نتائج اختبار التحميل لوقت قصير. مثلها مثل معظم المواد الإنشائية، تعانى الحراريات من تشوهات الزحف (شكل 4) عندما تتعرض لدرجات حرارة عالية (أى 0,5× درجة حرارة الانصهار أو أعلى). وتُظهر معظم الحراريات مرحلتين مميزتين للزحف، في المرحلة الأولى - التى تسمى الزحف الأولى- يتدهور معدل الهبوط تدريجيا مع مرور الوقت، وفى المرحلة الثانية – المسماة حالة الاستقرار – يصبح معدل الهبوط ثابتاً، وفى درجات الحرارة العالية جداً يلى زحف حالة الاستقرار أحيانا مرحلة زحف ثالثة، حيث يتسارع معدل الهبوط ويؤدى إلى انهيار ذريع أو تمزق زحفى. الزحف الأولى هو قصير عامة في مدته، بينما يمكن أن يحدث الزحف الثانوى على مدى زمنى طويل.
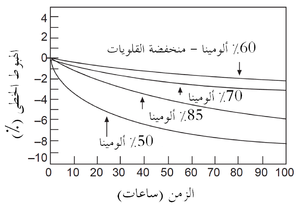
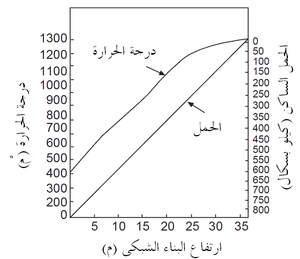
ولذلك فإن الزحف الثانوى عادة ما يقدم مقارنة أكثر وضوحا بين الحراريات، وهو المَعْلَم (البارامتر) الذى تُحدده الطريقة الموصوفة أعلاه. يوضح شكل 5 نتائج اختبار الزحف للعديد من طوب الألومينا العالية. لاحظ أن طوب 60٪ Al2O3 المنخفض القلويات (منخفض الشوائب) له مقاومة زحف أفضل مقارنة بطوب الألومينا العالية المحتوى على قلويات أكثر. نتائج الحمل والزحف هذه مفيدة في كثير من التطبيقات الحرارية، على سبيل المثال في إقامة البناء الشبكى لموقد الفرن العالي، حيث الأحمال ودرجات الحرارة معروفة كما في شكل 6. مثل هذه المعلومات يمكن بسهولة استخدامها لأغراض التصميم.
المقاومة
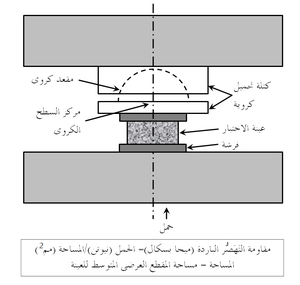
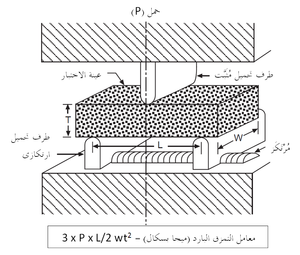
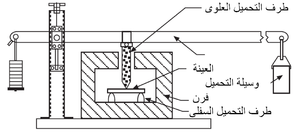
المقاومة الباردة للحراريات عادة ما تقاس في حالة الضغط (وتسمى مقاومة التَهَصُّر أو مقاومة الانسحاق) كما هو موضح في شكل 7، أو عرضياً كما في اختبار معامل التمزق الموضح في شكل 8. تعطى قيم المقاومة الباردة هذه بعض التقدير لقدرة المنتج الحرارى على العمل أثناء الشحن والإنشاء. يمكن أيضاً تعيين قيم المقاومة الساخنة بإجراءات مماثلة مع وضع العينة الحرارية في الفرن، الذى قد يوفر أيضاً جو واقى في محيط العينة. يبين شكل 9 رسم تخطيطى لجهاز قياس معامل التمزق الساخن.
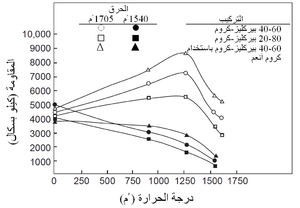
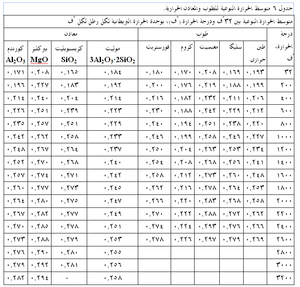
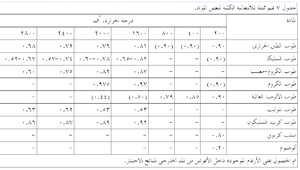
ويبين جدول 4 بعض الخصائص النموذجية الباردة لعدة أنواع من الحراريات، ومنه يتضح مدى الخصائص بين هذه المجموعات وداخلها. كما ذكر سابقاً، فإن هذه الخصائص الباردة هى أكثر فائدة في تقييم مدى اتساق جودة منتجات حرارية معينة. أما المقاومة الساخنة للحراريات فتتفاوت تفاوتاً كبيراً مع درجة الحرارة ومع معايير أخرى مثل جو الفرن. يوضح شكل 10 الطبيعة المعقدة للمقاومة الساحنة للحراريات لنموذج من الحراريات، حيث تظهر مقاومة حراريات البيرِكليز-كروم، كما تتغير مع درجات الحرارة، وتأثرها بكل من التركيب ودرجة حرارة الحرق المبدئى أثناء التصنيع. تتأثر المقاومة في درجة حرارة اختبار ثابتة كذلك بالتغييرات الطفيفة في مستوى الشوائب مثل (SiO2)، ونسبة CaO إلى SiO2 في حراريات المغنسيا.
سلوك الإجهاد والانفعال
عندما تتعرض مادة حرارية لحمل ميكانيكى فإنها تنضغط، ويمكن التعبير كمياً عن هذا السلوك بواسطة المعادلة التالية: ε=σ/E حيث : = الانفعال (ليس له أبعاد)، = الإجهاد، باسكال (رطل/بوصة مربعة)، E = معامل المرونة، باسكال (رطل/بوصة مربعة).
الانفعال يساوى مقدار الانضغاط مقسوما على الطول الأصلي. ε=∆L/L والإجهاد هو القوة المستخدمة في وحدة المساحة. σ=F/A
ومعامل المرونة، أو معامل يونج، للحراريات هو ثابت يعتمد على المادة ودرجة الحرارة. يتحدد سلوك الإجهاد والانفعال للمادة الحرارية بطريقة مماثلة لتلك المستخدمة لقياس مقاومة التهصر الساخنة، حيث تُسَخَّن عينة أسطوانية بانتظام إلى درجة الحرارة الاختبار، ثم تضغط باستخدام ماكينة اختبار ميكانيكى، وأثناء تحميل العينة، يتم رصد التغير في ارتفاعها عن طريق محول طاقة كهربائى، يُوَصَّل عن طريق قضبى استشعار صفَّير بالسطحين العلوى والسفلى من العينة. وتستخدم البيانات لعمل منحنى الإجهاد في مقابل الانفعال.
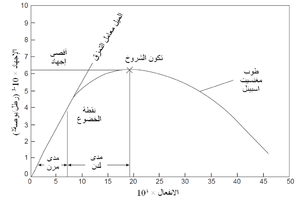
يوضح شكل 11 منحنى إجهاد وانفعال نموذجى. الجزء الأولى من المنحنى يكون عادة خطياً، ويسمى المدى المرن، ويعطى ميل المنحنى في هذا المدى معامل المرونة، وتسمى النقطة التى يصبح عندها منحنى الإجهاد والانفعال لاخطى نقطة الخضوع، ويؤدى انفعال المادة بعد هذه النقطة إلى حدوث تشوه دائم، ويعرف هذا الجزء من المنحنى بالمدى اللدن، وزيادة انفعال المادة بعد ذلك يؤدى إلى الإنهيار. بعض المواد لا تظهر سلوكاً لدناً في درجات حرارة معينة، ولكن بدلاً من ذلك تنهار مباشرة بعد الانفعال المرن. قيم معامل المرونة لعدد من الحراريات مبينة في جدول 5.
إن فهم سلوك الإجهاد والانفعال للحراريات في درجات الحرارة المرتفعة أمر مهم في جميع التطبيقات تقريباً، فغلاف الوعاء أو بنيته العلوية عادة ما يعمل على كبح التمددات الحرارية في البطانة، وقد يتطلب التصميم المناسب للبطانة ترك ثغرات فيها (سماحية للتمدد الحرارى) أثناء الإنشاء لمنع التراكم الكارثى للإجهادات في البطانة أثناء التسخين، إلا أنه يجب أن تكون سماحية التمدد أيضا مصممة بحيث تحافظ على استقرار البطانة. ويجب أيضا أن يكون المهندس مهتم بالإجهادات التى تؤثر بها الحراريات المتمددة على غلاف الوعاء أو بنيته العلوية. سنتناول فيما بعد التقنيات المستخدمة لتحليل سلوك الحراريات تحت الإجهادات.
الحرارة النوعية
الحرارة النوعية للمادة الحرارية تدل على مقدار الحرارة اللازمة لتغيير درجة حرارتها بمقدار معين، والحرارة النوعية هى كمية الحرارة بالوحدات الحرارية البريطانية (BTU’s)، التى يجب أن يستوعبها رطل واحد من المادة لزيادة درجة حرارته بمقدار درجة واحدة فهرنهايت. يعطى جدول 6 الحرارات النوعية لعدة أنواع من الطوب الحرارى والمواد الحرارية.
إن قيم الحرارة النوعية للمواد الحرارية هامة في كثير من التطبيقات، لأن كمية الحرارة المختزنة في البطانة أثناء التسخين غالبا ما تكون كبيرة، ففى الأفران الدورية حيث يتم تخزين كميات كبيرة من الحرارة بالتناوب خلال مراحل التسخين، يتم فقدها في محيط الفرن خلال مراحل التبريد، وكمية الحرارة المفقودة هنا مرتبطة بالحرارة النوعية للبطانة الحرارية. من التطبيقات التى يُرغب فيها في حرارة نوعية عالية مواقد الفرن العالي، فالمواقد مصممة خصيصاً لامتصاص وتخزين الحرارة من العوادم الغازية الساخنة، حيث تستخدم الحرارة المخزنة بعد ذلك لتسخين هواء الاحتراق قبل دخوله إلى الفرن.
الابتعاثية
الابتعاثية هى القدرة النسبية للسطح لبعث (إصدار) حرارة بالإشعاع، ويعبر عنها بكسرٍ من ابتعاثية جسم أسود مثالى, فمثل إشعاع الجسم الأسود هذا هو الحد الأقصى الممكن للإشعاع، ولا يمكن أبداً تحقيقه بواسطة المواد الحقيقية, والسطح المشع الجيد هو بالتساوى سطح ماص جيد للحرارة، والعاكس الجيد هو بالطبع ماص ردىء، ومن ثم مشع ردىء للحرارة، والعاكس التام - وهو أيضا غير موجود - ستكون ابتعاثيته صفراً، كذلك لا تشع المواد بالتساوى على جميع الأطوال الموجية، فالمقدرة على الإشعاع في طول موجى معين يشار إليها بالابتعاثية وحيدة اللون، ومن ثم فالابتعاثية الكلية تشير إلى الإشعاع الحرارى الحادث على طيف الأطوال الموجية كله.
تقل الابتعاثية الكلية لمعظم الحراريات إلى حد ما مع زيادة درجة الحرارة، فالابتعاثية هى التى تحدد كمية الحرارة التى تشع عبر فجوة في البناء الحرارى، والمعادلة المستخدمة في حساب هذه الكمية هى: Q_r=σ((T_1^4-T_2^4)/(1/ε_1 +1/(ε_2-1))) حيث: Q_r = الحرارة المُشَعَّة عبر الفجوة، وات م-2، σ = ثابت ستيفان-بولتزمان، وات م-2 ك-4، T1 = درجة حرارة السطح الأسخن من الفجوة، ك، T2 = درجة حرارة السطح الأبرد من الفجوة، ك، ε_1 = ابتعاثية السطح الأسخن من الفجوة، بدون أبعاد، ε_2 = ابتعاثية السطح الأبرد من الفجوة، بدون أبعاد. فى المعادلة أعلاه، يجب أن يتم التعبير عن درجات الحرارة باستخدام مقياس درجة الحرارة المطلقة، ودرجة الحرارة المطلقة بالكلفن هى ك = ْم + 273، وثابت ستيفان-بولتزمان هو 5,670 × 10-9 وات م-2ك-4 (1,714 × 10-9 وحدة حرارية بريطانية ساعة-1 قدم-2ر-4) . ابتعاثية الطبقة الخارجية في وعاء هى التى تحدد - إلى حد كبير - كمية الحرارة المنبعثة إلى البيئة المحيطة، ويُعطى الفاقد الحرارى إلى البيئة عى طريق الإشعاع غير المَعُوق بالعلاقة: Q_r=εσ(T_1^4-T_2^4 ) حيث : Q_r = الحرارة المُشَعَّة إلى المحيط، وات م-2، σ = ثابت ستيفان-بولتزمان، وات م-2 ك-4، = ابتعاثية السطح الخارجى، بدون أبعاد، T1 = درجة حرارة السطح الخارجى، ك، T2 = درجات حرارة المحيط، ك.
والسطح الخارجى في معظم التطبيقات هو غلاف فلزى، لوح من صلب كربونى مثلاً. وتتأثر ابتعاثية الغلاف في هذه الحالة بدرجة تأكسد السطح، حيث تميل الابتعاثية إلى الزيادة كلما زاد مقدار التأكسد. يدرج جدول 7 قيم الابتعاثية لعدد من الحراريات والمواد التى تستخدم في أغلفة الأفران.
التمدد الحرارى
جميع الحراريات تتمدد عند التسخين بطريقة مرتبطة بتركيباتها الكيميائية. يظهر شكل 12 أمثلة تقليدية على تمدد أنواع متباينة من الحراريات، ومن الواضح أن شكل منحنى التمدد ودرجة الحرارة والسعة القصوى للتمددات تختلف على نحو ملحوظ بين هذه المواد. تستخدم المواد القابلة للانضغاط والفجوات للتخلص من التمدد في أى بناء حرارى، لأنه من الواضح أن البطانة الحرارية يمكن أن تعانى نمواً يصل إلى عدة بوصات بسبب التمدد، ومن ثم فلابد من التخلص منه. الحراريات ذات التمدد الحرارى الخطى أو القريب من الخطى تتطلب عموماً عناية أقل بكثير من تلك التى لها تمدد غير خطى. والمثال التقليدى للحراريات التى تتطلب عناية أثناء التسخين الصاعد هو طوب السليكا، الذى يتكون بعد الحرق من موازنة مسيطر عليها بعناية بين أشكال معدنية مختلفة للمركب SiO2. يظهر شكل 13 التمدد الحرارى للأشكال المعدنية المختلفة للسليكا، التى تجعل التسخين ببطء لازماً خلال نطاقات حرجة مختلفة من درجة الحرارة. ونتيجة للتركيب المعدنى المعقد لطوب السليكا، تسخن المنشآت الكبيرة التى تستخدم هذه الطوب (مثل أفران الكوك) وتبرد بمعدلات بطيئة للغاية، وربما تتطلب عدة أسابيع للوصول إلى درجات حرارة التشغيل، وبمجرد تجاوز درجة الحرارة الحرجة، يُظْهِر طوب السليكا تمدداً حرارياً منخفضاً ومنتظماً، ويمكن تدويره حرارياً دون ضرر بين 1000-1538 ْم.
بصفة عامة، سلوكيات التمدد الحرارى للحراريات غير المحروقة أكثر تعقيدا من نظيراتها المحروقة، فأثناء التسخين الأولى قد تحدث تمددات هائلة أو تقلصات في المواد غير المحروقة، نتيجة للتغيرات في هيكل الترابط والبنية المعدنية وتأثيرات التلبيد.
يوضح شكل 14 خصائص التمدد الحرارى الحاصل لعدد من الحراريات المترابطة بالأسمنت خلال التسخين الصاعد الأولى، حيث تظهر هذه المواد انكماشاً على مدى درجة حرارة بين 205-315 ْم، الذى يصاحب التحلل الحرارى للأسمنت، ويتحدد مقدار الانكماش بجودة وكمية الأسمنت، وفى درجات الحرارة فوق 980 حتى 1090 ْم يحدث انكماش إضافى نتيجة للتَلَبُّد. والتمدد الحرارى الأساسى يُعَيَّن بخصائص الرُكَام المستخدم. الانكماشات التى تحدث أثناء التسخين الصاعد الأولى حتى 1430 ْم هى انكماشات دائمة بطبيعتها، ومقدارها عادة بين 0,2 إلى 1,5٪.
يبين شكل 15 منحنيات التمدد الحرارى لعدد من طوب المغنسيت-كربون. خلال مدى درجات الحرارة 370-540 ْم، حيث يعمل تكوُّن رابط كربونى زجاجى إلى تكثيف بنية المادة وينتج عن ذلك انكماشات. وفى المواد التى تحتوى على فلزات تحدث تفاعلات تمددية في درجات الحرارة المرتفعة، فالطوب المحتوى على مغنسيوم يُظْهِر تمدداً حرارياً هائلاً في المدى 540-705 ْم، وتظهر المواد التى تحتوى على ألومنيوم تسارعاً تدريجياً في التمدد فوق نحو 760 ْم، ويزداد التمدد الحرارى في درجات الحرارة العالية بدرجة كبيرة مع الزيادة في محتوى الفلزات. وبعد التسخين إلى 1430 ْم يُظْهِر طوب المغنسيت-كربون تمدداً دائماً من 0,1 إلى 1,0 ٪.
الموصلية الحرارية وانتقال الحرارة
كعوازل، استخدمت المواد الحرارية دائما لحفظ الحرارة، ومقاومتها لسريان الحرارة هو عامل اختيار رئيسى في كثير من التطبيقات. يبين شكل 16 منحنيات الموصلية الحرارية لأنواع حرارية عديدة تتراوح بين الحراريات الكثيفة والطوب العازل. بعض الحراريات مثل الكربون أو كربيد السليكون لديها موصليات حرارية عالية بصورة ملموسة (تصل إلى 43,26 وات م-1 ك-1) في حين أن مواد أخرى لديها موصليات حرارية أقل من 0,14 وات م-1 ك-1، مثل كتل العزل أو الألياف الحرارية.
وباستخدام قيم الموصلية المقيسة/المقاسة، يمكن حساب فواقد الانتقال الحرارى خلال الجدران الحرارية وحيدة أو عديدة المكونات باستخدام صيغة عامة، هى: Q/A=(T_1-T_2)/(L_1/K_1 +L_2/K_2 +∙∙∙∙L_n/K_n ) حيث: Q/A = الفاقد الحرارى معبراً عنه ب وات م-2، T1 = درجة حرارة السطح الأسخن، ْم، T2 = درجة حرارة السطح الأبرد، ْم، L1 وL2... Ln= تخانة (سُمْك) كل مادة، بوصة، K1 وK2... Kn= الموصلية الحرارية لكل مادة، وات م-1 ك-1. تتم هذه الحسابات الآن بسرعة باستخدام محاكاة الحاسب، حيث يمكن موازنة معدلات انتقال الحرارة المحسوبة مع الفاقد من سطح الحراريات الخارجى الحاصل بالإشعاع أو بالحمل الطبيعى أو القسرى. وعلاوة على ذلك، فإن تحديد بيانات الانتقال الحرارى وخاصة مرحلة الاستقرار أصبحت عمليات روتينية مع التقدم في الحواسب، بعد أن كانت قبل ذلك عمليات حسابية بطيئة. وعلى الرغم من أنه قد يبدو أن كل بناء ينبغى أن يُصمم بحيث يحقق أدنى فواقد حرارية، إلا أن هذا ليس هو الحال دوماً، فيجب توخى الحذر في بعض الحالات، من بينها ما يلي:
(1) حراريات الوجه الساخن في تطبيقات معينة يجب أن تكون قادرة على الصمود لدرجات الحرارة الأعلى التى ستنجم عندما تضاف طبقات احتياطية مُسَانِدة من مواد شديدة العزل.
(2) يجب أن تكون الخصائص الأخرى للحراريات مناسبة للبيئة، فمثلاً معظم المواد العازلة لن تتحمل التعرض المباشر للفلز أو الخبث، والمواد المُسَانِدة قد تكون عرضة للمهاجمة من قبل مكونات العملية المتبخرة (مثل القلويات ومركبات الكبريت والأحماض) أو مكثفاتها. وتكون القنوات الغازية خلال المواد المنفذة يجب أيضاً أن يؤخذ في الحسبان لمنع تكون البؤر الساخنة على غلاف الوعاء.
(3) يزيد العزل من عمق الاختراق والهجوم الكيميائى على طبقة الوجه الساخن.
وهناك طائفة واسعة جداً من الحراريات شديدةالعزل المعتمدة على الألياف، وهى متوفرة في هيئة كتل وأغطية وألواح ومنتجات مشكَلة. وفى مثل هذه المنتجات، تعتمد الموصلية الحرارية اعتمادا كبيراً على كثافة المنتج.
وفى تطبيقات معينة، تستخدم حراريات ذات موصلية عالية جداً لتبريد البطانة الحرارية وإقرارها ضد مزيد من بِلَى الحراريات.
فيستخدم مثلاً في المخروط السفلى لفرن عالى مواد جرافيتية ونصف جرافيتية، ذات موصليات من 70-80 و30-35 وات م-1 ك-1، على الترتيب في 1000 ْم، (لاحظ هذه القيم في مقارنة مع الحراريات التقليدية المبينة في شكل 15). وفى مثل هذه التصميمات، تعمل الحرارة المستخرجة من خلال مبردات النحاس على إطالة عمر الحراريات إلى عدة مرات أطول من البطانات غير المبردة. وبالمثل، فإن البناء المركب مع كربيد السليكون في المخروط العلوى للفرن العالى يتحكم في درجات حرارة الغلاف، ويسمح بتكوين بطانة مستقرة، وفى هذه الحالة يُرغب أن تكون كثافة لوح التبريد متفاوتة ما بين خفيفة إلى كثيفة.
العديد أيضاً من التطبيقات الحرارية في مصنع الصلب لم تصل أبداً إلى التوازن الحرارى، ويجب استخدام حسابات انتقال الحرارة الديناميكية في تحليل هذه التطبيقات، فمثلاً سَتَدُور مغرفة الصلب العادية عدة مرات يومياً، وخلال هذه الدورات، ستُظْهِر درجة حرارة الوجه الساخن – والبطانة بأكملها إلى حد أقل - سلوكاً دورياً.
الأهم من ذلك، أن نتذكر أن سريان الحرارة في حالة الاستقرار تحكمها الموصلية الحرارية k (من قانون "فورييه" الأول)، وخاصية المادة اللازمة في الحالة الانتقالية هى الانتشارية الحرارية l (من قانون "فورييه" الثانى). الانتشارية الحرارية "l" هى المكافئ لمعامل الانتشار في معادلة "فورييه" لسريان الحرارة، وهى مقياس لمدى سرعة انتقال نبضة حرارية خلال مادة جامدة. وترتبط الانتشارية الحرارية بكل من الموصلية الحرارية والسعة الحرارية من خلال العلاقة:
λ=k/(ρC_p )
حيث:
= الانتشارية الحرارية، م2 ث-1
K = الموصلية الحرارية، = الكثافة، Cp = السعة الحرارية.
وتُحدد الانتشارية الحرارية في الغالب بطريقة النبضة الحرارية، حيث تطبق نبضة حرارية على جانب واحد من قرص أو أسطوانة قصيرة وتُسجل الفترة الزمنية التى تصل فيها درجة حرارة الوجه المقابل إلى نصف قيمتها النهائية. ويُحصل في المعتاد على النبضات الحرارية بواسطة وميض ليزر آلى. يبين جدول 8 قيم الانتشارية لبعض المنتجات المنتقاة. العلاقة بين الكثافة والسعة الحرارية والموصلية الحرارية والانتشارية الحرارية ينبغى أن توضع نصب أعيننا، حتى إذا كانت إحدى الخصائص مجهولة، يمكن حسابها بسهولة بمعرفة بقيتها.
الصدمة الحرارية
مقاومة الصدمات الحرارية هى مسألة معقدة عند دراسة تصميم المواد الحرارية. تنتج الصدمات الحرارية أو التصدعات بسبب الإجهادات الحرارية التى تنبع من التفاوت في معدلات التمدد والتقلص داخل المادة الحرارية، الناجمة عن التغيرات السريعة في درجة الحرارة، أو التدرجات العالية لدرجة الحرارة داخل المادة الحرارية ذاتها. والتنبؤ بمقاومة المواد للكسر بسبب الصدمة الحرارية يمكن أن يعبر عنه بالعامل الآتى:
ks/αE
حيث:
k = الموصلية الحرارية، s = مقاومة الشد، = معامل التمدد الحرارى، E = معامل المرونة.
وكلما عَلَت قيمة العامل في المعادلة أعلاه، علت مقاومة الصدمات الحرارية المتوقعة للمادة. يمكن كذلك الحصول على قياس آخر لمقاومة الصدمات باستخدام قياسات شغل الكسر في درجات حرارة مرتفعة، حيث تستخدم للتنبؤ بالطاقة اللازمة لتمدد الشروخ بطيئة الحركة. وعادة ما تشتمل أساليب قياس الصدمات الحرارية الأخرى على اختبارات تتعرض فيها المادة لدورات حرارية.