تريبتوفان
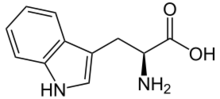
التريپتوفان Tryptophan، (اختصاره Trp أو W؛ رمزه UGG)، هو حمض أميني أليفاتي يستخدم في التخليق الحيوي للپروتينات. يحتوي على مجموعة أمينية أليفاتية، مجموعة حمض كربوكسلي-أليفاتي، وسلسلة إندول جانبية، مما يجعله حمضاً أمينياً عطرياً أحادي القطب. وهو من الأحماض الأمينية الأساسية في البشر، مما يعني أن الجسم لا يمكنه تخليقه ومن ثم فيجب أن يدخل الجسم ضمن النظام الغذائي. كما يعتبر التريپتوفان مركب طليعي للناقل العصبي السروتونين، الذي يلعب دوراً كبيراً في تحسين المزاج، وخلق شعور من الرفاهية والاسترخاء، وهرمون الملاتونين.[2]
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Tryptophan or (2S)-2-amino-3-(1H-indol-3-yl)propanoic acid
| |
| أسماء أخرى
2-Amino-3-(1H-indol-3-yl)propanoic acid
| |
| Identifiers | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.000.723 |
| KEGG | |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| InChI | InChI={{{value}}} |
| SMILES | |
| الخصائص | |
| الصيغة الجزيئية | C11H12N2O2 |
| كتلة مولية | 204.21 g mol-1 |
| قابلية الذوبان في الماء | Soluble: 0.23 g/L at 0 °C, 11.4 g/L at 25 °C, |
| قابلية الذوبان | قابل للذوبان في الكحول الساخن، الهيدروكسيدات القلوية؛ غير قابل للذوبان في الكلوروفورم. |
| الحموضة (pKa) | 2.38 (carboxyl), 9.39 (amino)[1] |
| القابلية المغناطيسية | -132.0·10−6 cm3/mol |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
مثل الأحاض الأمينية الأخرى، يعتبر التريپتوفان أيوناً مزدوجاً عند درجة الحموضة الفسيولوجية حيث تكون مجموعة الأمين بروتونية (–NH3+; pKa = 9.39) ويكون الحمض الكربوكسيلي منزوع البروتين ( –COO−; pKa = 2.38).[3]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
العزل
عام 1901، تمكن فردريك هوپنكز من عزل التريپتوفان لأول مرة.[4] قام هوپنكز باستخلاص التريپتوفان من الكازين المحلمه، حيث نجح في استخلاص 4-8 گرام تريپتوفان من 600 گرام من الكازين الخام.[5]
التخليق الحيوي والانتاج الصناعي
الوظيفة
الأحماض الأمينية، ومن ضمنها التريپتوفان، تستخدم في بناء الكتل ضمن عملية التخليق الحيوي للپروتين، وتعتبر عنصراً أساسياً لاستمرار حياة الپروتينات. الكثير من الحيوانات (ومن بينها البشر) لا تستطيع تخليق التريپتوفان: هم بحاجة للحصول عليه من خلال نظامهم الغذائي، مما يجعله حمض أميني أساسي. كما يعتبر التريپتوفان من الأحماض الأمينية الأقل شيوعاً في الپروتينا، لكنه يلعب دوراً بنيوياً أو أدوار وظيفية هامة أينما يوجد. على سبيل المثال، تلعب مخلفات التريپتوفان والتايروسين أدواراً خاصة في "تثبيت" الپروتينات الغشائية داخل غشاء الخلية. بالإضافة إلى ذلك، تتضمن وظائف التريپتوفان كونه مركباً طليعياً حيوياً للمركبات التالية (انظر الشكل على اليسار):
- السروتونين (ناقل عصبي، يخلق بواسطة هيدروكسيليز التريپتوفان.[6][7]
- الملاتونين (هرمون عصبي) يتم تخليقه من السروتونين، عن طريق انزيمي N-acetyltransferase و5-hydroxyindole-O-methyltransferase.[8]
- النياسين، ويعرف أيضاً بڤيتامين ب 3، B3، يتم تخليقه من التريپتوفان عن طريق الكينورنين وأحماض الكوينولينيك.[9]
- الأكسينات (أحد أنواع الهرمونات النباتية) يتم تخليقه من التريپتوفان.[10]
Tryptophan metabolism by human gastrointestinal microbiota ( )
|
ومن فوائد التريپتوفان الصحية:
- بما أن التريپتوفان يحفز مستويات السروتونين في الدماغ، فيمكنه علاج الاكتئاب والقلق. لذلك، يمكنك أن تأخذ مكملات التريپتوفان للحد من هذه الأعراض.[15]
- يساعد التريپتوفان على زيادة هرمونات النمو، لذلك هو ضروري للنمو السليم للأطفال والرضع.
- يستخدم التريپتوفان لعلاج الأرق، بسبب وجود السروتونين المفيد للسيطرة على أنماط النوم.
- ينصح الأشخاص الذين يعانون من الصداع النصفي بأخذ جرعات من التريپتوفان بانتظام، وتناول الأغذية الغنية بالتريپتوفان، التي تساعد أيضاً في الوقاية من نوبات القلق الذي يحسّن ردود فعل الشخص.
- يعمل على الحد من الشهية تجاه الطعام، لأنّ السروتونين يساعد على جعلك تشعر الاشباع والحد من تناول الطعام. بالتالي، فقدان الوزن يساعد على خفض السكري والمشاكل المتعلقة بأمراض القلب والأوعية الدموية.
- الجسم يحتاج للالتريپتوفان لإنتاج النياسين الذي يساعد في توليد الكولسترول الجيد وخفض الكولسترول السيئ. فالأغذية الغنية بالتريپتوفان تساعد أيضاً على تحويل الكربوهيدرات إلى طاقة والحفاظ على نظام صحي في الجهاز الهضمي، الجلد، الشعر والعينين.
- للنساء اللواتي يعانين من متلازمة ما قبل الحيض، الذي يحدث بسبب مشاكل بدنية أو عقلية أو عاطفية، تناول التريپتوفان يساعد على تحسين أعراض مزاجهم.
- الأغذية الغنية بالتريپتوفان تساعد الناس على الإقلاع عن التدخين ويحسّن علاج الإقلاع عن التدخين.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الحصص الغذائية الموصى بها
عام 2002، حسب معهد الطب الأمريكي كانت الحصة الغذائية الموصى بها هي 5 مگ/كگ من وزن الجسم/يومياً من التريپتوفان للبالغين من عمر 19 سنة وأكثر.[16]
المصادر الغذائية
يتواجد التريپتوفان في معظم الأغذية الپروتينية أو الپروتينات الغذائية. يتواجد بكميات وفيرة في الشيكولاتة، الشوفان، التمر، الحليب، الزبادي، الجبن القريش، اللحوم الحمراء، البيض، الأسماك، [[الدواجني]، السمسم، الحمص، اللوز، بذور عباد الشمس، بذور القرع، الحنطة السوداء، السپيرولينا، والفول السوداني. على عكس الاعتقاد الشعبي[17][18][19] بأن لحوم الديك الرومي تحتوي على كميات وفيرة من التريپتوفان، فإن محتوى لحوم الديك الرومي بها نفس كمية التريپتوفان الموجودة في لحوم الدواجن.[20]
| الغذاء | التريپتوفان [گ/100 گ من الغذاء] |
الپروتين [گ/100 گ من الغذاء] |
التريپتوفان/الپروتين [%] |
|---|---|---|---|
| بياض البيض، المجفف | |||
| السپيرولينا، المجفف | |||
| قد الأطلسي، المجفف | |||
| فول الصويا، النيء | |||
| جبن الپرمجيان | |||
| بذور السمسم | |||
| جبن الشيدر | |||
| بذور عباد الشمس | |||
| شرائح لحم الخنزير | |||
| لحم الديك الرومي | |||
| الدجاج | |||
| اللحم البقري | |||
| الشوفان | |||
| السلمون | |||
| لحم الضأن | |||
| سمك الفرخ الأطلسي | |||
| الحمص، النيء | |||
| البيض | |||
| دقيق القمح الأبيض | |||
| شيكولاتة الطبخ، غير محلاة | |||
| الحليب | |||
| الأرز، الأبيض، متوسط الحبة، المطهو | |||
| الكينوا، غير مطهوة | |||
| الكينوا، المطهوة | |||
| البطاطس | |||
| التمر هندي | |||
| الموز |
استخدامه كمكمل غذائي
الآثار الجانبية
التفاعلات
الأبحاث
الفلورة
السلامة
متلازمة إوسينوفيليا-ميالگيا
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
انظر أيضاً
المصادر
- ^ Dawson RM, et al. (1969). Data for Biochemical Research. Oxford: Clarendon Press. ISBN 0-19-855338-2.
- ^ Slominski A, Semak I, Pisarchik A, Sweatman T, Szczesniewski A, Wortsman J (January 2002). "Conversion of L-tryptophan to serotonin and melatonin in human melanoma cells". FEBS Letters. 511 (1–3): 102–6. doi:10.1016/s0014-5793(01)03319-1. PMID 11821057.
- ^ "L-tryptophan | C11H12N2O2 - PubChem". pubchem.ncbi.nlm.nih.gov. Retrieved 2016-12-22.
- ^ Hopkins FG, Cole SW (December 1901). "A contribution to the chemistry of proteids: Part I. A preliminary study of a hitherto undescribed product of tryptic digestion". The Journal of Physiology. 27 (4–5): 418–28. doi:10.1113/jphysiol.1901.sp000880. PMC 1540554. PMID 16992614.
- ^ Cox GJ, King H (1943). "L-Tryptophane". Org. Synth. 2: 612–616. doi:10.15227/orgsyn.010.0100.
- ^ Fernstrom JD (April 1983). "Role of precursor availability in control of monoamine biosynthesis in brain". Physiological Reviews. 63 (2): 484–546. PMID 6132421.
- ^ Schaechter JD, Wurtman RJ (November 1990). "Serotonin release varies with brain tryptophan levels" (PDF). Brain Research. 532 (1–2): 203–10. doi:10.1016/0006-8993(90)91761-5. PMID 1704290.
- ^ Wurtman RJ, Anton-Tay F (1969). "The mammalian pineal as a neuroendocrine transducer" (PDF). Recent Progress in Hormone Research. 25: 493–522. doi:10.1016/b978-0-12-571125-8.50014-4. PMID 4391290.
- ^ Ikeda M, Tsuji H, Nakamura S, Ichiyama A, Nishizuka Y, Hayaishi O (March 1965). "Studies on the biosynthesis of nicotinamide adenine dinucleotide. II. A role of picolinic carboxylase in the biosynthesis of nicotinamide adenine dinucleotide from tryptophan in mammals". The Journal of Biological Chemistry. 240 (3): 1395–401. PMID 14284754.
- ^ Palme K, Nagy F (April 2008). "A new gene for auxin synthesis". Cell. 133 (1): 31–2. doi:10.1016/j.cell.2008.03.014. PMID 18394986.
- ^ أ ب ت ث ج ح خ د ذ Zhang LS, Davies SS (April 2016). "Microbial metabolism of dietary components to bioactive metabolites: opportunities for new therapeutic interventions". Genome Med. 8 (1): 46. doi:10.1186/s13073-016-0296-x. PMC 4840492. PMID 27102537.
Lactobacillus spp. convert tryptophan to indole-3-aldehyde (I3A) through unidentified enzymes [125]. Clostridium sporogenes convert tryptophan to IPA [6], likely via a tryptophan deaminase. ... IPA also potently scavenges hydroxyl radicals
{{cite journal}}: CS1 maint: unflagged free DOI (link)
Table 2: Microbial metabolites: their synthesis, mechanisms of action, and effects on health and disease
Figure 1: Molecular mechanisms of action of indole and its metabolites on host physiology and disease - ^ Wikoff WR, Anfora AT, Liu J, Schultz PG, Lesley SA, Peters EC, Siuzdak G (March 2009). "Metabolomics analysis reveals large effects of gut microflora on mammalian blood metabolites". Proc. Natl. Acad. Sci. U.S.A. 106 (10): 3698–3703. doi:10.1073/pnas.0812874106. PMC 2656143. PMID 19234110.
Production of IPA was shown to be completely dependent on the presence of gut microflora and could be established by colonization with the bacterium Clostridium sporogenes.
IPA metabolism diagram - ^ "3-Indolepropionic acid". Human Metabolome Database. University of Alberta. Retrieved 12 October 2015.
Indole-3-propionate (IPA), a deamination product of tryptophan formed by symbiotic bacteria in the gastrointestinal tract of mammals and birds. 3-Indolepropionic acid has been shown to prevent oxidative stress and death of primary neurons and neuroblastoma cells exposed to the amyloid beta-protein in the form of amyloid fibrils, one of the most prominent neuropathologic features of Alzheimer's disease. 3-Indolepropionic acid also shows a strong level of neuroprotection in two other paradigms of oxidative stress. (PubMed )
Origin: • Endogenous • Microbial{{cite web}}: External link in|quote= - ^ Chyan YJ, Poeggeler B, Omar RA, Chain DG, Frangione B, Ghiso J, Pappolla MA (July 1999). "Potent neuroprotective properties against the Alzheimer beta-amyloid by an endogenous melatonin-related indole structure, indole-3-propionic acid". J. Biol. Chem. 274 (31): 21937–21942. doi:10.1074/jbc.274.31.21937. PMID 10419516.
[Indole-3-propionic acid (IPA)] has previously been identified in the plasma and cerebrospinal fluid of humans, but its functions are not known. ... In kinetic competition experiments using free radical-trapping agents, the capacity of IPA to scavenge hydroxyl radicals exceeded that of melatonin, an indoleamine considered to be the most potent naturally occurring scavenger of free radicals. In contrast with other antioxidants, IPA was not converted to reactive intermediates with pro-oxidant activity.
- ^ "فوائد التربتوفان كثيرة... فاليكم الاطعمة التي يوجد فيها!". صحتي. 2015-04-22. Retrieved 2018-01-16.
- ^ Institute of Medicine (2002). "Protein and Amino Acids". Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. Washington, DC: The National Academies Press. pp. 589–768.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةHelmenstine - ^ Ballantyne C (2007-11-21). "Does Turkey Make You Sleepy?". Scientific American. Retrieved 2013-06-06.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةMcCue - ^ أ ب Joanne Holden, Nutrient Data Laboratory, Agricultural Research Service. "USDA National Nutrient Database for Standard Reference, Release 22". United States Department of Agriculture. Retrieved 2009-11-29.
{{cite web}}: CS1 maint: multiple names: authors list (link) - ^ Rambali B, Van Andel I, Schenk E, Wolterink G, van de Werken G, Stevenson H, Vleeming W (2002). "[The contribution of cocoa additive to cigarette smoking addiction]" (PDF). RIVM. The National Institute for Public Health and the Environment (Netherlands) (report 650270002/2002).
قراءات إضافية
- Wood RM, Rilling JK, Sanfey AG, Bhagwagar Z, Rogers RD (May 2006). "Effects of tryptophan depletion on the performance of an iterated Prisoner's Dilemma game in healthy adults". Neuropsychopharmacology. 31 (5): 1075–84. doi:10.1038/sj.npp.1300932. PMID 16407905.
- Sturtz R (2009). "what is the difference between L-Tryptophan and 5-HTP?". The Lidtke letter: 1.
وصلات خارجية
- "KEGG PATHWAY: Tryptophan metabolism - Homo sapiens". KEGG: Kyoto Encyclopedia of Genes and Genomes. 2006-08-23. Retrieved 2008-04-20.
- G. P. Moss. "Tryptophan Catabolism (early stages)". Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB). Retrieved 2008-04-20.
- G. P. Moss. "Tryptophan Catabolism (later stages)". Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB). Retrieved 2008-04-20.
- B. Mikkelson; D. P. Mikkelson (2007-11-22). "Turkey Causes Sleepiness". Urban Legends Reference Pages. Snopes.com. Retrieved 2008-04-20.