ثابت الانحلال الحمضي
ثابت الانحلال الحمضي يرمز له العنصر Ka، (يعرف أيضا باسم ثابت الحموضة، أو ثابت تأين الحمض) وهو مقياس كمي لقوة الحمض في المحلول. وهو ثابت التوازن للتفاعل الكيميائي المعروف باسم تفكك في سياق تفاعلات حمض-قلوي. يمكن كتابة التوازن على النحو التالي:
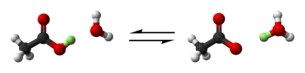
- HA
 A− + H+,
A− + H+,
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
العوامل المؤثرة على قيم pKa
تنص قاعدة پولنگ الثانية على أن قيمة أول pKa للأحماض التي صيغتها XOm(OH) n تكون تقريباً مستقلة عن n و X وتكون تقريباً 8 عندما تكون m = 0, 2 عندما m = 1, −3 عندما m = 2 and < −10 عندما m = 3.[1] This correlates with the oxidation state of the central atom, X: فكلما ارتفعت حالة التأكسد كلما ازدادت قوة الاوكسي حمض. فعلى سبيل المثال، pKa for HClO is 7.2, for HClO2 is 2.0, for HClO3 هو −1 and HClO4 هو حمض قوي.
قيم لمواد شائعة
There are multiple techniques to determine the pKa of a chemical, leading to some discrepancies between different sources. Well measured values are typically within 0.1 units of each other. Data presented here were taken at 25 °C in water.[2][3] More values can be found in thermodynamics, above.
| الاسم الكيميائي | الاتزان | pKa |
|---|---|---|
| B = Adenine | BH22+ BH+ + H+ | 4.17 |
| BH+ B + H+ | 9.65 | |
| H3A = Arsenic acid | H3A H2A− + H+ | 2.22 |
| H2A− HA2− + H+ | 6.98 | |
| HA2− A3− + H+ | 11.53 | |
| HA = Benzoic acid | HA H+ + A− | 4.204 |
| HA = Butanoic acid | HA H+ + A− | 4.82 |
| H2A = Chromic acid | H2A HA− + H+ | 0.98 |
| HA− A2− + H+ | 6.5 | |
| B = Codeine | BH+ B + H+ | 8.17 |
| HA = Cresol | HA H+ + A− | 10.29 |
| HA = Formic acid | HA H+ + A− | 3.751 |
| HA = Hydrofluoric acid | HA H+ + A− | 3.17 |
| HA = Hydrocyanic acid | HA H+ + A− | 9.21 |
| HA = Hydrogen selenide | HA H+ + A− | 3.89 |
| HA = Hydrogen peroxide (90%) | HA H+ + A− | 11.7 |
| HA = Lactic acid | HA H+ + A− | 3.86 |
| HA = Propionic acid | HA H+ + A− | 4.87 |
| HA = Phenol | HA H+ + A− | 9.99 |
| H2A = L-(+)-Ascorbic Acid | H2A HA− + H+ | 4.17 |
| HA− A2− + H+ | 11.57 |
الهامش
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةpauling - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةSA - ^ Speight, J.G. (2005). Lange's Handbook of Chemistry (18th ed.). McGraw–Hill. ISBN 0071432205. Chapter 8
وصلات خارجية
- All-in-one freeware for pH and acid-base equilibrium calculations and for simulation and analysis of potentiometric titration curves with spreadsheets.
- Includes a database with aqueous, non-aqueous, and gaseous phase pKa values than can be searched using SMILES or CAS registry numbers.
- pKa values for various acid and bases. Includes a table of some solubility products.
- Explanations of the relevance of these properties to pharmacology.
- Free online prediction tool (Marvin) pKa, logP, logD etc. From ChemAxon
Acid dissociation constant