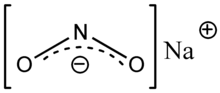
نتريت الصوديوم
نتريت الصوديوم Sodium nitrite هو مركب كيميائي له الصيغة NaNO2 ، بلوراته لها لون أبيض إلى أبيض مصفر. ينحل بشكل جيد بالماء، وهو استرطابي. من المنظور الصناعي، يعتبر ملح النتريت من الأملاح الهامة. وهو يدخل في مجموعة متنوعة من المركبات العضوية، مثل المستحضرات الصيدلانية والأصباغ ومبيدات الآفات، لكن من المحتمل أن يكون معروفًا بشكل أفضل كمادة غذائية مضافة تستخدم في صناعة اللحوم المعالجة و(في بعض البلدان) منتجات الأسماك.[3] ويمتاز بخواصه المسببة للقيء.

| |||
| |||
|
| |||
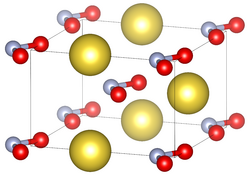 خلية وحدة نيتريت الصوديوم في الحالات القياسية.
| |||
| Identifiers | |||
|---|---|---|---|
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.687 | ||
| رقم EC |
| ||
| E number | E250 (preservatives) | ||
| KEGG | |||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
| UN number | 1500 3287 | ||
CompTox Dashboard (EPA)
|
|||
| InChI | InChI={{{value}}} | ||
| SMILES | |||
| الخصائص | |||
| الصيغة الجزيئية | NaNO2 | ||
| كتلة مولية | 68.9953 ج/مول | ||
| المظهر | مادة صلبة بيضاء أو بيصاء مصفرة | ||
| الكثافة | 2.168 ج/سم 3 | ||
| نقطة الانصهار | |||
| قابلية الذوبان في الماء | 71.4 g/100 مول (0 °س) 84.8 ج/100 مول (25 °س) 160 ج/100 مول (100 °س) | ||
| قابلية الذوبان | قابل للذوبان في الميثانول (4.4 ج/100 مول) الإيثانول قابل للذوبان قليلاً في ثنائي إيثيل الإيثر (0.3 ج/100 مول) قابل للذوبان بشكل كبير في الأمونيا | ||
| الحموضة (pKa) | ~9 | ||
| القابلية المغناطيسية | −14.5·10−6 سم3/مول | ||
| معامل الانكسار (nD) | 1.65 | ||
| البنية | |||
| البنية البلورية | orthorhombic | ||
| الزمرة الفراغية | Im2m | ||
| ثابت العقد | a = 3.5653(8) Å, b = 5.5728(7) Å, c = 5.3846(13) Å | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
−359 كيلوجول/مول[1] | ||
| Standard molar entropy S |
106 جول/مول ك | ||
| المخاطر | |||
| صفحة بيانات السلامة | External MSDS | ||
| ن.م.ع. مخطط تصويري |   
| ||
| ن.م.ع. كلمة الاشارة | خطر | ||
| H272, H301, H319, H400 | |||
| P220, P273, P301+P310, P305+P351+P338 | |||
| NFPA 704 (معيـَّن النار) | |||
| 489 °C (912 °F; 762 K) | |||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LD50 (الجرعة الوسطى)
|
180 ملج/كج (الجرذان، عن طريق الفم) | ||
| مركبات ذا علاقة | |||
أنيونات أخرى
|
نترات الصوديوم | ||
كاتيونات أخرى
|
نيتريت البوتاسيوم نتريت الأمونيوم نيتريت الليثيوم | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الاستخدامات
الكيمياء الصناعية
الاستخدام الرئيسي لنتريت الصوديوم هو الإنتاج الصناعي لمركبات النيتروجين العضوي. وهو كاشف لتحويل الأمين إلى مركبات داي آزو، والتي تعتبر مركبات طليعية رئيسية للعديد من الأصباغ، مثل صبغات داي آزو. تُحضر مركبات النتروزو من النتريت. وتستخدم هذه المركبات في صناعة المطاط.[3]
يستخدم نيتريت الصوديوم في مجموعة متنوعة من التطبيقات المعدنية، من أجل إضافة وإزالة الفوسفات.[3]
نيتريت الصوديوم هو مثبط تآكل فعال ويستخدم كمادة مضافة لإنتاج المشحمات الصناعية،[4] كمحلول مائي في أنظمة التبريد مغلقة الحلقة، وفي حالة منصهرة كوسيط لنقل الحرارة.[5]
كمادة مضافة وحافظة للأغذية
يستخدم نيتريت الصوديوم لتسريع عملية تجفيف اللحوم، ويمنع إنبات جراثيم المطثية الحيوية، كما يضفي لونًا ورديًا جذابًا على اللحوم.[6][7][8] يتفاعل النتريت مع ميوجلوبين اللحم لإحداث تغيرات في اللون، ويتحول أولاً إلى نيتروسوميوجلوبين (أحمر ساطع)، ثم عند التسخين إلى نيتروسوهيموكروم (صبغة وردية).[9]
تاريخياً، استخدم ملح لحفظ اللحوم. كان منتج اللحوم المحفوظ بالملح عادة بني-رمادي اللون. عند إضافة نتريت الصوديوم مع الملح، يتحول لون اللحم إلى اللون الأحمر ثم الوردي، وهو ما يرتبط باللحوم المعالجة مثل لحم الخنزير ولحم الخنزير المقدد والنقانق والبولونيا.[10]
في أوائل القرن العشرين، كان التجفيف غير المنتظم أمرًا شائعًا. أدى ذلك إلى مزيد من البحث حول استخدام نتريت الصوديوم باعتباره مادة مضافة في الأغذية، مع توحيد الكمية الموجودة في الأغذية لتقليل الكمية المطلوبة مع تعظيم دورها كمضافات غذائية.[11] من خلال هذا البحث، وجد أن نتريت الصوديوم يعطي طعمًا ولونًا للحوم ويمنع أكسدة الدهون التي تؤدي إلى الإنتان، بدرجات متفاوتة من الفعالية للتحكم في نمو العضيات الدقيقة المسببة للأمراض.[11] أدت قدرة نتريت الصوديوم على معالجة المشكلات المذكورة أعلاه إلى إنتاج اللحوم مع فترة تخزين طويلة وتحسين اللون والمذاق المرغوب فيهما. وفقًا للعلماء العاملين في صناعة اللحوم،[12] يحسن النتريت سلامة الأغذية.[11] هذا الرأي محل خلاف في ضوء الآثار المسرطنة المحتملة الناجمة عن إضافة النيتريت إلى اللحوم.[6]
يحمل النتريت رقم E E250. يستخدم نتريت البوتاسيوم (E249) بنفس الطريقة. اعتمد استخدامه في الاتحاد الأوروبي،[13][14] الولايات المتحدة[15] وأستراليا ونيوزيلندا.[16]
في معالجة اللحوم، لا يستخدم نتريت الصوديوم أبدًا في حالة نقية لكن يتم خلطه دائمًا مع الملك. يُعرف هذا الخليط بالملح النتريتي، ملح المعالجة أو ملح المعالجة النتريتي. في أوروبا، يحتوي ملح المعالجة بالنتريت على ما بين 99.1٪ و99.5٪ ملحاً شائعاً، 0.5٪ و0.9٪ منها نتريت. في الولايات المتحدة، يُحدد جرعات ملح المعالجة بالنتريت بنسبة 6٪ ويجب إعادة خلطه بالملح قبل الاستخدام.[17]
اللون والمذاق
يعد مظهر ومذاق اللحوم عنصراً هاماً في القبول لدى المستهلك.[11] نتريت الصوديوم مسؤول عن اللون الأحمر المرغوب فيه (أو الأحمر الوردي) للحوم.[11] هناك حاجة إلى القليل جدًا من النتريت لإحداث هذا التغيير.[11] أُبلغ عن الحاجة إلى ما لا يقل عن 2 إلى 14 جزءًا في المليون (ppm) للحث على هذا التغيير المرغوب في اللون.[18] ومع ذلك، لإطالة عمر هذا التغيير اللوني، هناك حاجة إلى مستويات أعلى بشكل ملحوظ.[18] الآلية المسؤولة عن هذا التغيير اللوني هي تكوين عوامل نيتروزيلاتينج بواسطة النتريت، والتي لديها القدرة على نقل أكسيد النيتريك الذي يتفاعل لاحقًا مع الميوجلوبين لإنتاج لون اللحم المجفف.[18] يتأثر المذاق الفريد المرتبط باللحوم المعالجة أيضًا بإضافة نتريت الصوديوم.[11] ومع ذلك، فإن الآلية الكامنة وراء هذا التغيير في المذاق لا تزال غير مفهومة تمامًا.[18]
تثبيط المُمرضات الجرثومية
بالاقتران مع مستويات الملح ودرجة الحموضة، يقلل نتريت الصوديوم من قدرة جراثيم مطثية حيوية على النمو إلى درجة إنتاج الذيفان.[8][19] تُصنع بعد منتجات اللحوم المجففة بدون استخدام النتريت. على سبيل المثال، لحم خنزير بارما، التي تُنتج بدون النتريت منذ عام 1993، تم في عام 2018 أُفيد أنها لم تسبب أي حالات من التسمم الغذائي.[6]
أظهر نتريت الصوديوم درجات متفاوتة من الفعالية للسيطرة على نمو أنواع أخرى من التلف أو العضيات الدقيقة المسببة للأمراض.[11]
على الرغم من أن آليات التثبيط غير معروفة بشكل جيد، إلا أن فعاليتها تعتمد على عدة عوامل بما في ذلك مستوى النتريت المتبقي، الأس الهيدروجيني، وتركيز الملح، والمختزلات الموجودة ومحتوى الحديد.[18] يؤثر نوع الجراثيم أيضاً على فعالية نتريت الصوديوم.[18] من المتفق عليه عمومًا أن نتريت الصوديوم ليس فعالًا للسيطرة على الجراثيم سلبية الگرام المسببة للأمراض المعوية مثل "السالمونلا" و"الإشريشيا المعوية".[18]
المضافات الغذائية الأخرى (مثل اللاكتات والسوربات) توفر حماية مماثلة ضد الجراثيم، لكنها لا توفر اللون الوردي المطلوب.[20][21]
تثبيط فوق أكسدة الدهون
نتريت الصوديوم قادر أيضًا على تأخير تطور عملية التزنخ المؤكسدة.[18] تعتبر فوق أكسدة الدهون سبباً رئيسياً لتدهور جودة منتجات اللحوم (التزنخ والطعم الغير شهي).[18] يعمل نتريت الصوديوم كمضاد للأكسدة بآلية مشابهة للآلية المسؤولة عن تأثير التلوين.[18] يتفاعل النتريت مع بروتينات الهيم وأيونات المعادن، معادلًا الجذور الحرة بواسطة أكسيد النيتريك (أحد منتجاته الثانوية).[18] يؤدي تحييد هذه الجذور الحرة إلى إنهاء دورة فوق أكسدة الدهون التي تؤدي إلى عملية التزنخ.[18]
الطب
| Chemical structure | |
| البيانات السريرية | |
|---|---|
| AHFS/Drugs.com | FDA Professional Drug Information |
| فئة السلامة أثناء الحمل |
|
| رمز ATC | |
| الحالة القانونية | |
| الحالة القانونية |
|
| المعرفات | |
| رقم CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| E number | E250 (preservatives) |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.028.687 |
| Chemical and physical data | |
| التركيب | NNaO2 |
| الكتلة المولية | 68٫99 g·mol−1 |
| 3D model (JSmol) | |
| |
| |
نتريت الصوديوم، يُستخدم مع ثيوكبريتات الصوديوم لعلاج تسمم السيانيد.[22] يوصى باستخدامه فقط في حالات التسمم الشديدة بالسيانيد.[23] بالنسبة لأولئك الذين يعانون من التسمم بالسيانيد والتسمم بأول أكسيد الكربون يوصى عادةً باستخدام ثيوسلفات الصوديوم ذاته.[24] يُعطى عن طريق الحقن البطيء في الوريد.[22]
قد تشمل الآثار الجانبية انخفاض ضغط الدم والصداع وضيق التنفس وفقدان الوعي والقيء.[22] يجب توخي مزيد من الحذر عند الأشخاص المصابين بأمراض القلب الكامنة.[22] يجب فحص مستويات الميتهيموجلوبين بانتظام أثناء العلاج.[22] على الرغم من عدم دراسته جيدًا أثناء الحمل، إلا أن هناك بعض الأدلة على احتمال حدوث ضرر للجنين.[25] يُعتقد أن نتريت الصوديوم يعمل عن طريق تكوين ميتهيموجلوبين يرتبط بعد ذلك بالسيانيد وبالتالي يزيله من الميتوكوندريا.[25]
بدأ الاستخدام الطبي لنتريت الصوديوم في العشرينيات والثلاثينيات.[26][27] وهو على قائمة الأدوية الأساسية حسب منظمة الصحة العالمية.[28]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الانتحار
ناقشت العديد من المنشورات الأكاديمية في عامي 2020 و2021 سمية نتريت الصوديوم، وزيادة واضحة مؤخرًا في حالات الانتحار باستخدام نتريت الصوديوم والذي طُلب عبر الإنترنت.[29] نوقش استخدام نتريت الصوديوم كطريقة انتحار بشكل مكثف في منتديات الانتحار، وخاصة منتدى Sanctioned Suicide.[30] كان نتريت الصوديوم أيضًا الجاني في قضية "مكارثي وآخرون. ضد أمازون، "دعوى قضائية تزعم أن أمازون ساعدت عن علم في وفاة أطفال أصحاء ببيعهم" مجموعات انتحار "كميزة "يتم شراؤها معًا بشكل متكرر" أوصت بشراء نتريد الصوديوم، مضاد قيء وكتاب تعليمات حول الانتحار معًا.[31] منذ عام 2019 يحظر متجر إيباي الإلكتروني بيع نتريت الصوديوم على مستوى العالم.[32]
السمية
نتريت الصوديوم هي مادة سامة.[33] LD50 (جرعة النصف المميتة) في الجرذان هي 180 ملج/كج وLDLo (أقل جرعة سامة منشورة) في البشر هي 71 ملج/كج.[34] ومع ذلك يمكن أن تحدث الوفاة عن طريق تناول نتريت الصوديوم بجرعة أقل.[35][36] يستخدم نتريت الصوديوم في القتل.[37][38] لمنع التسمم العرضي، يُصبغ نتريت الصوديوم (المخلوط بالملح) المباع كمضاف غذائي في الولايات المتحدة باللون الوردي الفاتح لتجنب الخلط بينه وبين الملح العادي أو السكر. في بلدان أخرى، لا يُصبغ الملح المعالج بالنتريت لكن تداوله خاضع للوائح صارمة.[39]
التواجد في الخضروات
لا يتواجد النتريت بشكل طبيعي في الخضروات بكميات كبيرة.[40] لا يؤثر سلق الخضروات على مستويات النتريت.[41]
وجود النتريت في الأنسجة الحيوانية هو نتيجة لاستقلاب لأكسيد النيتريك، وهو ناقل عصبي هام.[42] قد يتكون أكسيد النتريك "من جديد" من سينثاز أكسيد النيتريك باستخدام الأرجنين أو من النتريت.[43]
الخنازير
نظرًا لارتفاع مستوى سمية نتريت الصوديوم للخنازير ("الخنازير البرية")، يتم تطويره الآن في أستراليا للسيطرة على الخنازير الوحشية والبرية.[44][45] يحفز نتريت الصوديوم ميتهيموجلوبينية الدم في الخنازير، أي أنه يقلل من كمية الأكسجين التي تُطلق من الهيموجلوبين، لذلك سيشعر الحيوان بالإغماء ثم يفقد الوعي، ثم يموت بطريقة إنسانية بعد أن يصبح فقدانه الوعي مباشرة.[46] تدير مديرية تكساس للحدائق والحياة البرية مرفقًا بحثيًا في منطقة إدارة الحياة البرية في كير، حيث يقومون بفحص تفضيلات التغذية للخنازير الوحشية وتكتيكات الطعم لإدارة نتريت الصوديوم.[47]
السرطان
السرطنة هي قدرة أو ميل مادة كيميائية لتحفيز الأورام، أو زيادة حدوثها، أو تحفيز الورم الخبيث، أو تقصير وقت حدوث الورم.[48]
ثبت أن إضافة النيتريت إلى اللحوم تولد مواد مسرطنة معروفة مثل النيتروزامينات؛ حسب منظمة الصحة العالمية فإن كل 50 جرامًا من "اللحوم المصنعة" التي يتم تناولها يوميًا من شأنها أن تزيد من خطر الإصابة بسرطان الأمعاء بنسبة 18٪ على مدى العمر. عام 2015 خلصت مراجعة منظمة الصحة العالمية لأكثر من 400 دراسة، إلى أن هناك أدلة كافية على أن "اللحوم المصنعة" تسبب السرطان، وخاصة سرطان القولون؛[6] صنفت الوكالة الدولية لأبحاث السرطان (IARC) التابعة لمنظمة الصحة العالمية "اللحوم المصنعة" على أنها مسببة للسرطان البشرية (مسرطنات المجموعة 1)؛ "اللحوم المصنعة" هي اللحوم التي خضعت للتجفيف أو المعالجة أو التخمير أو التدخين أو غيرها من العمليات لتعزيز النكهة أو تحسين الحفظ.).[6][49]
يمكن تكوين النتروزامينات أثناء عملية التجفيف المستخدمة لحفظ اللحوم، عند طهي اللحوم المعالجة بنتريت الصوديوم، وأيضًا من تفاعل النتريت مع الأمينات الثانوية في ظل الظروف الحمضية (كما يحدث في معدة الإنسان). تشمل المصادر الغذائية للنيتروزامين اللحوم المعالجة الأمريكية والمحفوظة بنيتريت الصوديوم وكذلك الأسماك المملحة المجففة التي يتم تناولها في اليابان. في العشرينيات، أدى التغيير الكبير في ممارسات معالجة اللحوم في الولايات المتحدة إلى انخفاض بنسبة 69٪ في متوسط محتوى النتريت. سبق هذا الحدث بداية انخفاض كبير في معدل الوفيات بسرطان المعدة.[50] حوالي عام 1970، وجد أن حمض الأسكوربيك (فيتامين ج)، مضاد للأكسدة، يثبط تكوين النيتروزامين.[51] وبالتالي، فإن إضافة ما لا يقل عن 550 جزء في المليون من حمض الأسكوربيك مطلوب في اللحوم المصنعة بالولايات المتحدة. يستخدم المصنعون أحيانًا حمض الإريثوربيك، وهو أيزومر أرخص ثمناً لكنه بنفس الفعالية من حمض الأسكوربيك. بالإضافة إلى ذلك، قد تضيف الشركات المصنعة α-tocopherol (فيتامين E) لزيادة منع تكون النيتروزامين. α-Tocopherol، وحمض الأسكوربيك، وحمض الإريثوربيك جميعها تمنع تكون النيتروزامين بخصائصها المؤكسدة والمختزلة. حمض الأسكوربيك، على سبيل المثال، يتشكل حمض ديهيدروكوربيك عندما يتأكسد، والذي في وجود نيتروسونيوم، يكون عامل نترزة قوي يتكون من نتريت الصوديوم، يختزل النيتروزونيوم إلى أكسيد النيتريك.[52] عادة ما يكون أيون النيتروزونيوم المتكون في محاليل النتريت الحمضية[53][54] بطريقة خاطئة على أنه أنهيدريد النيتروز، وهو أكسيد نيتروجين غير مستقر لا يمكن أن يوجد في المختبر.[55]
بحسب الوكالة الدولية لأبحاث السرطان فإن تناول النتريت في ظل ظروف تؤدي إلى النترزة الخطرة التي صنفتها على أنها "مادة مسرطنة محتملة للبشر".[56][57]
كما رُبط استهلاك نتريت الصوديوم بإثارة الصداع النصفي لدى الأفراد الذين يعانون منه بالفعل.[58]
وجدت إحدى الدراسات وجود علاقة بين تناول اللحوم المعالجة بشكل متكرر بالملح الوردي ومرض الانسداد الرئوي المزمن، أحد أشكال الأمراض الرئوية.[بحاجة لمصدر] يشير باحثو الدراسة إلى أن ارتفاع كمية النيتريت في اللحوم كان السبب وراء ذلك. ومع ذلك، لم يثبت الفريق نظرية النتريت. بالإضافة إلى ذلك، لم تثبت الدراسة أن النتريت أو اللحوم المعالجة تسببت في ارتفاع معدلات الإصابة بمرض الانسداد الرئوي المزمن، بل مجرد رابط. قام الباحثون بتعديل العديد من عوامل الخطر لمرض الانسداد الرئوي المزمن، لكنهم علقوا على أنهم لا يستطيعون استبعاد جميع الأسباب أو المخاطر المحتملة غير القابلة للقياس لمرض الانسداد الرئوي المزمن.[59][60]
الانتاج
يتبع الإنتاج الصناعي لنتريت الصوديوم إحدى عمليتين، اختزال أملاح النترات، أو أكسدة أكاسيد النيتروجين الأقل.
تستخدم إحدى الطرق نترات الصوديوم المنصهرة كالملح، والرصاص الذي يتأكسد، بينما تستخدم الطريقة الأكثر حداثة برادة حديد الخردة لاختزال النترات.[3][61]
تتضمن الطريقة الأكثر شيوعًا التفاعل العام لأكاسيد النيتروجين في محلول مائي قلوي، مع إضافة محفز. تعتمد الظروف الدقيقة على أكاسيد النيتروجين المستخدمة، ونوع المؤكسد، حيث يجب التحكم في الظروف بعناية لتجنب الأكسدة المفرطة لذرة النيتروجين.[3]
يُنتج نتريت الصوديوم أيضًا من خلال اختزال أملاح النترات عن طريق التعرض للحرارة والضوء والإشعاع المؤين والمعادن والهيدروجين والاختزال الإلكتروليتي.[62]
التفاعلات الكيميائية
في المختبر، يمكن استخدام نتريت الصوديوم لتدمير أزيد الصوديوم الفائض.[63][64]
يتحلل نتريت الصوديوم فوق درجة حرارة 330°C (في الهواء) إلى أكسيد الصوديوم وأكسيد النيتريك وثاني أكسيد النيتروجين.[65]
قد يستخدم نتريت الصوديوم أيضاً في تحضير أكسيد النيتروز:
ثم ينحل أكسيد النيتروز بدوره، في الظروف العادية، إلى:
يتحلل ثاني أكسيد النيتروجين الناتج إلى خليط من حمضي النيتريك والنيتروز:
عنونة النظير 15N
في التركيب العضوي، يُخصب نظير نيتريت الصوديوم-15N يمكن استخدامها بدلاً من نتريت الصوديوم العادي لأن تفاعله متطابق تقريبًا في معظم التفاعلات.
المنتجات التي تم الحصول عليها تحمل النظير 15N ومن ثم يمكن إجراء الرنين المغناطيسي النووي بالنتروجين بكفاءة.[66]
مرئيات
| أضرار نيتريت الصوديوم على الجسم. |
| ما لفرق بين نترات الصوديوم ونتريت الصوديوم؟ |
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
المراجع
- ^ Zumdahl SS (2009). Chemical Principles (6th ed.). Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- ^ "GESTIS-Stoffdatenbank sodium nitrite". gestis.dguv.de. Retrieved 10 December 2021.
- ^ أ ب ت ث ج Laue W, Thiemann M, Scheibler E, Wiegand KW (2006). "Nitrates and Nitrites". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a17_265. ISBN 978-3-527-30673-2.
- ^ Krakhmalev SI, Vorotnikova VA, Ten NV, Taranova NV (1984). "Determination of sodium nitrite in complex sodium oils". Chemistry and Technology of Fuels and Oils. 20 (12): 612–613. doi:10.1007/BF00726438. S2CID 94383988.
- ^ "Sodium Nitrite". General Chemical. Archived from the original on 22 May 2013. Retrieved 28 September 2012.
- ^ أ ب ت ث ج Wilson B (2018-03-01). "Yes, bacon really is killing us". The Guardian (in الإنجليزية البريطانية). London. ISSN 0261-3077. Archived from the original on 2021-02-10. Retrieved 2021-02-14.
In trade journals of the 1960s, the firms who sold nitrite powders to ham-makers spoke quite openly about how the main advantage was to increase profit margins by speeding up production.
- ^ Lerfall J, Østerlie M (February 2011). "Use of sodium nitrite in salt-curing of Atlantic salmon (Salmo salar L.) – Impact on product quality". Food Chemistry. 124 (3): 759–766. doi:10.1016/j.foodchem.2010.06.092.
- ^ أ ب "Use and Removal of Nitrite in Meat Products". Archived from the original on 9 March 2023. Retrieved 23 April 2023.
- ^ Bailey ME, Frame RW, Naumann HD (January 1964). "Cured Meat Pigments, Studies of the Photooxidation of Nitrosomyoglobin". Journal of Agricultural and Food Chemistry. 12 (1): 89–93. doi:10.1021/jf60131a026.
- ^ ""Meat Pigment Chemistry", taken from IFT Mini-Experiments in Food Science Series" (PDF). Archived from the original (PDF) on 3 December 2019. Retrieved 28 January 2019.
- ^ أ ب ت ث ج ح خ د Sindelar JJ, Milkowski AL (May 2012). "Human safety controversies surrounding nitrate and nitrite in the diet". Nitric Oxide. 26 (4): 259–266. doi:10.1016/j.niox.2012.03.011. PMID 22487433.
- ^ "Science Says: Are hot dogs healthier without added nitrites? | Lifestyle from CTV News". www.ctvnews.ca. 30 June 2017.
- ^ "Approved additives and E numbers". Food Standards Agency (in الإنجليزية). Retrieved 2023-01-09.
- ^ "Health and Food Safety" (PDF). European Commission – European Commission. Retrieved 1 April 2018.
- ^ US Food and Drug Administration: "Listing of Food Additives Status Part II". Food and Drug Administration. Retrieved 27 October 2011.
- ^ Health. "Australia New Zealand Food Standards Code - Standard 1.2.4 - Labelling of Ingredients". www.legislation.gov.au (in الإنجليزية). Retrieved 2023-01-09.
- ^ Coudray G (February 2021). Who poisoned your bacon?. Icon Books. pp. xv. ISBN 978-1785786112.
- ^ أ ب ت ث ج ح خ د ذ ر ز س Sindelar J, Milkowski A (November 2011). "Sodium Nitrite in Processed Meat and Poultry Meats: A Review of Curing and Examining the Risk/Benefit of Its Use" (PDF). American Meat Science Association. 3: 1–14.
- ^ Lee S, Lee H, Kim S, Lee J, Ha J, Choi Y, et al. (August 2018). "Microbiological safety of processed meat products formulated with low nitrite concentration - A review". Asian-Australasian Journal of Animal Sciences. 31 (8): 1073–1077. doi:10.5713/ajas.17.0675. PMC 6043430. PMID 29531192.
- ^ Seward RA, Deibel RH, Lindsay RC (November 1982). "Effects of potassium sorbate and other antibotulinal agents on germination and outgrowth of Clostridium botulinum type E spores in microcultures". Applied and Environmental Microbiology. 44 (5): 1212–1221. Bibcode:1982ApEnM..44.1212S. doi:10.1128/AEM.44.5.1212-1221.1982. PMC 242170. PMID 6758699.
- ^ Sofos JN, Busta FF, Bhothipaksa K, Allen CE, Robach MC, Paquette MW (September 1980). "Effects of various concentrations of sodium nitrite and potassium sorbate on Clostridium botulinum toxin production in commercially prepared bacon". Journal of Food Science. 45 (5): 1285–1292. doi:10.1111/j.1365-2621.1980.tb06539.x.
- ^ أ ب ت ث ج World Health Organization (2009). Stuart MC, Kouimtzi M, Hill SR (eds.). WHO Model Formulary 2008. World Health Organization. p. 65. hdl:10665/44053. ISBN 9789241547659.
- ^ "Sodium Nitrite Solution for Injection - Summary of Product Characteristics (SPC) - (eMC)". www.medicines.org.uk. Archived from the original on 18 September 2017. Retrieved 15 January 2017.
- ^ Baren JM (2008). Pediatric Emergency Medicine (in الإنجليزية). Elsevier Health Sciences. p. 1018. ISBN 978-1416000877. Archived from the original on 2017-01-16 – via Google Books.
- ^ أ ب "Sodium Nitrite Injection - FDA prescribing information, side effects and uses". www.drugs.com. Archived from the original on 2017-01-18.
- ^ Dart RC (2004). Medical Toxicology (in الإنجليزية). Lippincott Williams & Wilkins. p. 172. ISBN 9780781728454. Archived from the original on 2017-01-16 – via Google Books.
- ^ Bryan NS, Loscalzo J (2011). Nitrite and Nitrate in Human Health and Disease (in الإنجليزية). Springer Science & Business Media. p. 226. ISBN 9781607616160. Archived from the original on 2017-01-16 – via Google Books.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ خطأ: الوظيفة "harvard_core" غير موجودة.; خطأ: الوظيفة "harvard_core" غير موجودة.; خطأ: الوظيفة "harvard_core" غير موجودة.; خطأ: الوظيفة "harvard_core" غير موجودة.; خطأ: الوظيفة "harvard_core" غير موجودة.; خطأ: الوظيفة "harvard_core" غير موجودة.; خطأ: الوظيفة "harvard_core" غير موجودة.; خطأ: الوظيفة "harvard_core" غير موجودة.; خطأ: الوظيفة "harvard_core" غير موجودة.; خطأ: الوظيفة "harvard_core" غير موجودة.
- ^ Twohey M (9 December 2021). "Where the Despairing Log On, and Learn Ways to Die". The New York Times. Retrieved 24 July 2022.
- ^ ""Amazon "suicide kits" have led to teen deaths, according to new lawsuit"". Ars Technica. 7 October 2022.
- ^ Director eBay (UK) Limited (8 January 2021). "Re Jason Thompson (deceased) – Sodium Nitrite" (PDF).
- ^ Crellin J. "How toxic is it?" (PDF). The Association for Science Educators. Retrieved 6 February 2022.
- ^ "Safety data for sodium nitrite". The Physical and Theoretical Chemistry Laboratory. Oxford University. Archived from the original on 10 April 2008.
- ^ Gowans WJ (November 1990). "Fatal methaemoglobinaemia in a dental nurse. A case of sodium nitrite poisoning". The British Journal of General Practice. 40 (340): 470–471. PMC 1371420. PMID 2271282.
- ^ Standefer JC, Jones AM, Street E, Inserra R (October 1979). "Death associated with nitrite ingestion: report of a case". Journal of Forensic Sciences. 24 (4): 768–771. doi:10.1520/JFS10905J. PMID 541641.
- ^ "Chinese teacher sentenced to death for poisoning nursery children". BBC News. 29 September 2020.
- ^ "Teacher in China sentenced to death for poisoning children's porridge". The Guardian. Agence France-Presse in Beijing. 29 September 2020.
- ^ "The Use and Removal of Nitrite in Meat Products | FAQs | the Food Safety Authority of Ireland".
- ^ Dennis MJ, Wilson LA (2003). "Nitrates and Nitrites". Encyclopedia of Food Sciences and Nutrition. pp. 4136–4141. doi:10.1016/B0-12-227055-X/00830-0. ISBN 978-0-12-227055-0.
- ^ Leszczyńska T, Filipiak-Florkiewicz A, Cieślik E, Sikora E, Pisulewski PM (June 2009). "Effects of some processing methods on nitrate and nitrite changes in cruciferous vegetables". Journal of Food Composition and Analysis. 22 (4): 315–321. doi:10.1016/j.jfca.2008.10.025.
- ^ Meulemans A, Delsenne F (October 1994). "Measurement of nitrite and nitrate levels in biological samples by capillary electrophoresis". Journal of Chromatography B, Biomedical Applications. 660 (2): 401–404. doi:10.1016/0378-4347(94)00310-6. PMID 7866533.
- ^ Southan GJ, Srinivasan A (August 1998). "Nitrogen oxides and hydroxyguanidines: formation of donors of nitric and nitrous oxides and possible relevance to nitrous oxide formation by nitric oxide synthase". Nitric Oxide. 2 (4): 270–286. doi:10.1006/niox.1998.0187. PMID 9851368.
- ^ (4 May 2009) "Is America Ready for a Humane Feral Pig Toxicant?" in Wildlife Damage Management Conference..
- ^ {{{1}}} patent {{{2}}}
- ^ Porter S, Kuchel T (2010). Assessing the humaness and efficacy of a new feral pig bait in domestic pigs. Study PC0409 (PDF). Canberra, South Australia: Veterinary Services Division, Institute of Medical and Veterinary Science. p. 11.
- ^ Texas Parks and Wildlife (21 February 2013). "Hogs Wild – Fighting the Feral Pig Problem – Texas Parks and Wildlife [Official]". Archived from the original on 2021-12-12. Retrieved 1 April 2018 – via YouTube.
- ^ "Known and Probable Human Carcinogens". www.cancer.org (in الإنجليزية). Retrieved 28 January 2019.
- ^ "IARC Monographs evaluate consumption of red meat and processed meat" (PDF). International Agency for Research on Cancer. 2015-10-26. Archived from the original (PDF) on 2021-01-18. Retrieved 2021-02-14.
Processed meat was classified as carcinogenic to humans (Group 1), based on sufficient evidence in humans that the consumption of processed meat causes colorectal cancer.
- ^ Paik DC, Saborio DV, Oropeza R, Freeman HP (February 2001). "The epidemiological enigma of gastric cancer rates in the US: was grandmother's sausage the cause?". International Journal of Epidemiology. 30 (1): 181–182. doi:10.1093/ije/30.1.181. PMID 11171883.
- ^ Mackerness CW, Leach SA, Thompson MH, Hill MJ (February 1989). "The inhibition of bacterially mediated N-nitrosation by vitamin C: relevance to the inhibition of endogenous N-nitrosation in the achlorhydric stomach". Carcinogenesis. 10 (2): 397–399. doi:10.1093/carcin/10.2.397. PMID 2492212.
- ^ "Research Newsletter". Linus Pauling Institute. 1 July 2014. Retrieved 1 April 2018.
- ^ Scanlan RA (May 1983). "Formation and occurrence of nitrosamines in food". Cancer Research. 43 (5 Suppl): 2435s–2440s. PMID 6831466. قالب:NAID.
- ^ Nollet LM, Toldrá F (2015). Handbook of Food Analysis (Third ed.). p. 290. ISBN 978-1-4822-9784-3.[صفحة مطلوبة]
- ^ Williams DL (2004). "Reagents effecting nitrosation". Nitrosation Reactions and the Chemistry of Nitric Oxide. pp. 1–34. doi:10.1016/B978-044451721-0/50002-5. ISBN 978-0-444-51721-0.
- ^ "List of classifications, Volumes 1–116 – IARC Monographs on the Evaluation of Carcinogenic Risks to Humans". International Agency for Research on Cancer (IARC) – World Health Organization (WHO). 2010. Retrieved 25 September 2016.
- ^ Ingested Nitrate and Nitrite, and Cyanobacterial Peptide Toxins. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Vol. 94. 2010. ISBN 978-92-832-1294-2. Retrieved 25 September 2016.
{{cite book}}:|work=ignored (help) - ^ "Heading Off Migraine Pain". FDA Consumer magazine. U.S. Food and Drug Administration. 1998.
- ^ Hitti M (17 April 2007). "Study: Cured Meats, COPD May Be Linked". WebMD Medical News.
- ^ Jiang R, Paik DC, Hankinson JL, Barr RG (April 2007). "Cured meat consumption, lung function, and chronic obstructive pulmonary disease among United States adults". American Journal of Respiratory and Critical Care Medicine. 175 (8): 798–804. doi:10.1164/rccm.200607-969OC. PMC 1899290. PMID 17255565.
- ^ Hao ZW, Xu XH, Wang DH (March 2005). "Reductive denitrification of nitrate by scrap iron filings". Journal of Zhejiang University. Science. B. 6 (3): 182–186. doi:10.1631/jzus.2005.B0182. PMC 1389719. PMID 15682502.
- ^ Pokorny L, Maturana I, Bortle WH (2006). "Sodium Nitrate and Nitrite". Kirk-Othmer Encyclopedia of Chemical Technology. doi:10.1002/0471238961.1915040916151115.a01.pub2. ISBN 978-0-471-23896-6.
- ^ "Sodium Azide". Hazardous Waste Management. Northeastern University. مارس 2003. Archived from the original on 4 نوفمبر 2007.
- ^ National Research Council (1995). Prudent practices in the laboratory: handling and disposal of chemicals. Washington, D.C.: National Academy Press. doi:10.17226/4911. ISBN 978-0-309-05229-0.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Stern KH (July 1972). "High Temperature Properties and Decomposition of Inorganic Salts Part 3, Nitrates and Nitrites". Journal of Physical and Chemical Reference Data. 1 (3): 747–772. Bibcode:1972JPCRD...1..747S. doi:10.1063/1.3253104. S2CID 95532988.
- ^ Kazem-Rostami M, Akhmedov NG, Faramarzi S (February 2019). "Molecular lambda shape light-driven dual switches: Spectroscopic and computational studies of the photoisomerization of bisazo Tröger base analogs". Journal of Molecular Structure. 1178: 538–543. Bibcode:2019JMoSt1178..538K. doi:10.1016/j.molstruc.2018.10.071. S2CID 105312344.
المصادر
- Durão C, Pedrosa F, Dinis-Oliveira RJ (July 2020). "A fatal case by a suicide kit containing sodium nitrite ordered on the internet". Journal of Forensic and Legal Medicine. 73: 101989. doi:10.1016/j.jflm.2020.101989. hdl:10400.26/34138. PMID 32658747. S2CID 219909654.
- Durão C, Pedrosa F, Dinis-Oliveira RJ (June 2021). "Another suicide by sodium nitrite and multiple drugs: an alarming trend for "exit"?". Forensic Science, Medicine, and Pathology. 17 (2): 362–366. doi:10.1007/s12024-020-00340-2. PMID 33247411. S2CID 227180461.
- Tomsia M, Głaz M, Nowicka J, Szczepański M (July 2021). "Sodium nitrite detection in costal cartilage and vitreous humor - Case report of fatal poisoning with sodium nitrite". Journal of Forensic and Legal Medicine. 81: 102186. doi:10.1016/j.jflm.2021.102186. PMID 34058704. S2CID 235268052.
- McCann SD, Kennedy JM, Tweet MS, Bryant SM (March 2021). "Sodium Nitrite Ingestion: an Emerging Trend in Suicide Attempts Shared via Online Communities". The Journal of Emergency Medicine. 60 (3): 409–412. doi:10.1016/j.jemermed.2020.10.021. PMID 33712114. S2CID 232218908.
- Dean DE, Looman KB, Topmiller RG (July 2021). "Fatal methemoglobinemia in three suicidal sodium nitrite poisonings". Journal of Forensic Sciences. 66 (4): 1570–1576. doi:10.1111/1556-4029.14689. PMID 33598944. S2CID 231952466.
- Hickey TB, MacNeil JA, Hansmeyer C, Pickup MJ (September 2021). "Fatal methemoglobinemia: A case series highlighting a new trend in intentional sodium nitrite or sodium nitrate ingestion as a method of suicide". Forensic Science International. 326: 110907. doi:10.1016/j.forsciint.2021.110907. PMID 34298207.
- Harvey M, Cave G, Chanwai G (October 2010). "Fatal methaemoglobinaemia induced by self-poisoning with sodium nitrite". Emergency Medicine Australasia. 22 (5): 463–465. doi:10.1111/j.1742-6723.2010.01335.x. PMID 21040485. S2CID 38780081.
- McCann SD, Tweet MS, Wahl MS (December 2021). "Rising incidence and high mortality in intentional sodium nitrite exposures reported to US poison centers". Clinical Toxicology. 59 (12): 1264–1269. doi:10.1080/15563650.2021.1905162. PMID 33787434. S2CID 232431594.
- Sedhai YR, Atreya A, Basnyat S, Phuyal P, Pokhrel S (June 2022). "The use of sodium nitrite for deliberate self-harm, and the online suicide market: Should we care?". The Medico-Legal Journal. 90 (2): 79–80. doi:10.1177/0025817221998119. PMID 33906496. S2CID 233429578.
- Mudan A, Repplinger D, Lebin J, Lewis J, Vohra R, Smollin C (September 2020). "Severe Methemoglobinemia and Death From Intentional Sodium Nitrite Ingestions". The Journal of Emergency Medicine. 59 (3): e85–e88. doi:10.1016/j.jemermed.2020.06.031. PMID 32713620. S2CID 220797852.
قراءات إضافية
- National Toxicology Program (May 2001). "Toxicology and carcinogenesis studies of sodium nitrite (CAS NO. 7632-00-0) in F344/N rats and B6C3F1 mice (drinking water studies)". National Toxicology Program Technical Report Series. 495: 7–273. PMID 12563346.
وصلات خارجية
- Drug information portal at the U.S. National Library of Medicine
- International Chemical Safety Card 1120.
- Nitrite in Meat
| الأملاح والمشتقات المكافئة لأيون النتريت | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HNO2 | He | ||||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO3)3 | C(NO2)4, CH(NO2)3, CH2(NO2)2, CH3(NO2) |
N(NO2)3 xNO3NO2 |
N2O3 | NO2F | Ne | ||||||||||||
| NaNO2 | Mg(NO2)2 | Al(NO2)3 | Si | P | S | NO2Cl | Ar | ||||||||||||
| KNO2 | Ca(NO2)2 | Sc(NO2)3 | Ti | VO(NO2)3 | Cr(NO2)3 | Mn(NO2)2 | Fe(NO2)3 | Co(NO2)2, Co(NO2)3 |
Ni(NO2)2 | Cu(NO2)2 | Zn(NO2)2 | Ga(NO2)3 | Ge | As | Se | NO2Br | Kr | ||
| RbNO2 | Sr(NO2)2 | Y(NO2)3 | Zr | Nb | Mo | Tc | Ru | Rh | Pd(NO2)2 | AgNO2 | Cd(NO2)2 | In | Sn | Sb | Te | NO2I | Xe | ||
| CsNO2 | Ba(NO2)2 | Hf | Ta | W | Re | Os | Ir | Pt(NO2)2, [Pt(NO2)4]2− |
Au | Hg2(NO2)2, Hg(NO2)2 |
TlNO2 | Pb(NO2)2 | Bi(NO2)3 BiO(NO2) |
Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La(NO2)3 | Ce(NO2)3 | Pr(NO2)3 | Nd(NO2)3 | Pm | Sm(NO2)3 | Eu(NO2)2 | Gd(NO2)3 | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Th | Pa | UO2(NO2)2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||