مرض مزيل للميالين
| Demyelinating disease | |
|---|---|
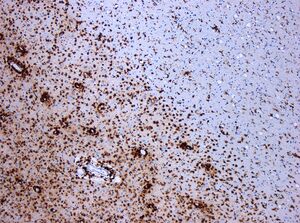 | |
| Photomicrograph of a demyelinating MS-lesion: Immunohistochemical staining for CD68 highlights numerous macrophages (brown). Original magnification 10×. | |
| التخصص | طب الجهاز العصبي |
المرض المزيل للميالين هو أي مرض يصيب الجهاز العصبي الذي يتضرر فيه غمد الميالين للخلايا العصبية.[1] يعيق هذا الضرر توصيل الإشارات في الأعصاب المصابة. بدوره ، يؤدي انخفاض القدرة على التوصيل إلى نقص في الإحساس أو الحركة أو الإدراك أو وظائف أخرى المعتمدة على الأعصاب المصابة.
يمكن أن تحدث الأمراض المزالة للميالين بسبب الجينات والعوامل المعدية وتفاعلات المناعة الذاتية وعوامل أخرى غير معروفة. تتضمن الأسباب المقترحة لإزالة الميالين العوامل الوراثية والعوامل البيئية مثل الإصابة بعدوى فيروسية أو التعرض للمواد الكيميائية. يمكن أن يؤدي التسمم بالفوسفات العضوي بالمبيدات الحشرية التجارية مثل سائل تطهير الأغنام ومبيدات الأعشاب ومستحضرات معالجة البراغيث للحيوانات الأليفة إلى إزالة الميالين العصبي[2] قد يؤدي التعرض المزمن لمضادات الذهان إلى إزالة الميالين.[3] قد يؤدي نقص فيتامين ب 12 أيضًا إلى خلل الميالين.[4][5]
الأمراض المزيلة للميالين تصنف تقليديا إلى نوعين: أمراض إزالة الميالين الورمية النخاعية وأمراض حثل المادة البيضاء المزيلة للميالين في المجموعة الأولى ، يتم تدمير الميالين الطبيعي والصحي بواسطة مادة سامة أو كيميائية أو مادة مناعية ذاتية. في المجموعة الثانية ، يكون الميالين غير طبيعي ويتحلل.[6] المجموعة الثانية كانت تسمي بأمراض مزيلة للميالين بواسطة Poser.[7]
في المثال الأكثر شهرة لمرض إزالة الميالين ، هو التصلب المتعدد ، أظهرت الأدلة أن جهاز المناعة في الجسم مسؤول جزئيًا على الأقل. من المعروف أن خلايا الجهاز المناعي المكتسبة والتي تسمى الخلايا التائية موجودة في موقع الآفات. تساهم خلايا الجهاز المناعي الأخرى المسماة البلاعم (وربما الخلايا البدينة ) أيضًا في حدوث الضرر.[8]
العلامات والاعراض
تختلف الأعراض والعلامات الموجودة في الأمراض المُزيلة للميالين من حالة إلى أخرى. يمكن أن تظهر هذه الأعراض والعلامات في الشخص المصاب بمرض مُزيل للميالين:[9]
|
اعتبارات تطورية
دور الميالين القشري لفترات طويلة في التطور البشري قد تم ااعتباره كعامل مساهم في بعض حالات مرض إزالة الميالين. على عكس الرئيسيات الأخرى ، يُظهر البشر نمطًا فريدًا من تكوّن النخاع بعد البلوغ ، والذي قد يساهم في تطور الاضطرابات النفسية والأمراض التنكسية العصبية التي تظهر في مرحلة البلوغ المبكرة وما بعدها. قد تسمح الفترة الممتدة لتكوين النخاع القشري في البشر بفرصة أكبر لاضطراب عملية تكوين النخاع ، مما يؤدي إلى ظهور مرض إزالة الميالين.[10] علاوة على ذلك ، يمتلك البشر حجمًا أكبر بكثير من المادة البيضاء في الفص الجبهي من الأنواع الرئيسية الأخرى ، مما يعني زيادة كثافة الميالين.[11] زيادة كثافة الميالين في البشر نتيجة لتكون الميالين لفترات طويلة قد يؤدي إلى تكوين مخاطر تنكس الميالين واختلال وظيفي. الاعتبارات التطورية لدور الميالين القشري لفترات طويلة كعامل خطر للإصابة بمرض إزالة الميالين وثيقة الصلة بشكل خاص بالنظر إلى أن علم الوراثة وفرضيات نقص المناعة الذاتية تفشل في تفسير العديد من حالات مرض إزالة الميالين. كما قيل ، لا يمكن تفسير أمراض مثل التصلب المتعدد من خلال نقص المناعة الذاتية وحده ، ولكنها تشير بقوة إلى تأثير عمليات النمو المعيبة في إمراض المرض.[12] لذلك ، فإن دور الفترة الطويلة الخاصة بالإنسان من عملية تكوّن الميالين القشري يعتبر اعتبارًا تطوريًا هامًا في التسبب في مرض إزالة الميالين..
التشخيص
تُستخدم طرق / تقنيات مختلفة لتشخيص أمراض إلمزيلة الميالين:
- استبعاد الحالات الأخرى التي لها أعراض متداخلة[13]
- التصوير بالرنين المغناطيسي (MRI) هو أحد تقنيات التصوير الطبي المستخدمة في الأشعة لتصور الهياكل الداخلية للجسم بالتفصيل. يستفيد التصوير بالرنين المغناطيسي من خاصية الرنين المغناطيسي النووي (NMR) لتصوير نوى الذرات داخل الجسم. هذه الطريقة موثوقة لأن التصوير بالرنين المغناطيسي يقيم التغيرات في كثافة البروتون. يمكن أن تحدث "البقع" نتيجة للتغيرات في محتوى الماء في الدماغ..[13]
- الجهد المثار هو الجهد الكهربائي المسجل من الجهاز العصبي بعد تقديم حافز كما الكشف عنها بواسطة رسم المخ الكهربائي (EEG)، وتخطيط كهربية العضل (EMG)، أو غيرها من طريقة تسجيل الكهربية.[13]
- يمكن أن يكون تحليل السائل الدماغي الشوكي (CSF) مفيدًا للغاية في تشخيص عدوي الجهاز العصبي المركزي. فحص زرع السائل الدماغي الشوكي قد تسفر عن الكائنات الحية الدقيقة التي تسبب العدوى.[13]
- مطيافية الرنين المغناطيسي الكمي (MRS) هو أسلوب تحليلي غير جراحي يُستخدم لدراسة التغيرات الأيضية في أورام المخ والسكتات الدماغية واضطرابات النوبات ومرض الزهايمر والاكتئاب والأمراض الأخرى التي تصيب الدماغ. كما تم استخدامه لدراسة الايض للأعضاء الأخرى مثل العضلات.[13]
- تشير معايير التشخيص إلى مجموعة محددة من العلامات والأعراض ونتائج الاختبار التي يستخدمها الطبيب في محاولة لتحديد التشخيص الصحيح.[13]
- يستخدم استعادة السائل الموهن بالانقعكاس (FLAIR) تسلسل النبض لقمع السائل الدماغي الشوكي وإظهار الآفات بشكل أكثر وضوحًا ، ويستخدم على سبيل المثال في تقييم التصلب المتعدد.
الانواع
يمكن تقسيم الأمراض المزيلة للميالين إلى تلك التي تصيب الجهاز العصبي المركزي (CNS) وتلك التي تصيب الجهاز العصبي المحيطي (PNS). يمكن تصنيفها أيضًا من خلال وجود أو عدم وجود التهاب . أخيرًا ، يمكن إجراء الانقسام بناءً على السبب الكامن وراء إزالة الميالين: يمكن أن تكون عملية المرض إزالة الميالين النخاعي ، حيث يتم تدمير الميالين ؛ أو حثل المادة البيضاء المزيل للميالين ، حيث يكون الميالين غير طبيعي وتنكسي .
الجهاز العصبي المركزي
تشمل اضطرابات إزالة الميالين في الجهاز العصبي المركزي ما يلي:
- تحلل الميالين أو إزالة الميالين:
- أشكال نموذجية من التصلب المتعدد
- التهاب النخاع والعصب البصري ، أو مرض ديفك
- أمراض التهابات مزيلة للميالين مجهولة السبب
- اضطرابات حثل الكريات البيضاء أو ازالة الميالين:
- الاعتلالات العصبية في الجهاز العصبي المركزي مثل تلك الناتجة عن نقص فيتامين ب 12
- تحلل النخاع الجسري المركزي
- اعتلالات النخاع مثل الجدرة الظهرية (اعتلال النخاع الزهري)
- اعتلال بيضاء الدماغ مثل اعتلال بيضاء الدماغ متعدد البؤر التقدمي
- حثل المادة البيضاء
ترتبط تحلل الميالين عادةً بأعراض مثل التهاب العصب البصري والتهاب النخاع المستعرض ، لأن الالتهاب المزيل للميالين يمكن أن يؤثر على العصب البصري أو النخاع الشوكي . كثير منهم مجهول السبب . قد يؤدي كل من أنماط المرض المورمة النخاعية والحثل الأبيض إلى الافات المزيلة للميالين للجهاز العصبي المركزي .
الجهاز العصبي المحيطي
تشمل أمراض إزالة الميالين في الجهاز العصبي المحيطي ما يلي:
- متلازمة غيان باريه ونظيرتها المزمنة ، التهاب الأعصاب المزمن المزيل للميالين
- الاعتلال العصبي المحيطي المضاد لـ MAG
- مرض شاركو-ماري-توث ونظيره اعتلال الأعصاب الوراثي مع قابلية الشلل الانضغاطي
- الحالات المرتبطة بنقص النحاس ( اعتلال الأعصاب المحيطية ، اعتلال النخاع ، ونادرًا اعتلال العصب البصري )
- اعتلال الأعصاب الالتهابي التقدمي
العلاج
العلاجات خاصة بالمريض وتعتمد على الأعراض المصاحبة للاضطراب ، بالإضافة إلى تطور الحالة. يمكن تحقيق تحسينات في حياة المريض من خلال تدبير الأعراض أو إبطاء معدل إزالة الميالين. يمكن أن يشمل العلاج الأدوية ، وتغيير نمط الحياة (مثل الإقلاع عن التدخين ، وزيادة الراحة ، وتغيير النظام الغذائي) ، والاستشارة ، والاسترخاء ، والتمارين البدنية ، وتثقيف المريض ، وفي بعض الحالات ، التحفيز العميق للمهاد (لتخفيف الرعاش )).[13]
المآل
يعتمد المآل على الحالة نفسها. تعتمد بعض الحالات مثل مرض التصلب المتعدد على النوع الفرعي للمرض والسمات المختلفة للمريض مثل العمر والجنس والأعراض الأولية ودرجة الإعاقة التي يعاني منها المريض.[14] متوسط العمر المتوقع لمرضى التصلب المتعدد أقل من 5 إلى 10 سنوات من الأشخاص غير المصابين.[15] مرض التصلب المتعدد هو مرض التهابي مزيل للميالين يصيب الجهاز العصبي المركزي (CNS) يتطور لدى الأفراد المعرضين وراثياً للإصابة بعد التعرض لمحفزات بيئية غير معروفة. قواعد مرض التصلب المتعدد غير معروفة ولكن يشتبه بشدة في أنها تنطوي على ردود فعل مناعية ضد المستضدات الذاتية ، وخاصة بروتينات الميالين. الفرضية الأكثر قبولًا هي أن التفاعل بين مستقبلات الخلايا التائية ومستضدات الميالين يؤدي إلى هجوم مناعي على مركب الميالين-دبقية قليلة التغصن تثير هذه التفاعلات بين الخلايا التائية النشطة ومستضدات الميالين استجابة التهابية مدمرة هائلة وتعزز التكاثر المستمر للخلايا T و B وتنشيط البلاعم ، مما يحافظ على إفراز الوسطاء الالتهابيين.[16] حالات أخرى مثل انحلال الميالين الجسري المركزي يتعافى حوالي ثلث المرضى ويعاني الثلثان الآخران من درجات متفاوتة من الإعاقة.[17] في بعض الحالات ، مثل التهاب النخاع المستعرض ، يمكن للمريض أن يبدأ في التعافي في وقت مبكر من 2 إلى 12 أسبوعًا بعد بداية الحالة.
علم الأوبئة
تختلف الإصابة بأمراض إزالة الميالين باختلاف الاضطراب. تظهر بعض الحالات المرضية ، مثل التابس الظهري، في الغالب عند الذكور وتبدأ في منتصف العمر. على الرغم من ذلك ، يحدث التهاب العصب البصري بشكل تفضيلي عند الإناث عادة بين سن 30 و 35 عامًا.[18] تختلف الحالات الأخرى مثل التصلب المتعدد في انتشاره حسب البلد والسكان.[19] يمكن أن تظهر هذه الحالة عند الأطفال والبالغين.[15]
البحث العلمي
يستهدف الكثير من الأبحاث التي أجريت على الأمراض المزيلة للميالين اكتشاف الآليات التي تعمل بها هذه الاضطرابات في محاولة لتطوير علاجات وعلاجات للأفراد المتأثرين بهذه الحالات. على سبيل المثال،الپروتيوميات قد كشفت عن العديد من البروتينات التي تساهم في الفيزيولوجيا المرضية للأمراض المزيلة للميالين.[20]
على سبيل المثال ، تورط إنزيم سيكلو أكسيجيناز-2 في موت الخلايا الدبقية قليلة التغصن في نماذج حيوانية لإزالة الميالين..[21] ارتبط وجود حطام الميالين بالتهاب ضار بالإضافة إلى ضعف التجدد ، بسبب وجود مكونات الميالين المثبطة.[22][23]
يتم التعبير عن N-cadherin في مناطق إعادة الميالين النشطة وقد يلعب دورًا مهمًا في توليد بيئة محلية تساعد على إعادة الميالين.[24] تم تحديد ناهضات N-cadherin وملاحظتها لتحفيز نمو المحوار وهجرة الخلايا ، وهي الجوانب الرئيسية لتعزيز نمو المحوار العصبي وإعادة الميالين بعد الإصابة أو المرض .[25]
Iثبت أن الأدوية المعدلة للمناعة مثل فينجوليمود تقلل الضرر المناعي الذي يصيب الجهاز العصبي المركزي ، مما يمنع المزيد من الضرر في مرضى التصلب المتعدد. يستهدف الدواء دور البلاعم في تطور المرض.[26][27]
قد يصبح التلاعب بمستويات هرمون الغدة الدرقية استراتيجية قابلة للتطبيق لتعزيز إعادة الميالين ومنع الضرر الذي لا يمكن إصلاحه في مرضى التصلب المتعدد.[28] وقد ثبت أيضًا أن إعطاء أبوترانسفيرين (aTf) عن طريق الأنف يمكن أن يحمي الميالين ويحث على إعادة الميالين.[29] أخيرًا ، قد يوفر التحفيز الكهربائي الذي ينشط الخلايا الجذعية العصبية طريقة يمكن من خلالها إصلاح مناطق إزالة الميالين.[30]
في حيوانات اخري
تم العثور على أمراض / اضطرابات مزيلة للميالين في جميع أنحاء العالم في حيوانات مختلفة. بعض هذه الحيوانات تشمل الفئران والخنازير والماشية والهامستر والجرذان والأغنام والقطط السيامية وعدد من سلالات الكلاب (بما في ذلك Chow Chow و Springer Spaniel و Dalmatian و Samoyed و Golden Retriever و Lurcher و Bernese Mountain Dog و Vizsla و Weimaraner ، والحرير الأسترالي ، والسلالات المختلطة).[31][32]
حيوان آخر بارز وجد قادرًا على الإصابة بمرض إزالة الميالين هو ختم الفراء الشمالي . تم علاج زيجي ستار ، أنثى فقمة الفراء الشمالية ، في مركز الثدييات البحرية بداية من مارس 2014 [33] وتم تسجيلها كأول حالة تم الإبلاغ عنها لمثل هذا المرض في الثدييات البحرية. تم نقلها لاحقًا إلى أكواريوم ميستيك ومعهد الاستكشاف لرعاية مدى الحياة كسفيرة للجمهور.[34]
انظر ايضا
- حدود التصلب المتعددة
- مشروع الآفة (التصلب المتعدد)
- مشروع الميالين
- مؤسسة إصلاح الميالين
المراجع
- ^ "demyelinating disease" في قاموس دورلاند الطبي
- ^ Lotti M, Moretto A (2005). "Organophosphate-induced delayed polyneuropathy". Toxicol Rev. 24 (1): 37–49. doi:10.2165/00139709-200524010-00003. PMID 16042503.
- ^ Konopaske GT; Dorph-Petersen KA; Sweet RA; et al. (April 2008). "Effect of chronic antipsychotic exposure on astrocyte and oligodendrocyte numbers in macaque monkeys". Biol. Psychiatry. 63 (8): 759–65. doi:10.1016/j.biopsych.2007.08.018. PMC 2386415. PMID 17945195.
{{cite journal}}: Cite has empty unknown parameter:|author-separator=(help) - ^ Agadi S, Quach MM, Haneef Z (2013). "Vitamin-responsive epileptic encephalopathies in children". Epilepsy Res Treat. 2013: 510529. doi:10.1155/2013/510529. PMC 3745849. PMID 23984056.
{{cite journal}}: CS1 maint: multiple names: authors list (link) CS1 maint: unflagged free DOI (link) - ^ Yoganathan S, Varman M, Oommen SP, Thomas M (2017). "A Tale of Treatable Infantile Neuroregression and Diagnostic Dilemma with Glutaric Aciduria Type I." J Pediatr Neurosci. 12 (4): 356–359. doi:10.4103/jpn.JPN_35_17. PMC 5890558. PMID 29675077.
{{cite journal}}: CS1 maint: multiple names: authors list (link) CS1 maint: unflagged free DOI (link) - ^ Fernández O.; Fernández V.E.; Guerrero M. (2015). "Demyelinating diseases of the central nervous system". Medicine. 11 (77): 4601–4609. doi:10.1016/j.med.2015.04.001.
- ^ Poser C. M. (1961). "Leukodystrophy and the Concept of Dysmyelination". Arch Neurol. 4 (3): 323–332. doi:10.1001/archneur.1961.00450090089013. PMID 13737358.
- ^ Laetoli (January 2008). "Demyelination". Archived from the original on 2012-07-28.
- ^ "Symptoms of Demyelinating Disorders - Right Diagnosis." Right Diagnosis. Right Diagnosis, 01 Feb 2012. Web. 24 Sep 2012
- ^ Miller Daniel J (2012). "Prolonged Myelination in Human Neocortical Evolution". PNAS. 109 (41): 16480–16485. Bibcode:2012PNAS..10916480M. doi:10.1073/pnas.1117943109. PMC 3478650. PMID 23012402.
- ^ Schoenemann, Thomas P.; Sheehan Michael J.; Glotzer L. Daniel (2005). "Prefrontal White Matter Volume Is Disproportionately Larger in Humans than in Other Primates". Nature Neuroscience. 8 (2): 242–52. doi:10.1038/nn1394. PMID 15665874.
- ^ Chaudhuri Abhijit (2013). "Multiple Sclerosis Is Primarily a Neurodegenerative Disease". J Neural Transm. 120 (10): 1463–466. doi:10.1007/s00702-013-1080-3. PMID 23982272.
- ^ أ ب ت ث ج ح خ Freedman, Mark S (2005). Advances in Neurology Volume 98: Multiple Sclerosis and Demyelinating Diseases. Philadelphia: Lippincott Williams & Wilkins. p. 112. ISBN 0781751705.
- ^ Weinshenker BG (1994). "Natural history of multiple sclerosis". Ann. Neurol. 36 (Suppl): S6–11. doi:10.1002/ana.410360704. PMID 8017890.
- ^ أ ب Compston A, Coles A (October 2008). "Multiple sclerosis". Lancet. 372 (9648): 1502–17. doi:10.1016/S0140-6736(08)61620-7. PMID 18970977.
- ^ Minegar, Alireza (2003). "Blood-Brain Barrier Disruption in Multiple Sclerosis". Multiple Sclerosis Journal. Sage Journals. 9 (6): 540–549. doi:10.1191/1352458503ms965oa. PMID 14664465.
- ^ Abbott R, Silber E, Felber J, Ekpo E (October 2005). "Osmotic demyelination syndrome". BMJ. 331 (7520): 829–30. doi:10.1136/bmj.331.7520.829. PMC 1246086. PMID 16210283.
- ^ Rodriguez M, Siva A, Cross SA, O'Brien PC, Kurland LT (1995). "Optic neuritis: a population-based study in Olmsted County, Minnesota". Neurology. 45 (2): 244–50. doi:10.1212/WNL.45.2.244. PMID 7854520.
- ^ Rosati G (April 2001). "The prevalence of multiple sclerosis in the world: an update". Neurol. Sci. 22 (2): 117–39. doi:10.1007/s100720170011. PMID 11603614.
- ^ Newcombe, J.; Eriksson, B.; Ottervald, J.; Yang, Y.; Franzen, B. (2005). "Extraction and proteomic analysis of proteins from normal and multiple sclerosis postmortem brain". Journal of Chromatography B. 815 (1–2): 119–202. doi:10.1016/j.jchromb.2004.10.073. PMID 15652809.
- ^ Palumbo, S.; Toscano, C.D.; Parente, L.; Weigert, R.; Bosetti, F. (2012). "The cyclooxygenase-2 pathway via the pge₂ ep2 receptor contributes to oligodendrocytes apoptosis in cuprizone-induced demyelination". Journal of Neurochemistry. 121 (3): 418–427. doi:10.1111/j.1471-4159.2011.07363.x. PMC 3220805. PMID 21699540.
- ^ Clarner, T.; Diederichs, F.; Berger, K.; Denecke, B.; Gan, L.; Van Der Valk, P.; Beyer, C.; Amor, S.; Kipp, M. (2012). "Myelin debris regulates inflammatory responses in an experimental demyelination animal model and multiple sclerosis lesions". Glia. 60 (10): 1468–1480. doi:10.1002/glia.22367. PMID 22689449.
- ^ Podbielska M, Banik NL, Kurowska E, Hogan EL (2013). "Myelin recovery in multiple sclerosis: the challenge of remyelination". Brain Sci. 3 (4): 1282–324. doi:10.3390/brainsci3031282. PMC 4061877. PMID 24961530.
{{cite journal}}: CS1 maint: multiple names: authors list (link) CS1 maint: unflagged free DOI (link) - ^ Hochmeister, S.; Romauch, M; Bauer, J; Seifert-Held, T; Weissert, R; Linington, C; Hurtung, H.P.; Fazekas, F; Storch, M.K. (2012). "Re-expression of n-cadherin in remyelinating lesions of experimental inflammatory demyelination". Experimental Neurology. 237 (1): 70–77. doi:10.1016/j.expneurol.2012.06.010. PMID 22735489.
- ^ Burden-Gulley, S.M.; Gates, T.J.; Craig, S.E.L.; Gupta, M.; Brady-Kalnay, S.M. (2010). "Stimulation of n-cadherin-dependent neurite outgrowth by small molecule peptide mimetic agonists of the n-cadherin hav motif". Peptides. 31 (5): 842–849. doi:10.1016/j.peptides.2010.02.002. PMID 20153391.
- ^ Gasperini, C.; Ruggieri, S. (2012). "Development of oral agent in the treatment of multiple sclerosis- how the first available oral therapy, fingolimod will change therapeutic paradigm approach". Drug Design, Development and Therapy. 6: 175–186. doi:10.2147/DDDT.S8927. PMC 3414371. PMID 22888218.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Ransohoff, R.M.; Hower, C.L.; Rodriquez, M. (2005). "Growth factor treatment of demyelinating disease- at last, a leap into the light". Trends in Immunology. 23 (11): 512–516. doi:10.1016/S1471-4906(02)02321-9. PMID 12401395.
- ^ Silverstroff, L.; Batucci, S.; Pasquini, J.; Franco, P. (2012). "Cuprizone-induced demyelination in the rat cerebral cortex and thyroid hormone effects on cortical remyelination". Experimental Neurology. 235 (1): 357–367. doi:10.1016/j.expneurol.2012.02.018. PMID 22421533.
- ^ Clausi, M.G.; Paez, P.M.; Campagnoni, A.T.; Pasquini, L.A.; Pasquini, J.M.; Ahmadiani, A. (2012). "Intranasal administration of atf protects and repairs the neonatal white matter after a cerebral hypoxic-ischemic event". Glia. 60 (10): 1540–1554. doi:10.1002/glia.22374. PMID 22736466.
- ^ Sherafat, M.A.; Heibatollahi, M.; Mongabadi, S.; Moradi, F.; Javan, M.; Ahmadiani, A. (2012). "Electromagnetic field stimulation potentiates endogenous myelin repair by recruiting subventricular neural stem cells in an experimental model of white matter demyelination". Journal of Molecular Neuroscience. 48 (1): 144–153. doi:10.1007/s12031-012-9791-8. PMID 22588976.
- ^ Merck Sharp; Dohme Corp (2011). "The Merck Veterinary Manual – Demyelinating Disorders: Introduction". Merck Veterinary Manual. Archived from the original on 2010-12-19. Retrieved 2012-10-30.
- ^ "Johnson RT. DEMYELINATING DISEASES. In: Institute of Medicine (US) Forum on Microbial Threats; Knobler SL, O'Connor S, Lemon SM, et al., editors. The Infectious Etiology of Chronic Diseases: Defining the Relationship, Enhancing the Research, and Mitigating the Effects: Workshop Summary. Washington (DC): National Academies Press (US)". NCBI. 2004. Retrieved 2012-10-30.
- ^ "Archived copy". Archived from the original on 2016-10-25. Retrieved 2016-10-25.
{{cite web}}: CS1 maint: archived copy as title (link) - ^ "Ziggy Star has a Neurologic Condition". The Marine Mammal Center. Archived from the original on 19 February 2014. Retrieved 2 February 2014.
وصلات خارجية
| Classification | |
|---|---|
| External resources |