الداء البطني
| الداء البطني | |
|---|---|
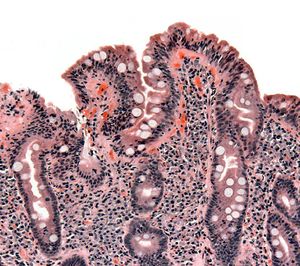 | |
| خزعة من الأمعاء الدقيقة تبين الداء البطني ظاهراً بتقصف الخملات، crypt hyperplasia, والخلايات الليمفية تتغلغل في crypts | |
| التبويب والمصادر الخارجية | |
| التخصص | طب الجهاز الهضمي |
| ICD-10 | K90.0 |
| ICD-9-CM | 579.0 |
| OMIM | 212750 |
| DiseasesDB | 2922 |
| MedlinePlus | 000233 |
| eMedicine | med/308 ped/2146 radio/652 |
| Patient UK | فشل عرض الخاصية P1461: لم يتم العثور على الخاصية P1461. الداء البطني |
| MeSH | D002446 |
الداء البطني أو الداء الزلاقي إنگليزية: Coeliac Disease يشير إليه البعض بإسم (مرض حساسية القمح) وهي تسمية غير دقيقة، هو مرض مناعي مكتسب يصيب الأمعاء الدقيقة لدى الأشخاص ذوي العرضة والذين يتمتعون بقابلية جينية للإصابة به، قد يحدث داء البطني في أية مرحلة عمرية منذ الطفولة وحتى الشيخوخة المتأخرة، تتراوح نسبة حدوث هذا المرض لدى الأطفال ما بين 0.33 – 1.06 % أما لدى البالغين فيتراوح العدد ما بين 0.18 – 1.2 %، بعض الحالات المرضية كالعته المنغولي والسكري المعتمد على الانسولين ومتلازمة ترنر لديهم قابلية أعلى للإصابة بداء بطني وتتراوح نسبة الإصابة لديهم بين 5 – 10 %، من أهم الأعراض المصاحبة لهذا المرض: الاسهال والنفخة وآلام البطن، كما تم اكتشاف وجود الداء البطني لدى الكثيرين ممن لا يشكون من أية أعراض وذلك خلال المسوح والفحوصات الطبية العامة.[1] يحدث داء بطني كردة فعل للتعرض لمادة الگليادين الموجودة في الحبوب وخاصة القمح.
لا يوجد علاج لهذا الداء، لكن يمكن التحكم بهذا المرض بكفاءة بتغيير النمط الغذائي.
نشوء المرض
تتضافر عدة عوامل في نشوء داء بطني، لدى التعرض لمادة الگليادين الموجودة في الحبوب و خاصة القمح تقوم إنزيمات الترانسجلوتامينيز بتعديل تركيبة بروتين الگليادين، نتيجة لهذا التعديل يقوم الجهاز المناعي في جسم الإنسان بمهاجمة أنسجة الأمعاء محدثاً رد فعل مناعي ومسبباً حدوث التهاب فيها، يؤدي هذا الالتهاب إلى تدمير الزغب المبطن للأمعاء و الذي يقوم بدور الامتصاص مما يجعل السطح المبطن للأمعاء أملساً، الأمر الذي يؤدي إلى حدوث سوء امتصاص للغذاء، يصيب داء بطني الأمعاء الدقيقة وغالباً ما تكون منطقة المعي الصائم الأكثر عرضة لهذا الالتهاب المناعي.
عوامل جينية
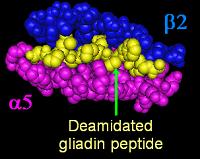
الغالبية العظمى من المرضى يحملون إحدى نوعي جينات التوافق الجيني HLA DQ و الموجود على الذراع القصير للكروموسوم (الصبغي) السادس. التوافق الجيني HLA DQ له سبعة أنواع (DQ2 و DQ4 حتى DQ9) ويوجد لدى المصابين بداء بطني عادة إما نوع DQ2 أو DQ8، تزيد هذه الجينات من عدد المستقبلات التي ترتبط ببروتين الگليادين مما يزيد من قوة تنشيط الخلايا اللمفاوية t cells وبالتالي تفعيل الجهاز المناعي ضد الخلايا المبطنة للأمعاء.[3][4]
پرولامينات
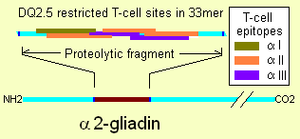
غالبية البروتينات الموجودة في الغذاء والمسؤولة عن داء بطني هي من فئة البرولامينات، وهي بروتينات غنية بأحماض البرولين والگلوتامين الأمينية، يعتبر الگليادين من البرولامينات وهو بروتين سكري أيضاً. تتميز البرولامينات بائبيتها في الكحول وقدرتها على مقاومة تأثير أنزيمات الببتيديز (محطم البروتين) والبروتياز المسؤولين عن تحطيم البروتينات الغذائية.
تقوم بروتينات الگليادين بالتأثير على نقاط الالتحام الموجودة بين خلايا بطانة الأمعاء الدقيقة مما يسهل دخول جزيئات أكبر إلى داخل الأنسجة المعوية ويسبب وصول الپرولامينات والپپتيدات المحتوية على الگليادين إلى مرمى الجهاز المناعي مسببة رد فعل مناعي.[6]
إنزيم الترانس گلوتامينيز (ناقلات الأمين)
وجد لدى تشريح المصابين بالداء البطني نسب عالية من الأجسام المضادة لأنزيم الترانس أمينيز [7]، ويشكل هذا التفاعل رواسب تظهر في عدة أمراض مناعية ولدى بعض المصابين بفقر الدم وسوء الامتصاص.
سوء الامتصاص وضمور الزغب المعوي
يؤدي رد الفعل المناعي الناتج عن مهاجمة الخلايا اللمفاوية t cells لبطانة الأمعاء الدقيقة مسببة تهديم البنية الهندسية للزغب المعوي و محدثة ترققاً في جدار الأمعاء، نتيجة هذا يصاب المريض بسوء الامتصاص و خاصة امتصاص فيتامينات (أ) و (د) و (هـ) و (ك)، يعدث في كثير من الحالات أيضاً سوء امتصاص سكر اللاكتوز الموجود في منتجات الحليب.
أعراض سريرية
غالبية الأعراض المشاهدة في حالات داء بطني تكون متعلقة بالجهاز الهضمي غالباً ما تظهر لدى الاطفال المصابين ما بين عمر 9 أشهر وسنتين وعادة ما تكون بعد ادخال الحبوب و الخبر إلى طعام الطفل بفترة قصيرة، و أشهر هذه الأعراض:
- الاسهال.
- نقصان الوزن.
- تأخر النمو.
- فقر الدم.
- الضعف و الوهن.
- آلام البطن.
- النفخة المعوية.
- تقرحات فموية [8]
- زيادة قابلية النزف و ذلك نتيجة انخفاض نسبة فيتامين ك في الدم.
- تكاثر البكتيريا داخل الأمعاء الدقيقة نتيجة سوء الإمتصاص.
- التهاب الجلد الحلائي و هي حالة جلدية تصيب مرضى داء بطني و تسبب حكة جلدية، يحدث التهاب الجلد الحلائي نتيجة لعمل الانزيم ناقل الغلوتامين في الجلد.
كثيراً ما يتم الخلط بين هذا المرض لدى البالغين و بين مرض القولون العصبي، و قد لوحظ ظهور سوء هضم اللاكتور لدى مرضى داء بطني، وجد أن الإصابة بداء بطني تزيد من احتمالية الإصابة بسرطانات الأمعاء الدقيقة كما أنها تترافق مع عدة أمراض نقص مناعة و أشهارها نقص غلوبينات IgA المناعية.[9][10]
أحياناً لا يعاني بعض المصابين من أي أعراض هضمية. فأعراض الداء الزلاقي قد تشابه تلك التي في بعض الحالات الأخرى مثل: متلازمة الأمعاء الهيوجة، أو القرحة المعدية، أو داء كرون، أو الأخماج الطفيلية، أو فقر الدم، أو الاضطرابات الجلدية أو الحالات العصبية.
قد يتظاهر الداء الزلاقي بطرق أقل وضوحاً منها:
- هيجان أو اكتئاب
- فقر دم
- اضطراب معدي
- ألم مفصلي
- تشنجات عضلية
- طفح جلدي
- قروح فموية
- اضطرابات عظمية وسنية (مثل تخلخل العظام)
- نخز في الأرجل والأقدام (اعتلال عصبي)
حالات أخرى غير متعلقة بالگلوتين
التهاب الجلد هربسي الشكل هو مرض حاك قرحي للجلد والذي هو كذلك نتيجة لعدم تحمل الغلوتين. غالباً ما ينشأ الطفح في المرفق والركبة والإلية. يمكن لهذا المرض أن يسبب أذية كبيرة للأمعاء مطابقة للداء الزلاقي. لكن لا يسبب أعراض هضمية بارزة. يعالج هذا المرض بحمية خالية من الغلوتين، بالإضافة إلى العلاجات لمنع الطفح.
التشخيص
كثيرة هي الطرق التي يتم فيها تشخيص داء بطني، و عادة ما تلعب الأعراض السريرية دوراً هاماً في تحديد نوع الفحص المخبري أو الأشعاعي أو الإجراءات المختارة للتشخيص، من المهم الإشارة إلى أن كل التحاليل تصبح بلا قيمة في حال كان المريض بالأساس متبعاً لحمية غذائية خالية من الحبوب أو بروتين الغليادين لأن الضرر المعوي الناتج عن داء بطني قد يشفى خلال أسابيع من بدء الحمية و تنحسر تراكيز الأجسام المضادة خلال شهور قليلة.
يتم من أجل المرضى المحميين غذائياً إعادة ادخال مادة الغليادين من خلال إضافة 10 جرامات أو قطعتي خبز لحمية المريض لمدة 2-6 أسابيع و بعدها يعاد إجراء التحاليل المخبرية.
اختبار وجود الأجسام المضادة
سابقاً تم اعتماد عدة فحوص مصلية للكشف عن عدة أجسام مضادة في محاولة لتشخيص داء بطني، من أكثر الأجسام المضادة التي استخدمت سابقً: مضادات الغليادين أو الريلاكتين أو الإندوميوسين، لوحظ أن هذه التحاليل غير دقيقة بشكل كافٍ و خاصة لدى الأطفال دون الخامسة من العمر و لذى توجب إيجاد تحاليل أكثر دقة و حساسية في التشخيص.
حالياً يتم اختبار وجود أجسام مضادة للأنزيم ناقل الغلوتامين في مصل الدم لتأكيد تشخيص داء بطني، لقد أصبح هذا التحليل المصلي المفضل على باقي التحاليل المصلية القديمة و ذلك لدقتة النوعية و الكمية. فتبلغ حساسيته 99% و دقته النوعية أكثر من 90%، إلا أنه و بالرغم من دقته العالية و لأهمية هذا الداء غدا من الضروري ارفاقه بتنظير علوي للأمعاء مع أخذ خزعات نسيجية سواء أكان هذا التحليل المصلي إيجابياً أو سلبياً.[11]
ينصح بتفقد مستوى الغلوبينات المناعية IgA بالإضافة لفحص أجسام مضادة، لأن المرضى المصابين بنقص الغلوبينات المناعية IgA تكون أجسامهم غير قادرة على إنتاج الأجسام المضادة بشكل كافٍ و تصبح تحاليل الكشف عن الأجسام المضادة في المصل غير مجدية.[12]
الكشف عن القابلية الجينية
كما ذكر سابقاً يوجد لدى المصابين بداء بطني عادة إما نوع DQ2 أو DQ8 من جين القابية الجينية إنگليزية: HLA DQ ، تبلغ حساسية HLA DQ2 94% و دقته النوعية 74%، و بالنسبة ل HLA DQ8 تبلغ حساسيته 12% أما دقته النوعية فتبلغ 84%.
فحص الدم
| الفحص | الحساسية | specificity |
|---|---|---|
| HLA-DQ2 | 94% | 73% |
| HLA-DQ8 | 12% | 81% |
المنظار المعوي
التنظير العلوي للجهاز الهضمي مع أخذ الخزعات النسيجية هو حجر الأساس في تشخيص داء بطني، يجب الوصول إلى المعي الاثني عشري و المعي الصائم حتى يكون التنظير مجدياً، كثير من الخزعات المأخوذة من مرضى داء بطني قد تبدو سليمة و لذا يجب أخذ عدة عينات نسيجية من مناطق مختلفة حتى يكون التنظير دقيقاً ومثمراً.
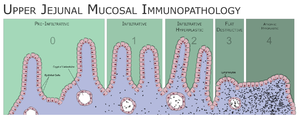
تصنيف مارش
يعتمد تصنيف مارش الپاثولوجي لتحديد مدى حدة تأثر الأمعاء الدقيقة بداء بطني، مراحل تصنيف مارش الخمسة هي:
- المرحلة 0: أغشية مخاطية طبيعية.
- المرحلة 1: ازدياد عدد الخلايا اللمفاوية في النسيج الطلائي للأمعاء وغالباً ما يكون العدد أكثر من 20 خلية لمفاوية لكل 100 خلية معوية.
- المرحلة 2: تزايد خبايا ليبركون في جدار الأمعاء.
- المرحلة 3: ضمور زغابي جزئي أو كلي.
- المرحلة 4: نقص تنسج البنية المعوية.
عادة ما تتحسن الحالة خلال2-6 أسابيع من إزالة بروتين الگلوتن من الطعام وينصح بإعادة أخذ وفحص الخزعات النسيجية بعد 4-6 شهور من بداية العلاج.
فحوصات أخرى
من الفحوص الأخرى المهمة لنفي التشخيصات الأخرى و قياس مدى حدة و تأثير الأعراض الجانبية كسوء الامتصاص ما يلي:
- تعداد الدم الكامل.
- تراكيز الشوارد في الدم
- فحص وظائف الكلى
- فحص وظائف الكبد
- تركيز فيتامين ب 12 في الدم
- تركيز حمض الفوليك في الدم
- فحص سرعة تخثر الدم
العلاج
الحمية الغذائية
تعتبر الحمية الغذائية الخالية من بروتين الگلوتن حجر الأساس وعماد العلاج في الداء البطني، يتوجب اتباع هذا العلاج مدى الحياة، ولا يوجد أي علاج آخر حاليا يمنع حدوث الالتهابات في جدار الأمعاء سوى إزالة بروتين الگلوتن من الحمية الغذائية [13]، اتباع هذه الحمية صعب وعويص وكثيراً ما يفشل المرضى باتباع هذه الحمية نظراً لانتشار مادة الگلوتن في كثير من المواد الغذائية كاللحوم المعلبة والمقانق والمشروبات الكحولية.
حالات عصية
وجد لدى عدد بسيط من مرضى داء بطني أن الحالة المرضية لا تتحسن بعد اتباع الحمية الغذائية، و قد يعزى ذلك لطول استمرارية المرض الأمر الذي يجعل التضرر الحاصل في الأمعاء الدقيقة بالغاً و غير قابل للعكس و العلاج.
علاجات تجريبية
توجد مجموعة من العلاجات للداء البطني ما زالت في طور التجربة وما زلنا ننتظر نتائج الدراسات السريرية فيها، من هذه العلاجات:
- تناول الحبوب المعدلة وراثياً والخالية من الگلوتن، إلا أن مشكلة تواجه هذا النوع من الحبوب تكمن في انخفاض جودة العجين المصنع منه لغياب هذه المادة.
- إضافة بعض الأنزيمات الهاضمة للگلوتن إلى الحمية الغذائية و ذلك لتسهيل هضم هذه المادة و تمكين المريض من تناول الأغذية المحتوية على الگلوتن.[14]
- تثبيط عمل بروتين الزولين الذي يزيد من نفاذية الأغشية المخاطية في الأمعاء مما يقلل من حجم الاتهاب الناتج عن عبور البرولامينات إلى داخل جدار الأمعاء و حدوث رد الفعل الاتهابي فيها.[15]
عوامل الخطورة
رغم أن هذا المرض يمكن أن يصيب أي شخص كان، إلا أنه يميل للظهور لدى الأفراد المصابين بـ:
- السكري من النمط الأول
- الداء الدرقي المناعي الذاتي
- التهاب الكولون المجهري، خصوصاً التهاب الكولون الكولاجيني
إضافة إلى ذلك، فتوجد جينات معينة (HLA-DQ2 و DQ8) متعلقة بزيادة خطورة الإصابة بالداء الزلاقي. لكن توجد جينات أخرى لا تزال غير معروفة تلعب دوراً في تطور هذا المرض.
الاختلاطات
في حال عدم معالجته، فيمكن للداء الزلاقي أن يؤدي إلى عدد من الاختلاطات منها:
سوء الامتصاص
يمكن أن يسبب هذا المرض تطور حالة من سوء الامتصاص. والتي بدورها يمكن أن تؤدي إلى سوء تغذية. يحدث هذا برغم تناول حمية ملائمة. وذلك بسبب فقد المواد المغذية مع البراز بدلاً من امتصاصها إلى مجرى الدم. يمكن لسوء الامتصاص أن يسبب عوز في الفيتامينات والمعادن مثل فيتامين B12 و D والفولات والحديد مما يؤدي إلى الإصابة بفقر الدم وفقد الوزن. يمكن لسوء التغذية أن يؤخر نمو الأطفال.
فقد الكالسيوم وكثافة العظم
مع الفقد المستمر للدسم مع البراز، يمكن أن يفقد الكالسيوم وفيتامين D بكميات كبيرة. يمكن أن ينتج عن ذلك اعتلال عظمي يدعى بتلين العظام ostermalacia، وهو رخاوة في العظام، ويدعى بالرخد لدى الأطفال، وفقد لطثافة العظم (تخلخل العظام)، وهذه الحالة تجعل العظام هشة وعرضة للكسر. وإضافة إلى ذلك، فإن نقص امتصاص الكالسيوم يمكن أن يؤدي إلى نمط معين من الحصيات الكلوية (حصيات الأوكزالات).
عدم تحمل اللاكتوز
نتيجة للضرر الحادث في الأمعاء بسبب الغلوتين، فيمكن للأغذية غير الحاوية على الغلوتين أن تسبب ألماً وإسهالاً. بعض مرضى الداء الزلاقي لا يتحملون تناول سكر الحليب (اللاكتوز) المتوفر في منتجات الألبان، وهي حالة تدعى "عدم تحمل اللاكتوز". إذا كان هذا هو السبب، فيجب تجنب الأطعمة والأشربة الحاوية على اللاكتوز وكذلك تلك الحاوية على الغلوتين. وبمجرد شفاء الأمعاء، يمكن تحمل منتجات الألبان مرة أخرى. لكن بعض الأشخاص يستمرون بالمعانات من أعراض عدم تحمل اللاكتوز رغم التدبير الناجح للداء الزلاقي.
السرطان
يمكن للأشخاص الذين لا يحافظون على استهلاك حمية خالية من الغلوتين أن يكونوا عرضة لفرصة أكبر للإصابة لواحد أو لعدة أشكال من السرطان، خصوصاً اللمفوما المعوية وسرطان الأمعاء.
الاختلاطات العصبية
ارتبط الداء الزلاقي كذلك مع اعتلالات في الجهاز العصبي، متضمنة نوبات الصرع وضرر الأعصاب (الاعتلال العصبي المحيطي)
التشخيص والاختبارات
كيفية التشخيص
يشتبه الداء الزلاقي لدى الأفراد الذين يبدون أعراض وعلامات سوء الامتصاص سوء التغذية. يمكن كذلك لبعض الأمراض الأخرى أن تؤدي إلى سوء امتصاص أو سوء تغذية مثل قصور البنكرياس، وداء كرون في الأمعاء الدقيقة ونمو البكتيريا في الأمعاء الدقيقة. لذلك من المهم تأكيد الإصابة بالداء الزلاقي بالاختبار الملائم.
خزعة الأمعاء الدقيقة
تعتبر الخزعة الأكثر دقة في تشخيص الداء الزلاقي. يمكن الحصول على هذه الخزعة بالتنظير المريئي المعدي الإثناعشري. أثناء هذا الإجراء، يقوم الطبيب بإدخال منظار داخلي طويل مرن عبر الفم حتى الوصول إلى الإثناعشر. يمكن بعدها إمرار أداة خزع عبر قناة في المنظار لأخذ العينات من البطانة المعوية. يتم عادة أخذ عينات عديدة لزيادة دقة التشخيص. يمكن بعدها دراسة الخزعة تحت المجهر للبحث عن فقدان الزغيبات وغيرها من خصائص الداء الزلاقي مثل زيادة عدد اللمفاويات.
لكن يبقى للخزعة المعوية بعض المحددات. مثلاً التهاب المعدة والأمعاء الفيروسي الحاد والحساسية لحليب البقر أو بروتين الصويا يمكن أن تبدي خزعات لا يمكن تمييزها عن تلك لدى الداء الزلاقي. لكن في حال التهاب المعدة والأمعاء الفيروسي فيمكن تمييزه بسهولة عن الداء الزلاقي من خلال اختلاف حدة الاعراض (تظهر الأعراض ببداية مفاجئة وتستمر فقط لعدة أيام بعكس الداء الزلاقي). أما في حال الحساسية لحليب البقر أو بروتين الصويا فيمكن الخلط بينهما وبين الداء الزلاقي بسهولة. لكن هذه الأنواع من الحساسية نادرة وغالباً ما تحدث لدى الأطفال الصغار. رغم تلك المحددات فالخزعة تعد مطلوبة حتى من الأفراد الذين يملكون أضداد شاذة للداء الزلاقي.
اختبارات الأضداد النوعية
تتضمن الاختبارات الدموية النوعية للداء الزلاقي أضداد endomysial و أضداد ناقل الغلوتامين النسيجي، وأضداد الغليادين gliadin (بروتين في القمح). تتميز الأضداد ضد الغليادين بأنها أضداد متولدة ضد الغليادين المتواجد في الغذاء. بينما أضداد endomysial وناقل الغلوتامين النسيجي هي أضداد منتجة ضد نسج جسم الإنسان نفسه.
يعتبر هذين النوعين من الأضداد ذات موثوقية عالية لتشخيص الداء الزلاقي. فالمريض الذي يبدي ارتفاع غير طبيعي لهذين الضدين فلديه احتمالية أعلى من 95% للإصابة بالداء الزلاقي. أما أضداد الغليادين فهي أقل اعتماداً لأنها تبدي معدلات إيجابية كاذبة عالية. لذلك الأفراد الذين يملكون مستويات مرتفعة من أضداد الغليادين ليس بالضرورة أن يكونوا مصابين بالداء الزلاقي. مع ذلك، فهذه الأضداد مفيدة في مراقبة الاستجابة للعلاج لأن مستويات أضداد الغليادين تبدأ بالانخفاض خلال عدة شهور من العلاج الناجح بواسطة الحمية الخالية من الغلوتين.
الأفراد الواجب عليهم إجراء فحوص دموية لأضداد الداء الزلاقي
ينصح بعض الخبراء بإجراء الفحوص الدموية للتحري عن الأضداد على جميع الأفراد الأصحاء حتى بدون أي أعراض أو علامات للداء الزلاقي. ففي إيطاليا (حيث ينتشر الداء الزلاقي) يتم تحري هذا الداء لدى جميع الأطفال. أما الخبراء في الولايات المتحدة لا يوصون بذلك، وإنما يطلبون إجراء الفحوص الدموية للأضداد عند الأفراد الأكثر عرضة للإصابة بالداء الزلاقي. هؤلاء المرضى هم:
1. المرضى المصابين بإسهال مزمن (إسهال يستمر لأكثر من ثلاث أسابيع)، وكميات متزايدة للدسم في البراز (إسهال دهني) وفقد وزن.
2. المرضى المصابين بزيادة غازات ونفخة وتمدد بطني
3. الأطفال المصابين بتأخر النمو
4. المرضى المصابين بفقر دم بعوز الحديد غير مفسر
5. المرضى المصابين بطفح جلدي الدال على التهاب الجلد هبرسي الشكل
6. المرضى المصابين بقرحات فموية متكررة (التهاب الفم القلاعي)
كذلك المرضى المصابين بأمراض مرافقة للداء الزلاقي. مثل السكري المعتمد على الإنسولين والداء الدرقي المناعي الذاتي والتهاب المفاصل الروماتيدي والذئبة الحمامية الجهازية والتهاب الكولون القرحي وغيرها.
لماذا يجب تشخيص الداء الزلاقي بدقة؟
يجب إثبات الإصابة بالداء الزلاقي بشكل حاسم قبل البدء بالعلاج بحمية خالية من الغلوتين لعدة أسباب.
1. الحمية الخالية من الغلوتين هي التزام مضجر على مدى الحياة ويجب أخذه بجدية تامة. كما أنه مكلف ويؤثر على الحياة الاجتماعية.
2. المرضى المصابين بمتلازمة الأمعاء الهيوجة يمكن أن يبدو بعض التحسن من ناحية النفخة والألم البطني والإسهال مع الحمية الخالية من الغلوتين. فبدون إثبات الداء الزلاقي بالخزعة، فعندها سيضطرون للالتزام بشكل غير ضروري بحمية خالية من الغلوتين على مدى الحياة.
3. يمكن للحمية الخالية من الغلوتين أن تنقص مستويات الأضداد في الدم وتسمح بعودة المظهر الطبيعي للأمعاء الدقيقة مما يمنع التشخيص الدقيق للداء الزلاقي.
العلاج
لا يوجد علاج حقيقي لهذا المرض وإنما يعتمد على الحمية الخالية من الغلوتين. يختلف المرضى بمقدار التحسس للغلوتين؛ فالبعض بإمكانه تناول كميات قليلة من الغلوتين بدون ظهور أعراض بينما الآخرون يبدون أعراض من الإسهال الشديد مع كميات زهيدة من الغلوتين. فالعلاج الأساسي لهؤلاء المرضى يتطلب التجنب الكامل للغلوتين على مدى الحياة. يتضمن مبدأ الحمية الخالية من الغلوتين:
1. تجنب كل الأطعمة المحضرة من القمح والشعير والشيلم. مثلاً: الخبز وحبوب الإفطار والمعكرونة والكعك والكاتو والبسكويت.
2. تجنب الشوفان. ومع أن بعض المرضى يتحملونه في غذائهم لكن المأمونية طويلة الأمد فهي غير مؤكدة. كما أن بعض محضرات الشوفان تكون ملوثة ببعض القمح. لذلك من الأفضل تجنب الشوفان على الأقل عند بدء العلاج بحمية خالية من الغلوتين. وعند هدوء المرض يمكن البدء بإعادة إدخال كميات قليلة من الشوفان إلى الغذاء وذلك تحت الرقابة الطبية.
3. يجب الانتباه للطعام المعالج الذي قد يحوي على الغلوتين. فهو مكون شائع في عديد من الأغذية المعالجة ومنها:
• الحساء المعلب • توابل السلطات • البوظة • الحلوى • القهوة الفورية • وجبات الغداء الجاهزة • الكاتشب • الخردل • اللحوم المعلبة • اللبن الرائب • السجق • المعكرونة
4. يجب الحذر من المضغوطات والكبسولات ومستحضرات الفيتامينات الحاوية على الغلوتين. فغالباً ما يستعمل نشا القمح كعامل رابط في المضغوطات والكبسولات. كما أنه يتواجد أحياناً في بعض مستحضرات التجميل مثل أقلام حمرة الشفاه.
5. تجنب الجعة
6. تجنب الحليب ومنتجات الألبان الأخرى الحاوية على اللاكتوز. فالمرضى غير المعالجين من الداء الزلاقي غالباً ما يعانون من عدم تحمل لاكتوز. ومع المعالجة الناجحة، فيمكن إعادة إدخال منتجات الألبان مرة أخرى ببطء إلى الحمية
7. لا بأس بتناول الأسماك واللحوم الطازجة والأرز والذرة وفول الصويا والبطاطس والدواجن والفاكهة والخضار ومنتجات الألبان (للأفراد الذين لا يعانون من عدم تحمل لاكتوز).
8.استشر خبراء التغذية والجمعيات العناية بمرضى الداء الزلاقي من أجل معرفة المنتجات الخالية من الغلوتين. اقرأ كذلك النشرات المرفقة مع علب الأغذية قبل شرائها أو تناولها. يعد هذا هاماً في كل مرة لأن المصنع قد يغير من المكونات بأي لحظة. فيمكن للمنتج الخالي من الغلوتين أن يصبح حاوياً عليها، وحتى أن المنتج الخالي من الغلوتين في دولة ما يمكن أن يكون حاوياً عليها في دولة أخرى. فعند عدم التأكد من احتواء المنتج على الغلوتين فيمكن مراجعة المصنع.
9. تعد الفيتامينات والمعادن المعاوضة هامة في هذا المرض بسبب سوء الامتصاص الحادث. فينصح بأخذ المستحضرات الحاوية على الفيتامينات المتعددة يوميأً. ويجب معالجة المرضى المصابين بفقر الدم بعوز الحديد بمركبات الحديد ومرضى فقر الدم بعوز الفولات أو فيتامين B12 بهذين الفيتامينين. أما المرضى الذين يبدون زمن بروترومبين شاذ فيجب أن يعالجوا بفيتامين K. وأما المرضى المصابين بمستويات كالسيوم منخفضة أو تخلخل العظام فيجب أن يعالجوا بأدوية الكالسيوم وفيتامين D.
تؤدي الحمية الخالية من الغلوتين لدى معظم المرضى إلى تحسن في الأعراض خلال أسابيع. كما أن بعضهم يبدون تحسن في الأعراض خلال 48 ساعة. ولدى الأطفال المصابين بالداء الزلاقي، فالاستجابة للحمية الخالية من الغلوتين تكون فجائية. ليس فقط اختفاء الإسهال والانزعاج البطني، لكن أيضاً التحسن السلوكي وعودة النمو (مع لحاق سريع لذويه في الطول). يتبع هذه التحسنات ظهور الزغابات المعوية من جديد. ولكن عودة الأمعاء للحالة الطبيعية قد يستلزم شهور. أما لدى المرضى البالغين فيتبع تحسن الأعراض عودة تشكل جزئية للزغابات المعوية. ولدى مرضى التهاب الجلد هربسي الشكل، فالآفاتن الجلدية قابلة للتحسن مع الحمية الخالية من الغلوتين.
فشل المعالجة
يمكن أن يكون فشل الاستجابة للحمية الخالية من الغلوتين نتيجة لأسباب عدة:
1. المريض غير ملتزم بشدة بالحمية ولا يزال يستهلك كميات ضئيلة من الغلوتين
2. المريض يستهلك بدون علم مصادر غير متوقعة للغلوتين مثل النشا والعوامل الرابطة والمالئة في الأدوية.
3. يمكن للمريض أن يكون مصاباً بمرض سابق مثل متلازمة الأمعاء الهيوجة وزيادة نمو البكتيريا في الأمعاء الدقيقة والتهاب الكولون المجهري وعوز البنكرياس وهذه الأمراض قد تكون هي المسببة للأعراض.
4. يمكن للمريض أن يكون مصاباً بداء حرون أو بأحد اختلاطات الداء الزلاقي.
الداء الزلاقي الحرون
هو حالة نادرة حيث تكون أعراض الداء الزلاقي (وفقد الزغيبات المعوية) غير قابلة للتحسن رغم اتباع الحمية الخالية من الغلوتين لعدة أشهر. قبل تشخيص الداء الزلاقي الحرون من الهام استثناء اختلاطات الداء الزلاقي والحالات الأخرى المرافقة التي يمكن أن تسبب أعراض مشابهة. يعتبر عديد من الأطباء أن هذا الداء هو حالة خبيثة أي أنها نوع من السرطان.
علاج الداء الزلاقي الحرون
يبدأ العلاج بالتأكد من إزالة الغلوتين من كامل الحمية الغذائية. وإذا لم تتحسن الأعراض، فيمكن استخدام المعالجات. استخدمت الستيروئيدات القشرية مثل البريدنيزون بنجاح في علاج بعض المرضى. واستخدمت كذلك الأدوية المثبطة للمناعة مثل الآزاتيوبيرين والسيكلوسبورين. لكن الستيروئيدات القشرية ومثبطات المناعة هي أدوية شديدة الفاعلية وذات أعراض جانبية خطيرة. عديد من مرضى الداء الزلاقي الحرون يكونون مصابين بنقص تغذية وجهازهم المناعي يكون مضعف. والستيروئيدات القشرية ومثبطات المناعة يمكنها زيادة خطر حدوث أخماج خطيرة. لذلك يجب على الأطباء المختصين بمعالجة الداء الزلاقي أن يراقبوا معالجة الداء الزلاقي الحرون.
ولسوء الحظ مع بعض المرضى المصابين بالداء الحرون، فيمكن لسوء الامتصاص وسوء التغذية أن يستمر رغم المعالجة الدوائية. وهنا لا يوجد حل سوى التغذية الوريدية. يلجأ هنا للتغذية الوريدية الكاملة TPN للتزويد بالحريرات والكاربوهيدرات والحموض الأمينية والدسم وذلك بواسطة محاليل مائية عبر قثطرة وريدية.
للدمج أعلاه
الداء الزلاقي Celiac disease هو اعتلال معوي مناعي يصيب الأمعاء الدقيقة عند الأشخاص المؤهبين وراثياً من الأطفال والبالغين، ويتحرض بتناول الأغذية الحاوية على الغلوتين (الدّبق) كالقمح والشعير ومشتقاتهما، فيعاني هؤلاء الأشخاص من رد فعل مناعي تحسسي في الأمعاء الدقيقة عند تناول هذه الأطعمة مما يسبب أذية للمخاطية المبطنة للمعي الدقيق حيث تلتهب وتتسطح نتيجة تضرر الزغابات المعوية مما يسبب صعوبة في امتصاص بعض المكونات الغذائية وبالتالي يحدث العوز الغذائي لبعض الفيتامينات الضرورية لسلامة كل من الدماغ والجهاز العصبي المحيطي والعظام والكبد وغيرها من الأعضاء الحيوية
الآلية الإمراضية السببية
تفسر الآلية الإمراضية بوجود أذية لمخاطية الأمعاء الدقيقة محدثة بسبب بروتين غير منحل في الماء ومنحل في الكحول يعرف باسم الغلوتين.
المراجع
- ^ van Heel D, West J (2006). "Recent advances in coeliac disease". Gut. 55 (7): 1037–46. doi:10.1136/gut.2005.075119. PMID 16766754.
- ^ Kim C, Quarsten H, Bergseng E, Khosla C, Sollid L (2004). "Structural basis for HLA-DQ2-mediated presentation of gluten epitopes in celiac disease". Proc Natl Acad Sci USA. 101 (12): 4175–9. doi:10.1073/pnas.0306885101. PMC 384714. PMID 15020763.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Jores RD, Frau F, Cucca F; et al. (2007). "HLA-DQB1*0201 homozygosis predisposes to severe intestinal damage in celiac disease". Scand. J. Gastroenterol. 42 (1): 48–53. doi:10.1080/00365520600789859. PMID 17190762.
{{cite journal}}: Explicit use of et al. in:|author=(help)CS1 maint: multiple names: authors list (link) - ^ أ ب Hadithi M, von Blomberg BM, Crusius JB; et al. (2007). "Accuracy of serologic tests and HLA-DQ typing for diagnosing celiac disease". Ann. Intern. Med. 147 (5): 294–302. PMID 17785484.
{{cite journal}}: Explicit use of et al. in:|author=(help)CS1 maint: multiple names: authors list (link) - ^ Qiao SW, Bergseng E, Molberg Ø; et al. (2004). "Antigen presentation to celiac lesion-derived T cells of a 33-mer gliadin peptide naturally formed by gastrointestinal digestion". J. Immunol. 173 (3): 1757–62. PMID 15265905.
{{cite journal}}: Explicit use of et al. in:|author=(help); Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Green PH, Cellier C (2007). "Celiac disease". N. Engl. J. Med. 357 (17): 1731–43. doi:10.1056/NEJMra071600. PMID 17960014.
{{cite journal}}: Unknown parameter|month=ignored (help) - ^ Dieterich W, Ehnis T, Bauer M, Donner P, Volta U, Riecken E, Schuppan D (1997). "Identification of tissue transglutaminase as the autoantigen of celiac disease". Nat Med. 3 (7): 797–801. doi:10.1038/nm0797-797. PMID 9212111.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Ferguson R, Basu M, Asquith P, Cooke W (1976). "Jejunal mucosal abnormalities in patients with recurrent aphthous ulceration". Br Med J. 1 (6000): 11–13. PMC 1638254. PMID 1247715.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Crabbé P, Heremans J (1967). "Selective IgA deficiency with steatorrhea. A new syndrome". Am J Med. 42 (2): 319–26. doi:10.1016/0002-9343(67)90031-9. PMID 4959869.
- ^ Collin P, Mäki M, Keyriläinen O, Hällström O, Reunala T, Pasternack A (1992). "Selective IgA deficiency and coeliac disease". Scand J Gastroenterol. 27 (5): 367–71. doi:10.3109/00365529209000089. PMID 1529270.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Sblattero D, Berti I, Trevisiol C; et al. (2000). "Human recombinant tissue transglutaminase ELISA: an innovative diagnostic assay for celiac disease". Am. J. Gastroenterol. 95 (5): 1253–7. doi:10.1111/j.1572-0241.2000.02018.x. PMID 10811336.
{{cite journal}}: Explicit use of et al. in:|author=(help); Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Wong R, Steele R, Reeves G, Wilson R, Pink A, Adelstein S (2003). "Antibody and genetic testing in coeliac disease". Pathology. 35 (4): 285–304. PMID 12959764.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Treem W (2004). "Emerging concepts in celiac disease". Curr Opin Pediatr. 16 (5): 552–9. doi:10.1097/01.mop.0000142347.74135.73. PMID 15367850.
- ^ Siegel M, Bethune M, Gass J, Ehren J, Xia J, Johannsen A, Stuge T, Gray G, Lee P, Khosla C (2006). "Rational design of combination enzyme therapy for celiac sprue". Chem Biol. 13 (6): 649–58. doi:10.1016/j.chembiol.2006.04.009. PMID 16793522.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Fasano A, Not T, Wang W, Uzzau S, Berti I, Tommasini A, Goldblum S (2000). "Zonulin, a newly discovered modulator of intestinal permeability, and its expression in coeliac disease". Lancet. 355 (9214): 1518–9. doi:10.1016/S0140-6736(00)02169-3. PMID 10801176.
{{cite journal}}: CS1 maint: multiple names: authors list (link)
وصلات خارجية
- الداء البطني at the Open Directory Project
- Celiac Disease Awareness Campaign from the National Institutes of Health
- Celiac Disease Foundation - U.S.
- Coeliac UK - leading UK charity
- Celiac Disease practice guideline from the World Gastroenterology Organisation (WGO)
- Celiac Sprue Association - U.S.
- Outcomes of 2004 consensus development conference, U.S. National Institutes of Health
- GeneReviews/NCBI/NIH/UW entry on Celiac Disease
- National Digestive Diseases Clearinghouse - page on coeliac disease
- National Foundation for Celiac Awareness - U.S.