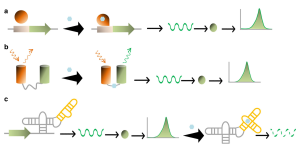
مستشعر حيوي
المستشعر الحيوي إنگليزية: biosensor هو جهاز تحليلي يستخدم للكشف عن مادة كيميائية، يجمع بين مكون بيولوجي وكاشف فيزيائي كيميائي.[1][2][3][4] العنصر البيولوجي الحساس، على سبيل المثال الأنسجة، الكائنات الحية الدقيقة، العضيات، مستقبلات الخلايا، الإنزيمات، الأجسام المضادة، الحمض النووي، وما إلى ذلك، هي مادة مشتقة بيولوجياً أو مكون المحاكاة الحيوية الذي يتفاعل مع أو يرتبط أو يتعرف على المادة التحليلية قيد الدراسة. يمكن أيضاً إنشاء العناصر الحساسة بيولوجياً بواسطة الهندسة الحيوية. يعمل محول الطاقة أو عنصر الكاشف، الذي يحول إشارة إلى أخرى، بطريقة فيزيائية كيميائية: بصرية، كهرضغطية، كهروكيميائية، اللمعان الكهربي الكيميائي وما إلى ذلك، الناتجة عن تفاعل المادة التحليلية مع العنصر البيولوجي، للقياس والتحديد الكمي بسهولة.يتصل جهاز قارئ المستشعر الحيوي بالإلكترونيات المرتبطة أو معالجات الإشارات المسؤولة بشكل أساسي عن عرض النتائج بطريقة سهلة الاستخدام.[5] يمثل هذا أحياناً الجزء الأغلى من جهاز الاستشعار، ولكن من الممكن إنشاء شاشة سهلة الاستخدام تتضمن محول طاقة وعنصراً حساساً (مستشعر ثلاثي الأبعاد). عادةً ما يتم تصميم القراء وتصنيعهم خصيصاً لتلائم مبادئ العمل المختلفة لأجهزة الاستشعار الحيوية.
نظام الاستشعار الحيوي
يتكون المستشعر الحيوي عادةً من مستقبلات حيوية (إنزيم/جسم مضاد/خلية/حمض نووي/أپتمر)، ومكون محول (مادة شبه موصلة/مادة نانوية)، و نظام إلكتروني يتضمن مضخم إشارة، المعالج وشاشة العرض.[6]يمكن دمج المحولات والإلكترونيات، على سبيل المثال، في أنظمة مستشعرات دقيقة تعتمد على سيموس.[7][8]يستخدم مكون التعرف، الذي يُسمى غالباً بالمستقبل الحيوي، الجزيئات الحيوية من الكائنات الحية أو المستقبلات المصممة على غرار الأنظمة البيولوجية للتفاعل مع المادة التحليلية محل الاهتمام. يتم قياس هذا التفاعل بواسطة المحول الحيوي الذي ينتج إشارة قابلة للقياس تتناسب مع وجود المادة التحليلية المستهدفة في العينة. الهدف العام من تصميم جهاز الاستشعار البيولوجي هو تمكين الاختبار السريع والمريح في نقطة الاهتمام أو الرعاية حيث تم الحصول على العينة.[1][9][10]
المستقبلات الحيوية
في المستشعر الحيوي، تم تصميم المستقبل الحيوي للتفاعل مع المادة التحليلية المحددة ذات الأهمية لإنتاج تأثير يمكن قياسه بواسطة محول الطاقة. تعد الانتقائية العالية للتحليل بين مصفوفة مكونات كيميائية أو بيولوجية أخرى مطلباً رئيسياً للمستقبل الحيوي. بينما يمكن أن يختلف نوع الجزيء الحيوي المستخدم على نطاق واسع، يمكن تصنيف المستشعرات الحيوية وفقاً للأنواع الشائعة لتفاعلات المستقبلات الحيوية التي تشمل: الجسم المضاد/المستضد،[11] الإنزيمات/الروابط الأيونية، الأحماض النووية/DNA، الهياكل الخلوية/الخلايا، أو مواد المحاكاة الحيوية.[12][13]
تفاعلات الجسم المضاد/المستضد
يستخدم جهاز استشعار مناعي ألفة ارتباط محددة جداً للأجسام المضادة لمركب معين أو مولد ضد. تتشابه الطبيعة المحددة لتفاعل الجسم المضاد مع المستضد مع القفل والمفتاح الملائم من حيث أن مولد الضد سوف يرتبط بالجسم المضاد فقط إذا كان لديه التشكل الصحيح. تؤدي الأحداث الملزمة إلى تغيير فيزيائي كيميائي يمكن أن يولد إشارة بالاقتران مع متتبع، مثل جزيئات الفلورسنت أو الإنزيمات أو النظائر المشعة. توجد قيود على استخدام الأجسام المضادة في المستشعرات: 1. تعتمد قدرة ربط الجسم المضاد بشدة على ظروف الفحص (مثل الأس الهيدروجيني ودرجة الحرارة)، و 2. يكون التفاعل بين الجسم المضاد والمستضد قوياً بشكل عام، ومع ذلك، يمكن تعطيل الارتباط بواسطة الكواشف Chaotropic أو المذيبات العضوية أو حتى الأشعة فوق الصوتية.[14][15]
يمكن أيضاً استخدام تفاعلات الجسم المضاد مع المستضد في الاختبارات المصلية، أو لاكتشاف الأجسام المضادة المنتشرة استجابة لمرض معين. الأهم من ذلك، أصبحت اختبارات الأمصال جزءاً مهماً من الاستجابة العالمية لوباء مرض ڤيروس كورونا 2019.[16]
بروتينات الربط المصطنعة
استخدام الأجسام المضادة كعنصر التعرف البيولوجي لأجهزة الاستشعار الحيوية له عيوب عديدة. لها أوزان جزيئية عالية واستقرار محدود، وتحتوي على روابط ثاني كبريتيد أساسية، كما أن إنتاجها مكلف. في أحد الأساليب للتغلب على هذه القيود، صُممت أجزاء الارتباط المصطنع (Fab، Fv أو scFv) أو مجالات (VH ،VHH) للأجسام المضادة.[17]في نهج آخر، تم تصميم دعامات البروتين الصغيرة ذات الخصائص الفيزيائية الحيوية المواتية لتوليد عائلات اصطناعية من بروتينات ربط المستضد (AgBP)، القادرة على الارتباط المحدد ببروتينات مستهدفة مختلفة مع الاحتفاظ بالخصائص المفضلة للجزيء الأصلي. غالباً ما يتم تحديد عناصر العائلة التي ترتبط على وجه التحديد بمولد ضد مستهدف معين في المختبر من خلال تقنيات العرض: عرض الآكلة، عرض الريبوسوم، عرض الخميرة أو عرض mRNA. تكون بروتينات الارتباط الاصطناعي أصغر بكثير من الأجسام المضادة (عادة ما تكون أقل من 100 من بقايا الأحماض الأمينية)، ولها ثبات قوي، وتفتقر إلى روابط ثاني كبريتيد ويمكن التعبير عنها بإنتاجية عالية في البيئات الخلوية المختزلة مثل السيتوبلازم البكتيري، على عكس الأجسام المضادة ومشتقاتها.[18][19]وبالتالي فهي مناسبة بشكل خاص لإنشاء أجهزة استشعار حيوية.[20][21]
التفاعلات الأنزيمية
إن قدرات الارتباط المحددة والنشاط التحفيزي للإنزيم تجعلها مستقبلات حيوية شائعة. يتم تمكين التعرف على التحليلات من خلال العديد من الآليات الممكنة: 1) الإنزيم الذي يحول المادة التحليلية إلى منتج يمكن اكتشافه بواسطة المستشعر، 2) اكتشاف تثبيط الإنزيم أو تنشيطه بواسطة التحليلة، أو 3) مراقبة تعديل خصائص الإنزيم الناتج عن التفاعل مع المادة التحليلية.[15] الأسباب الرئيسية للاستخدام الشائع للإنزيمات في أجهزة الاستشعار الحيوية هي: 1) القدرة على تحفيز عدد كبير من التفاعلات. 2) القدرة على الكشف عن مجموعة من المواد التحليلية (المواد المتفاعلة، منتجات، مثبطات، ومعدلات النشاط التحفيزي)؛ و3) الملاءمة مع العديد من طرق التنبيغ المختلفة للكشف عن المادة الحليلة. والجدير بالذكر أنه نظراً لعدم استهلاك الإنزيمات في التفاعلات، يمكن بسهولة استخدام المستشعر الحيوي بشكل مستمر. يسمح النشاط التحفيزي للإنزيمات أيضاً بحدود أقل للكشف مقارنة بتقنيات الربط الشائعة. ومع ذلك، فإن عمر المستشعر مقيد بثبات الإنزيم.
مستقبلات ربط التقارب
تحتوي الأجسام المضادة على ثابت ترابط مرتفع يزيد عن 10^8 لتر/مول، وهو ما يمثل ارتباطاً لا رجوع فيه تقريباً بمجرد تكوين زوجين من الجسم المضاد والمستضد. بالنسبة لجزيئات تحليلية معينة مثل الگلوكوز توجد بروتينات ربط تقارب تترابط بدرجة عالية النوعية مثل الجسم المضاد، ولكن مع ثابت ارتباط أصغر كثيراً في حدود 10^2 إلى 10^4 لتر/مول. إن الارتباط بين المادة التحليلية والمستقبلات يكون ذا طبيعة قابلة للعكس وبجانب الزوجين بين كليهما أيضاً، تحدث الجزيئات الحرة بتركيز قابل للقياس. في حالة الگلوكوز، على سبيل المثال، قد يعمل concanavalin A كمستقبل تقارب يظهر ثابت ترابط قدره 4x10^2 L/mol.[22]اقترح شولتز وسيمز استخدام مستقبلات ربط التقارب لأغراض التحليل البيولوجي في عام 1979 [23]وتم تكوينه لاحقاً في اختبار الفلورسنت لقياس الگلوكوز في النطاق الفيزيولوجي ذي الصلة 4.4 و6.1 mmol/L.[24]يتميز مبدأ المستشعر بأنه لا يستهلك المادة الحليلة في تفاعل كيميائي كما يحدث في المقايسات الأنزيمية.
تفاعلات الحمض النووي
يمكن أن تعتمد المستشعرات الحيوية التي تستخدم مستقبلات أساسها الحمض النووي على تفاعلات اقتران القاعدة التكميلية المشار إليها باسم المستشعرات الجينية أو محاكيات الأجسام المضادة القائمة على الحمض النووي (aptamers) كمستشعرات aptasensors.[25] في السابق، تستند عملية التعرف على مبدأ الاقتران القاعدي التكميلي، الأدنين:الثايمين والسيتوزين:الگوانين في DNA. إذا كان تسلسل الحمض النووي المستهدف معروفاً، فيمكن تصنيع التسلسلات التكميلية، وتمييزها، ثم تثبيتها على المستشعر. يمكن الكشف عن حدث التهجين بصرياً والتأكد من وجود DNA/RNA المستهدف. في الأخير، تتعرف الأپتميرات المتولدة ضد الهدف على ذلك من خلال تفاعل تفاعلات محددة غير تساهمية والتركيب المستحث. يمكن تمييز هذه الأبتامرات بجسيمات نانوية فلورية/معدنية بسهولة للكشف البصري أو يمكن استخدامها لمنصات الكشف الكهروكيميائية أو الكابولية الخالية من الملصقات لمجموعة واسعة من الجزيئات المستهدفة أو الأهداف المعقدة مثل الخلايا والفيروسات.[26][27]بالإضافة إلى ذلك، يمكن دمج الأپتميرات مع إنزيمات الحمض النووي، مثل إنزيمات الحمض النووي الريبي المنقسمة على الحمض النووي الريبي، مما يوفر التعرف على الهدف وتوليد الإشارات في جزيء واحد، مما يُظهر التطبيقات المحتملة في تطوير أجهزة الاستشعار الحيوية المتعددة.[28]
علم التخلق
اقتُرح أنه يمكن استغلال المرنانات البصرية المتكاملة المحسنة بشكل صحيح للكشف عن التعديلات اللاجينية (مثل مثيلة الحمض النووي، وتعديلات هيستون بعد الترجمة) في سوائل الجسم من المرضى المصابين بالسرطان أو بأمراض أخرى.[29] يتم تطوير أجهزة الاستشعار الحيوية الضوئية ذات الحساسية الفائقة في الوقت الحاضر على مستوى بحثي للكشف بسهولة عن الخلايا السرطانية داخل بول المريض.[30] تهدف المشاريع البحثية المختلفة إلى تطوير أجهزة محمولة جديدة تستخدم خراطيش رخيصة وصديقة للبيئة ويمكن التخلص منها وتتطلب معالجة بسيطة فقط دون الحاجة إلى مزيد من المعالجة أو الغسيل أو التلاعب من قبل فنيين خبراء.[31]
العضيات
تشكل العضيات مقصورات منفصلة داخل الخلايا وعادة ما تؤدي وظائفها بشكل مستقل. أنواع مختلفة من العضيات لها مسارات استقلابية مختلفة وتحتوي على إنزيمات لأداء وظيفتها. تشمل العضيات المستخدمة بشكل شائع الليزوزوم والبلاستيدات الخضراء والمتقدرات. يرتبط نمط التوزيع المكاني والزماني للكالسيوم ارتباطاً وثيقاً بمسار الإشارات في كل مكان. تشارك المتقدرات بنشاط في استقلاب أيونات الكالسيوم للتحكم في الوظيفة وتعديل مسارات الإشارات المتعلقة بالكالسيوم. أثبتت التجارب أن المتقدرات لديها القدرة على الاستجابة لتركيزات الكالسيوم العالية المتولدة بالقرب منها عن طريق فتح قنوات الكالسيوم.[32] بهذه الطريقة، يمكن استخدام المتقدرات للكشف عن تركيز الكالسيوم في الوسط ويكون الاكتشاف حساساً للغاية بسبب الدقة المكانية العالية. يتم استخدام تطبيق آخر للمتقدرات للكشف عن تلوث المياه. ستؤدي سمية مركبات المنظف إلى إتلاف الخلية والبنية تحت الخلوية بما في ذلك المتقدرات. سوف تتسبب المنظفات في حدوث انتفاخ يمكن قياسه من خلال تغيير الامتصاص. تُظهر بيانات التجربة أن معدل التغيير يتناسب مع تركيز المادة المطهرة، مما يوفر معياراً عالياً لدقة الكشف.[33]
الخلايا
غالباً ما تستخدم الخلايا في المستقبلات الحيوية لأنها حساسة للبيئة المحيطة ويمكنها الاستجابة لجميع أنواع المنشطات. تميل الخلايا إلى الالتصاق بالسطح بحيث يمكن تثبيتها بسهولة. بالمقارنة مع العضيات فإنها تظل نشطة لفترة أطول وقابلية التكاثر تجعلها قابلة لإعادة الاستخدام. يتم استخدامها بشكل شائع للكشف عن المعلمات العالمية مثل حالة الإجهاد والسمية والمشتقات العضوية. يمكن استخدامها أيضاً لمراقبة تأثير العلاج للأدوية. أحد التطبيقات هو استخدام الخلايا لتحديد مبيدات الأعشاب التي تعد ملوثاً مائياً رئيسياً.[34]تعلق الطحالب الدقيقة على بلورات ألياف دقيقة ويجمع فلور الكلوروفيل المعدل بواسطة الأعشاب المجففة عند طرف حزمة من الألياف الضوئية وينتقل إلى مقياس التألق. يتم استزراع الطحالب باستمرار للحصول على القياس الأمثل. أظهرت النتائج أن حد الكشف عن بعض مبيدات الأعشاب يمكن أن يصل إلى مستوى تركيز أقل من جزء في البليون. يمكن أيضاً استخدام بعض الخلايا لمراقبة التآكل الجرثومي.[35]تُعزل فصائل الزائفة الزنجارية عن سطح المواد المتآكلة ومثبت على غشاء الأسيتيل سلولوز. ويتم تحديد نشاط التنفس عن طريق قياس استهلاك الأكسجين. كما توجد علاقة خطية بين التيار المتولد وتركيز حامض الكبريتيك. يرتبط وقت الاستجابة بتحميل الخلايا والبيئات المحيطة ويمكن التحكم فيه بما لا يزيد عن 5 دقائق.
النسيج
تستخدم الأنسجة لجهاز الاستشعار الحيوي لوفرة الإنزيمات الموجودة. تشمل مزايا الأنسجة كمستشعرات حيوية ما يلي:[36]
- أسهل في التجمد مقارنة بالخلايا والعضيات
- ارتفاع النشاط والثبات من الحفاظ على الإنزيمات في البيئة الطبيعية
- التوافر والسعر المنخفض
- تجنب العمل الشاق لاستخراج وطرد وتنقية الأنزيمات
- توجد عوامل مساعدة ضرورية لعمل الإنزيم
- التنوع يوفر مجموعة واسعة من الخيارات المتعلقة بأهداف مختلفة.
توجد أيضاً بعض عيوب الأنسجة، مثل الافتقار إلى النوعية بسبب تداخل الإنزيمات الأخرى ووقت الاستجابة الأطول بسبب حاجز النقل.
أجهزة الاستشعار الحيوية الجرثومية
تستغل المستشعرات الحيوية الجرثومية استجابة البكتيريا لمادة معينة. على سبيل المثال، يمكن اكتشاف الزرنيخ باستخدام ars operon الموجود في العديد من الأصناف البكتيرية.[37]
وضع المستشعرات
يعتمد الوضع المناسب للمستشعرات الحيوية على مجال تطبيقها، والذي يمكن تقسيمه تقريباً إلى التقانة الحيوية، الزراعة، تكنولوجيا الغذاء والطب الحيوي.
في التكنولوجيا الحيوية، يمكن إجراء تحليل التركيب الكيميائي لزراعة السوائل البروتينية في سلاسل العمليات، قيد التشغيل، في النشاطات، وبعيداً عن الخط. كما أوضحت إدارة الغذاء والدواء الأمريكية (FDA) لا تتم إزالة العينة من مجرى العملية للمستشعرات المضمنة، بينما يتم تحويلها من عملية التصنيع للقياسات عبر الإنترنت. بالنسبة للمستشعرات قيد التشغيل يمكن إزالة العينة وتحليلها على مقربة شديدة من مجرى العملية.[38] مثال على هذا الأخير هو مراقبة اللاكتوز في مصنع معالجة الألبان.[39] تُقارن المستشعرات الحيوية خارج الخط مع تقنيات التحليل الحيوي التي لا تعمل في المجال، ولكن في المختبر. تستخدم هذه التقنيات بشكل أساسي في الزراعة وتكنولوجيا الأغذية والطب الحيوي.
تُصنف المستشعرات الحيوية في التطبيقات الطبية عموماً على أنها أنظمة في المختبر وفي الجسم الحي. يتم قياس المستشعر الحيوي في المختبر في أنبوب اختبار أو طبق زرع أو صفيحة معايرة دقيقة أو في أي مكان آخر خارج الكائن الحي. يستخدم المستشعر مستقبلات حيوية ومحول طاقة كما هو موضح أعلاه. مثال على المستشعر الحيوي في المختبر هو مستشعر حيوي لقياس إنزيم مراقبة گلوكوز الدم. هناك تحدٍ لإنشاء مستشعر حيوي يعمل وفقاً لمبدأ نقطة الرعاية السريرية، أي في الموقع حيث يلزم الاختبار.[40][41] من بين هذه الدراسات تطوير المستشعرات الحيوية القابلة للارتداء.[42]يمكن للتخلص من الاختبارات المخبرية توفير الوقت والمال. يمكن أن يكون تطبيق المستشعر الحيوي في الاختبارات في نقطة الرعاية لاختبار HIV في المناطق التي يصعب على المرضى اختبارها. يمكن إرسال جهاز استشعار حيوي مباشرة إلى الموقع ويمكن استخدام اختبار سريع وسهل.

المستشعر الحيوي في الجسم الحي هو جهاز قابل للزرع يعمل داخل الجسم. بالطبع، يجب أن تستوفي غرسات المستشعر الحيوي اللوائح الصارمة بشأن التعقيم من أجل تجنب الاستجابة الالتهابية الأولية بعد الزرع. يتعلق الشاغل الثاني بالتوافق الحيوي على المدى الطويل، أي التفاعل غير الضار مع بيئة الجسم خلال الفترة المقصودة من الاستخدام.[44]القضية الأخرى التي تنشأ هي الفشل. في حالة حدوث عطل، يجب إزالة الجهاز واستبداله، مما يؤدي إلى جراحة إضافية. مثال على استخدام مستشعر حيوي في الجسم الحي هو مراقبة الأنسولين داخل الجسم، وهو أمر غير متوفر حتى الآن.
طُورت معظم غرسات المستشعر الحيوي المتقدمة من أجل المراقبة المستمرة للگلوكوز.[45][46] يعرض الشكل جهازاً يتم فيه استخدام غلاف Ti والبطارية كما تم تحديدهما لزرع القلب والأوعية الدموية مثل أجهزة تنظيم ضربات القلب و مزيل الرجفان.[43] يتم تحديد حجمها بواسطة البطارية كما هو مطلوب لمدة عام واحد. سيتم إرسال بيانات الگلوكوز المقاسة لاسلكياً إلى خارج الجسم داخل نطاق 402-405 MHz وفقاً لما تمت الموافقة عليه للزرعات الطبية.
يمكن أيضاً دمج المستشعرات الحيوية في أنظمة الهاتف المحمول، مما يجعلها سهلة الاستخدام ومتاحة لعدد كبير من المستخدمين.[47]
التطبيقات
هناك العديد من التطبيقات المحتملة للمستشعرات الحيوية من أنواع مختلفة. المتطلبات الرئيسية لنهج المستشعر الحيوي ليكون ذا قيمة فيما يتعلق بالبحث والتطبيقات التجارية هي تحديد الجزيء المستهدف، وتوافر عنصر التعرف البيولوجي المناسب، وإمكانية تفضيل أنظمة الكشف المحمولة التي يمكن التخلص منها على التقنيات المعتمدة على المختبرات الحساسة في بعض الحالات. بعض الأمثلة هي مراقبة الگلوكوز في مرضى السكري، والأهداف الأخرى المتعلقة بالصحة الطبية، والتطبيقات البيئية، على سبيل المثال الكشف عن [[مبيد الآفات |مبيدات الآفات]] وملوثات مياه الأنهار، مثل أيونات المعادن الثقيلة،[48] الاستشعار عن بعد للبكتيريا المحمولة جواً، على سبيل المثال في أنشطة مكافحة الإرهاب البيولوجي، والاستشعار عن بعد لجودة المياه في المياه الساحلية من خلال وصف الجوانب المختلفة عبر الإنترنت لعلم السلوكيات (الإيقاعات البيولوجية، ومعدلات النمو، وسجلات التفريخ أو الموت) في مجموعات من ذوات الصدفتين المهجورة حول العالم ،[49]الكشف عن مسببات الأمراض، وتحديد مستويات المواد السامة قبل وبعد المعالجة الحيوية، وكشف وتحديد الفوسفات العضوي، والقياس التحليلي الروتيني لـ حمض الفوليك، البيوتين، ڤيتامين ب12 وحمض الپانتوثنيك كبديل للمقايسة الميكروبيولوجية، وتحديد بقايا الأدوية في الطعام، مثل المضادات الحيوية ومحفزات النمو، وخاصة اللحوم والعسل، اكتشاف الأدوية وتقييم النشاط الحيوي للمركبات الجديدة، وهندسة البروتين في المستشعرات الحيوية،[50] واكتشاف المستقلبات السامة مثل السموم الفطرية.
من الأمثلة الشائعة على المستشعر الحيوي التجاري جهاز الاستشعار الحيوي الگلوكوز في الدم، والذي يستخدم الإنزيم أكسيداز الگلوكوز لكسر الگلوكوز في الدم. عند القيام بذلك، يقوم أولاً بأكسدة الگلوكوز ويستخدم إلكترونين لتقليل FAD (أحد مكونات الإنزيم) إلى FADH2. يتأكسد هذا بدوره بواسطة القطب في عدد من الخطوات. التيار الناتج هو مقياس لتركيز الگلوكوز. في هذه الحالة، يكون القطب هو محول الطاقة والإنزيم هو المكون النشط حيوياً.
يمكن اعتبار كناري القفص، كما يستخدمه عمال المناجم للتحذير من الغاز، مستشعراً حيوياً. العديد من تطبيقات المستشعر الحيوي اليوم متشابهة، من حيث أنها تستخدم الكائنات الحية التي تستجيب للمواد السامة بتركيزات أقل بكثير مما يستطيع البشر اكتشافه للتحذير من وجودها. يمكن استخدام هذه الأجهزة في المراقبة البيئية،[49] الكشف عن أثر الغازات وفي مرافق معالجة المياه.
رصد الگلوكوز
تعتمد أجهزة رصد الگلوكوز المتوفرة تجارياً على الاستشعار الأمپيرومتري للگلوكوز عن طريق أكسيداز الگلوكوز، الذي يؤكسد الگلوكوز المنتج لبيروكسيد الهيدروجين الذي يكتشفه القطب. للتغلب على محدودية أجهزة الاستشعار الأمپيرومترية، توجد سلسلة من الأبحاث حول طرق الاستشعار الجديدة، مثل المستشعرات الحيوية للگلوكوز الفلوري.[51]
مستشعر تصوير الانعكاسية بقياس التداخل
يعتمد مستشعر تصوير الانعكاس بقياس التداخل (IRIS) على مبادئ التداخل البصري ويتكون من ركيزة أكسيد السليكون-السليكون والبصريات القياسية ومصابيح LED المتماسكة منخفضة الطاقة. عندما يضيء الضوء من خلال هدف تكبير منخفض على ركيزة ذات طبقات من أكسيد السيليكون-السيليكون، يتم إنتاج توقيع قياس التداخل. نظراً لأن الكتلة الحيوية، التي لها معامل الانكسار مثل أكسيد السليكون، تتراكم على سطح الركيزة، يحدث تغيير في بصمة قياس التداخل ويمكن ربط التغيير بكتلة قابلة للقياس الكمي. استخدم "دعبول وآخرون" IRIS لإنتاج حساسية خالية من الملصقات تقريباً 19 ng/mL.[52] آن وآخرون. تحسين حساسية IRIS من خلال تقنية الملاحقة الجماعية.[53]
منذ النشر الأولي، تم تكييف IRIS لأداء وظائف مختلفة. أولاً، قامت IRIS بدمج قدرة التصوير الفلوري في أداة التصوير بقياس التداخل كطريقة محتملة لمعالجة تباين مصفوفة البروتين الفوري الصغرى.[54]باختصار، فإن الاختلاف في المصفوفات الدقيقة الفلورية مشتق بشكل رئيسي من عدم تناسق البروتين على الأسطح وقد يتسبب في تشخيص خاطئ في المصفوفات الدقيقة للحساسية.[55]لتصحيح أي اختلاف في تجميد البروتين، يتم بعد ذلك تطبيع البيانات المكتسبة في طريقة التألق من خلال البيانات المكتسبة في الطريقة الخالية من الملصقات.[55]تم تكييف IRIS أيضاً لإجراء عد جسيمات متناهية الصغر عن طريق تبديل هدف التكبير المنخفض المستخدم لتقدير الكتلة الحيوية الخالية من الرقعات إلى تكبير موضوعي أعلى.[56][57] تتيح هذه الطريقة تمييز الحجم في العينات البيولوجية البشرية المعقدة. استخدم مونرو وآخرون IRIS لقياس مستويات البروتين التي ارتفعت في الدم والمصل البشري بالكامل وتحديد حساسية مسببات الحساسية في عينات دم بشرية مميزة باستخدام معالجة العينات الصفرية.[58] تشمل الاستخدامات العملية الأخرى لهذا الجهاز الكشف عن الفيروسات ومسببات الأمراض.[59]
تحليل الطعام
هناك العديد من تطبيقات المستشعرات الحيوية في تحليل الطعام.[60][61][62]في صناعة الأغذية، تُستخدم البصريات المغلفة بالأجسام المضادة بشكل شائع للكشف عن مسببات الأمراض والسموم الغذائية. عادةً ما يكون نظام الضوء في هذه المستشعرات الحيوية مضاناً، لأن هذا النوع من القياس البصري يمكن أن يضخم الإشارة بشكل كبير.
طُورت مجموعة من المقايسات المناعية والرابطية للكشف عن الجزيئات الصغيرة وقياسها مثل الفيتامينات القابلة للذوبان في الماء والملوثات الكيميائية (مخلفات الأدوية) مثل السلفوناميدات ومنبهات-بيتا للاستخدام في أنظمة الاستشعار القائمة على SPR، وغالباً ما يتم تكييفها من مقايسة الممتز المناعي المرتبط بالإنزيم (إليسا) أو مقايسة مناعية أخرى. هذه منتشرة على نطاق واسع في صناعة المواد الغذائية.
كشف/مراقبة الملوثات
يمكن استخدام المستشعرات الحيوية لرصد الهواء، الماء، وملوثات التربة مثل مبيدات الآفات، والمواد المسببة للسرطان و/أو المطفرة و/أو السامة والمواد الكيميائية المسببة لاضطراب الغدد الصماء.[63][64]
على سبيل المثال، طور علماء التقانة النانوية الحيوية مستشعر حيوي قابل للتطبيق، ROSALIND 2.0، يمكنه اكتشاف مستويات ملوثات المياه المتنوعة.[65][66]
قياس الأوزون
نظراً لأن الأوزون يقوم بتصفية الأشعة فوق البنفسجية الضارة، فقد أثار اكتشاف الثقوب في طبقة الأوزون في الغلاف الجوي للأرض القلق بشأن مقدار الضوء فوق بنفسجي الذي يصل إلى سطح الأرض. ومما يثير القلق بشكل خاص الأسئلة المتعلقة بمدى عمق اختراق الأشعة فوق البنفسجية في مياه البحر وكيفية تأثيرها على الكائنات البحرية، وخاصة العوالق (الكائنات الدقيقة العائمة) والڤيروسات التي تهاجم العوالق. تشكل العوالق قاعدة سلاسل الغذاء البحرية ويعتقد أنها تؤثر على درجة حرارة كوكبنا والطقس عن طريق امتصاص CO2 لعملية التمثيل الضوئي.
ابتكر دنيب كارنتز، الباحث في مختبر البيولوجيا الإشعاعية والصحة البيئية (جامعة كاليفورنيا، سان فرانسسكو) طريقة بسيطة لقياس تغلغل الأشعة فوق البنفسجية وشدتها. أثناء عملها في المحيط المتجمد الجنوبي، غمرت في أعماق عدة أكياس بلاستيكية رفيعة تحتوي على سلالات خاصة من إي. كولاي التي تكاد تكون غير قادرة تماماً على إصلاح تلف الأشعة فوق البنفسجية للحمض النووي. تمت مقارنة معدلات الوفيات البكتيرية في هذه الأكياس مع المعدلات في أكياس التحكم غير المعرضة لنفس الكائن الحي. كشفت "المستشعرات الحيوية" البكتيرية عن ضرر ثابت من الأشعة فوق البنفسجية على عمق 10 أمتار وغالباً عند 20 و30 متر. يخطط كارنتز لدراسات إضافية حول كيفية تأثير الأشعة فوق البنفسجية على انتشار العوالق الموسمية (طفرات النمو) في المحيطات.[67]
رصد خلايا السرطان المتحور
الانبثاث هو انتشار السرطان من جزء من الجسم إلى جزء آخر إما عن طريق الدورة الدموية أو الجهاز اللمفاوي.[68]على عكس اختبارات التصوير الشعاعي (تصوير الثدي بالأشعة السينية)، التي ترسل أشكالاً من الطاقة (الأشعة السينية، والمجالات المغناطيسية، وما إلى ذلك) عبر الجسم لالتقاط الصور الداخلية فقط، فإن أجهزة الاستشعار الحيوية لديها القدرة على اختبار القوة الخبيثة للورم مباشرة. يسمح الجمع بين العنصر البيولوجي والكاشف بمتطلبات عينة صغيرة وتصميم مضغوط وإشارات سريعة وكشف سريع وانتقائية عالية وحساسية عالية للتحليل الذي تتم دراسته. مقارنةً باختبارات التصوير الشعاعي المعتادة، تتمتع أجهزة الاستشعار الحيوية ليس فقط بميزة اكتشاف مدى انتشار السرطان والتحقق مما إذا كان العلاج فعالاً ولكن أيضاً طرق أرخص وأكثر كفاءة (من حيث الوقت والتكلفة والإنتاجية) لتقييم انتشار السرطان في المراحل المبكرة من علاج السرطان.
ابتكر باحثو الهندسة البيولوجية أجهزة استشعار حيوية للأورام لسرطان الثدي.[69]سرطان الثدي هو السرطان الشائع الرائد بين النساء في جميع أنحاء العالم.[70] مثال على ذلك هو موازنة دقيقة بلورية كوارتز ترانسفيرين (QCM). كمستشعر حيوي، ينتج توازن دقيق بلوري كوارتز تذبذبات في تردد الموجة الدائمة للبلورة من جهد متناوب لاكتشاف تغيرات كتلة النانو جرام. تم تصميم هذه المستشعرات الحيوية خصيصاً للتفاعل ولديها انتقائية عالية للمستقبلات على أسطح الخلايا (السرطانية والعادية). من الناحية المثالية، يوفر هذا كشفاً كمياً للخلايا التي تحتوي على هذا المستقبل لكل مساحة سطحية بدلاً من الكشف عن الصورة النوعية بواسطة تصوير الثدي بالأشعة السينية.
لاحظت سيدا أتاي، باحثة التكنولوجيا الحيوية في جامعة حاجةتپه، بشكل تجريبي هذه الخصوصية والانتقائية بين QCM وخلايا الثدي MDA-MB 231، MCF 7 وخلايا MDA-MB 231 المجمدة الباردة في المختبر.[69] كما ابتكرت مع باحثين آخرين طريقة لغسل هذه الخلايا المنتشرة المختلفة المستوية على المستشعرات لقياس التحولات الجماعية بسبب الكميات المختلفة من مستقبلات الترانسفيرين. على وجه الخصوص، يمكن تحديد القوة النقيلية لخلايا سرطان الثدي من خلال الموازين الدقيقة البلورية الكوارتز مع الجسيمات النانوية والترانسفيرين التي من المحتمل أن ترتبط بمستقبلات الترانسفيرين على أسطح الخلايا السرطانية. حيث توجد انتقائية عالية جداً لمستقبلات الترانسفيرين نظراً لإفراط في التعبير عنها في الخلايا السرطانية. إذا كانت الخلايا تحتوي على نسبة عالية من التعبير عن مستقبلات الترانسفيرين، مما يدل على قوتها النقيلية العالية، فإنها تكون أكثر تقارباً وترتبط أكثر بـ QCM الذي يقيس الزيادة في الكتلة. اعتماداً على حجم تغير الكتلة النانوي جرام، يمكن تحديد القوة المنتقلة.
بالإضافة إلى ذلك، في السنوات الماضية، تم التركيز بشكل كبير على اكتشاف المؤشرات الحيوية لسرطان الرئة دون خزعة. في هذا الصدد، تعد المستشعرات الحيوية أدوات جذابة للغاية وقابلة للتطبيق لتوفير عمليات الكشف السريع والحساسة والمحددة والمستقرة والفعالة من حيث التكلفة وغير الغازية للتشخيص المبكر لسرطان الرئة. وبالتالي، تتكون المستشعرات الحيوية للسرطان من جزيئات التعرف البيولوجي المحددة مثل الأجسام المضادة أو مجسات الحمض النووي التكميلي أو غيرها من الجزيئات الحيوية المعطلة على سطح محول الطاقة. تتفاعل جزيئات التعرف البيولوجي على وجه التحديد مع المؤشرات الحيوية (الأهداف) ويتم تحويل الاستجابات البيولوجية المتولدة بواسطة محول الطاقة إلى إشارة تحليلية قابلة للقياس. اعتماداً على نوع الاستجابة البيولوجية، يتم استخدام محولات طاقة مختلفة في تصنيع أجهزة الاستشعار الحيوية للسرطان مثل المحولات الكهروكيميائية والبصرية والكتلة.[71]
رصد المسببات الأمراض
يمكن استخدام المستشعرات الحيوية للكشف عن الكائنات المسببة للأمراض.[64]
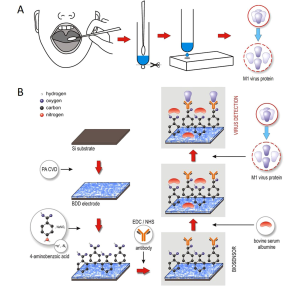
طُورت المستشعرات الحيوية المضمنة للتوقيعات المسببة للأمراض - مثل SARS-CoV-2 - التي يمكن ارتداؤها - مثل أقنعة وجه مدمجة الاختبارات.[72][73] انظر أيضاً: COVID-19 public transport R&D
يمكن للأنواع الجديدة من رقائق المستشعرات الحيوية أن تتيح طرقاً جديدة "مثل مستشعرات مسببات الأمراض التي تنتشر بواسطة الطائرات بدون طيار والتي تقوم بمسح نشط للهواء أو مياه الصرف الصحي". يمكن استخدام الأبتاميرات المرتبطة بالبروتين لاختبار مسببات الأمراض المعدية.[74] قد تتيح أنظمة الجلد الإلكتروني (أو جلود الروبوت) المزودة بأجهزة استشعار حيوية مدمجة (أو أجهزة استشعار كيميائية) وقد تُمكِّن واجهات بين الإنسان والآلة ارتداء جهاز يمكن ارتداؤه وكذلك الاستشعار عن بُعد أو الاستشعار الآلي لمسببات الأمراض (بالإضافة إلى العديد من المواد الخطرة و الإدراك اللمسي).[75][بحاجة لمصادر إضافية]
الأنواع
المستشعرات الحيوية الضوئية
تعتمد العديد من المستشعرات الحيوية الضوئية على ظاهرة تقنيات رنين سطح الپلازمون (SPR).[76][77]يستخدم ذلك خاصية وغيرها من المواد؛ على وجه التحديد، يمكن لطبقة رقيقة من الذهب على سطح زجاجي بمؤشر انكسار عالٍ أن تمتص ضوء الليزر، وتنتج موجات إلكترونية (پلازمونات سطحية) على سطح الذهب. يحدث هذا فقط عند زاوية محددة وطول موجي للضوء الساقط ويعتمد بشكل كبير على سطح الذهب، بحيث ينتج ارتباط المادة التحليلية المستهدفة بمستقبل على سطح الذهب إشارة قابلة للقياس.
تعمل مستشعرات الرنين السطحية للپلازمون باستخدام شريحة مستشعر تتكون من شريط بلاستيكي يدعم صفيحة زجاجية، أحد جوانبها مغطى بطبقة مجهرية من الذهب. يتصل هذا الجانب بجهاز الكشف البصري للأداة. ثم يتم الاتصال بالجانب الآخر بنظام تدفق موائع جزيئية. ينشئ الاتصال بنظام التدفق قنوات يمكن عبرها تمرير الكواشف في المحلول. يمكن تعديل هذا الجانب من رقاقة المستشعر الزجاجي بعدة طرق، للسماح بسهولة ربط الجزيئات ذات الأهمية. عادة يتم تغطيتها في دكستران كربوكسي ميثيل أو مركب مشابه.
لمؤشر الانكسار في جانب التدفق لسطح الرقاقة تأثير مباشر على سلوك الضوء المنعكس عن الجانب الذهبي. الارتباط بجانب التدفق للرقاقة له تأثير على مؤشر الانكسار وبهذه الطريقة يمكن قياس التفاعلات البيولوجية بدرجة عالية من الحساسية بنوع من الطاقة. يتغير معامل الانكسار للوسط بالقرب من السطح عندما ترتبط الجزيئات الحيوية بالسطح، وتختلف زاوية SPR كدالة لهذا التغيير.
ينعكس الضوء ذو الطول الموجي الثابت عن الجانب الذهبي للرقاقة بزاوية الانعكاس الداخلي الكلي، ويتم اكتشافه داخل الجهاز. تتنوع زاوية الضوء الساقط من أجل مطابقة معدل انتشار الموجة الزائل مع معدل انتشار پولاريتونات الپلازمونات السطحية.[78]هذا ما يدفع الموجة الزائلة إلى اختراق اللوح الزجاجي وبعض المسافة في السائل المتدفق على السطح.
تعتمد المستشعرات الحيوية الضوئية الأخرى بشكل أساسي على التغييرات في الامتصاص أو التألق لمركب مؤشر مناسب ولا تحتاج إلى هندسة انعكاس داخلي كاملة. على سبيل المثال، تم تصنيع نموذج أولي لجهاز يعمل بكامل طاقته للكشف عن الكازين في الحليب. يعتمد الجهاز على اكتشاف التغيرات في امتصاص طبقة الذهب.[79]يمكن أيضاً اعتبار أداة البحث المستخدمة على نطاق واسع، وهي المصفوفة الدقيقة، بمثابة جهاز استشعار حيوي.
المستشعرات الحيوية البيولوجية
غالباً ما تشتمل المستشعرات الحيوية، المعروفة أيضاً باسم المستشعرات الوراثية الضوئية، على شكل معدل وراثياً من بروتين أو إنزيم أصلي. يتم تكوين البروتين لاكتشاف مادة تحليلية معينة وتتم قراءة الإشارة التي تلت ذلك بواسطة أداة كشف مثل مقياس التألق أو مقياس اللمعان. أحد الأمثلة على جهاز استشعار حيوي تم تطويره مؤخراً هو أحد الأمثلة للكشف عن تركيز العصارة الخلوية من المركب التحليلي (الأدينوزين أحادي فوسفات الدوري)، وهو مرسال ثانٍ يشارك في الإشارات الخلوية التي يتم تشغيلها بواسطة الترابطات المتفاعلة مع المستقبلات الموجودة على غشاء الخلية.[80]أُنشئت أنظمة مماثلة لدراسة الاستجابات الخلوية للرابطات الأصلية أو غريب حيوي (السموم أو مثبطات الجزيئات الصغيرة). تستخدم مثل هذه "المقايسات" بشكل شائع في تطوير اكتشاف الأدوية من قبل شركات الأدوية والتكنولوجيا الحيوية. تتطلب معظم فحوصات cAMP في الاستخدام الحالي تحلل الخلايا قبل قياس cAMP. يمكن استخدام مستشعر الخلية الحية لـ cAMP في الخلايا غير المتحللة مع ميزة إضافية للقراءات المتعددة لدراسة حركية استجابة المستقبلات.
تستخدم مستشعرات النانو مسبار مستقبلات حيوية معطلة تكون انتقائية لجزيئات التحليل المستهدفة. المواد النانوية عبارة عن مستشعرات كيميائية وبيولوجية حساسة بشكل رائع. تظهر المواد النانوية خصائص فريدة. يمكن أن تحقق مساحة سطحها الكبيرة إلى نسبة الحجم تفاعلات سريعة ومنخفضة التكلفة، باستخدام مجموعة متنوعة من التصميمات.[81]
تم تسويق المستشعرات الحيوية للموجة الزائلة الأخرى باستخدام أدلة الموجة حيث يتم تغيير ثابت الانتشار من خلال الدليل الموجي عن طريق امتصاص الجزيئات إلى سطح الدليل الموجي. أحد الأمثلة، يستخدم قياس التداخل ثنائي الاستقطاب دليل موجي مدفون كمرجع يُقاس على أساسه التغيير في ثابت الانتشار. التكوينات الأخرى مثل ماخ–زندر أذرع مرجعية محددة بالطباعة الحجرية على الركيزة. يمكن تحقيق مستويات أعلى من التكامل باستخدام هندسة الرنان حيث يتغير تردد الرنين للرنان الحلقي عند امتصاص الجزيئات.[82][83]
الأجهزة الإلكترونية الأنفية
في الآونة الأخيرة، تم تطبيق مصفوفات من العديد من جزيئات الكاشف المختلفة فيما يسمى بأجهزة الأنف الإلكتروني، حيث يتم استخدام نمط الاستجابة من أجهزة الكشف لبصمة مادة ما.[84] في كاشف الرائحة للدبابير المدربة، يكون العنصر الميكانيكي عبارة عن كاميرا فيديو والعنصر البيولوجي عبارة عن خمسة دبابير طفيلية تم تكييفها للاستجابة لوجود مادة كيميائية معينة.[85]ومع ذلك، لا تستخدم الأنوف الإلكترونية التجارية الحالية عناصر بيولوجية.
مستشعرات الحمض النووي
يمكن أن يكون الحمض النووي محللاً لمستشعر حيوي، يتم اكتشافه من خلال وسائل محددة، ولكن يمكن استخدامه أيضاً كجزء من مستشعر حيوي أو، من الناحية النظرية، حتى كمستشعر حيوي كامل.
توجد العديد من التقنيات للكشف عن الحمض النووي، والذي عادة ما يكون وسيلة للكشف عن الكائنات الحية التي لديها هذا الحمض النووي المعين. يمكن أيضاً استخدام تسلسل الحمض النووي كما هو موضح أعلاه. ولكن توجد مناهج أكثر تطلعية، حيث يمكن تصنيع الحمض النووي ليحمل الإنزيمات في مادة هلامية بيولوجية وثابتة.[86] التطبيقات الأخرى هي تصميم الأبتاميرات، تسلسل الحمض النووي الذي له شكل محدد لربط الجزيء المطلوب. تستخدم العمليات الأكثر ابتكاراً طي الحمض النووي نانوياً لهذا الغرض، مما يؤدي إلى إنشاء تسلسلات تطوي في بنية يمكن التنبؤ بها تكون مفيدة في الكشف.[87][88]
قام العلماء ببناء نماذج أولية لأجهزة الاستشعار لاكتشاف الحمض النووي للحيوانات من امتصاص الهواء، "eDNA المحمولة جواً".[89]
"Nanoantennas" مصنوع من DNA - نوع جديد من مقياس النانو الهوائي البصري –يمكن ربطها بـ پروتين وإنتاج إشارة عبر فلورة عندما تؤدي هذه الوظائف وظائفها البيولوجية، ولا سيما من أجل التغيير التوافقي المتميز.[90][91]
مستشعر حيوي قائم على الگرافين
الگرافين مادة ثنائية الأبعاد قائمة على الكربون تتمتع بخصائص بصرية وكهربائية وميكانيكية وحرارية وميكانيكية فائقة. أثبتت القدرة على امتصاص وتثبيت مجموعة متنوعة من البروتينات، خاصةً بعضها مع هياكل حلقة الكربون، أن الگرافين مرشح ممتاز كمحول طاقة مستشعر حيوي. نتيجة لذلك، تم استكشاف وتطوير أجهزة الاستشعار الحيوية المختلفة القائمة على الگرافين في الآونة الأخيرة.[14] [92]
انظر أيضاً
- Bioactive paper
- إلكترونيات حيوية
- تفاعل حيوي
- واصمة حيوية
- DNA field-effect transistor
- قياس التداخل ثنائي الاستقطاب
- Electro-switchable biosurfaces
- تألق كهروكيميائي
- Impedance microbiology
- Lanthanide probes
- Magnotech
- Microphysiometry
- Multi-parametric surface plasmon resonance
- تقانة نانوية حيوية
- Optogenetic methods to record cellular activity
- پلازمون
- Small molecule sensors
- رنين سطح الپلازمون
- Bio-FET
- ثقب النانو
المراجع
- ^ أ ب Khalilian, Alireza; Khan, Md. Rajibur Rahaman; Kang, Shin-Won (2017). "Highly sensitive and wide-dynamic-range side-polished fiber-optic taste sensor". Sensors and Actuators B. 249: 700–707. doi:10.1016/j.snb.2017.04.088.
- ^ Turner, Anthony; Wilson, George; Kaube, Isao (1987). Biosensors:Fundamentals and Applications. Oxford, UK: Oxford University Press. p. 770. ISBN 978-0198547242.
- ^ Bănică, Florinel-Gabriel (2012). Chemical Sensors and Biosensors:Fundamentals and Applications. Chichester, UK: John Wiley & Sons. p. 576. ISBN 9781118354230.
- ^ Dincer, Can; Bruch, Richard; Costa‐Rama, Estefanía; Fernández‐Abedul, Maria Teresa; Merkoçi, Arben; Manz, Andreas; Urban, Gerald Anton; Güder, Firat (2019-05-15). "Disposable Sensors in Diagnostics, Food, and Environmental Monitoring". Advanced Materials. 31 (30): 1806739. doi:10.1002/adma.201806739. hdl:10044/1/69878. ISSN 0935-9648. PMID 31094032.
- ^ Cavalcanti A, Shirinzadeh B, Zhang M, Kretly LC (2008). "Nanorobot Hardware Architecture for Medical Defense" (PDF). Sensors. 8 (5): 2932–2958. Bibcode:2008Senso...8.2932C. doi:10.3390/s8052932. PMC 3675524. PMID 27879858.
- ^ Kaur, Harmanjit; Shorie, Munish (2019). "Nanomaterial based aptasensors for clinical and environmental diagnostic applications". Nanoscale Advances. 1 (6): 2123–2138. Bibcode:2019NanoA...1.2123K. doi:10.1039/C9NA00153K.
- ^ A. Hierlemann, O. Brand, C. Hagleitner, H. Baltes, "Microfabrication techniques for chemical/biosensors", Proceedings of the IEEE 91 (6), 2003, 839–863.
- ^ A. Hierlemann, H. Baltes, "CMOS-based chemical microsensors", The Analyst 128 (1), 2003, pp. 15–28.
- ^ "Biosensors Primer". Retrieved 28 January 2013.
- ^ Dincer, Can; Bruch, Richard; Kling, André; Dittrich, Petra S.; Urban, Gerald A. (August 2017). "Multiplexed Point-of-Care Testing – xPOCT". Trends in Biotechnology. 35 (8): 728–742. doi:10.1016/j.tibtech.2017.03.013. PMC 5538621. PMID 28456344.
- ^ Juzgado, A.; Solda, A.; Ostric, A.; Criado, A.; Valenti, G.; Rapino, S.; Conti, G.; Fracasso, G.; Paolucci, F.; Prato, M. (2017). "Highly sensitive electrochemiluminescence detection of a prostate cancer biomarker". J. Mater. Chem. B. 5 (32): 6681–6687. doi:10.1039/c7tb01557g. PMID 32264431.
- ^ Vo-Dinh, T.; Cullum, B. (2000). "Biosensors and biochips: Advances in biological and medical diagnostics". Fresenius' Journal of Analytical Chemistry. 366 (6–7): 540–551. doi:10.1007/s002160051549. PMID 11225766. S2CID 23807719.
- ^ Valenti, G.; Rampazzo, E.; Biavardi, E.; Villani, E.; Fracasso, G.; Marcaccio, M.; Bertani, F.; Ramarli, D.; Dalcanale, E.; Paolucci, F.; Prodi, L. (2015). "An electrochemiluminescencesupramolecular approach to sarcosine detection for early diagnosis of prostate cancer". Faraday Discuss. 185: 299–309. Bibcode:2015FaDi..185..299V. doi:10.1039/c5fd00096c. PMID 26394608.
- ^ أ ب Parizi, Mohammad Salemizadeh; Salemizadehparizi, Fatemeh; Zarasvand, Mahdi Molaei; Abdolhosseini, Saeed; Bahadori-Haghighi, Shahram; Khalilian, Alireza (2022). "High-performance graphene-based biosensor using a metasurface of asymmetric silicon disks". IEEE Sensors Journal. 22 (3): 2037–2044. Bibcode:2022ISenJ..22.2037P. doi:10.1109/JSEN.2021.3134205. S2CID 245069669.
- ^ أ ب Marazuela, M.; Moreno-Bondi, M. (2002). "Fiber-optic biosensors – an overview". Analytical and Bioanalytical Chemistry. 372 (5–6): 664–682. doi:10.1007/s00216-002-1235-9. PMID 11941437. S2CID 36791337.
- ^ Stowell, Sean; Guarner, Jeannette (5 November 2020). "Role of Serology in the Coronavirus Disease 2019 Pandemic". Clinical Infectious Diseases. 71 (8): 1935–1936. doi:10.1093/cid/ciaa510. PMC 7197618. PMID 32357206.
- ^ Crivianu-Gaita, V; Thompson, M (Nov 2016). "Aptamers, antibody scFv, and antibody Fab' fragments: An overview and comparison of three of the most versatile biosensor biorecognition elements". Biosens Bioelectron. 85: 32–45. doi:10.1016/j.bios.2016.04.091. PMID 27155114.
- ^ Skrlec, K; Strukelj, B; Berlec, A (Jul 2015). "Non-immunoglobulin scaffolds: a focus on their targets". Trends Biotechnol. 33 (7): 408–418. doi:10.1016/j.tibtech.2015.03.012. PMID 25931178.
- ^ Jost, C; Plückthun, A (Aug 2014). "Engineered proteins with desired specificity: DARPins, other alternative scaffolds and bispecific IgGs". Curr Opin Struct Biol. 27: 102–112. doi:10.1016/j.sbi.2014.05.011. PMID 25033247.
- ^ Brient-Litzler, E; Plückthun, A; Bedouelle, H (Apr 2010). "Knowledge-based design of reagentless fluorescent biosensors from a designed ankyrin repeat protein" (PDF). Protein Eng Des Sel. 23 (4): 229–241. doi:10.1093/protein/gzp074. PMID 19945965.
- ^ Miranda, FF; Brient-Litzler, E; Zidane, N; Pecorari, F; Bedouelle, Hugues (Jun 2011). "Reagentless fluorescent biosensors from artificial families of antigen binding proteins". Biosens Bioelectron. 26 (10): 4184–4190. doi:10.1016/j.bios.2011.04.030. PMID 21565483.
- ^ J. S. Schultz; S. Mansouri; I. J. Goldstein (1982). "Affinity sensor: A New Technique for Developing Implantable Sensors for Glucose and Other Metabolites". Diabetes Care. 5 (3): 245–253. doi:10.2337/diacare.5.3.245. PMID 6184210. S2CID 20186661.
- ^ J. S. Schultz; G. Sims (1979). "Affinity sensors for individual metabolites". Biotechnol. Bioeng. Symp. 9 (9): 65–71. PMID 94999.
- ^ R. Ballerstadt; J. S. Schultz (2000). "A Fluorescence Affinity Hollow Fiber Sensor for Continuous Transdermal Glucose Monitoring". Anal. Chem. 72 (17): 4185–4192. doi:10.1021/ac000215r. PMID 10994982.
- ^ Kaur, Harmanjit; Shorie, Munish (29 Apr 2019). "Nanomaterial based aptasensors for clinical and environmental diagnostic applications". Nanoscale Advances. 1 (6): 2123–2138. Bibcode:2019NanoA...1.2123K. doi:10.1039/C9NA00153K.
- ^ Sefah, Kwame (2010). "Development of DNA aptamers using Cell-SELEX". Nature Protocols. 5 (6): 1169–1185. doi:10.1038/nprot.2010.66. PMID 20539292. S2CID 4953042.
- ^ Shorie, Munish; Kaur, Harmanjit (20 October 2018). "Microtitre Plate Based Cell-SELEX Method". Bio-Protocol. 8 (20): e3051. doi:10.21769/BioProtoc.3051. PMC 8342047. PMID 34532522.
- ^ Montserrat Pagès, Aida (2021). "DNA-only bioassay for simultaneous detection of proteins and nucleic acids". Analytical and Bioanalytical Chemistry. 413 (20): 4925–4937. doi:10.1007/s00216-021-03458-6. PMC 8238030. PMID 34184101.
- ^ Donzella, V; Crea, F (June 2011). "Optical biosensors to analyze novel biomarkers in oncology". J Biophotonics. 4 (6): 442–52. doi:10.1002/jbio.201000123. PMID 21567973. S2CID 5190250.
- ^ Vollmer, F; Yang, Lang (October 2012). "Label-free detection with high-Q microcavities: a review of biosensing mechanisms for integrated devices". Nanophotonics. 1 (3–4): 267–291. Bibcode:2012Nanop...1..267V. doi:10.1515/nanoph-2012-0021. PMC 4764104. PMID 26918228.
- ^ "Home - GLAM Project - Glass-Laser Multiplexed Biosensor". GLAM Project - Glass-Laser Multiplexed Biosensor.
- ^ Rizzuto, R.; Pinton, P.; Brini, M.; Chiesa, A.; Filippin, L.; Pozzan, T. (1999). "Mitochondria as biosensors of calcium microdomains". Cell Calcium. 26 (5): 193–199. doi:10.1054/ceca.1999.0076. PMID 10643557.
- ^ Bragadin, M.; Manente, S.; Piazza, R.; Scutari, G. (2001). "The Mitochondria as Biosensors for the Monitoring of Detergent Compounds in Solution". Analytical Biochemistry. 292 (2): 305–307. doi:10.1006/abio.2001.5097. hdl:10278/16452. PMID 11355867.
- ^ Védrine, C.; Leclerc, J.-C.; Durrieu, C.; Tran-Minh, C. (2003). "Optical whole-cell biosensor using Chlorella vulgaris designed for monitoring herbicides". Biosensors & Bioelectronics. 18 (4): 457–63. CiteSeerX 10.1.1.1031.5904. doi:10.1016/s0956-5663(02)00157-4. PMID 12604263.
- ^ Dubey, R. S.; Upadhyay, S. N. (2001). "Microbial corrosion monitoring by an amperometric microbial biosensor developed using whole cell of Pseudomonas sp". Biosensors & Bioelectronics. 16 (9–12): 995–1000. doi:10.1016/s0956-5663(01)00203-2. PMID 11679280.
- ^ Campàs, M.; Carpentier, R.; Rouillon, R. (2008). "Plant tissue-and photosynthesis-based biosensors". Biotechnology Advances. 26 (4): 370–378. doi:10.1016/j.biotechadv.2008.04.001. PMID 18495408.
- ^ Petänen, T.; Virta, M.; Karp, M.; Romantschuk, M. (2001). "Construction and use of broad host range mercury and arsenite sensor plasmids in the soil bacterium Pseudomonas fluorescens OS8". Microbial Ecology. 41 (4): 360–368. doi:10.1007/s002480000095. PMID 12032610. S2CID 21147572.
- ^ US Department of Health and Human Services, ed. (September 2004), Guidance for Industry: PAT — A Framework for Innovative Pharmaceutical Development, Manufacturing, and Quality Assurance, http://www.gmp-compliance.org/guidemgr/files/PAT-FDA-6419FNL.PDF
- ^ Pasco, Neil; Glithero, Nick. Lactose at-line biosensor 1st viable industrial biosensor? "Archived copy" (PDF). Archived from the original (PDF) on 8 February 2013. Retrieved 9 February 2016.
{{cite web}}: CS1 maint: archived copy as title (link) (accessed 30 January 2013). - ^ Kling, Jim (2006). "Moving diagnostics from the bench to the bedside". Nat. Biotechnol. 24 (8): 891–893. doi:10.1038/nbt0806-891. PMID 16900120. S2CID 32776079.
- ^ Quesada-González, Daniel; Merkoçi, Arben (2018). "Nanomaterial-based devices for point-of-care diagnostic applications". Chemical Society Reviews. 47 (13): 4697–4709. doi:10.1039/C7CS00837F. ISSN 0306-0012. PMID 29770813.
- ^ Windmiller, Joshua Ray; Wang, Joseph (2013). "Wearable Electrochemical Sensors and Biosensors: A Review". Electroanalysis. 25: 29–46. doi:10.1002/elan.201200349.
- ^ أ ب Birkholz, Mario; Glogener, Paul; Glös, Franziska; Basmer, Thomas; Theuer, Lorenz (2016). "Continuously operating biosensor and its integration into a hermetically sealed medical implant". Micromachines. 7 (10): 183. doi:10.3390/mi7100183. PMC 6190112. PMID 30404356.
- ^ Kotanen, Christian N.; Gabriel Moussy, Francis; Carrara, Sandro; Guiseppi-Elie, Anthony (2012). "Implantable enzyme amperometric biosensors". Biosensors and Bioelectronics. 35 (1): 14–26. doi:10.1016/j.bios.2012.03.016. PMID 22516142.
- ^ Gough, David A.; Kumosa, Lucas S.; Routh, Timothy L.; Lin, Joe T.; Lucisano, Joseph Y. (2010). "Function of an Implanted Tissue Glucose Sensor for More than 1 Year in Animals". Sci. Transl. Med. 2 (42): 42ra53. doi:10.1126/scitranslmed.3001148. PMC 4528300. PMID 20668297.
- ^ Mortellaro, Mark; DeHennis, Andrew (2014). "Performance characterization of an abiotic and fluorescent-based continuous glucose monitoring system in patients with type 1 diabetes". Biosens. Bioelectron. 61: 227–231. doi:10.1016/j.bios.2014.05.022. PMID 24906080.
- ^ Quesada-González, Daniel; Merkoçi, Arben (2016). "Mobile phone-based biosensing: An emerging "diagnostic and communication" technology". Biosensors & Bioelectronics. 92: 549–562. doi:10.1016/j.bios.2016.10.062. PMID 27836593.
- ^ Saharudin Haron Archived 5 مارس 2016 at the Wayback Machine and Asim K. Ray (2006) Optical biodetection of cadmium and lead ions in water. Medical Engineering and Physics, 28 (10). pp. 978–981.
- ^ أ ب "MolluSCAN eye". MolluSCAN eye. CNRS & Université de Bordeaux. Archived from the original on 13 November 2016. Retrieved 24 June 2015.
- ^ Lambrianou, Andreas; Demin, Soren; Hall, Elizabeth A. H (2008). Protein Engineering and Electrochemical Biosensors. Advances in Biochemical Engineering/Biotechnology. Vol. 109. pp. 65–96. doi:10.1007/10_2007_080. ISBN 978-3-540-75200-4. PMID 17960341.
- ^ Ghoshdastider U, Wu R, Trzaskowski B, Mlynarczyk K, Miszta P, Gurusaran M, Viswanathan S, Renugopalakrishnan V, Filipek S (2015). "Nano-Encapsulation of Glucose Oxidase Dimer by Graphene". RSC Advances. 5 (18): 13570–78. doi:10.1039/C4RA16852F.
- ^ Daaboul, G.G.; et al. (2010). "LED-based Interferometric Reflectance Imaging Sensor for quantitative dynamic monitoring of biomolecular interactions". Biosens. Bioelectron. 26 (5): 2221–2227. doi:10.1016/j.bios.2010.09.038. PMID 20980139.
- ^ Ahn, S.; Freedman, D. S.; Massari, P.; Cabodi, M.; Ünlü, M. S. (2013). "A Mass-Tagging Approach for Enhanced Sensitivity of Dynamic Cytokine Detection Using a Label-Free Biosensor". Langmuir. 29 (17): 5369–5376. doi:10.1021/la400982h. PMID 23547938.
- ^ Reddington, A.; Trueb, J. T.; Freedman, D. S.; Tuysuzoglu, A.; Daaboul, G. G.; Lopez, C. A.; Karl, W. C.; Connor, J. H.; Fawcett, H. E.; Ünlü, M. S. (2013). "An Interferometric Reflectance Imaging Sensor for Point of Care Viral Diagnostics". IEEE Transactions on Biomedical Engineering. 60 (12): 3276–3283. doi:10.1109/tbme.2013.2272666. PMC 4041624. PMID 24271115.
- ^ أ ب Monroe, M. R.; Reddington, A.; Collins, A. D.; Laboda, C. D.; Cretich, M.; Chiari, M.; Little, F. F.; Ünlü, M. S. (2011). "Multiplexed method to calibrate and quantitate fluorescence signal for allergen-specific IgE". Analytical Chemistry. 83 (24): 9485–9491. doi:10.1021/ac202212k. PMC 3395232. PMID 22060132.
- ^ Yurt, A.; Daaboul, G. G.; Connor, J. H.; Goldberg, B. B.; Ünlü, M. S. (2012). "Single nanoparticle detectors for biological applications". Nanoscale. 4 (3): 715–726. Bibcode:2012Nanos...4..715Y. doi:10.1039/c2nr11562j. PMC 3759154. PMID 22214976.
- ^ C. A. Lopez, G. G. Daaboul, R. S. Vedula, E. Ozkumur, D. A. Bergstein, T. W. Geisbert, H. Fawcett, B. B. Goldberg, J. H. Connor, and M. S. Ünlü, "Label-free multiplexed virus detection using spectral reflectance imaging," Biosensors and Bioelectronics, 2011
- ^ Monroe, M. R.; Daaboul, G. G.; Tuysuzoglu, A.; Lopez, C. A.; Little, F. F.; Ünlü, M. S. (2013). "Single Nanoparticle Detection for Multiplexed Protein Diagnostics with Attomolar Sensitivity in Serum and Unprocessed Whole Blood". Analytical Chemistry. 85 (7): 3698–3706. doi:10.1021/ac4000514. PMC 3690328. PMID 23469929.
- ^ Daaboul, G. G.; Yurt, A.; Zhang, X.; Hwang, G. M.; Goldberg, B. B.; Ünlü, M. S. (2010). "High-Throughput Detection and Sizing of Individual Low-Index Nanoparticles and Viruses for Pathogen Identification". Nano Letters. 10 (11): 4727–4731. Bibcode:2010NanoL..10.4727D. doi:10.1021/nl103210p. PMID 20964282.
- ^ Svigelj, Rossella; Zuliani, Ivan; Grazioli, Cristian; Dossi, Nicolò; Toniolo, Rosanna (17 March 2022). "An Effective Label-Free Electrochemical Aptasensor Based on Gold Nanoparticles for Gluten Detection". Nanomaterials. 12 (6): 987. doi:10.3390/nano12060987. PMC 8953296. PMID 35335800.
- ^ Svigelj, Rossella; Dossi, Nicolo; Pizzolato, Stefania; Toniolo, Rosanna; Miranda-Castro, Rebeca; de-los-Santos-Álvarez, Noemí; Lobo-Castañón, María Jesús (1 October 2020). "Truncated aptamers as selective receptors in a gluten sensor supporting direct measurement in a deep eutectic solvent". Biosensors and Bioelectronics (in الإنجليزية). 165: 112339. doi:10.1016/j.bios.2020.112339. hdl:10651/57640. ISSN 0956-5663. PMID 32729482. S2CID 219902328.
- ^ Svigelj, Rossella; Dossi, Nicolò; Grazioli, Cristian; Toniolo, Rosanna (6 October 2021). "Paper-based aptamer-antibody biosensor for gluten detection in a deep eutectic solvent (DES)". Analytical and Bioanalytical Chemistry (in الإنجليزية). 414 (11): 3341–3348. doi:10.1007/s00216-021-03653-5. ISSN 1618-2650. PMC 8494473. PMID 34617152.
- ^ Justino, Celine I. L.; Duarte, Armando C.; Rocha-Santos, Teresa A. P. (December 2017). "Recent Progress in Biosensors for Environmental Monitoring: A Review". Sensors (Basel, Switzerland) (in الإنجليزية). 17 (12): 2918. Bibcode:2017Senso..17.2918J. doi:10.3390/s17122918. PMC 5750672. PMID 29244756.
- ^ أ ب Alhadrami, Hani A. (2018). "Biosensors: Classifications, medical applications, and future prospective". Biotechnology and Applied Biochemistry (in الإنجليزية). 65 (3): 497–508. doi:10.1002/bab.1621. ISSN 1470-8744. PMID 29023994. S2CID 27115648.
- ^ "DNA computer could tell you if your drinking water is contaminated". New Scientist. Retrieved 16 March 2022.
- ^ Jung, Jaeyoung K.; Archuleta, Chloé M.; Alam, Khalid K.; Lucks, Julius B. (17 February 2022). "Programming cell-free biosensors with DNA strand displacement circuits". Nature Chemical Biology (in الإنجليزية). 18 (4): 385–393. doi:10.1038/s41589-021-00962-9. ISSN 1552-4469. PMC 8964419. PMID 35177837.
- ^ J. G. Black,"Principles and explorations", edition 5th.
- ^ Hanahan, Douglas; Weinberg, Robert A. (2011). "Hallmarks of Cancer: The Next Generation". Cell. 144 (5): 646–74. doi:10.1016/j.cell.2011.02.013. PMID 21376230.
- ^ أ ب Atay, Seda; Pişkin, Kevser; Yılmaz, Fatma; Çakır, Canan; Yavuz, Handan; Denizli, Adil (2016). "Quartz Crystal Microbalance Based Biosensors for Detecting Highly Metastatic Breast Cancer Cells via Their Transferrin Receptors". Anal. Methods. 8 (1): 153–61. doi:10.1039/c5ay02898a.
- ^ Nordqvist, Christian. "Breast Cancer Cancer / Oncology Women's Health / Gynecology Breast Cancer: Causes, Symptoms and Treatments." Medical News Today. N.p., 5 May 2016. Web.
- ^ Khanmohammadi, Akbar; Aghaie, Ali; Vahedi, Ensieh; Qazvini, Ali; Ghanei, Mostafa; Afkhami, Abbas; Hajian, Ali; Bagheri, Hasan (2020). "Electrochemical biosensors for the detection of lung cancer biomarkers: A review". Talanta. 206: 120251. doi:10.1016/j.talanta.2019.120251. PMID 31514848.
- ^ "Face masks that can diagnose COVID-19". medicalxpress.com (in الإنجليزية). Retrieved 11 July 2021.
- ^ Nguyen, Peter Q.; Soenksen, Luis R.; Donghia, Nina M.; Angenent-Mari, Nicolaas M.; de Puig, Helena; Huang, Ally; Lee, Rose; Slomovic, Shimyn; Galbersanini, Tommaso; Lansberry, Geoffrey; Sallum, Hani M.; Zhao, Evan M.; Niemi, James B.; Collins, James J. (28 June 2021). "Wearable materials with embedded synthetic biology sensors for biomolecule detection". Nature Biotechnology (in الإنجليزية). 39 (11): 1366–1374. doi:10.1038/s41587-021-00950-3. ISSN 1546-1696. PMID 34183860. S2CID 235673261.
- ^ Fuller, Carl W.; Padayatti, Pius S.; Abderrahim, Hadi; Adamiak, Lisa; Alagar, Nolan; Ananthapadmanabhan, Nagaraj; Baek, Jihye; Chinni, Sarat; Choi, Chulmin; Delaney, Kevin J.; Dubielzig, Rich; Frkanec, Julie; Garcia, Chris; Gardner, Calvin; Gebhardt, Daniel; Geiser, Tim; Gutierrez, Zachariah; Hall, Drew A.; Hodges, Andrew P.; Hou, Guangyuan; Jain, Sonal; Jones, Teresa; Lobaton, Raymond; Majzik, Zsolt; Marte, Allen; Mohan, Prateek; Mola, Paul; Mudondo, Paul; Mullinix, James; Nguyen, Thuan; Ollinger, Frederick; Orr, Sarah; Ouyang, Yuxuan; Pan, Paul; Park, Namseok; Porras, David; Prabhu, Keshav; Reese, Cassandra; Ruel, Travers; Sauerbrey, Trevor; Sawyer, Jaymie R.; Sinha, Prem; Tu, Jacky; Venkatesh, A. G.; VijayKumar, Sushmitha; Zheng, Le; Jin, Sungho; Tour, James M.; Church, George M.; Mola, Paul W.; Merriman, Barry (1 February 2022). "Molecular electronics sensors on a scalable semiconductor chip: A platform for single-molecule measurement of binding kinetics and enzyme activity". Proceedings of the National Academy of Sciences (in الإنجليزية). 119 (5). Bibcode:2022PNAS..11912812F. doi:10.1073/pnas.2112812119. ISSN 0027-8424. PMC 8812571. PMID 35074874.
- ^ Yu, You; Li, Jiahong; Solomon, Samuel A.; Min, Jihong; Tu, Jiaobing; Guo, Wei; Xu, Changhao; Song, Yu; Gao, Wei (June 1, 2022). "All-printed soft human-machine interface for robotic physicochemical sensing". Science Robotics (in الإنجليزية). 7 (67): eabn0495. doi:10.1126/scirobotics.abn0495. ISSN 2470-9476. PMC 9302713. PMID 35648844.
{{cite journal}}: CS1 maint: PMC embargo expired (link) - ^ S.Zeng; Baillargeat, Dominique; Ho, Ho-Pui; Yong, Ken-Tye; et al. (2014). "Nanomaterials enhanced surface plasmon resonance for biological and chemical sensing applications" (PDF). Chemical Society Reviews. 43 (10): 3426–3452. doi:10.1039/C3CS60479A. hdl:10356/102043. PMID 24549396. Archived from the original (PDF) on 6 January 2016. Retrieved 14 September 2015.
- ^ Krupin, O.; Wang, C.; Berini, P. (2016). "Optical plasmonic biosensor for leukemia detection". SPIE Newsroom (22 January 2016). doi:10.1117/2.1201512.006268.
- ^ Homola J (2003). "Present and future of surface plasmon resonance biosensors". Anal. Bioanal. Chem. 377 (3): 528–539. doi:10.1007/s00216-003-2101-0. PMID 12879189. S2CID 14370505.
- ^ Hiep, H. M.; et al. (2007). "A localized surface plasmon resonance based immunosensor for the detection of casein in milk". Sci. Technol. Adv. Mater. 8 (4): 331–338. Bibcode:2007STAdM...8..331M. doi:10.1016/j.stam.2006.12.010.
- ^ Fan, F.; et al. (2008). "Novel Genetically Encoded Biosensors Using Firefly Luciferase". ACS Chem. Biol. 3 (6): 346–51. doi:10.1021/cb8000414. PMID 18570354.
- ^ Urban, Gerald A (2009). "Micro- and nanobiosensors—state of the art and trends". Meas. Sci. Technol. 20 (1): 012001. Bibcode:2009MeScT..20a2001U. doi:10.1088/0957-0233/20/1/012001. S2CID 116936804.
- ^ Iqbal, M.; Gleeson, M. A.; Spaugh, B.; Tybor, F.; Gunn, W. G.; Hochberg, M.; Baehr-Jones, T.; Bailey, R. C.; Gunn, L. C. (2010). "Label-Free Biosensor Arrays Based on Silicon Ring Resonators and High-Speed Optical Scanning Instrumentation". IEEE Journal of Selected Topics in Quantum Electronics. 16 (3): 654–661. Bibcode:2010IJSTQ..16..654I. doi:10.1109/jstqe.2009.2032510. S2CID 41944216.
- ^ J. Witzens; M. Hochberg (2011). "Optical detection of target molecule induced aggregation of nanoparticles by means of high-Q resonators". Opt. Express. 19 (8): 7034–7061. Bibcode:2011OExpr..19.7034W. doi:10.1364/oe.19.007034. PMID 21503017.
- ^ "UCSB sensor sniffs explosives through microfluidics, might replace Rover at the airport (video)". Microfluidic Solutions. 8 December 2012. Archived from the original on 4 July 2014.
- ^ "Wasp Hound". Science Central. Archived from the original on 16 July 2011. Retrieved 23 February 2011.
- ^ Huang, Yishun; Xu, Wanlin; Liu, Guoyuan; Tian, Leilei (2017). "A pure DNA hydrogel with stable catalytic ability produced by one-step rolling circle amplification". Chemical Communications (in الإنجليزية). 53 (21): 3038–3041. doi:10.1039/C7CC00636E. ISSN 1359-7345. PMID 28239729.
- ^ Tinnefeld, Philip; Acuna, Guillermo P.; Wei, Qingshan; Ozcan, Aydogan; Ozcan, Aydogan; Ozcan, Aydogan; Vietz, Carolin; Lalkens, Birka; Trofymchuk, Kateryna; Close, Cindy M.; Inan, Hakan (2019-04-15). "DNA origami nanotools for single-molecule biosensing and superresolution microscopy". Biophotonics Congress: Optics in the Life Sciences Congress 2019 (BODA,BRAIN,NTM,OMA,OMP) (2019), Paper AW5E.5 (in الإنجليزية). Optical Society of America: AW5E.5. doi:10.1364/OMA.2019.AW5E.5. ISBN 978-1-943580-54-5. S2CID 210753045.
- ^ Selnihhin, Denis; Sparvath, Steffen Møller; Preus, Søren; Birkedal, Victoria; Andersen, Ebbe Sloth (26 June 2018). "Multifluorophore DNA Origami Beacon as a Biosensing Platform". ACS Nano. 12 (6): 5699–5708. doi:10.1021/acsnano.8b01510. ISSN 1936-086X. PMID 29763544.
- ^ "Scientists vacuumed animal DNA out of thin air for the first time". Science News. 18 January 2022. Retrieved 29 January 2022.
- ^ "Chemists use DNA to build the world's tiniest antenna". University of Montreal (in الإنجليزية). Retrieved 19 January 2022.
- ^ Harroun, Scott G.; Lauzon, Dominic; Ebert, Maximilian C. C. J. C.; Desrosiers, Arnaud; Wang, Xiaomeng; Vallée-Bélisle, Alexis (January 2022). "Monitoring protein conformational changes using fluorescent nanoantennas". Nature Methods (in الإنجليزية). 19 (1): 71–80. doi:10.1038/s41592-021-01355-5. ISSN 1548-7105. PMID 34969985. S2CID 245593311.
- ^ Khayamian, Mohammad Ali; Parizi, Mohammad Salemizadeh; Ghaderinia, Mohammadreza; Abadijoo, Hamed; Vanaei, Shohreh; Simaee, Hossein; Abdolhosseini, Saeed; Shalileh, Shahriar; Faramarzpour, Mahsa; Naeini, Vahid Fadaei; Hoseinpour, Parisa; Shojaeian, Fatemeh; Abbasvandi, Fereshteh; Abdolahad, Mohammad (2021). "A label-free graphene-based impedimetric biosensor for real-time tracing of the cytokine storm in blood serum; suitable for screening COVID-19 patients". RSC Advances. 11 (55): 34503–34515. Bibcode:2021RSCAd..1134503K. doi:10.1039/D1RA04298J. PMC 9042719. PMID 35494759.
فهرس
- Frieder Scheller & Florian Schubert (1989). Biosensoren. Akademie-Verlag, Berlin. ISBN 978-3-05-500659-3.
- Massimo Grattarola & Giuseppe Massobrio (1998). Bioelectronics Handbook - MOSFETs, Biosensors and Neurons. McGraw-Hill, New York. ISBN 978-0070031746.
وصلات خارجية
- Scratching at the surface of biosensors – an Instant Insight discussing how surface chemistry lets porous silicon biosensors fulfil their promise from the Royal Society of Chemistry