پرمنگنات الپوتاسيوم
پرمنگنات الپوتاسيوم أو برمنجنات البوتاسيوم هو مركب كيميائي صيغته الكيميائية KMnO4
وفى هذا الملح يكون المنجنيز في حاله الأكسدة +7 وهو يسمى أيضا برمنجنات ملح القلي.
|
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
Potassium manganate(VII)
| |||
| أسماء أخرى
پرمنگنات الپوتاسيوم
منگنات الپوتاسيوم السباعية معدن الحرباء بلورات كوندي پرمنگنات البوتاش | |||
| Identifiers | |||
| رقم CAS | |||
| ECHA InfoCard | 100.028.874 | ||
| رقم EC |
| ||
| KEGG | |||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UN number | 1490 | ||
CompTox Dashboard (EPA)
|
|||
| الخصائص | |||
| الصيغة الجزيئية | KMnO4 | ||
| كتلة مولية | 158.034 g/mol | ||
| المظهر | إبر قرمزية-برونزية-رمادية ماجنتا–وردية في المحلول | ||
| الرائحة | عديم الرائحة | ||
| الكثافة | 2.703 g/cm3 | ||
| نقطة الانصهار | |||
| قابلية الذوبان في الماء | 6.38 g/100 ml (20 °C) 25 g/100 mL (65 °C) | ||
| قابلية الذوبان | ينحل في الكحول و المذيبات العضوية | ||
| البنية | |||
| البنية البلورية | Orthorhombic | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
−813.4 kJ/mol | ||
| Standard molar entropy S |
171.7 J K−1 mol−1 | ||
| المخاطر | |||
تبويب الاتحاد الاوروپي (DSD)
|
مؤكسد (O) ضار (Xn) خطر على البيئة (N) | ||
| توصيف المخاطر | R8, R22, R50/53 | ||
| تحذيرات وقائية | (S2), S60, S61 | ||
| NFPA 704 (معيـَّن النار) | |||
| مركبات ذا علاقة | |||
أنيونات أخرى
|
منگنيت الپوتاسيوم منگنات الپوتاسيوم | ||
كاتيونات أخرى
|
پرمنگنات الصوديوم پرمنگنات الأمونيوم | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
يعتبر أيون البرمنجنات عامل مؤكسد قوي وهو له القدرة على الذوبان في الماء ليعطى محلول ذو لون قرمزي غامق. وتبخيره يعطى بلورات سوداء ناعمة
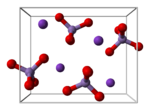
بلورات پرمنگنات البوتاسيوم لها بنية بلورية من النمط orthorhombic (معينة من النمط أورثو).
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخواص
الخواص العامة
- بلورات پرمنگنات الپوتاسيوم لها بنية بلورية من النمط المعيني المستقيم، وتكون ثوابت الشبكة البلورية كالتالي: a = 910.5 pm و b = 572.0 pm و c = 742.5 pm ، في حين أن طول الرابطة Mn-O تبلغ 162.9 بيكومتر.
- ينحل فوق منغنات البوتاسيوم بشكل جيد في الماء، وتكون محاليله ذات لون لون قرمزي غامق. يستخدم حمض الأكساليك من أجل تقييس تلك المحاليل وذلك في الكيمياء التحليلية. [1]
- عند تسخين بلورات فوق منغنات البوتاسيوم إلى درجات حرارة تصل إلى 240°س يتفكك المركب إلى كل من منغنات البوتاسيوم وأكسيد المنغنيز الرباعي (ثنائي أكسيد المنغنيز) وأكسيد البوتاسيوم، ويطلق غاز الأكسجين [2] حسب المعادلة التالية:
10KMnO4 –Δ→ 3K2MnO4 + 7MnO2 + 2K2O + 6O2
ويؤدي التسخين إلى درجات حرارة أعلى إلى تفكك المنغنات أيضاً:
2K2MnO4 –Δ→ 2MnO2 + K2O + O2
الخواص المؤكسدة
يتميز پرمنگنات الپوتاسيوم بخواصه المؤكسدة القوية، وذلك لأن المنغنيز يكون بأعلى حالة أكسدة له. لذلك فإن أغلب تفاعلاته الكيميائية مع المركبات المختلفة تتأثر بتلك الخاصية، وذلك عند التفاعل مع كل من:
الأحماض
يتأكسد حمض هيدروكلوريك ليعطي غاز الكلور، وبشكل مشابه يتفاعل پرمنگنات الپوتاسيوم مع حمض الكبريتيك المركز بتفاعل أكسدة ليعطي أكسيد المنغنيز السباعي (سباعي أكسيد المنغنيز) Mn2O7، ويمكن أن يكون هذا التفاعل انفجارياً. [3] يمكن لتفاعل فوق المنغنات مع حمض الكبريتيك أن يعطي غاز الأوزون حسب المعادلة:
- 6 KMnO4 (aq) + 9 H2SO4 (aq) → 6 MnSO4 (aq) + 3 K2SO4 (aq) + 9 H2O (l) + 5 O3 (g)
إلا أنه يجب أخذ الحيطة والحذر عند إجرائه. [4][5]
المركبات اللاعضوية
يؤكسد پرمنگنات الپوتاسيوم أيونات الحديد الثنائي إلى الثلاثي، كما يؤكسد أيونات الكبريتيت إلى أيونات الكبريتات، ويكون مخطط الأكسدة-اختزال للمثال الأخير كالتالي:
المركبات العضوية
بالنسبة للمركبات العضوية فإن فوق منغنات البوتاسيوم يؤكسد الرابطة المضاعفة في الألكينات ليعطي الحمض الكربوكسيلي الموافق. [6]
- CH3(CH2)17CH=CH2 + [O] → CH3(CH2)17COOH
كما يؤكسد الألدهيدات أيضاً إلى الأحماض الكربوكسيلية الموافقة، فعلى سبيل المثال فهو يؤكسد الهيبتانال إلى حمض الهيبتانويك. [7]
- C6H13CHO + [O] → C6H13COOH
كما أنه يؤكسد التولوين إلى حمض البنزويك [8]
التحضير
يحضر مركب پرمنگنات الپوتاسيوم من أكسيد المنغنيز الرباعي (ثنائي أكسيد المنغنيز) MnO2 والذي يتفاعل مع هيدروكسيد البوتاسيوم بوجود أكسجين الهواء ليعطي مركب منغنات البوتاسيوم K2MnO4، والذي يؤكسد إلى فوق منغنات كهربائياً (أكسدة مصعدية).
أما مخبرياً فيمكن تحضير المركب بأكسدة ثنائي أكسيد المنغنيز باستعمال مركب كلورات البوتاسيوم في وسط قلوي ومن ثم بتمرير غاز ثنائي أكسيد الكربون في المحلول.
الاستخدامات
التعقيم ومعالجة المياه
استخدم مركب پرمنگنات الپوتاسيوم في السابق من أجل معالجة مياه الشرب مياه المسابح والخزانات. [9] كما يمكن أن تستخدم محاليله المائية من أجل معالجة حالات متوسطة من مرض الفاقوع pompholyx، والتهاب الجلد Dermatitis (طفح). [10][11] وفي حالات إصابة الأطراف بالفطريات. [12]
وتستخدم في علاج ماء المسابح والخزانات.
استخدامات طبية حيوية
- استعملت محاليل البرمنغنات فيما مضى من أجل علاج مرض السيلان، ويستعمل للآن من أجل علاج مرض داء المبيضات. [13]
- يؤدي حضن أنسجة مثبتة بپرمنگنات الپوتاسيوم إلى منع أميلويد amyloid AA من تلطيخ صباغ أحمر الكونغو، في حين أن الأنواع الأخرى من الأميلويد لا تتأثر بذلك. [14][15]
الاصطناع العضوي
يستعمل پرمنگنات الپوتاسيوم من أجل الاصطناع العضوي للعديد من المركبات العضوية. فعلى سبيل المثال تستهلك كميات كبيرة منه لتحضير حمض الأسكوربيك وكلورامفينيكول والسكارين وحمض إيزو النيكوتينيك وحمض البيرازينويك. [16]
الهامش
- ^ Kovacs KA, Grof P, Burai L, Riedel M (2004). "Revising the Mechanism of the Permanganate/Oxalate Reaction". J. Phys. Chem. A. 108: 11026. doi:10.1021/jp047061u.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Römpp CD 2006, Georg Thieme Verlag 2006
- ^ F. A. Cotton, G. Wilkinson, C. A. Murillo, and M. Bochmann (April 1999). Advanced Inorganic Chemistry, 6th Edition. Wiley-VCH. ISBN 0-471-19957-5
- ^ Barthel, H. and Duvinage, B. (2000). "Clemens Winkler. His Experiments with Ozone in 1892". Praxis der Naturwissenschaften, Chemie. 49: 18ff.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Dzhabiev, T. S.; Denisov, N. N.; Moiseev, D. N. and Shilov, A. E. (2005). "Formation of Ozone During the Reduction of Potassium Permanganate in Sulfuric Acid Solutions". Russian Journal of Physical Chemistry. 79: 1755–1760.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ قالب:OrgSynth
- ^ قالب:OrgSynth
- ^ Gardner KA, Mayer JM (1995). "Understanding C-H Bond Oxidations: H· and H- Transfer in the Oxidation of Toluene by
Permanganate". Science. 269 (5232): 1849. doi:10.1126/science.7569922. PMID 7569922.
{{cite journal}}: line feed character in|title=at position 85 (help) - ^ Assembly of Life Sciences (U.S.). Safe Drinking Water Committee. Drinking water and health, Volume 2. p. 98. ISBN 9780309029315.
- ^ BIRT AR (1964). "Drugs for eczema of children". Can Med Assoc J. 90 (11): 693–4. PMC 1922428. PMID 14127384.
{{cite journal}}: Unknown parameter|month=ignored (help) - ^ Stalder JF, Fleury M, Sourisse M; et al. (1992). "Comparative effects of two topical antiseptics (chlorhexidine vs KMn04) on bacterial skin flora in atopic dermatitis". Acta Derm Venereol Suppl (Stockh). 176: 132–4. PMID 1476027.
{{cite journal}}: Explicit use of et al. in:|author=(help)CS1 maint: multiple names: authors list (link) - ^ Program for Appropriate Technology in Health PATH (1988). "Skin diseases". Health Technol Dir. 8 (3): 1–10. PMID 12282068.
- ^ Haseltine, Florence (1976). "Private Medicine". Woman Doctor: the Internship of a Modern Woman (Book Club ed.). Houghton Mifflin. p. 32.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ^ Wright, J. R.; Calkins E.; Humphrey R. L. (1977). "Potassium permanganate reaction in amyloidosis. A histologic method to assist in differentiating forms of this disease". Lab Invest. 36 (3): 274–81. PMID 839739.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ van Rijswijk, M. H.; van Heusden, C. W. (1979). "The potassium permanganate method. A reliable method for differentiating amyloid AA from other forms of amyloid in routine laboratory practice". Am J Pathol. 97 (1): 43–58. PMC 2042379. PMID 495695.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Arno H. Reidies "Manganese Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a16_123