نترات الفضة
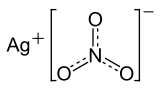
نترات الفِضّة Silver nitrate مادة كيميائية، تُستخدم في الطب والصناعة. والصيغة الكيميائيـــة، لنترات الفضــة، هــي AgNO3، وهي تذوب بسهولة في الماء، وتحرق الجلد، ويمكن أن تسبب تسمما خطيراً، وقد تسبب الموت في حالة الابتلاع.
 | |

| |
 | |
| الأسماء | |
|---|---|
| اسم أيوپاك
Silver nitrate
| |
| اسم أيوپاك النظامي
Silver(I) nitrate | |
| أسماء أخرى
Nitric acid silver(1+) salt
Lapis infernalis Argentous nitrate | |
| Identifiers | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.028.958 |
| رقم EC |
|
PubChem CID
|
|
| رقم RTECS |
|
| UNII | |
| UN number | 1493 |
CompTox Dashboard (EPA)
|
|
| InChI | InChI={{{value}}} |
| SMILES | |
| الخصائص | |
| الصيغة الجزيئية | AgNO3 |
| كتلة مولية | 169.86 g mol-1 |
| المظهر | colorless solid |
| الرائحة | Odorless |
| الكثافة | 4.35 g/cm3 (24 °C) 3.97 g/cm3 (210 °C)[1] |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | 122 g/100 mL (0 °C) 170 g/100 mL (10 °C) 256 g/100 mL (25 °C) 373 g/100 mL (40 °C) 912 g/100 mL (100 °C)[2] |
| قابلية الذوبان | Soluble in acetone,[1] ammonia, ether, glycerol |
| قابلية الذوبان في acetic acid | 0.776 g/kg (30 °C) 1.244 g/kg (40 °C) 5.503 g/kg (93 °C)[3] |
| قابلية الذوبان في acetone | 0.35 g/100 g (14 °C) 0.44 g/100 g (18 °C)[2] |
| قابلية الذوبان في benzene | 0.22 g/kg (35 °C) 0.44 g/kg (40.5 °C)[2] |
| قابلية الذوبان في ethanol | 3.1 g/100 g (19 °C)[2] |
| قابلية الذوبان في ethyl acetate | 2.7 g/100 g (20 °C)[3] |
| log P | 0.19 |
| القابلية المغناطيسية | −45.7·10−6 cm3/mol |
| معامل الانكسار (nD) | 1.744 |
| اللزوجة | 3.77 cP (244 °C) 3.04 cP (275 °C)[3] |
| البنية | |
| البنية البلورية | Orthorhombic, oP56[4] |
| الزمرة الفراغية | P212121, No. 19[4] |
| ثابت العقد | a = 6.992(2) Å, b = 7.335(2) Å, c = 10.125(2) Å[4] |
| ثابت العقد | α = 90°, β = 90°, γ = 90° |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
−124.4 kJ/mol[1] |
| Standard molar entropy S |
140.9 J/mol·K[1] |
| سعة الحرارة النوعية، C | 93.1 J/mol·K[1] |
| المخاطر | |
| خطر رئيسي | Reacts explosively with ethanol. Toxic. Corrosive. |
| ن.م.ع. مخطط تصويري |     [5] [5]
|
| ن.م.ع. كلمة الاشارة | Danger |
| H272, H314, H410[5] | |
| P220, P273, P280, P305+P351+P338, P310, P501[5] | |
| NFPA 704 (معيـَّن النار) | |
| الجرعة أو التركيز القاتل (LD, LC): | |
LDLo (المنشورة الأقل)
|
800 mg/kg (rabbit, oral) 20 mg/kg (dog, oral)[6] |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
ويمكن تنقية الفضة، بإذابتها في حمض النتريك، مع تمرير تيار كهربائي خلال محلول نترات الفضة.وتتكون الفضة النقية، عند الكَاثُود (القطب السالب). كما يستخدم الكيميائيون، نترات الفضة، للمساعدة في إعداد أو تحضير مركبات الفضة الأخرى، ومن ثم تحديد المواد الكيميائية في المحلول.
يقوم أصحاب المصانع، أو المختبرات، بصناعة نترات الفضة، بإذابة الفضة في حمض النتريك، ومن ثم تبخير المحلول. وفي بعض الأحيان يصهرون، نترات الفضة، ويتركونها تتصلب في شكل كتلة متبلرة صافية. وتعرف نترات الفضة، في هذا الشكل أيضًا، بالكاوية الفضية.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التخليق والبنية
ألبرتوس ماگنس، في القرن 13، وثّق قدرة حمض النيتريك على فصل الذهب والفضة عن طريق إذابة الفضة.[7] في الواقع يمكن تحضير نترات الفضة بإذابة الفضة في حمض النيتريك متبوعًا بتبخير المحلول. يعتمد القياس المتكافئ للتفاعل على تركيز حمض النيتريك المستخدم.
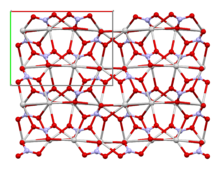
تم فحص بنية نترات الفضة بواسطة علم البلورات بالأشعة السينية عدة مرات. في الشكل المعيني المشترك المستقر عند درجة الحرارة والضغط العاديين ، تشكل ذرات الفضة أزواجاً مع Ag---Ag contacts of 3.227 Å. Each Ag+ center is bonded to six oxygen centers of both uni- and bidentate nitrate ligands. The Ag-O distances range from 2.384 to 2.702 Å.[4]
التفاعلات
A typical reaction with silver nitrate is to suspend a rod of copper in a solution of silver nitrate and leave it for a few hours. The silver nitrate reacts with copper to form hairlike crystals of silver metal and a blue solution of copper nitrate:
- 2 AgNO3 + Cu → Cu(NO3)2 + 2 Ag
Silver nitrate decomposes when heated:
Qualitatively, decomposition is negligible below the melting point, but becomes appreciable around 250 °C and fully decomposes at 440 °C.[8]
Most metal nitrates thermally decompose to the respective oxides, but silver oxide decomposes at a lower temperature than silver nitrate, so the decomposition of silver nitrate yields elemental silver instead.
الاستخدامات
يستخدم الأطباء نترات الفضة، لكي الجروح الناتجة عن الحريق لمنع النزيف، أو العدوى، وكذلك لإزالة الثآليل الصغيرة.كما يستخدمون محلولاْ معتدلاً باردًا من نترات الفضة، لمعالجة بعض أمراض العين، والجلد، ويستخدم أيضا مطهراً. وتطلب بعض الدول أنْ تتم معالجة عيون الأطفال حديثي الولادة، بمحلول نترات الفضة، لمنع العمى المحتمل. وتستخدم صناعة التصوير الضوئي نترات الفضة في صناعة الأفلام. كما أن معظم أملاح الفضة المستخدمة في الفيلم، تصنع من نترات الفضة، فعلى سبيل المثال، يصنع فيلم التصوير الضوئي المصنوع من بروميد الفضة، من محلول نترات الفضة وبروميد البوتاسيوم، ثم يضاف الجيلاتين، وهو مادة بروتينية، إلى المحلول لتشكيل مادة تسمى المستحلب، أو الطبقة الحساسة، التي تغطي الفيلم.
وتُستخدم نترات الفضة، أيضًا في صناعة المرايا والحبر (المداد الثابت، المتعذر إزالته) وفي تصفيح أو طلاء الفضة.
سابق لمركبات أخرى للفضة
Silver nitrate is the least expensive salt of silver; it offers several other advantages as well. It is non-hygroscopic, in contrast to silver fluoroborate and silver perchlorate. It is relatively stable to light. Finally, it dissolves in numerous solvents, including water. The nitrate can be easily replaced by other ligands, rendering AgNO3 versatile. Treatment with solutions of halide ions gives a precipitate of AgX (X = Cl, Br, I). When making photographic film, silver nitrate is treated with halide salts of sodium or potassium to form insoluble silver halide in situ in photographic gelatin, which is then applied to strips of tri-acetate or polyester. Similarly, silver nitrate is used to prepare some silver-based explosives, such as the fulminate, azide, or acetylide, through a precipitation reaction.
Treatment of silver nitrate with base gives dark grey silver oxide:[9]
- 2 AgNO3 + 2 NaOH → Ag2O + 2 NaNO3 + H2O
إزالة الهاليدات
The silver cation, Ag+ , reacts quickly with halide sources to produce the insoluble silver halide, which is a cream precipitate if Br− is used, a white precipitate if Cl− is used and a yellow precipitate if I− is used. This reaction is commonly used in inorganic chemistry to abstract halides:
- Ag+ (aq) + X− (aq) → AgX(s)
where X− = Cl− , Br− , or I− .
Other silver salts with non-coordinating anions, namely silver tetrafluoroborate and silver hexafluorophosphate are used for more demanding applications.
Similarly, this reaction is used in analytical chemistry to confirm the presence of chloride, bromide, or iodide ions. Samples are typically acidified with dilute nitric acid to remove interfering ions, e.g. carbonate ions and sulfide ions. This step avoids confusion of silver sulfide or silver carbonate precipitates with that of silver halides. The color of precipitate varies with the halide: white (silver chloride), pale yellow/cream (silver bromide), yellow (silver iodide). AgBr and especially AgI photo-decompose to the metal, as evidence by a grayish color on exposed samples.
The same reaction was used on steamships in order to determine whether or not boiler feedwater had been contaminated with seawater. It is still used to determine if moisture on formerly dry cargo is a result of condensation from humid air, or from seawater leaking through the hull.[10]
تخليق عضوي
Silver nitrate is used in many ways in organic synthesis, e.g. for deprotection and oxidations. Ag+ binds alkenes reversibly, and silver nitrate has been used to separate mixtures of alkenes by selective absorption. The resulting adduct can be decomposed with ammonia to release the free alkene.[11] Silver nitrate is highly soluble in water but is poorly soluble in most organic solvents, except acetonitrile (111.8 g/100 g, 25 °C).[12]
علم الأحياء
In histology, silver nitrate is used for silver staining, for demonstrating reticular fibers, proteins and nucleic acids. For this reason it is also used to demonstrate proteins in PAGE gels. It can be used as a stain in scanning electron microscopy.[13]
حبر لا يُمحى
Silver nitrate produces long-lasting stain when applied to skin. An electoral stain makes use of this to mark a finger of people who have voted in an election, allowing easy identification to prevent double-voting.
طب
Silver salts have antiseptic properties. In 1881 Credé introduced the use of dilute solutions of AgNO3 in newborn babies' eyes at birth to prevent contraction of gonorrhea from the mother, which could cause blindness. (Modern antibiotics are now used instead).[14][15][16]
Fused silver nitrate, shaped into sticks, was traditionally called "lunar caustic". It is used as a cauterizing agent, for example to remove granulation tissue around a stoma. General Sir James Abbott noted in his journals that in India in 1827 it was infused by a British surgeon into wounds in his arm resulting from the bite of a mad dog to cauterize the wounds and prevent the onset of rabies.[17]
Silver nitrate is used to cauterize superficial blood vessels in the nose to help prevent nose bleeds.
Dentists sometimes use silver nitrate-infused swabs to heal oral ulcers. Silver nitrate is used by some podiatrists to kill cells located in the nail bed.
The Canadian physician C. A. Douglas Ringrose researched the use of silver nitrate for sterilization procedures, believing that silver nitrate could be used to block and corrode the fallopian tubes.[18] The technique was ineffective.[19]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
تطهير
Much research has been done in evaluating the ability of the silver ion at inactivating Escherichia coli, a microorganism commonly used as an indicator for fecal contamination and as a surrogate for pathogens in drinking water treatment. Concentrations of silver nitrate evaluated in inactivation experiments range from 10–200 micrograms per liter as Ag+. Silver's antimicrobial activity saw many applications prior to the discovery of modern antibiotics, when it fell into near disuse. Its association with argyria made consumers wary and led them to turn away from it when given an alternative.
ضد البثور
Repeated daily application of silver nitrate can induce adequate destruction of cutaneous warts, but occasionally pigmented scars may develop. In a placebo-controlled study of 70 patients, silver nitrate given over nine days resulted in clearance of all warts in 43% and improvement in warts in 26% one month after treatment compared to 11% and 14%, respectively, in the placebo group.[20]
السلامة
As an oxidant, silver nitrate should be properly stored away from organic compounds. Despite its common usage in extremely low concentrations to prevent gonorrhea and control nose bleeds, silver nitrate is still very toxic and corrosive.[21] Brief exposure will not produce any immediate side effects other than the purple, brown or black stains on the skin, but upon constant exposure to high concentrations, side effects will be noticeable, which include burns. Long-term exposure may cause eye damage. Silver nitrate is known to be a skin and eye irritant. Silver nitrate has not been thoroughly investigated for potential carcinogenic effect.[22]
Silver nitrate is currently unregulated in water sources by the United States Environmental Protection Agency. However, if more than 1 gram of silver is accumulated in the body, a condition called argyria may develop. Argyria is a permanent cosmetic condition in which the skin and internal organs turn a blue-gray color. The United States Environmental Protection Agency used to have a maximum contaminant limit for silver in water until 1990, when it was determined that argyria did not impact the function of any affected organs despite the discolouration.[23] Argyria is more often associated with the consumption of colloidal silver solutions rather than with silver nitrate, since it is only used at extremely low concentrations to disinfect the water. However, it is still important to be wary before ingesting any sort of silver-ion solution.
المصادر
- ^ أ ب ت ث ج قالب:CRC90
- ^ أ ب ت ث Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2nd ed.). New York City: D. Van Nostrand Company. pp. 617–619.
- ^ أ ب ت Kiper, Ruslan Anatolievich. "silver nitrate". Chemister.ru. Retrieved 2014-07-20.
- ^ أ ب ت ث خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةiucr - ^ أ ب ت Sigma-Aldrich Co., Silver nitrate. Retrieved on 2014-07-20.
- ^ "Silver (metal dust and soluble compounds, as Ag)". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Szabadváry, Ferenc (1992). History of analytical chemistry. Taylor & Francis. p. 17. ISBN 978-2-88124-569-5.
- ^ Stern, K. H. (1972). "High Temperature Properties and Decomposition of Inorganic Salts Part 3, Nitrates and Nitrites". Journal of Physical and Chemical Reference Data. 1 (3): 747–772. Bibcode:1972JPCRD...1..747S. doi:10.1063/1.3253104. S2CID 95532988.
- ^ قالب:OrgSynth (preparation of Ag2O, used in oxidation of an aldehyde)
- ^ "Silver nitrate method". Transport Information Service. Gesamtverband der Deutschen Versicherungswirtschaf. Retrieved 22 June 2015.
- ^ قالب:OrgSynth
- ^ "silver nitrate". chemister.ru. Retrieved 2019-04-04.
- ^ Geissinger HD (2011). "The use of silver nitrate as a stain for scanning electron microscopy of arterial intima and paraffin sections of kidney". Journal of Microscopy. 95 (3): 471–481. doi:10.1111/j.1365-2818.1972.tb01051.x. PMID 4114959. S2CID 38335416.
- ^ Peter.H (2000). "Dr Carl Credé (1819–1892) and the prevention of ophthalmia neonatorum". Arch Dis Child Fetal Neonatal Ed. 83 (2): F158–F159. doi:10.1136/fn.83.2.F158. PMC 1721147. PMID 10952715.
- ^ Credé C. S. E. (1881). "Die Verhürtung der Augenentzündung der Neugeborenen". Archiv für Gynäkologie. 17 (1): 50–53. doi:10.1007/BF01977793. S2CID 10053605.
- ^ Schaller, Ulrich C. & Klauss, Volker (2001). "Is Credés prophylaxis for ophthalmia neonatorum still valid?". Bulletin of the World Health Organization. 79 (3): 262–266. PMC 2566367. PMID 11285676.
- ^ British Library, India Office Records, European Manuscripts, MSS EUR F171/33/3, page 109.
- ^ Ringrose CA. (1973). "Office tubal sterilization". Obstetrics and Gynecology. 42 (1): 151–5. PMID 4720201.
- ^ Cryderman v. Ringrose (1978), 89 D.L.R. (3d) 32 (Alta S.C.) and Zimmer et al. v. Ringrose (1981) 4 W.W.R. 75 (Alta C.A.).
- ^ Sterling, J. C.; Handfield-Jones, S.; Hudson, P. M.; British Association of Dermatologists (2001). "Guidelines for the management of cutaneous warts" (PDF). British Journal of Dermatology. 144 (1): 4–11. doi:10.1046/j.1365-2133.2001.04066.x. PMID 11167676. S2CID 20179474. Archived from the original (PDF) on 2012-03-03.
- ^ "Safety data for silver nitrate (MSDS)". Oxford University Chemistry department.
- ^ "New Jersey Right-To-Know-Act Hazardous Substance Fact Sheet - Silver Nitrate" (PDF).
- ^ "Silver Compounds." Encyclopedia of Chemical Technology. Vol. 22. Fourth Ed. Excec. Ed. Jaqueline I. Kroschwitz. New York: John Wiley and Sons, 1997.
وصلات خارجية
- International Chemical Safety Card 1116
- NIOSH Pocket Guide to Chemical Hazards
- History of Kodak: About Film and Imaging
| أملاح وأسترات أيون النترات | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HNO3 | He | ||||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO3)4− | RONO2 | NO3− NH4NO3 |
O | FNO3 | Ne | ||||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClONO2 | Ar | ||||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)3 | Co(NO3)2, Co(NO3)3 |
Ni(NO3)2 | Cu(NO3)2 | Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | Br | Kr | ||
| RbNO3 | Sr(NO3)2 | Y | Zr(NO3)4 | Nb | Mo | Tc | Ru | Rh | Pd(NO3)2 | AgNO3 | Cd(NO3)2 | In | Sn | Sb | Te | I | XeFNO3 | ||
| CsNO3 | Ba(NO3)2 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg2(NO3)2, Hg(NO3)2 |
Tl(NO3)3 | Pb(NO3)2 | Bi(NO3)3 | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |||
| ↓ | |||||||||||||||||||
| La | Ce(NO3)x | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Th | Pa | UO2(NO3)2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||
