بروميد الليثيوم
بروميد الليثيوم مركب كيميائي له الصيغة LiBr ، ويكون على شكل مسحوق بلوري أبيض. Its extreme hygroscopic character makes LiBr useful as a desiccant in certain air conditioning systems.[7]
 | |

| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Lithium bromide
| |
| Identifiers | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.028.582 |
| رقم EC |
|
PubChem CID
|
|
| رقم RTECS |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| InChI | InChI={{{value}}} |
| SMILES | |
| الخصائص | |
| الصيغة الجزيئية | LiBr |
| كتلة مولية | 86.845 g/mol[1] |
| المظهر | White hygroscopic solid[1] |
| الكثافة | 3.464 g/cm3[1] |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | 143 g/100 mL (0 °C) 166.7 g/100 mL (20 °C) 266 g/100 mL (100 °C)[2] |
| قابلية الذوبان | soluble in methanol, ethanol,[1] ether,[1] acetone slightly soluble in pyridine |
| القابلية المغناطيسية | −34.3·10−6 cm3/mol[4] |
| معامل الانكسار (nD) | 1.7843 (589 nm)[3] |
| البنية | |
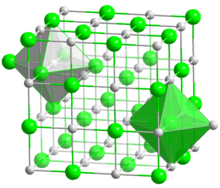
| البنية البلورية | Cubic, Pearson symbol cF8, No. 225 |
| الزمرة الفراغية | Fm3m |
| ثابت العقد | a = 0.5496 nm |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
-351.2 kJ/mol |
| Standard molar entropy S |
74.3 J/mol K |
| المخاطر | |
| ن.م.ع. مخطط تصويري | 
|
| ن.م.ع. كلمة الاشارة | Warning |
| H315, H317, H319[5] | |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | Not-flammable |
| الجرعة أو التركيز القاتل (LD, LC): | |
LD50 (الجرعة الوسطى)
|
1800 mg/kg (oral, rat)[6] |
| مركبات ذا علاقة | |
أنيونات أخرى
|
Lithium fluoride Lithium chloride Lithium iodide |
كاتيونات أخرى
|
Sodium bromide Potassium bromide Rubidium bromide Caesium bromide |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الانتاج والخصائص
LiBr is prepared by treating an aqueous suspension of lithium carbonate with hydrobromic acid or by reacting lithium hydroxide with bromine.[7] It forms several crystalline hydrates, unlike the other alkali metal bromides.[8]
Lithium hydroxide and hydrobromic acid (aqueous solution of hydrogen bromide) will precipitate lithium bromide in the presence of water.
- LiOH + HBr → LiBr + H2O
استخدامات
محلول مائي بنسبة 50–60% من بروميد الليثيوم يُستخدم في أنظمة تكييف الهواء كمجفف. It is also used in absorption chilling along with water (انظر التبريد بالامتصاص). Solid LiBr is a useful reagent in organic synthesis. It is included into oxidation and hydroformylation catalysts; it is also used for deprotonation and dehydration of organic compounds containing acidic protons, and for the purification of steroids and prostaglandins.[7]
التطبيقات الطبية
Lithium bromide was used as a sedative beginning in the early 1900s, but it fell into disfavor in the 1940s as newer sedatives became available and when some heart patients died after using the salt substitute lithium chloride.[9] Like lithium carbonate and lithium chloride, it was used as treatment for bipolar disorder.
المخاطر
Lithium salts are psychoactive and somewhat corrosive. Heat is quickly generated when lithium bromide is dissolved into water because it has a negative enthalpy of solution.
المراجع
- ^ أ ب ت ث ج خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةr1 - ^ Haynes, p. 5.169
- ^ Haynes, p. 10.249
- ^ Haynes, p. 4.128
- ^ Lithium bromide. SIgma Aldrich
- ^ Chambers, Michael. "ChemIDplus – 7550-35-8 – AMXOYNBUYSYVKV-UHFFFAOYSA-M – Lithium bromide – Similar structures search, synonyms, formulas, resource links, and other chemical information". chem.sis.nlm.nih.gov. Retrieved 3 April 2018.
- ^ أ ب ت Wietelmann, Ulrich and Bauer, Richard J. (2005) "Lithium and Lithium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH: Weinheim. DOI:10.1002/14356007.a15_393.pub2
- ^ قالب:Holleman&Wiberg
- ^ "Bipolar Disorder: Treatment and Care". webmd.com. Retrieved 3 April 2018.
المصادر المذكورة
- Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97th ed.). CRC Press. ISBN 9781498754293.
وصلات خارجية
- "A PDF file from GFS Chemicals, a supplier of lithium bromide" (PDF). Archived from the original (PDF) on 2006-03-16. Retrieved 2005-09-15.
